Aunque múltiples estudios indican una mayor mortalidad en la miocardiopatía de Chagas crónica (MCC) en comparación con otras miocardiopatías, la ausencia de metanálisis que respalden esta perspectiva limita la posibilidad de generar conclusiones robustas respecto a este fenómeno. El objetivo de este estudio es evaluar de manera sistemática la evidencia actual respecto al riesgo de mortalidad en la MCC respecto a otras miocardiopatías.
MétodosSe realizaron búsquedas en PubMed/Medline y EMBASE de estudios que compararan el riesgo de mortalidad entre pacientes con MCC y con otras miocardiopatías, como la miocardiopatía no isquémica (MNI), la miocardiopatía isquémica y la miocardiopatía no chagásica (MNC). Se realizó un metanálisis de efectos aleatorios para combinar los efectos de los estudios evaluados.
ResultadosSe incluyeron 37 estudios que evaluaron a 17.949 pacientes. Los pacientes con MCC presentaron un riesgo de mortalidad significativamente mayor en comparación con los pacientes con MNI (HR=2,04; IC95%, 1,60-2,60; I2, 47%; 8 estudios) y MNC (HR=2,26; IC95%, 1,65-3,10; I2, 71%; 11 estudios). Sin embargo, no se observó ningún efecto significativo entre los grupos con MCC y con miocardiopatía isquémica (HR=1,72; IC95%, 0,80-3,66; I2, 69%; 4 estudios) en el metanálisis de efectos ajustados.
ConclusionesLos pacientes con MCC se enfrentan a un riesgo de mortalidad casi 2 veces mayor en comparación con los individuos con otras etiologías de miocardiopatía isquémica. Este resultado pone de relieve la necesidad de políticas públicas eficaces e iniciativas de investigación centradas en abordar de manera óptima los retos de la MCC.
Palabras clave
La enfermedad de Chagas, causada por el parásito Trypanosoma cruzi, afecta actualmente a unos 6-8 millones de personas, principalmente en áreas endémicas de América Latina1. Sin embargo, la emigración ha convertido la enfermedad de Chagas en un problema de salud pública mundial, con una estimación de casi 300.000 casos en EE. UU. y 50.000 en Europa1. Durante la evolución de la enfermedad, el 30% de los pacientes presentarán miocardiopatía chagásica crónica (MCC), caracterizada por una rápida progresión de la insuficiencia cardiaca (IC), y una elevada incidencia de accidentes cerebrovasculares y arritmias ventriculares mortales2. Aunque el pronóstico de los pacientes con IC ha mejorado considerablemente con la aparición de los tratamientos de bloqueo neurohormonal durante las últimas 4 décadas, numerosos estudios indican mayor riesgo continuo de resultados cardiovasculares adversos en la población con MCC que en otras cardiomiopatías (OM)3. No obstante, la evidencia que respalda esta asociación proviene principalmente de estudios y revisiones originales individuales no centrados en pacientes con IC, por lo que existe una brecha de conocimiento importante en esta área4,5. Por tanto, el objetivo de este estudio fue evaluar sistemáticamente la evidencia que compara el riesgo de mortalidad en la MCC con el de OM.
MÉTODOSFuentes de datos y estrategia de búsquedaEste estudio se ajustó a la Declaración PRISMA (tabla 1 del material adicional). Se realizaron búsquedas en las bases de datos PubMed/Medline (National Library of Medicine, EE. UU.) y EMBASE (Elsevier, Países Bajos) desde su inicio hasta el 3 de octubre de 2023 para identificar estudios longitudinales que compararan la incidencia de mortalidad en pacientes adultos ambulatorios con MCC y OM. No se aplicó ninguna restricción de idioma. Se utilizaron, entre otros, los siguientes términos de búsqueda: miocardiopatía de Chagas, enfermedad de Chagas, Trypanosoma cruzi,tripanosomiasis americana, mortalidad y resultados. La estrategia de búsqueda completa se describe en el material adicional.
Selección del estudio y criterios de inclusiónSe incluyeron ensayos clínicos y todos los estudios observacionales (transversales, de cohortes, y de casos y controles), salvo casos clínicos y series de casos. También se excluyeron las revisiones sistemáticas y los metanálisis. Se tuvieron en cuenta aquellos estudios que evaluaban pacientes adultos con MCC y comparaban el riesgo de mortalidad con el de aquellos con OM. El seguimiento de los estudios incluidos también tenía que realizarse en un entorno ambulatorio. Se excluyeron los estudios sobre población pediátrica o con animales.
Selección y extracción de datosEl proceso de selección se llevó a cabo mediante Rayyan6. Dos revisores independientes examinaron los títulos y resúmenes, teniendo en cuenta los criterios de selección. Cualquier desacuerdo fue resuelto por un tercer revisor. Después de esta etapa, se revisaron los textos completos para determinar si todos los estudios cumplían con los criterios de selección. Se extrajeron los datos relevantes de los estudios incluidos con un formulario de Excel. En cuanto a los estudios que comunicaban solo medianas e intervalos (intervalo intercuartílico, intervalo y valores máximo-mínimo), estos valores se convirtieron en medias y desviaciones estándar con el método explicado por Hozo et al.7.
Valoración del riesgo de sesgoLa calidad del estudio se evaluó de forma independiente por 2 autores con la escala de Newcastle-Ottawa. En los casos en los que resultaba difícil llegar a un consenso, medió un tercer autor para obtener una resolución. La calidad de cada uno de los estudios se analizó en una escala de 10 puntos, estratificada en «bajo riesgo de sesgo» con 9-10 puntos, «riesgo medio de sesgo» con 6-8 puntos y «alto riesgo de sesgo» para puntuaciones inferiores a 6.
Síntesis y análisis de datosLas medidas de síntesis de las variables continuas se expresan en media±desviación estándar, mientras que las variables cualitativas lo hacen en proporciones. Se clasificó inicialmente a los participantes en 4 grupos: a) MCC; b) miocardiopatía no isquémica (MNI), y c) miocardiopatía isquémica (MCI). Además, se incluyó un cuarto grupo de miocardiopatía no chagásica (MNC) para aquellos estudios que no clasificaron a los individuos de la población de referencia (sin miocardiopatía chagásica) en relación con su etiología. La síntesis de datos se hizo con modelos de efectos aleatorios según el método de la variancia inversa para estimar los efectos agrupados por tamaño, mientras que el estimador de Paule-Mandel se utilizó para tener en cuenta el error aleatorizado. Además, se aplicó la corrección de Hartung-Knapp. Los riesgos relativos (RR) no corregidos agrupados se calcularon a partir de la información de mortalidad comunicada, mientras que las hazard ratios (HR) corregidas se extrajeron directamente de los modelos multivariante de los estudios. La heterogeneidad se evaluó utilizando el valor muestral I2. Se consideró que los valores superiores al 75% indicaban una alta heterogeneidad; los comprendidos entre el 25 y el 75%, moderada, y los inferiores al 25%, baja. El análisis de metarregresión se realizó en contraste con más de 10 estudios para evaluar variables que podrían explicar la heterogeneidad en las asociaciones observadas, mientras que se llevó a cabo un análisis de sensibilidad que comparaba los estudios publicados antes y después de 2016 para analizar la posible influencia del uso de los inhibidores de la neprilisina y del receptor de la angiotensina introducidos más recientemente. Por último, el sesgo de publicación se evaluó mediante gráficos en embudo y la prueba de Egger. Si se identificaba un posible sesgo de publicación, se empleaba el método trim-and-fill (de ajuste y relleno) utilizando el paquete metafor para calcular un tamaño de efecto ajustado, teniendo en cuenta la presencia de este sesgo. La significación estadística se fijó en p<0,05. Todos los análisis se realizaron con el software estadístico R (v4.2.3; R Core Team 2023), y los paquetes meta y metafor.
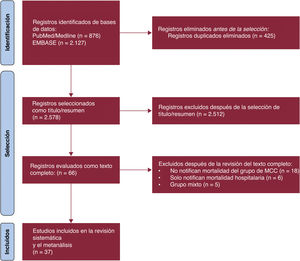
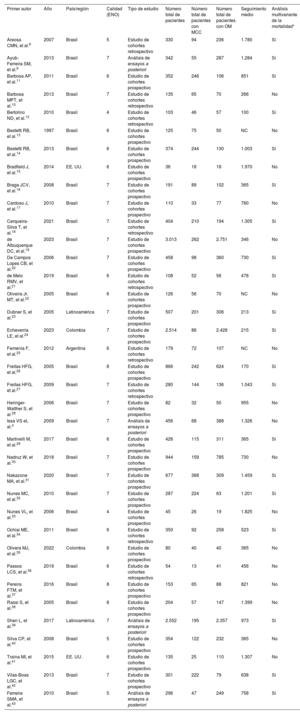
RESULTADOSCaracterísticas del estudio y de los pacientesDe los 2.134 estudios seleccionados, 37 cumplían los criterios de selección y se incluyeron en el metanálisis (figura 1 y tabla 1)3,8–43. Estos estudios proceden sobre todo de Brasil (n=32; 86,5%) y fueron principalmente cohortes prospectivas (64,9%). Se analizó a 17.949 pacientes (4.258 con MCC y 13.691 con OM). Los pacientes con MCC eran más jóvenes (diferencia media, −2,35 años; intervalo de confianza del 95% [IC95%], −4,05 a −0,65 años; I2 = 93%) y con menos frecuencia varones (odds ratio [OR] = 0,74; IC95%, 0,63-0,87; I2 = 40%) en comparación con los pacientes con OM, sin diferencias importantes en la proporción de pacientes en estado de la clase III-IV de la New York Heart Association (NYHA) (OR = 0,88; IC95%, 0,70-1,09; I2 = 44,3%) o fracción de eyección del ventrículo izquierdo (FEVI) (diferencia media, 0,77%; IC95%, −0,79-2,33%; I2 = 90%). Los tiempos medios de seguimiento en los estudios evaluados oscilaron entre 100 y 1.970 días (mediana, 758 días). Por último, la mayoría de los estudios (86,5%) se clasificaron como de bajo riesgo de sesgo (figura 2A,B).
Características generales de los estudios incluidos y de la población evaluada
| Primer autor | Año | País/región | Calidad (ENO) | Tipo de estudio | Número total de pacientes | Número total de pacientes con MCC | Número total de pacientes con OM | Seguimiento medio | Análisis multivariante de la mortalidad* |
|---|---|---|---|---|---|---|---|---|---|
| Areosa CMN, et al.8 | 2007 | Brasil | 5 | Estudio de cohortes retrospectivo | 330 | 94 | 236 | 1.780 | Sí |
| Ayub-Ferreira SM, et al.9 | 2013 | Brasil | 7 | Análisis de ensayos a posteriori | 342 | 55 | 287 | 1.284 | Sí |
| Barbosa AP, et al.11 | 2011 | Brasil | 6 | Estudio de cohortes prospectivo | 352 | 246 | 106 | 851 | Sí |
| Barbosa MPT, et al.10 | 2013 | Brasil | 7 | Estudio de cohortes retrospectivo | 135 | 65 | 70 | 266 | No |
| Bertolino ND, et al.12 | 2010 | Brasil | 4 | Estudio de cohortes retrospectivo | 103 | 46 | 57 | 100 | Sí |
| Bestetti RB, et al.13 | 1997 | Brasil | 6 | Estudio de cohortes prospectivo | 125 | 75 | 50 | NC | No |
| Bestetti RB, et al.14 | 2013 | Brasil | 6 | Estudio de cohortes prospectivo | 374 | 244 | 130 | 1.003 | Sí |
| Bradfield J, et al.15 | 2014 | EE. UU. | 6 | Estudio de cohortes prospectivo | 36 | 18 | 18 | 1.970 | No |
| Braga JCV, et al.16 | 2008 | Brasil | 7 | Estudio de cohortes prospectivo | 191 | 89 | 102 | 365 | Sí |
| Cardoso J, et al.17 | 2010 | Brasil | 7 | Estudio de cohortes prospectivo | 110 | 33 | 77 | 760 | No |
| Cerqueira-Silva T, et al.18 | 2021 | Brasil | 7 | Estudio de cohortes retrospectivo | 404 | 210 | 194 | 1.305 | Sí |
| de Albuquerque DC, et al.19 | 2023 | Brasil | 7 | Estudio de cohortes prospectivo | 3.013 | 262 | 2.751 | 346 | No |
| De Campos Lopes CB, et al.20 | 2006 | Brasil | 7 | Estudio de cohortes prospectivo | 458 | 98 | 360 | 730 | Sí |
| de Melo RMV, et al.21 | 2019 | Brasil | 6 | Estudio de cohortes retrospectivo | 108 | 52 | 56 | 478 | Sí |
| Oliveira Jr. MT, et al.22 | 2005 | Brasil | 6 | Estudio de cohortes prospectivo | 126 | 56 | 70 | NC | No |
| Dubner S, et al.23 | 2005 | Latinoamérica | 7 | Estudio de cohortes prospectivo | 507 | 201 | 306 | 213 | Sí |
| Echeverría LE, et al.24 | 2023 | Colombia | 7 | Estudio de cohortes prospectivo | 2.514 | 86 | 2.428 | 215 | Sí |
| Femenía F, et al.25 | 2012 | Argentina | 6 | Estudio de cohortes retrospectivo | 179 | 72 | 107 | NC | No |
| Freitas HFG, et al.26 | 2005 | Brasil | 8 | Estudio de cohortes prospectivo | 866 | 242 | 624 | 170 | Sí |
| Freitas HFG, et al.27 | 2009 | Brasil | 7 | Estudio de cohortes retrospectivo | 280 | 144 | 136 | 1.043 | Sí |
| Heringer-Walther S, et al.28 | 2006 | Brasil | 7 | Estudio de cohortes prospectivo | 82 | 32 | 50 | 955 | No |
| Issa VS et, al.3 | 2009 | Brasil | 7 | Análisis de ensayos a posteriori | 456 | 68 | 388 | 1.326 | No |
| Martinelli M, et al.29 | 2017 | Brasil | 6 | Estudio de cohortes prospectivo | 426 | 115 | 311 | 365 | Sí |
| Nadruz W, et al.30 | 2018 | Brasil | 7 | Estudio de cohortes prospectivo | 944 | 159 | 785 | 730 | No |
| Nakazone MA, et al.31 | 2020 | Brasil | 7 | Estudio de cohortes prospectivo | 677 | 368 | 309 | 1.459 | Sí |
| Nunes MC, et al.32 | 2010 | Brasil | 7 | Estudio de cohortes prospectivo | 287 | 224 | 63 | 1.201 | Sí |
| Nunes VL, et al.33 | 2006 | Brasil | 4 | Estudio de cohortes prospectivo | 45 | 26 | 19 | 1.825 | No |
| Ochiai ME, et al.34 | 2011 | Brasil | 6 | Estudio de cohortes retrospectivo | 350 | 92 | 258 | 523 | Sí |
| Olivera MJ, et al.35 | 2022 | Colombia | 6 | Estudio de cohortes prospectivo | 80 | 40 | 40 | 365 | No |
| Passos LCS, et al.36 | 2019 | Brasil | 6 | Estudio de cohortes retrospectivo | 54 | 13 | 41 | 456 | No |
| Pereira FTM, et al.37 | 2016 | Brasil | 8 | Estudio de cohortes prospectivo | 153 | 65 | 88 | 821 | No |
| Rassi S, et al.38 | 2005 | Brasil | 8 | Estudio de cohortes prospectivo | 204 | 57 | 147 | 1.399 | No |
| Shen L, et al.39 | 2017 | Latinoamérica | 7 | Análisis de ensayos a posteriori | 2.552 | 195 | 2.357 | 973 | Sí |
| Silva CP, et al.40 | 2008 | Brasil | 5 | Estudio de cohortes prospectivo | 354 | 122 | 232 | 365 | No |
| Traina MI, et al.41 | 2015 | EE. UU. | 6 | Estudio de cohortes prospectivo | 135 | 25 | 110 | 1.307 | No |
| Vilas-Boas LGC, et al.42 | 2013 | Brasil | 7 | Estudio de cohortes prospectivo | 301 | 222 | 79 | 638 | Sí |
| Ferreira SMA, et al.43 | 2010 | Brasil | 5 | Análisis de ensayos a posteriori | 296 | 47 | 249 | 758 | Sí |
ENO: escala de Newcastle-Ottawa; MCC: miocardiopatía chagásica crónica; NC: no comunicado; OM: otras miocardiopatías.
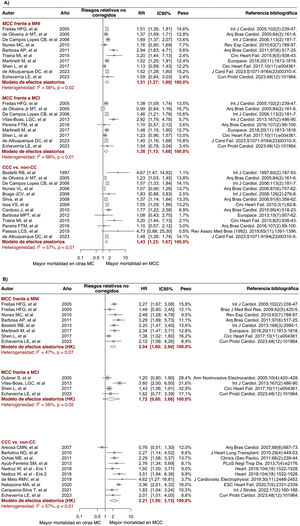
Gráficos de bosque que comparan el riesgo de mortalidad entre la MCC y la insuficiencia cardiaca de otras etiologías. A: RR no ajustado para MCC frente a MNI, MCI y MNC. B: HR ajustada procedente de modelos multivariable de riesgos proporcionales de Cox para MCC frente a MNI, MCI y MNC. HK: corrección de Hartung-Knapp; HR: hazard ratio; IC95%: intervalo de confianza del 95%; MC: miocardiopatía; MCC: miocardiopatía chagásica crónica; MCI: miocardiopatía isquémica; MNC: miocardiopatía no chagásica; MNI: miocardiopatía no isquémica; RR: riesgo relativo. Las referencias bibliográficas citadas en la figura corresponden a: Issa et al.3, Areosa et al.8, Ayub-Ferreira et al.9, Barbosa et al.11, Barbosa et al.10, Bertolino et al.12, Bestetti et al.13, Bestetti et al.14, Bradfield et al.15, Braga et al.16, Cardoso et al.17, Cerqueira-Silva et al.18, de Albuquerque et al.19, De Campos Lopes et al.20, de Melo et al.21, Oliveira Jr. et al.22, Dubner et al.23, Echeverría et al.24, Femenía et al.25, Freitas et al.26, Freitas et al.27, Heringer-Walther et al.28, Martinelli et al.29, Nadruz et al.30, Nakazone et al.31, Nunes et al.32, Nunes et al.33, Ochiai et al.34, Olivera et al.35, Passos et al.36, Pereira et al.37, Rassi et al.38, Shen et al.39, Silva et al.40, Traina et al.41, Vilas-Boas et al.42 y Ferreira et al.43.
En los análisis no ajustados, los pacientes con MCC presentaron un riesgo de mortalidad significativamente mayor durante el seguimiento que aquellos con MNI (RR = 1,44; IC95%, 1,21-1,71; I2 = 65%; 12 estudios), MCI (RR = 1,34; IC95%, 1,11-1,63; I2 = 65%; 10 estudios) y MNC (RR = 1,42; IC95%, 1,30-1,55; I2 = 37%; 22 estudios) (figura 2A). Veinte estudios proporcionaron medidas de efecto ajustadas del riesgo de mortalidad, que incluyen principalmente la edad, el sexo, la clase de la NYHA, la FEVI y los medicamentos para la IC como covariables de ajuste. El metanálisis de las medidas ajustadas informó de un riesgo de mortalidad significativamente mayor en el grupo de MCC que en los grupos de MNI (HR = 2,04; IC95%, 1,60-2,60; I2 = 47%; 8 estudios) y de MNC (HR = 2,26; IC95%, 1,65-3,10; I2 = 71%; 11 estudios), mientras que no se observó ningún efecto significativo cuando se comparó a los pacientes con MCC con aquellos con MCI (HR = 1,72; IC95%, 0,80-3,66; I2 = 69%; 4 estudios) (figura 2B). Es de destacar que algunos estudios ofrecieron información de más de un grupo de comparación (MCI/MNI/MNC) y, por consiguiente, el número total de contrastes fue mayor que el de artículos incluidos.
Metarregresión y sesgo de publicaciónLos resultados del análisis de metarregresión revelaron que ninguna de las características del estudio evaluadas (edad, sexo, clase de la NYHA, FEVI, año de publicación y tiempo de seguimiento) fue una fuente significativa de heterogeneidad (p>0,05) (tabla 2 del material adicional). Además, un análisis de sensibilidad por año de publicación (antes de 2016 y después de 2016) no mostró diferencias significativas en los efectos entre grupos de los diferentes contrastes (tabla 3 del material adicional). Al mismo tiempo, la prueba de Egger no sugirió sesgo de publicación en la mayoría de los análisis realizados (p>0,05), salvo por el contraste no ajustado entre pacientes con MCC y pacientes con MNC, que mostró un sesgo potencial hacia el informe de efectos mayores (p=0,024) (figura 1 del material adicional). No obstante, después de implementar el método de trim-and-fill para este contraste, las estimaciones ajustadas mostraron un riesgo de mortalidad sistemáticamente mayor en el grupo de MCC (RR = 1,39; IC95%, 1,26-1,52; I2 = 44%) (figura 2 del material adicional).
DISCUSIÓNEn este metanálisis, en el que se evaluó a más de 17.000 pacientes con IC, se observó que la IC secundaria a MCC se asociaba con un riesgo de mortalidad significativamente mayor que la IC derivada de otras causas. Este resultado fue evidente tanto en los modelos no ajustados como en los ajustados. En particular, se encontró un riesgo de mortalidad similar en el metanálisis de efectos ajustados al comparar MCC e MCI. Sin embargo, este hallazgo se vio limitado por un menor número de estudios (n=4) que en las otras comparaciones ajustadas (MCC frente a MNI [n=8] y MCC frente a MNC [n=10]). En general, estos hallazgos confirman la tendencia registrada anteriormente en estudios individuales, y ofrecen una información valiosa sobre las estimaciones en cada grupo etiológico y la importancia del riesgo de mortalidad asociado con el diagnóstico de MCC en pacientes con IC. Curiosamente, se observó una menor prevalencia del sexo masculino en el grupo de MCC que en el de OM. La evidencia actual sugiere que el sexo masculino se asocia con una mayor progresión de la forma indeterminada de la enfermedad de Chagas a MCC44; sin embargo, también hay evidencia que sugiere que el sexo masculino se asocia significativamente con el desarrollo de OM, y el efecto de esta variable es potencialmente mayor en otras etiologías de IC que en la MCC45–48.
La MCC es una forma rápidamente progresiva de afección cardiaca con una fisiopatología peculiar, caracterizada por una infiltración grave de células inmunitarias en el miocardio, que provoca una extensa remodelación miocárdica, afección fibrótica intensa y un fenotipo de miocardiopatía dilatada49. Además, la sustitución transmural del miocardio por tejido cicatricial es frecuente en la MCC y se ha asociado con el desarrollo de arritmias mortales, lo que convierte la muerte súbita cardiaca en la segunda causa de mortalidad en esta población después de empeorar la IC50. Además, las embolias sistémicas tienen una gran incidencia en la MCC por la elevada prevalencia de anomalías estructurales, como aneurismas ventriculares y fibrilación auricular, así como la existencia de trastornos de la coagulación intrínsecos a la infección crónica por Trypanosomacruzi49,51. Por último, la afección neuroendocrina observada durante la evolución de la enfermedad, marcada por la función comprometida de las glándulas suprarrenales y del timo junto con una denervación parasimpática más pronunciada, posiblemente pueda explicar el perfil clínico más grave de esta miocardiopatía en comparación con otras etiologías52,53. A pesar de estas reflexiones, las soluciones terapéuticas dirigidas que tienen en cuenta la fisiopatología complicada de la MCC continúan siendo esquivas. Del mismo modo, no ha habido ensayos controlados aleatorizados específicos que evalúen el beneficio del bloqueo neurohormonal en esta población de pacientes. Por consiguiente, se desconoce si los pacientes con MCC se benefician de manera similar de estos tratamientos, o continúan teniendo un mayor riesgo de mortalidad y resultados cardiovasculares adversos a pesar de recibir un tratamiento óptimo para la IC54,55. Por tanto, se esperan los resultados del ensayo PARACHUTE con impaciencia, ya que compararán el sacubitrilo-valsartán con el enalapril en pacientes con MCC, centrándose en el riesgo de mortalidad y otros resultados cardiovasculares. Los resultados de este ensayo clínico pueden definir el futuro del tratamiento farmacológico de la MCC y tienen el potencial de establecer una nueva tendencia respecto a la mortalidad en esta población vulnerable56.
LimitacionesA pesar de su exhaustividad, este estudio tiene varias limitaciones. En primer lugar, la moderada o elevada heterogeneidad de los estudios de algunas comparaciones, incluidas diversas poblaciones, metodologías y entornos clínicos, podría haber introducido posibles sesgos. Aunque es difícil de determinar, la heterogeneidad observada en los estudios puede deberse a numerosos factores. Estos incluyen el año de publicación del estudio. Aunque el año de publicación no se asoció significativamente con el impacto del diagnóstico de MCC en la mortalidad en los análisis de metarregresión, la sensibilidad relativamente baja de este enfoque no nos permite descartar la existencia de un efecto significativo. Esto se debe a que los enfoques diagnósticos y terapéuticos de la IC variaron considerablemente entre la publicación del primer (1997) y el último estudio (2023) incluido. Otros factores importantes incluyen el tipo y la etapa de afección cardiaca, ya que algunos estudios no aclararon las etiologías de los grupos de comparación o si los individuos tenían un diagnóstico de IC o estaban en etapas más tempranas de miocardiopatía, así como el tiempo medio de seguimiento, que, aunque no era importante en el análisis de metarregresión, también podría haber influido en las diferencias observadas. Por último, aunque la mayoría de los estudios se llevaron a cabo en poblaciones brasileñas, 7 (19%) se realizaron en otros países, principalmente Colombia y EE. UU. Las diferencias en la distribución de las distintas unidades de tipificación de Trypanosoma cruzi y otras variables también podrían haber influido en los resultados observados.
En segundo lugar, se identificó un posible sesgo de publicación en los estudios que comunicaban riesgos no ajustados para los grupos de MCC frente a los que no los son. Sin embargo, todavía se observó un efecto significativo después de que se ajustara este tipo de sesgo utilizando un método de trim-and-fill. Además, los posibles factores de confusión incluidos en los modelos multivariante ajustados variaron considerablemente entre los estudios, ya que se utilizaron diferentes enfoques de selección de covariables. No obstante, la ausencia de resultados significativos en los análisis de metarregresión respalda la precisión de estos resultados. Asimismo, la ausencia de datos sobre los pacientes restringió nuestra capacidad para elaborar análisis de subgrupos más refinados o evaluar la influencia de las características individuales de los pacientes en los resultados.
Es de destacar que los pacientes con MCC son una población vulnerable, con acceso limitado a los servicios sanitarios y, por tanto, a medicamentos y tratamientos para la IC que reducen la mortalidad, como el bloqueo neurohormonal y los desfibriladores automáticos implantables, que pueden influir en su supervivencia. A pesar de ello, no se pudo incluir en estos análisis datos sobre el nivel socioeconómico, el acceso a tratamientos para la IC o el cumplimiento terapéutico, lo que es una limitación importante.
Finalmente, la evaluación de la mortalidad por cualquier causa permitió la inclusión de un mayor número de estudios, sin discriminar entre las diferentes causas de mortalidad (IC, muerte súbita cardiaca o ictus, entre otras).
CONCLUSIONESEste metanálisis indica que los pacientes con MCC tienen un aumento del riesgo de mortalidad de casi el doble durante el seguimiento en comparación con sus equivalentes con IC secundaria a OM. Este hallazgo subraya la acuciante necesidad de aumentar la conciencia del pronóstico de la MCC y fomentar ensayos clínicos aleatorizados grandes que evalúen el beneficio de los tratamientos de la IC en esta población especial. Además, estos resultados invitan a una mayor investigación de los factores posiblemente asociados con el peor pronóstico observado en pacientes con MCC, destacando potencialmente el acceso a los tratamientos de la IC, el cumplimiento terapéutico y el diagnóstico precoz de la miocardiopatía. Estas ideas son fundamentales para dar forma a políticas públicas eficaces, y enfocar las iniciativas de investigación para abordar mejor los retos de la MCC y mejorar los resultados de este grupo de pacientes vulnerables.
- -
La MCC se caracteriza por una fisiopatología peculiar que la diferencia de otras etiologías de la IC, lo que limita potencialmente el beneficio de los enfoques diagnósticos y terapéuticos convencionales para la IC.
- -
La MCC se ha caracterizado por una rápida progresión y una alta tasa de mortalidad. A pesar de los numerosos estudios que destacan peores resultados clínicos que en otras miocardiopatías, existe una falta de evidencia añadida que analice si el diagnóstico de MCC se asocia con un mayor riesgo de mortalidad.
- -
En este metanálisis de 17.949 pacientes, aquellos con MCC mostraron un riesgo de mortalidad sistemáticamente mayor que los pacientes con otras miocardiopatías, incluso después del ajuste por covariables de confusión relevantes.
El presente estudio no recibió financiación.
CONSIDERACIONES ÉTICASEste trabajo está exento de aprobación por parte del comité de ética institucional porque corresponde a una revisión sistemática de la bibliografía y metanálisis, que no requirió selección de pacientes ni acceso a información desglosada sobre personas, ya que se basó en publicaciones científicas de la bibliografía médica de libre acceso. Los posibles sesgos de sexo/género no se tuvieron en cuenta en la preparación de este artículo.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIALNo se utilizaron herramientas de inteligencia artificial para el diseño o la preparación de este estudio.
CONTRIBUCIÓN DE LOS AUTORESS.A. Gómez-Ochoa participó en el diseño del estudio, la recopilación de datos, la revisión sistemática, la selección de estudios, la metodología, el análisis estadístico, y la revisión y edición del original. A.Y. Serrano-García supervisó el diseño del estudio, la recopilación de datos, la revisión sistemática, la selección de estudios, la metodología, el análisis estadístico, y la revisión y edición del original. A. Hurtado-Ortiz y A. Aceros estuvieron a cargo de la recopilación de datos, la revisión sistemática, la selección de estudios y la revisión del original. L.Z. Rojas y L.E. Echeverría supervisaron el diseño del estudio, la selección de estudios, y la revisión y edición del original. Todos los autores son responsables de la revisión del original y de la aprobación de la versión final.
CONFLICTO DE INTERESESLos autores declaran que no tienen ningún conflicto de intereses.