A menudo la evaluación de los riesgos de ictus y hemorragia en la fibrilación auricular (FA) es basal para predecir los resultados años después. Sin embargo, estos riesgos no son estáticos. Se investiga si los cambios dinámicos en CHA2DS2-VASc y HAS-BLED a lo largo del tiempo modifican la predicción del riesgo.
MétodosSe incluyó a pacientes con FA estables en tratamiento con antagonistas de la vitamina K. Durante 6 años de seguimiento, se registraron todos los ictus isquémicos/accidentes isquémicos transitorios (AIT) y hemorragias mayores. El CHA2DS2-VASc y HAS-BLED se revaluaron cada 2 años y se investigaron los resultados clínicos en periodos de 2 años.
ResultadosSe incluyó a 1.361 pacientes (medias de CHA2DS2-VASc y HAS-BLED, 4,0±1,7 y 2,9±1,2). Durante el seguimiento, 156 pacientes (11,5%) sufrieron un ictus isquémico/AIT y 269 (19,8%), una hemorragia mayor. En comparación con el valor basal, el CHA2DS2-VASc recalculado a los 2 años presentó mayor capacidad predictiva de ictus isquémico/AIT durante el periodo de 2-4 años. El índice de mejoría de la discriminación (IDI) y el índice de reclasificación neta (NRI) mostraron mejoras en la sensibilidad y mejor reclasificación. El CHA2DS2-VASc recalculado a los 4 años arrojó un mejor rendimiento predictivo que el basal durante el periodo de 4-6 años, con una mejora en el IDI y una mejora de la reclasificación. El HAS-BLED recalculado a los 2 años presentó mayor capacidad predictiva de hemorragia mayor que el basal durante el período de 2-4 años, con mejoras significativas en la sensibilidad y la reclasificación. Se observó un ligero aumento en la sensibilidad del HAS-BLED recalculado a los 4 años respecto al basal.
ConclusionesEn pacientes con FA, los riesgos de ictus y hemorragia son dinámicos y cambian con el tiempo. Las escalas CHA2DS2-VASc y HAS-BLED deben revaluarse con regularidad, especialmente para una precisa predicción del riesgo de ictus.
Palabras clave
La fibrilación auricular (FA) es la arritmia más habitual y conlleva un riesgo considerable de ictus y tromboembolia; de ahí que las guías recomienden la administración de anticoagulantes orales (ACO)1,2 como uno de los pilares de su abordaje y su tratamiento apropiados.
No obstante, la administración de ACO requiere estratificar el riesgo de ictus, que también debería equilibrarse con la evaluación del riesgo de hemorragia, empleando escalas de riesgo clínico como CHA2DS2-VASc y HAS-BLED3,4, tal como recomiendan la mayoría de las guías clínicas. Lamentablemente, suele hacerse una evaluación del riesgo basal, como una evaluación única que considera el riesgo un proceso estático, y estos valores suelen aplicarse para predecir resultados clínicos que tienen lugar muchos años después.
Sin embargo, los factores de riesgo de ictus y de hemorragia no son estáticos, sino que tienen una naturaleza más bien dinámica, y la mayoría de los pacientes con FA adquirirán al menos 1 nuevo factor de riesgo antes de sufrir un evento tromboembólico5. Estos cambios dinámicos pueden aumentar los valores de las escalas CHA2DS2-VASc y HAS-BLED respecto a su evaluación basal, lo que modificaría así el riesgo absoluto (y la tasa) de ictus y de hemorragia. Por lo tanto, el riesgo inicial estimado de estos eventos puede empeorar debido al envejecimiento y a otras enfermedades concomitantes incidentes6,7.
El objetivo del presente estudio es investigar si la evaluación dinámica de las escalas CHA2DS2-VASc y HAS-BLED a lo largo del tiempo mejoraría la predicción del riesgo en una cohorte de pacientes con FA tratados con ACO e incluidos de manera prospectiva en el Proyecto Murcia FA.
MÉTODOSEntre el 1 de mayo y el 1 de diciembre del 2007 se incluyó a los pacientes adultos ambulatorios con FA permanente o paroxística consecutivos que estuvieran estables en tratamiento anticoagulante con antagonistas de la vitamina K durante los 6 meses previos (es decir, razón internacional normalizada [INR] 2-3, de modo que el tiempo en rango terapéutico en el momento de la inclusión era del 100%) y acudieran a nuestra consulta de anticoagulación. Se excluyó a los pacientes con prótesis valvulares o FA reumática, así como a los que habían sufrido un síndrome coronario agudo o un ictus, los que se habían sometido a una intervención quirúrgica o habían sido hospitalizados y aquellos con cualquier inestabilidad hemodinámica durante los 6 meses anteriores.
El comité de ética del Hospital General Universitario Morales Meseguer aprobó el protocolo del estudio según las normas éticas establecidas en la Declaración de Helsinki de 1964. Todos los pacientes proporcionaron el consentimiento informado para participar.
Escalas CHA2DS2-VASc y HAS-BLEDEn el momento de la inclusión en el estudio, se registró la historia clínica completa. Se calcularon los valores basales de las escalas CHA2DS2-VASc y HAS-BLED de cada paciente según sus definiciones originales (apéndice A del material adicional)3,4. Debido a las características de la cohorte en el momento de su inclusión en el estudio (véase criterios de inclusión), se cuantificó el criterio INR lábil inicial como 0 en todos los pacientes.
Durante el seguimiento, se revaluaron todas las variables de riesgo de las escalas y volvieron a calcularse los valores de las escalas CHA2DS2-VASc y HAS-BLED al final de cada periodo de 2 años. Se analizó la capacidad predictiva de ambas escalas comparando su valor basal con el obtenido en intervalos de 2 años (del inicio al año 2, del año 2 al 4 y del año 4 al 6). Si los pacientes fallecían entre periodos de comparación, se aplicaba censura estadística. Por ejemplo, si un paciente fallecía al cabo de 3 años, sus datos se utilizaban para comparar el valor basal con el recalculado a los 2 años, pero no en las siguientes comparaciones, ya que a los 4 años no podría obtenerse de nuevo información relativa a sus comorbilidades. No hubo datos ausentes sobre las variables clínicas utilizadas para calcular las escalas.
Seguimiento y resultados clínicosEl seguimiento se hizo según la práctica clínica habitual en cada visita de control sistemático del tratamiento anticoagulante. Cuando el paciente no acudió a estas visitas, se recurrió a su historia clínica o se le llamó por teléfono para obtener la información requerida y comprobar que siguiera vivo, sin ninguna otra intervención ni visita específica con finalidades de estudio. El seguimiento se prolongó durante 6 años. Durante este periodo, se registraron todos los eventos adversos. No se perdió ningún paciente durante el seguimiento.
En el presente estudio, los objetivos primarios fueron el ictus isquémico/accidente isquémico transitorio (AIT) y la hemorragia mayor. Las definiciones de los objetivos primarios se detallan en el apéndice B del material adicional. Los investigadores identificaron, confirmaron y registraron todos los resultados clínicos.
Análisis estadísticoLas variables cuantitativas se expresan con media ± desviación estándar o mediana [intervalo intercuartílico], según corresponda, tras probar la normalidad mediante la prueba de Kolmogorov-Smirnov. Las variables cualitativas se expresan con frecuencias absolutas y porcentajes. Para comparar las proporciones se utilizó la prueba de la χ2 de Pearson. Para comparar las variables continuas y las variables cualitativas se utilizó la prueba de la t de Student o la prueba de la U de Mann-Whitney.
Para visualizar la proporción de pacientes que se movieron entre las distintas categorías de riesgo se utilizó un diagrama aluvial. La capacidad predictiva (expresada como estadísticos C) de los valores basales y dinámicos de las escalas CHA2DS2-VASc y HAS-BLED se evaluó mediante curvas de características operativas del receptor (ROC), con la versión cuantitativa de las escalas CHA2DS2-VASc y HAS-BLED en todos los casos. Para contrastar la precisión diagnóstica, se compararon las curvas ROC con el método de DeLong et al8. También se calcularon los índices de mejora neta de la reclasificación (NRI) y la mejora de la discriminación integrada (IDI) de los valores basales y dinámicos tal como describieron Pencina et al9
.Se estimó la utilidad clínica y el beneficio neto de los valores originales (basales) en comparación con los valores dinámicos utilizando el análisis de la curva de decisión (DCA), tal como propusieron Vickers et al10. El DCA muestra la utilidad clínica de cada nuevo modelo según un continuo de posibles umbrales de eventos adversos (eje x) y el beneficio neto de utilizar el modelo para estratificar a los pacientes en riesgo (eje y) en relación con suponer que ningún paciente sufrirá un evento adverso. En este estudio, los modelos de predicción se representan con líneas de colores. Cuanto más se alejen los modelos de predicción de la línea negra discontinua (asumir que todos los pacientes sufrirán un evento adverso) y la línea negra horizontal (asumir que ningún paciente sufrirá un evento adverso), mayor será el beneficio clínico neto.
Se aceptó un valor de p <0,05 como estadísticamente significativo. Se hicieron análisis estadísticos utilizando el software SPSS v. 25,0 (SPSS, Estados Unidos), Origin v. 2022, (OriginLab Corporation, Estados Unidos), MedCalc v. 16.4.3 (software MedCalc bvba, Bélgica), STATA v. 16,0 (Stata Corp, Estados Unidos) y el paquete PredictABEL para R v. 4.1.2 para Windows.
RESULTADOSEste estudio incluyó a 1.361 pacientes, de los que 693 (50,9%) eran mujeres, con una mediana de edad de 76 [71-81] años. En la tabla 1 se muestra un resumen de otras características basales.
Características clínicas basales
| N=1.361 | |
|---|---|
| Datos demográficos | |
| Varones | 663 (48,7) |
| Edad (años) | 76 [71-81] |
| Comorbilidades | |
| Hipertensión | 1.116 (82,0) |
| Diabetes mellitus | 363 (26,7) |
| Insuficiencia cardiaca | 429 (31,5) |
| Antecedentes de ictus/AIT/tromboembolias | 267 (19,6) |
| Insuficiencia renal | 144 (10,6) |
| Enfermedad coronaria | 255 (18,7) |
| Hipercolesterolemia | 443 (32,5) |
| Fumador habitual | 210 (15,4) |
| Consumidor de alcohol | 50 (3,7) |
| Antecedentes de hemorragia previa | 113 (8,3) |
| Enfermedad maligna concomitante | 105 (7,7) |
| Tratamiento concomitante | |
| Amiodarona | 77 (5,7) |
| Digoxina | 272 (20,0) |
| Antagonistas del calcio | 339 (25,0) |
| Bloqueadores beta | 470 (34,5) |
| Estatinas | 331 (24,3) |
| Diuréticos | 614 (45,1) |
| Antiagregantes plaquetarios | 243 (18,0) |
| IECA/ARA-II | 717 (52,7) |
AIT: accidente isquémico transitorio; ARA-II: antagonistas del receptor de la angiotensina II; IECA: inhibidores de la enzima de conversión de la angiotensina.
Los valores expresan n (%) o mediana [intervalo intercuartílico].
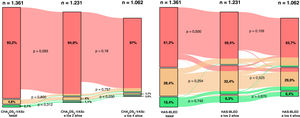
El valor basal medio de la escala CHA2DS2-VASc fue 4,0±1,7, mientras que el valor medio de CHA2DS2-VASc a los 2 años fue 4,3±1,6 y a los 4 años, 4,5±1,6. Comparado con el valor basal de la escala CHA2DS2-VASc, al cabo de 2 y 4 años los valores fueron considerablemente mayores (en ambos casos, p <0,001). El valor de la escala CHA2DS2-VASc a los 4 años también fue considerablemente mayor que el CHA2DS2-VASc a los 2 años (p <0,001). En consecuencia, las proporciones de los participantes clasificados como en riesgo bajo, moderado o alto según el valor basal de la escala CHA2DS2-VASc fueron el 2,1% (28), el 4,8% (65) y el 93,2% (1.268) respectivamente. De los 1.062 pacientes que estaban vivos al cabo de 4 años, se clasificó a 8 (0,8%) como pacientes en bajo riesgo, a 24 (2,3%) como en riesgo moderado y a 1.030 (97,0%) como en riesgo alto por el valor recalculado de la escala CHA2DS2-VASc (figura 1).
Diagramas aluviales que muestran la estratificación de los riesgos basales de ictus y de hemorragia (CHA2DS2-VASc y HAS-BLED basales) y su reclasificación en distintas categorías de riesgo durante el seguimiento. Verde, riesgo bajo de ictus o hemorragia; naranja, riesgo moderado de ictus o hemorragia; rojo, riesgo alto de ictus o hemorragia.
El valor medio de la escala HAS-BLED fue 2,7±1,2 al inicio, 2,9±1,3 al cabo de 2 años y 3,1±1,2 al cabo de 4 años. Comparados con el valor basal de la escala HAS-BLED, los valores de HAS-BLED a los 2 y a los 4 años fueron considerablemente mayores (ambos, p <0,001). El valor de HAS-BLED a los 4 años también fue considerablemente mayor que el de HAS-BLED a los 2 años (p <0,001). Al inicio, las proporciones de participantes clasificados como en riesgo bajo, moderado o alto mediante la escala HAS-BLED fueron del 10,4% (n=141), el 28,4% (n=387) y el 61,2% (n=833) respectivamente. De los 1.062 pacientes que estaban vivos al cabo de 4 años, 68 (6,4%) se clasificaron como pacientes en riesgo bajo, 318 (29,9%) como en riesgo moderado y 676 (63,7%) como en riesgo alto por el valor recalculado de la escala HAS-BLED (figura 1).
Objetivos primarios y capacidad predictivaDurante los 6 años de seguimiento, 156 pacientes (11,5%) sufrieron un ictus isquémico/AIT y 269 (19,8%), un evento de hemorragia mayor. Además, 472 pacientes (34,68%) fallecieron. El periodo con mayores tasas de incidencia de ictus isquémico/AIT y hemorragia mayor fue el del año 2 al 4, lo cual pone de relieve una razón de tasa de incidencia considerablemente mayor respecto a los demás para los eventos de hemorragia mayor. En el apéndice C y la tabla 1 del material adicional se da información complementaria sobre resultados clínicos e incidencias entre los distintos periodos.
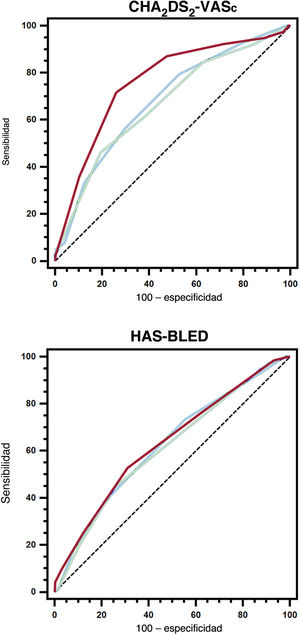
La probabilidad de sufrir un ictus isquémico/AIT aumentó al utilizar el valor recalculado de la escala CHA2DS2-VASc, y es en la evaluación a los 4 años donde se observa la mayor hazard ratio incluso después del ajuste (tabla 2 del material adicional). Con respecto al rendimiento predictivo de ictus isquémico/AIT, el valor recalculado de la CHA2DS2-VASc al cabo de 2 años tenía una capacidad predictiva considerablemente mayor en el periodo del año 2 al 4 comparado con el valor basal, mientras que el IDI y el NRI mostraron mejoras en la sensibilidad y la reclasificación (tabla 2). Asimismo, el valor recalculado de la escala CHA2DS2-VASc a los 4 años proporcionó un rendimiento predictivo de ictus isquémico/AIT considerablemente mejor durante el periodo del año 4 al 6 comparado con el valor basal (figura 2). De nuevo, el IDI mostró una mejora de la sensibilidad y hubo un aumento de la capacidad de reclasificación basada en el NRI (tabla 2).
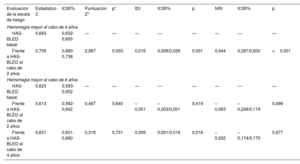
Estadísticos C, comparación de los estadísticos c, IDI y NRI del valor dinámico de la escala CHA2DS2-VASc frente al valor original
| Evaluación de la escala de riesgo | Estadístico C | IC95% | Puntuación Z* | p* | IDI | IC95% | p | NRI | IC95% | p |
|---|---|---|---|---|---|---|---|---|---|---|
| Ictus isquémico/AIT a los 4 años | ||||||||||
| CHA2DS2-VASc basal | 0,604 | 0,576-0,631 | — | — | — | — | — | — | — | — |
| CHA2DS2-VASc al cabo de 2 años | 0,701 | 0,675-0,727 | 3,628 | <0,001 | 0,014 | 0,007/0,020 | <0,001 | 0,677 | 0,427/0,926 | <0,001 |
| Ictus isquémico/AIT a los 6 años | ||||||||||
| CHA2DS2-VASc basal | 0,682 | 0,653-0,710 | — | — | — | — | — | — | — | — |
| CHA2DS2-VASc al cabo de 2 años | 0,670 | 0,640-0,697 | 0,889 | 0,374 | 0,002 | –0,001/0,004 | 0,211 | 0,209 | –0,092/0,511 | 0,173 |
| CHA2DS2-VASc al cabo de 4 años | 0,761 | 0,734-0,786 | 2,234 | 0,026 | 0,030 | 0,016/0,044 | <0,001 | 0,757 | 0,496/1,018 | <0,001 |
IC95%: intervalo de confianza del 95%; IDI: mejora de la discriminación integrada; NRI: mejora neta de la reclasificación.
Curvas de las características operativas del receptor de los valores basales y dinámicos (al cabo de 2 y 4 años) de las escalas CHA2DS2-VASc y HAS-BLED para predecir ictus isquémico/AIT o hemorragia mayor. Línea azul, valores basales; línea verde, valores recalculados a los 2 años; línea roja, valores recalculados a los 4 años.
Tal y como ocurría con el ictus, la probabilidad de hemorragia mayor fue más alta con el HAS-BLED recalculado (tabla 3 del material adicional). A los 2 años, el valor recalculado de HAS-BLED también mostró una capacidad predictiva de eventos de hemorragia mayor considerablemente más añta que el valor basal durante el periodo del año 2 al 4. El IDI y el NRI demostraron mejoras considerables respecto al valor basal de HAS-BLED (tabla 3). Para las hemorragias mayores en el periodo del año 4 al 6, el estadístico C del valor de la escala HAS-BLED recalculado a los 4 años fue numéricamente mayor, pero no estadísticamente significativo comparado con el valor basal. Hubo un ligero aumento de la sensibilidad evaluada por el IDI, pero no fue significativamente mejor la reclasificación con el NRI (tabla 3).
Estadísticos C, comparación de los estadísticos c, IDI y NRI del valor dinámico de la escala HAS-BLED frente al valor basal
| Evaluación de la escala de riesgo | Estadístico C | IC95% | Puntuación Z* | p* | IDI | IC95% | p | NRI | IC95% | p |
|---|---|---|---|---|---|---|---|---|---|---|
| Hemorragia mayor al cabo de 4 años | ||||||||||
| HAS-BLED basal | 0,663 | 0,632-0,693 | — | — | — | — | — | — | — | — |
| Frente a HAS-BLED al cabo de 2 años | 0,709 | 0,680-0,738 | 2,987 | 0,003 | 0,016 | 0,006/0,026 | 0,001 | 0,444 | 0,287/0,600 | <0,001 |
| Hemorragia mayor al cabo de 6 años | ||||||||||
| HAS-BLED basal | 0,623 | 0,593-0,652 | — | — | — | — | — | — | — | — |
| Frente a HAS-BLED al cabo de 2 años | 0,613 | 0,582-0,642 | 0,467 | 0,640 | –0,001 | –0,003/0,001 | 0,419 | –0,063 | –0,246/0,119 | 0,498 |
| Frente a HAS-BLED al cabo de 4 años | 0,631 | 0,601-0,660 | 0,318 | 0,751 | 0,009 | 0,001/0,016 | 0,018 | –0,002 | –0,174/0,170 | 0,977 |
IC95%: intervalo de confianza del 95%; IDI: mejora de la discriminación integrada; NRI: mejora neta de la reclasificación.
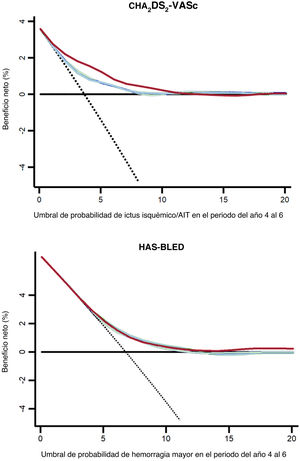
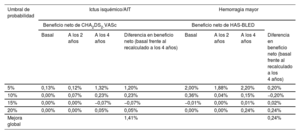
Las DCA podrían ayudar en la estimación de pacientes que sufrirán alguno de los objetivos primarios según las predicciones de las escalas de riesgo basal en comparación con las recalculadas a los 2 y 4 años de seguimiento. En la figura 3, los modelos de predicción que están más alejados de la línea negra discontinua (asumir que todos los pacientes sufrirán un evento adverso) y la línea negra horizontal (asumir que ningún paciente sufrirá un evento adverso) presentaron el mayor beneficio neto. Las DCA demostraron que utilizar los valores dinámicos de las escalas CHA2DS2-VASc y HAS-BLED fue clínicamente útil y proporcionó una mejora global del beneficio neto a la hora de predecir ictus isquémico/AIT y hemorragia mayor. En la tabla 4 se muestra una estimación detallada del beneficio neto en cada umbral de probabilidades desde el 0 al 20%. En la figura 4 se muestra un resumen de todos los resultados del estudio.
Curva de análisis de decisión de los valores basales y dinámicos (a 2 y 4 años) de las escalas CHA2DS2-VASc y HAS-BLED para ictus isquémico/AIT o hemorragia mayor. Línea negra continua, se presume que todos los pacientes sufrirán un evento adverso; línea negra discontinua, se presume que ningún paciente sufrirá eventos adversos; línea azul, valores basales; línea verde, valores recalculados al cabo de 2 años; línea roja, valores recalculados al cabo de 4 años.
Beneficios netos con los valores basales, a los 2 años y a los 4 años de las escalas CHA2DS2-VASc/HAS-BLED a distintos umbrales de probabilidad
| Umbral de probabilidad | Ictus isquémico/AIT | Hemorragia mayor | ||||||
|---|---|---|---|---|---|---|---|---|
| Beneficio neto de CHA2DS2-VASc | Beneficio neto de HAS-BLED | |||||||
| Basal | A los 2 años | A los 4 años | Diferencia en beneficio neto (basal frente al recalculado a los 4 años) | Basal | A los 2 años | A los 4 años | Diferencia en beneficio neto (basal frente al recalculado a los 4 años) | |
| 5% | 0,13% | 0,12% | 1,32% | 1,20% | 2,00% | 1,88% | 2,20% | 0,20% |
| 10% | 0,00% | 0,07% | 0,23% | 0,23% | 0,36% | 0,04% | 0,15% | −0,20% |
| 15% | 0,00% | 0,00% | −0,07% | −0,07% | −0,01% | 0,00% | 0,01% | 0,02% |
| 20% | 0,00% | 0,00% | 0,05% | 0,05% | 0,00% | 0,00% | 0,24% | 0,24% |
| Mejora global | 1,41% | 0,24% | ||||||
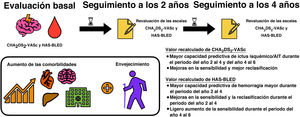
En este estudio de cohortes de la práctica clínica real, nuestros principales resultados son los siguientes: a) la revaluación consecutiva del riesgo de ictus y de hemorragia mediante las escalas CHA2DS2-VASc y HAS-BLED demostró una capacidad predictiva y un beneficio neto significativamente mayores respecto a los valores basales, y b) los riesgos de ictus y de hemorragia de los pacientes con FA son dinámicos y cambian durante el seguimiento.
La incidencia de nuevos factores de riesgo y las tendencias temporales de la escala CHA2DS2-VASc se han investigado con anterioridad. Chao et al5 incluyeron a 14.606 pacientes con FA que no recibían antiagregantes plaquetarios ni ACO, con valores basales de la escala CHA2DS2-VASc de 0 (varones) o 1 (mujeres) y con factores de riesgo incidentes, y observaron un aumento dinámico de los valores de la escala CHA2DS2-VASc5. Ciertamente, esto a menudo se traduce en un cambio dinámico en la categoría de riesgo6,11,12. En un estudio reciente se demostró que los cambios en la escala CHA2DS2-VASc a lo largo del tiempo estaban asociados con la incidencia de ictus, lo que indica que el riesgo de ictus no es estático13. De hecho, el valor de la escala CHA2DS2-VASc en pacientes con FA aumenta a medida que envejecen y acumulan más enfermedades concomitantes, y se observa un significativo aumento progresivo de la escala CHA2DS2-VASc en consonancia con la literatura publicada anteriormente5,6,11, lo que volvería a destacar la naturaleza dinámica del riesgo tromboembólico.
Aunque el concepto de revaluación del riesgo está bien aceptado5,14,15, en las guías clínicas previas no se proporcionan recomendaciones claras y concisas sobre esta cuestión. El panorama ha cambiado con la publicación de las últimas guías internacionales, que insisten en la necesidad de realizar una evaluación dinámica, como mínimo anualmente, del riesgo tromboembólico1,2,16-19. No obstante, la periodicidad con que debería revaluarse este riesgo tromboembólico es controvertido. En un estudio publicado por Chao et al5, el valor de la escala CHA2DS2-VASc de los pacientes inicialmente clasificados como en bajo riesgo aumentó en aproximadamente un 12,1% al año. Por consiguiente, los autores proponen que el riesgo de ictus de los pacientes en bajo riesgo debería revaluarse cada 4 meses, con el objetivo de prescribir un tratamiento con ACO a aquellos cuyo valor en la escala CHA2DS2-VASc haya aumentado.
Las guías recomiendan utilizar la escala HAS-BLED para evaluar el riesgo de hemorragia y proponen una revaluación frecuente de los pacientes con un riesgo de hemorragia alto (HAS-BLED ≥ 3)1,2,16,18-21 con especial atención a los factores de riesgo de hemorragia modificables. Aunque la naturaleza dinámica de las variables asociadas con la hemorragia está bien aceptada, en pocos estudios se ha investigado de manera específica esta cuestión. Como sucede con el riesgo de ictus, la evaluación del riesgo de hemorragia a menudo solo se hace al inicio, al comienzo del tratamiento con ACO, mientras que los eventos hemorrágicos pueden observarse muchos años después. Esto puede reflejar que la evaluación del riesgo de hemorragia se ha visto sujeta a mal uso e interpretación errónea, y que los factores de riesgo de hemorragia modificables deberían abordarse como parte de un enfoque holístico de la evaluación y el tratamiento de los pacientes con FA22. Estratificar el riesgo de hemorragia debería servir para identificar a los pacientes con alto riesgo de hemorragia grave y realizar un seguimiento más cuidadoso y riguroso para resolver los factores modificables y reducir el posible riesgo de hemorragia mayor. Este enfoque se ha comprobado de manera prospectiva en el ensayo mAFA-II, donde en el grupo en el que se utilizó la escala HAS-BLED se observó un menor riesgo de hemorragia al cabo de 1 año y un aumento del uso de ACO comparado con el tratamiento habitual, con el que se constataron más hemorragias y una disminución del uso de ACO23.
En un estudio centrado en la naturaleza dinámica del riesgo de hemorragia se observó que con evaluaciones dinámicas de la escala HAS-BLED mejoraba la capacidad predictiva del riesgo comparado con una única evaluación basal para predecir hemorragia mayor24. Estos resultados se parecen a los observados en nuestro estudio, donde la capacidad predictiva de la escala HAS-BLED calculada al cabo de 2 años fue significativamente mejor que la evaluación inicial. Aunque no hubo diferencias significativas entre el valor dinámico de HAS-BLED a los 4 años y el valor basal, el valor dinámico mostró una ligera mejora de la sensibilidad y la utilidad clínica global y el beneficio neto de los valores dinámicos de HAS-BLED siguieron siendo mayores.
En conjunto, nuestros resultados refuerzan los resultados de estudios anteriores, puesto que el uso de los valores dinámicos de las escalas CHA2DS2-VASc y HAS-BLED se asoció con un mayor beneficio neto y, por lo tanto, a una mayor utilidad clínica que los valores basales. Aunque actualmente la evaluación y la revaluación dinámicas de los riesgos de ictus y de hemorragia están bien aceptadas, en muchas guías de práctica clínica internacionales sobre FA aún no se incluyen recomendaciones claras y concisas sobre cómo realizar y abordar este control dinámico del riesgo. Las guías sobre FA de la Asia Pacific Heart Rhythm Society de 2021 proporcionan recomendaciones sobre la naturaleza dinámica del riesgo en pacientes con FA, en las que se propone la revaluación frecuente de los pacientes con FA con las escalas CHA2DS2-VASc y HAS-BLED2,25.
En nuestro estudio se muestra que los cambios en el valor global de CHA2DS2-VASc también corresponden a variaciones en la categoría de riesgo de los pacientes con FA, que muestran un aumento evolutivo en la proporción de pacientes clasificados dentro del grupo en alto riesgo, en detrimento de una disminución en la proporción de pacientes con riesgo bajo y moderado. Por esta razón, la revaluación periódica del riesgo de ictus es de particular interés en los pacientes clasificados como en bajo riesgo por un valor basal de la escala CHA2DS2-VASc (es decir, 0 los varones y 1 las mujeres) ya que estos pacientes no requieren ACO, pero el envejecimiento, los nuevos factores de riesgo y las comorbilidades cambiarían el valor global de la escala CHA2DS2-VASc y, en consecuencia, los ACO podrían estar indicados15,26,27. Aunque hay un interés clínico especial en revaluar la escala CHA2DS2-VASc para reconsiderar la decisión de iniciar ACO en estos pacientes inicialmente clasificados como en bajo riesgo, también es importante revaluar el riesgo de ictus de los pacientes con FA con alto riesgo ya tratados con ACO. De hecho, las tasas de ictus pueden variar de forma considerable entre los pacientes con CHA2DS2-VASc de 3-9, a pesar de que todos ellos se hallan en la misma categoría de alto riesgo, y no todos los factores de riesgo de ictus tienen el mismo impacto28. Además, muchos de los factores de riesgo de ictus son también factores de riesgo de hemorragia, por lo que podrían identificarse factores de riesgo modificables para abordarlos y reducirlos de manera apropiada en los pacientes en alto riesgo.
LimitacionesEste estudio tiene algunas limitaciones. En primer lugar, está limitado por su población mayormente caucásica y por el diseño unicéntrico. En segundo lugar, aunque se excluyó a los pacientes con prótesis valvulares, no se pudo disponer de datos sobre otras enfermedades valvulares que pudiesen tener algún impacto en los eventos adversos de estos pacientes con FA. En tercer lugar, durante los 6 meses anteriores a su inclusión en el estudio, todos los pacientes se mantuvieron estables con antagonistas de la vitamina K (INR 2,0-3,0) y no padecieron eventos adversos ni inestabilidad hemodinámica para asegurar la homogeneidad, ya que estos factores pueden influir en el riesgo inicial y en los posteriores resultados clínicos. Por consiguiente, puede que la cohorte del presente estudio tenga un riesgo tromboembólico y hemorrágico basal menor. Esto puede haber interferido con los valores basales de las escalas CHA2DS2-VASc y HAS-BLED y subestimar su capacidad predictiva en comparación con la estimación dinámica del riesgo. Puede que estos criterios de selección estrictos no reflejen la práctica clínica habitual, pero creemos que esta homogeneización inicial de la población limita la posibilidad de que algunas variables que generan inestabilidad actuaran como factores de confusión, y el seguimiento prolongado acorde a la práctica clínica habitual hace que esta cohorte sea apropiada. Algunos de los ictus isquémicos que se produjeron durante el seguimiento pueden deberse a razones no cardioembólicas y no se han investigado con detalle. No obstante, el seguimiento de los participantes fue riguroso y se registraron todos los episodios (incluso los más tempranos).
Reconocemos que, en conjunto, estos factores limitan la generalización de los resultados a poblaciones más amplias y diversas, incluso los pacientes tratados con ACO de acción directa, y que la cohorte podría no ser representativa de la población más amplia de pacientes con FA, sobre todo aquellos en mayor riesgo.
Aunque el conjunto de datos se obtuvo de manera prospectiva, la evaluación basal y la revaluación de los valores de riesgo se realizaron post hoc, lo que podría introducir posibles sesgos. Así pues, estos resultados deberían interpretarse con prudencia y únicamente como generadores de hipótesis. Por último, no pudo investigarse el cambio (delta) CHA2DS2-VASc o delta HAS-BLED, ya que el tamaño de la muestra es pequeño y los diversos periodos de observación (relativamente cortos) no permitieron evaluar de manera adecuada este parámetro.
CONCLUSIONESEn pacientes con FA, los riesgos de ictus y de hemorragia son dinámicos y cambian con el tiempo, la edad y las comorbilidades incidentes. Los valores de las escalas CHA2DS2-VASc y HAS-BLED (y los perfiles de riesgo clínico) deberían revaluarse regularmente, lo cual es necesario sobre todo para predecir de manera apropiada los riesgos de ictus y de hemorragia.
- -
La fibrilación auricular (FA) se asocia con alto riesgo de ictus y tromboembolia.
- -
La evaluación del riesgo en la FA suele llevarse a cabo al inicio, como una evaluación puntual que considera el riesgo un proceso estático.
- -
Los riesgos de ictus y de hemorragia son dinámicos, lo que puede aumentar los valores basales de las escalas CHA2DS2-VASc y HAS-BLED.
- -
Tanto el valor de la escala CHA2DS2-VASc como el de la HAS-BLED fueron considerablemente más altos al cabo de 2 y 4 años.
- -
El valor recalculado de la escala CHA2DS2-VASc al cabo de 2 y 4 años presentó una capacidad predictiva de ictus isquémico/AIT considerablemente mayor que el basal durante los periodos del año 2 al 4 y del año 4 al 6.
- -
A los 2 años, el valor recalculado de HAS-BLED también mostró una capacidad predictiva de hemorragia mayor considerablemente mayor que el valor basal durante el periodo del año 2 al 4.
- -
Los valores dinámicos de las escalas CHA2DS2-VASc y HAS-BLED fueron clínicamente útiles y proporcionaron una mejora global del beneficio neto a la hora de predecir ictus isquémico/AIT y hemorragia mayor.
- -
Los valores de las escalas CHA2DS2-VASc y HAS-BLED deberían revaluarse regularmente.
Este trabajo fue financiado por el Ministerio de Economía, Industria y Competitividad de España, a través del Instituto de Salud Carlos III, tras la revisión de expertos independientes (subvención de investigación PI17/01375 cofinanciada por el Fondo Europeo de Desarrollo Regional) y el grupo CB16/11/00385 de CIBERCV.
CONSIDERACIONES ÉTICASEl comité de ética del Hospital General Universitario Morales Meseguer aprobó el protocolo del estudio según las normas éticas establecidas en la Declaración de Helsinki de 1964. Todos los pacientes proporcionaron el consentimiento informado para participar. En esta investigación se tuvieron en cuenta las posibles variables de sexo y género según las directrices SAGER. De hecho, el estudio está equilibrado entre participantes varones y mujeres (el 48,7 y el 51,3%).
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIALNo se utilizaron herramientas de inteligencia artificial para la preparación de este artículo.
CONTRIBUCIÓN DE LOS AUTORESM.J. Serna, J.M. Rivera-Caravaca y V. Roldán contribuyeron a la obtención de datos, realizaron los análisis estadísticos y redactaron el artículo. E. Soler-Espejo y R. López-Gálvez realizaron la revisión crítica del artículo. G.Y.H. Lip y F. Marín concibieron y supervisaron el estudio y realizaron la revisión crítica del artículo. Todos los autores discutieron y aprobaron la versión final del artículo.
CONFLICTO DE INTERESESG.Y.H. Lip es asesor y conferenciante de BMS/Pfizer, Boehringer Ingelheim y Daiichi-Sankyo. No ha recibido subvenciones personales. J.M. Rivera-Caravaca es asesor de Idorsia Pharmaceuticals LTD. Los demás autores no tienen nada que declarar.