La trombolisis sistémica (TS) en la tromboembolia pulmonar aguda (TEP) de riesgo intermedio-alto (RIA) y alto (RA) mejora los parámetros clínicos y hemodinámicos a costa de un aumento del riesgo de hemorragias, por lo que está infrautilizada1. En un intento de disminuir este riesgo y aumentar las terapias de reperfusión, se han comenzado a aplicar terapias dirigidas por catéter (TDC), en el marco de grupos multidisciplinarios llamados equipos de respuesta rápida al TEP (PERT)2. Actualmente la TDC está recomendada para pacientes con contraindicación para la TS y TEP RA (IIa C) y se puede considerar en caso de deterioro hemodinámico en el RIA3. Experiencias previas publicadas muestran resultados positivos y prometedores2.
Se realizó un registro observacional prospectivo de pacientes consecutivos (hospitalarios) en un solo centro dentro de un programa PERT y basado en un protocolo validado en el hospital en una comisión de enfermedades tromboembólicas. El equipo de hemodinámica de guardia encargado del código infarto se encarga también de la TDC, por lo que la atención es continua (24/7). El médico intensivista es quien activa el PERT tras el diagnóstico y el consenso con urgencias y cardiología. Todos los pacientes firmaron un consentimiento en el que se especifica que se trata de un tratamiento alternativo al estándar con anticoagulación. Nuestro PERT establece realizar TDC emergente en RA (siempre con contraindicación para TS), y de manera urgente (en menos de 12 h) en RIA.
Se trató con TDC a un total de 65 pacientes (tabla 1) entre 2017-2019 (el 90% de los pacientes ingresados en UCI por TEP). Se incluyó a pacientes con TEP de RIA y RA confirmado por tomografía según los criterios de estratificación de riesgo recomendados por las guías de práctica clínica, que incluyen estabilidad hemodinámica, elevación de marcadores y afección del ventrículo derecho según parámetros de ecocardiograma.
Características de la muestra
| Características y presentación clínica | |
| Pacientes, n | 65 |
| Edad (años) | 60,6±1,9 |
| Factor predisponente | 11 (16,90) |
| Intermedio-alto | 58 (89,20) |
| Alto | 7 (10,7) |
| Disnea | 47 (72,30) |
| Dolor torácico | 20 (30,30) |
| PCR/shock | 4 (6,1) |
| Síncope | 21 (32,30) |
| sPESI=1 punto | 26 (40) |
| sPESI ≥ 2 puntos | 39 (60) |
| Lactato arterial (mg/dl) | 22,9±2,06 |
| PaO2 basal (mmHg) | 58,09±1,86 |
| Datos del procedimiento | |
| Acceso venoso cefálica/basílica | 60 (92,30) |
| Acceso venoso femoral | 5 (7,70) |
| Tiempo diagnóstico-procedimiento (h) | 19,42±4,4 |
| Fragmentación mecánica | 44 (67,70) |
| Tromboaspiración | 7 (10,70) |
| Perfusión de r-TPA | 60 (92,30) |
| Dosis media absoluta (mg) | 21,03±0,8 |
| Duración media (h) | 21,68±0,6 |
| Bolo de r-TPA | 12 (18,50) |
| Dosis media de bolo (mg) | 7,25±0,7 |
PaO2: presión arterial de oxígeno; PCR: parada cardiorrespiratoria; r-TPA: activador del plasminógeno tisular; sPESI: puntuación PESI simplificada.
Salvo otra indicación, los valores expresan n (%) o media±desviación estándar.
A criterio del operador y basado en la carga trombótica, la situación hemodinámica y las presiones derechas, la TDC varió entre: fragmentación mecánica, aspiración manual/mecánica, y/o trombolisis local con activador tisular de plasminógeno (r-TPA), en forma de bolo (2,5-10mg) y/o infusión continua de 0,5-1mg/h (12-24 h) combinado con el tratamiento anticoagulante con heparina sódica ajustada al peso. En los casos de RIA se utilizó trombolisis local y fragmentación (catéter pigtail de 5-6 Fr) si había oclusión de ramas principales o lobulares importantes. En caso de RA, se realizaron ambos procedimientos y además aspiración (catéteres de intervención coronaria). Esta última se realizó también en algún caso de RIA por alta carga trombótica. Se revaluó a los pacientes por hemodinámica y angiografía a las 24 h.
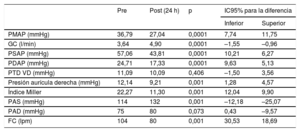
Se definió un objetivo de eficacia (disminución de la presión media de la arteria pulmonar de 5mmHg o aumento del gasto cardiaco en 0,5 l/min), que se alcanzó en el 90% de los casos. Se analizaron los datos hemodinámicos antes y después de la TDC, y se comprobó un descenso de la presión arterial pulmonar media del 28% y un aumento del gasto cardiaco del 34%. También se produjo disminución de la carga trombótica según la puntuación Miller (tabla 2). Como objetivo de seguridad, se analizó la incidencia de hemorragia mayor (BARC ≥ 3).
Resultados hemodinámicos (prueba de la t de Student para comparación de muestras emparejadas)
| Pre | Post (24 h) | p | IC95% para la diferencia | ||
|---|---|---|---|---|---|
| Inferior | Superior | ||||
| PMAP (mmHg) | 36,79 | 27,04 | 0,0001 | 7,74 | 11,75 |
| GC (l/min) | 3,64 | 4,90 | 0,0001 | –1,55 | –0,96 |
| PSAP (mmHg) | 57,06 | 43,81 | 0,0001 | 10,21 | 6,27 |
| PDAP (mmHg) | 24,71 | 17,33 | 0,0001 | 9,63 | 5,13 |
| PTD VD (mmHg) | 11,09 | 10,09 | 0,406 | –1,50 | 3,56 |
| Presión aurícula derecha (mmHg) | 12,14 | 9,21 | 0,001 | 1,28 | 4,57 |
| Índice Miller | 22,27 | 11,30 | 0,001 | 12,04 | 9,90 |
| PAS (mmHg) | 114 | 132 | 0,001 | –12,18 | –25,07 |
| PAD (mmHg) | 75 | 80 | 0,073 | 0,43 | –9,57 |
| FC (lpm) | 104 | 80 | 0,001 | 30,53 | 18,69 |
FC: frecuencia cardiaca; GC: gasto cardiaco; PAD: presión arterial diastólica; PAS: presión arterial sistólica; PDAP: presión diastólica de la arteria pulmonar; PMAP: presión media de la arteria pulmonar; PSAP: presión sistólica de la arteria pulmonar; PTD VD: presión telediastólica del ventrículo derecho.
Hubo 2 muertes hospitalarias (3,07%), 1 por complicación respiratoria tardía (36 días) en una paciente con enfermedad de Steinert y afección de la musculatura respiratoria y otra secundaria a hemorragia intracraneal en un paciente con síncope y traumatismo craneal. La mortalidad a 30 días fue del 1,53% (solo 1 muerte, hospitalaria). La incidencia de hemorragia mayor fue del 3% (2 hemorragias cerebrales, ambas en pacientes con síncope y traumatismo craneal).
Actualmente el tratamiento percutáneo de la TEP se encuentra en fases iniciales y no existen un procedimiento estándar ni dispositivos totalmente específicos. Se desconoce también cuándo y con qué demora realizarlo, y en qué perfil de pacientes. Sin embargo, la evidencia publicada en TDC concuerda en cuanto a la seguridad y la eficacia.
Nuestros resultados son similares a los de estudios previos, con una mortalidad hospitalaria similar a la del SEATTLE4 (3%) y menor que la del PERFECT5 (6%). La mejoría hemodinámica se logra con una tasa de complicaciones hemorrágicas baja, menor que en ensayos con TS. Estudios como SEATTLE4 o PERFECT5 ya habían demostrado que métodos mecánicos y fibrinolíticos a dosis bajas mejoraban la hemodinámica con bajo riesgo hemorrágico.
La incidencia de hemorragia mayor con este abordaje está influida por 3 factores: la dosis de fármaco y su distribución a lo largo de 24 h (frente a dosis habituales de 50-100 μg de r-TPA en 1-2 h de TS), el tipo de acceso vascular (solo el 7% por la vena femoral frente al 80% en el SEATTLE4, lo que puede minimizar las hemorragias al hacerlas fácilmente identificables y controlables) y la forma de presentación clínica. En nuestra serie las 2 hemorragias cerebrales fueron tras un síncope con traumatismo craneal, por lo que creemos que no se debe tratar a estos pacientes con TDC que incluya trombolisis.
Como conclusión, pese a las limitaciones del tamaño muestral, el abordaje con TDC de la TEP es eficaz y seguro, y mejoran parámetros hemodinámicos y clínicos, con una tasa de complicaciones hemorrágicas aceptable. Este registro puede abrir la puerta a otros más amplios que aporten mayor evidencia.