El impacto de la fibrilación auricular en el pronóstico del infarto de miocardio sigue siendo controvertido. Se analizó la importancia pronóstica de la fibrilación auricular previa y de nueva aparición (de novo) en el hospital y a largo plazo en el infarto agudo de miocardio.
MétodosEstudio prospectivo de 4.284 pacientes con infarto agudo de miocardio con elevación del segmento ST. Se estudió la mortalidad por todas las causas hospitalaria y a largo plazo (mediana, 7,2 años) mediante modelos ajustados.
ResultadosEl 3,2% de los pacientes tenían fibrilación auricular previa y el 9,8%, de novo. En general ambos grupos de pacientes tenían un perfil de mayor riesgo basal y mayor probabilidad de complicaciones intrahospitalarias. La mortalidad bruta hospitalaria fue mayor entre los pacientes con fibrilación auricular previa que en la de novo (el 22 frente al 12%; p<0,001; 30 frente al 10%; p<0,001). La densidad de incidencia de mortalidad a largo plazo fue de 11,11/100 pacientes-año en la fibrilación auricular previa y 5,35/100 pacientes-año en la de novo (ambos grupos, p<0,001). Únicamente la fibrilación auricular de novo (odds ratio=1,55; intervalo de confianza del 95%, 1,08-2,22) fue predictor independiente de mortalidad hospitalaria. La fibrilación auricular previa (hazard ratio=1,24; intervalo de confianza del 95%, 0,94-1,64) y la de novo (hazard ratio=0,98; intervalo de confianza del 95%, 0,80-1,21) no resultaron predictores independientes de mortalidad a largo plazo.
ConclusionesLa fibrilación auricular de novo durante el ingreso es un factor independiente de mortalidad hospitalaria en el infarto agudo de miocardio.
Palabras clave
La fibrilación auricular (FA) probablemente sea la arritmia más frecuente en la población general1, a menudo está infratratada2 y es un hallazgo no excepcional (2-22%) en el infarto agudo de miocardio3,4. El impacto de la FA en el pronóstico hospitalario y tras el alta ha sido objeto de una prolongada controversia en la última década. Mientras algunos estudios muestran asociación independiente con una mayor mortalidad5–19, otros no la encuentran20 y finalmente hay quien la asocia con mejor pronóstico21. Se ha señalado también que la FA que aparece durante el ingreso (FA de novo) es la que podría tener impacto adverso en el pronóstico, en contraste con la FA preexistente (FA previa)8.
El problema conceptual que subyace a esta controversia se basa en considerar la FA como un simple marcador de insuficiencia cardiaca (IC) o como un actor causal que podría per se empeorar la circulación coronaria y la función ventricular, además de contribuir a una mayor activación neurohumoral22. En esta línea, también se ha apuntado que la FA podría incrementar la incidencia de taquiarritmias ventriculares graves23.
Durante los últimos años, la optimización del tratamiento del infarto agudo de miocardio con elevación del segmento ST (IAMCEST) y, especialmente, el incremento de los tratamientos de reperfusión han mejorado el pronóstico disminuyendo la IC y la mortalidad, con lo que cabría esperar menos aparición de FA24. El estudio de las tendencias temporales en la aparición de IC y FA durante el ingreso puede ayudar a aclarar la relación entre ambas.
El objetivo de este estudio es analizar la importancia pronóstica de las FA previa y de novo hospitalarias y tras el alta a largo plazo en pacientes no seleccionados ingresados con diagnóstico de IAMCEST. Como objetivo secundario, se analizó la evolución temporal de la FA de novo y su relación con la aparición de IC durante el ingreso.
MÉTODOSReclutamientoEntre enero de 1998 y enero de 2008, se reclutó a los pacientes con diagnóstico de IAMCEST en las unidades coronarias de dos hospitales de la Región de Murcia: Hospital Universitario Virgen de la Arrixaca (Murcia) y Hospital Universitario de Santa Lucía (Cartagena). Se incluyó a los pacientes en un estudio observacional, longitudinal y prospectivo.
El IAMCEST se definió como dolor torácico típico de duración ≥ 30min y/o elevación de marcadores de necrosis miocárdica, junto con una elevación del segmento ST en ≥ 2 derivaciones precordiales > 0,2mm en V1, V2 o V3 y > 0,1mm en derivaciones laterales (aVL, I) o inferiores (II, III y aVF) o bloqueo de rama izquierda presuntamente nuevo. El estudio fue aprobado por el comité ético y los pacientes dieron su consentimiento por escrito.
Variables. DefinicionesSe consideró FA cualquier ritmo documentado electrocardiográficamente en un registro de 12 derivaciones cuyo ritmo ventricular fuera irregular y no discriminase ondas p y f (flutter). Se consideró FA previa la existencia de diagnóstico previo documentado de FA (electrocardiograma o historia clínica) y FA de novo durante el ingreso, la que aparece durante el ingreso sin diagnóstico de FA previa, es decir, de nuevo diagnóstico. Esta se ha subdividido según su aparición: en las primeras 24h (FA de novo en las primeras 24h) o después durante el ingreso (FA de novo > 24h).
Se consideró complicaciones hemorrágicas graves o mayores las hemorragias cerebrales y retroperitoneales, o en cualquier otra localización, causantes de deterioro hemodinámico y/o necesidad de transfusión de sangre total o hemoderivados.
Se definió angioplastia durante el ingreso como la suma de angioplastia primaria más la realizada durante el ingreso, es decir, la angioplastia diferida o del día siguiente tras fibrinolisis exitosa. Se definió rotura cardiaca como la suma de rotura de pared libre, septo interventricular o cuerda tendinosa mitral.
Se realizó seguimiento tras el alta a largo plazo (mediana, 7,2 años) mediante contacto telefónico, revisión de historias clínicas, seguimiento en consultas externas y revisión de los registros de mortalidad. Para estos análisis se excluyó la mortalidad hospitalaria. La información relativa al seguimiento de los pacientes incluidos en el estudio se consiguió en el 98% de los casos.
Análisis estadísticoSe analizaron los factores asociados con la muerte hospitalaria y la FA de novo durante el ingreso mediante regresión logística binaria multivariable. Se calcularon los odds ratio (OR) y sus respectivos intervalos de confianza del 95% (IC95%). Se empleó la prueba de la χ2 para evaluar la importancia de cada variable en el modelo de predicción de la FA de novo. El análisis de la supervivencia se realizó mediante el método de Kaplan-Meier y el test de Mantel-Haenszel. Se utilizaron modelos jerárquicos de regresión multivariable de Cox para estudiar la mortalidad tras el alta, estimando la hazard ratio (HR) y su IC95% Las variables no gaussianas se transformaron mediante el logaritmo de base decimal. El ajuste del modelo se realizó mediante la inclusión en bloques por método introducir, incluyendo las variables consideradas relevantes según la bibliografía previa: edad, sexo, índice de masa corporal, diabetes mellitus, hipertensión arterial, tabaquismo activo, dislipemia (bloque 1), enfermedad pulmonar obstructiva crónica, neoplasia de reciente diagnóstico (< 1 año), insuficiencia renal crónica, cardiopatía isquémica previa, accidente cerebrovascular previo, clase funcional de la New York Heart Association ≥ II previa (bloque 2), frecuencia cardiaca y presión arterial sistólica a su llegada a urgencias, clase Killip, fracción de eyección del ventrículo izquierdo al ingreso (bloque 3), revascularización mediante angioplastia y fibrinolisis (bloque 4) e IC durante el ingreso (> 24h) (bloque 5). Los supuestos log-lineal y de proporcionalidad de riesgos se comprobaron mediante métodos gráficos. Se estimó la discriminación del modelo final mediante el estadístico C y la calibración mediante el test de Hosmer-Lemeshow. Se calculó el estadístico C de Harrell para los modelos de Cox.
Para el estudio de las tendencias, se empleó el test de tendencias lineales y se consideraron cinco periodos de 2 años según el momento de reclutamiento: periodo 1 (1998–1999), periodo 2 (2000–2001), periodo 3 (2002–2003), periodo 4 (2004–2005) y periodo 5 (2006–enero de 2008). Los valores perdidos por variable fueron en general < 2% en la gran mayoría de las variables (99%). Se consideró estadísticamente significativo un valor de p<0,05. Los análisis se realizaron con PASW, versión 20 (IBM, Estados Unidos) y STATA 9.1 (College Station, Texas, Estados Unidos).
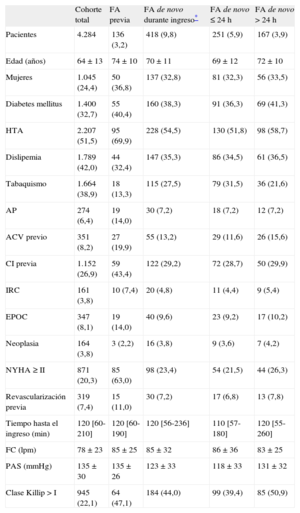
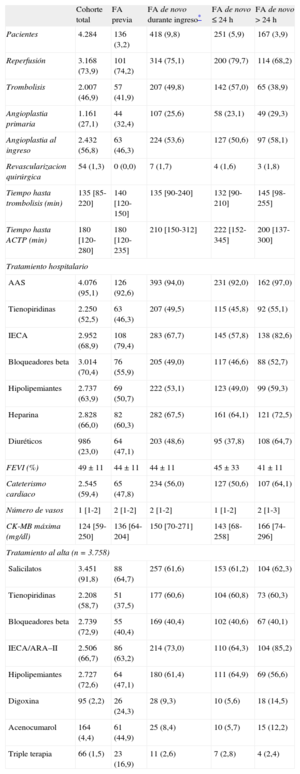
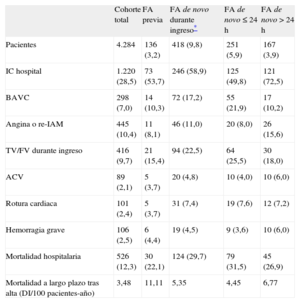
RESULTADOSCaracterísticas basales de la muestraEn la tabla 1 se presentan las características basales de la muestra del estudio (n=4.284). La media de edad era 64 años; el 24,0% eran mujeres. El 3,2% tenía FA previa y el 9,8% contrajo FA de novo (el 60,0% en las primeras 24h). De las que aparecieron tras las primeras 24h, el 80,8% se presentó antes del final del tercer día. El 8,7% de los pacientes con FA de novo que sobrevivieron al ingreso persistían en FA al alta. En la tabla 2 se muestra el tratamiento hospitalario, incluida la terapia de reperfusión, y el tratamiento al alta. La tabla 3 presenta las complicaciones hospitalarias.
Características basales. Antecedentes y situación clínica al ingreso
| Cohorte total | FA previa | FA de novo durante ingreso* | FA de novo ≤ 24 h | FA de novo > 24 h | |
| Pacientes | 4.284 | 136 (3,2) | 418 (9,8) | 251 (5,9) | 167 (3,9) |
| Edad (años) | 64±13 | 74±10 | 70±11 | 69±12 | 72±10 |
| Mujeres | 1.045 (24,4) | 50 (36,8) | 137 (32,8) | 81 (32,3) | 56 (33,5) |
| Diabetes mellitus | 1.400 (32,7) | 55 (40,4) | 160 (38,3) | 91 (36,3) | 69 (41,3) |
| HTA | 2.207 (51,5) | 95 (69,9) | 228 (54,5) | 130 (51,8) | 98 (58,7) |
| Dislipemia | 1.789 (42,0) | 44 (32,4) | 147 (35,3) | 86 (34,5) | 61 (36,5) |
| Tabaquismo | 1.664 (38,9) | 18 (13,3) | 115 (27,5) | 79 (31,5) | 36 (21,6) |
| AP | 274 (6,4) | 19 (14,0) | 30 (7,2) | 18 (7,2) | 12 (7,2) |
| ACV previo | 351 (8,2) | 27 (19,9) | 55 (13,2) | 29 (11,6) | 26 (15,6) |
| CI previa | 1.152 (26,9) | 59 (43,4) | 122 (29,2) | 72 (28,7) | 50 (29,9) |
| IRC | 161 (3,8) | 10 (7,4) | 20 (4,8) | 11 (4,4) | 9 (5,4) |
| EPOC | 347 (8,1) | 19 (14,0) | 40 (9,6) | 23 (9,2) | 17 (10,2) |
| Neoplasia | 164 (3,8) | 3 (2,2) | 16 (3,8) | 9 (3,6) | 7 (4,2) |
| NYHA ≥ II | 871 (20,3) | 85 (63,0) | 98 (23,4) | 54 (21,5) | 44 (26,3) |
| Revascularización previa | 319 (7,4) | 15 (11,0) | 30 (7,2) | 17 (6,8) | 13 (7,8) |
| Tiempo hasta el ingreso (min) | 120 [60-210] | 120 [60-190] | 120 [56-236] | 110 [57-180] | 120 [55-260] |
| FC (lpm) | 78±23 | 85±25 | 85±32 | 86±36 | 83±25 |
| PAS (mmHg) | 135±30 | 135±26 | 123±33 | 118±33 | 131±32 |
| Clase Killip > I | 945 (22,1) | 64 (47,1) | 184 (44,0) | 99 (39,4) | 85 (50,9) |
ACV: accidente cerebrovascular; AP: arteriopatía periférica; CI: cardiopatía isquémica; EPOC: enfermedad pulmonar obstructiva crónica; FA: fibrilación auricular; FC: frecuencia cardiaca; HTA: hipertensión arterial; IC: insuficiencia cardiaca; IRC: insuficiencia renal crónica; NYHA: New York Heart Association; PAS: presión arterial sistólica.
La variable «tiempo hasta el ingreso» se ha estimado como el tiempo transcurrido desde el inicio del primer síntoma torácico o síntoma guía y la llegada al hospital.
Los datos expresan n (%), media±desviación estándar o mediana [intervalo intercuartílico].
Reperfusión y tratamiento hospitalario y al alta
| Cohorte total | FA previa | FA de novo durante ingreso* | FA de novo ≤ 24 h | FA de novo > 24 h | |
| Pacientes | 4.284 | 136 (3,2) | 418 (9,8) | 251 (5,9) | 167 (3,9) |
| Reperfusión | 3.168 (73,9) | 101 (74,2) | 314 (75,1) | 200 (79,7) | 114 (68,2) |
| Trombolisis | 2.007 (46,9) | 57 (41,9) | 207 (49,8) | 142 (57,0) | 65 (38,9) |
| Angioplastia primaria | 1.161 (27,1) | 44 (32,4) | 107 (25,6) | 58 (23,1) | 49 (29,3) |
| Angioplastia al ingreso | 2.432 (56,8) | 63 (46,3) | 224 (53,6) | 127 (50,6) | 97 (58,1) |
| Revascularizacion quirúrgica | 54 (1,3) | 0 (0,0) | 7 (1,7) | 4 (1,6) | 3 (1,8) |
| Tiempo hasta trombolisis (min) | 135 [85-220] | 140 [120-150] | 135 [90-240] | 132 [90-210] | 145 [98-255] |
| Tiempo hasta ACTP (min) | 180 [120-280] | 180 [120-235] | 210 [150-312] | 222 [152-345] | 200 [137-300] |
| Tratamiento hospitalario | |||||
| AAS | 4.076 (95,1) | 126 (92,6) | 393 (94,0) | 231 (92,0) | 162 (97,0) |
| Tienopiridinas | 2.250 (52,5) | 63 (46,3) | 207 (49,5) | 115 (45,8) | 92 (55,1) |
| IECA | 2.952 (68,9) | 108 (79,4) | 283 (67,7) | 145 (57,8) | 138 (82,6) |
| Bloqueadores beta | 3.014 (70,4) | 76 (55,9) | 205 (49,0) | 117 (46,6) | 88 (52,7) |
| Hipolipemiantes | 2.737 (63,9) | 69 (50,7) | 222 (53,1) | 123 (49,0) | 99 (59,3) |
| Heparina | 2.828 (66,0) | 82 (60,3) | 282 (67,5) | 161 (64,1) | 121 (72,5) |
| Diuréticos | 986 (23,0) | 64 (47,1) | 203 (48,6) | 95 (37,8) | 108 (64,7) |
| FEVI (%) | 49±11 | 44±11 | 44±11 | 45±33 | 41±11 |
| Cateterismo cardiaco | 2.545 (59,4) | 65 (47,8) | 234 (56,0) | 127 (50,6) | 107 (64,1) |
| Número de vasos | 1 [1-2] | 2 [1-2] | 2 [1-2] | 1 [1-2] | 2 [1-3] |
| CK-MB máxima (mg/dl) | 124 [59-250] | 136 [64-204] | 150 [70-271] | 143 [68-258] | 166 [74-296] |
| Tratamiento al alta (n=3.758) | |||||
| Salicilatos | 3.451 (91,8) | 88 (64,7) | 257 (61,6) | 153 (61,2) | 104 (62,3) |
| Tienopiridinas | 2.208 (58,7) | 51 (37,5) | 177 (60,6) | 104 (60,8) | 73 (60,3) |
| Bloqueadores beta | 2.739 (72,9) | 55 (40,4) | 169 (40,4) | 102 (40,6) | 67 (40,1) |
| IECA/ARA–II | 2.506 (66,7) | 86 (63,2) | 214 (73,0) | 110 (64,3) | 104 (85,2) |
| Hipolipemiantes | 2.727 (72,6) | 64 (47,1) | 180 (61,4) | 111 (64,9) | 69 (56,6) |
| Digoxina | 95 (2,2) | 26 (24,3) | 28 (9,3) | 10 (5,6) | 18 (14,5) |
| Acenocumarol | 164 (4,4) | 61 (44,9) | 25 (8,4) | 10 (5,7) | 15 (12,2) |
| Triple terapia | 66 (1,5) | 23 (16,9) | 11 (2,6) | 7 (2,8) | 4 (2,4) |
ACTP: angioplastia coronaria transluminal percutánea; ARA–II: antagonista del receptor de la angiotensina II; CK-MB: isoforma MB de la creatincinasa; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; IECA: inhibidores de la enzima de conversión de la angiotensina.
El porcentaje está calculado sobre el total de fibrinolisis.
La variable «tiempo hasta la trombolisis» se ha definido como el tiempo transcurrido desde el inicio del primer síntoma torácico o guía hasta el inicio de la trombolisis sistémica. La variable «tiempo hasta angioplastia coronaria transluminal percutánea» se ha definido como el tiempo transcurrido entre el inicio del primer síntoma torácico o guía y el inicio de la angioplastia coronaria.
Los datos expresan n (%), media±desviación estándar o mediana [intervalo intercuartílico].
Complicaciones y mortalidad hospitalarias y mortalidad a largo plazo
| Cohorte total | FA previa | FA de novo durante ingreso* | FA de novo ≤ 24 h | FA de novo > 24 h | |
| Pacientes | 4.284 | 136 (3,2) | 418 (9,8) | 251 (5,9) | 167 (3,9) |
| IC hospital | 1.220 (28,5) | 73 (53,7) | 246 (58,9) | 125 (49,8) | 121 (72,5) |
| BAVC | 298 (7,0) | 14 (10,3) | 72 (17,2) | 55 (21,9) | 17 (10,2) |
| Angina o re-IAM | 445 (10,4) | 11 (8,1) | 46 (11,0) | 20 (8,0) | 26 (15,6) |
| TV/FV durante ingreso | 416 (9,7) | 21 (15,4) | 94 (22,5) | 64 (25,5) | 30 (18,0) |
| ACV | 89 (2,1) | 5 (3,7) | 20 (4,8) | 10 (4,0) | 10 (6,0) |
| Rotura cardiaca | 101 (2,4) | 5 (3,7) | 31 (7,4) | 19 (7,6) | 12 (7,2) |
| Hemorragia grave | 106 (2,5) | 6 (4,4) | 19 (4,5) | 9 (3,6) | 10 (6,0) |
| Mortalidad hospitalaria | 526 (12,3) | 30 (22,1) | 124 (29,7) | 79 (31,5) | 45 (26,9) |
| Mortalidad a largo plazo tras alta (DI/100 pacientes-año) | 3,48 | 11,11 | 5,35 | 4,45 | 6,77 |
ACV: accidente cerebrovascular; BAVC: bloqueo auriculoventricular completo; IC: insuficiencia cardiaca; DI: densidad de incidencia; FA: fibrilación auricular; FV: fibrilación ventricular; IAM: infarto agudo de miocardio; TV: taquicardia ventricular.
Salvo otra indicación, los datos expresan n (%).
Comparados con aquellos sin antecedente de FA previa, los pacientes con FA previa tenían significativamente más edad y eran en mayor proporción mujeres, diabéticos e hipertensos, pero menos dislipémicos y fumadores activos. Presentaban una comorbilidad marcadamente mayor: más antecedentes de cardiopatía isquémica, accidente cerebrovascular, arteriopatía periférica, insuficiencia renal crónica, enfermedad pulmonar obstructiva crónica y New York Heart Association ≥ II (tabla 1). Se presentaron al hospital con mayor frecuencia cardiaca y mayor clase Killip. Respecto del tratamiento intrahospitalario, se los sometió a menos angioplastias durante el ingreso y se los trató con más inhibidores de la enzima de conversión de la angiotensina y diuréticos, pero menos bloqueadores beta e hipolipemiantes. Además, eran pacientes con peor fracción de eyección del ventrículo izquierdo (tabla 2).
Al alta, se les prescribió más triple terapia, más inhibidores de la enzima de conversión de la angiotensina y digoxina pero menos salicilatos, tienopiridinas y bloqueadores beta (tabla 2).
Características basales de la muestra según la aparición de fibrilación auricular de novo. Factores predictoresEn el presente estudio, 418 pacientes contrajeron FA de novo durante el ingreso. Los predictores no ajustados de esta condición fueron edad, sexo femenino, diabetes mellitus, antecedente de accidente cerebrovascular, New York Heart Association ≥ II basal, mayores frecuencia cardiaca al ingreso y clase Killip, mayor elevación de la isoforma MB de la creatincinasa y aparición de IC durante el ingreso, mientras fueron protectores la dislipemia, el tabaquismo activo y las mayores presión arterial sistólica y fracción de eyección del ventrículo izquierdo (tabla 1 del material suplementario). Los predictores independientes en el modelo fueron únicamente la edad (por cada logaritmo decimal en años, OR=266; IC95%, 42-1.673), la presión arterial sistólica (por cada logaritmo decimal en mmHg, OR=0,04; IC95%, 0,01-0,11) y la IC durante el ingreso (OR=2,49; IC95%, 1,88-3,31). En este modelo, a juzgar por el estadístico χ2, el predictor más importante fue la IC durante el ingreso, seguido de la edad y la presión arterial sistólica (tabla 1 del material suplementario).
Complicaciones y mortalidad hospitalaria según la presencia de fibrilación auricular previa o fibrilación auricular de novoLos pacientes con FA previa presentaron mayor IC durante el ingreso (el 54 frente al 28%; p<0,001) y mayor mortalidad hospitalaria bruta (el 22 frente al 12%; p<0,001) que aquellos sin FA previa, sin diferencias significativas en las demás complicaciones hospitalarias. A su vez, los pacientes con FA de novo tuvieron mayor asociación con el desarrollo de IC durante el ingreso (p<0,001), bloqueo auriculoventricular completo (p<0,001), accidente cerebrovascular (p<0,001), rotura cardiaca (p<0,001) y mortalidad hospitalaria (p<0,001) (tabla 3). Las dos causas más importantes de mortalidad hospitalaria fueron el shock cardiogénico y la disociación electromecánica, tanto en los pacientes con FA previa (el 46,7 y el 33,3% respectivamente) como en aquellos con FA de novo (el 63,7 y el 19,4%).
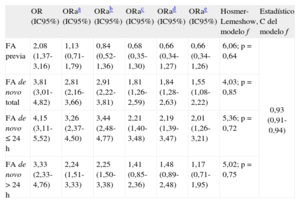
En un modelo ajustado (tabla 4), bien calibrado y de elevado poder discriminativo, la FA de novo durante el ingreso (OR=1,55; IC95%, 1,08-2,22) y la FA de novo en las primeras 24h (OR=2,01; IC95%, 1,26-3,21) fueron predictores independientes de la mortalidad hospitalaria. La FA previa (OR=0,55; IC95%, 0,34-1,26) y la FA de novo > 24h (OR=1,17; IC95%, 0,71-1,95) no resultaron predictoras. Es interesante que el riesgo de muerte asociado con la FA de novo y la FA de novo ≤ 24h fue constante entre los pacientes que adquirieron IC durante el ingreso y los que no (tabla 2 del material suplementario). (interacción, p=0,398 y p=0,984).
Modelos de regresión logística binaria para mortalidad hospitalaria (método introducir) con ajuste incremental por confusores
| OR (IC95%) | ORaa (IC95%) | ORab (IC95%) | ORac (IC95%) | ORad (IC95%) | ORae (IC95%) | Hosmer-Lemeshow, modelo f | Estadístico C del modelo f | |
| FA previa | 2,08 (1,37-3,16) | 1,13 (0,71-1,79) | 0,84 (0,52-1,36) | 0,68 (0,35-1,30) | 0,66 (0,34-1,27) | 0,66 (0,34-1,26) | 6,06; p = 0,64 | 0,93 (0,91-0,94) |
| FA de novo total | 3,81 (3,01-4,82) | 2,81 (2,16-3,66) | 2,91 (2,22-3,81) | 1,81 (1,26-2,59) | 1,84 (1,28-2,63) | 1,55 (1,08-2,22) | 4,03; p = 0,85 | |
| FA de novo ≤ 24 h | 4,15 (3,11-5,52) | 3,26 (2,37-4,50) | 3,44 (2,48-4,77) | 2,21 (1,40-3,48) | 2,19 (1,39-3,47) | 2,01 (1,26-3,21) | 5,36; p = 0,72 | |
| FA de novo > 24 h | 3,33 (2,33-4,76) | 2,24 (1,51-3,33) | 2,25 (1,50-3,38) | 1,41 (0,85-2,36) | 1,48 (0,89-2,48) | 1,17 (0,71-1,95) | 5,02; p = 0,75 |
FA: fibrilación auricular; IC95%: intervalo de confianza del 95%; OR: odds ratio; ORa: OR ajustada.
Ajustada por edad, sexo, índice de masa corporal y factores de riesgo cardiovascular clásicos (antecedentes familiares de cardiopatía isquémica, diabetes mellitus, hipertensión, tabaquismo activo, dislipemia).
Ajustada por lo previo más comorbilidades (insuficiencia renal crónica, enfermedad pulmonar obstructiva crónica, neoplasia, clase funcional de la New York Heart Association basal ≥ II, cardiopatía isquémica previa, accidente cerebrovascular previo, arteriopatía periférica previa).
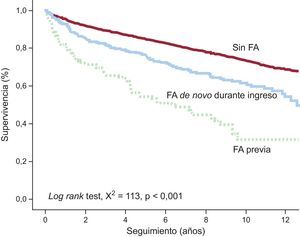
Durante el seguimiento (mediana, 7,2 [intervalo intercuartílico, 2,7-10,3] años) se observó una densidad de incidencia de mortalidad a largo plazo de 3,5/100 pacientes-año: 11,11/100 pacientes-año con FA previa y 5,35/100 pacientes-año con FA de novo. La figura 1 muestra la curva de supervivencia según la presencia de FA previa o de novo.
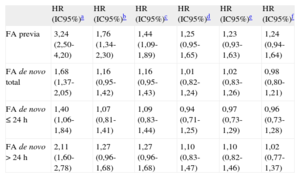
En un contexto multivariable (tabla 5), la FA previa (HR=1,24; IC95%, 0,94-1,64), la FA de novo (HR=0,98; IC95%, 0,80-1,21), la FA de novo ≤ 24h (HR=0,96; IC95%, 0,73-1,28) y la FA de novo > 24h (HR=1,02; IC95%, 0,77-1,37) no resultaron predictoras de mortalidad a largo plazo. Los resultados presentados no mostraron variación al estratificar según el desarrollo de IC durante el ingreso (tabla 3 del material suplementario). (interacción, p > 0,05 en todos los casos).
Modelos de regresión de Cox para mortalidad a largo plazo (método introducir) con ajuste incremental por confusores
| HR (IC95%)a | HR (IC95%)b | HR (IC95%)c | HR (IC95%)d | HR (IC95%)e | HR (IC95%)f | |
| FA previa | 3,24 (2,50-4,20) | 1,76 (1,34-2,30) | 1,44 (1,09-1,89) | 1,25 (0,95-1,65) | 1,23 (0,93-1,63) | 1,24 (0,94-1,64) |
| FA de novo total | 1,68 (1,37-2,05) | 1,16 (0,95-1,42) | 1,16 (0,95-1,43) | 1,01 (0,82-1,24) | 1,02 (0,83-1,26) | 0,98 (0,80-1,21) |
| FA de novo ≤ 24 h | 1,40 (1,06-1,84) | 1,07 (0,81-1,41) | 1,09 (0,83-1,44) | 0,94 (0,71-1,25) | 0,97 (0,73-1,29) | 0,96 (0,73-1,28) |
| FA de novo > 24 h | 2,11 (1,60-2,78) | 1,27 (0,96-1,68) | 1,27 (0,96-1,68) | 1,10 (0,83-1,47) | 1,10 (0,82-1,46) | 1,02 (0,77-1,37) |
FA: fibrilación auricular; HR: hazard ratio; IC95%: intervalo de confianza del 95%.
Seguimiento, mediana 7,2 [2,7-10,3] años.
Estadístico C de Harrell del modelo f=0,7933.
Se ha comprobado la condición de proporcionalidad de riesgos para las variables fibrilación auricular previa, fibrilación auricular de novo total, fibrilación auricular de novo ≤ 24h y fibrilación auricular de novo > 24h mediante curvas logaritmo menos logaritmo.
Ajustada por edad, sexo, índice de masa corporal y factores de riesgo cardiovascular clásicos (antecedentes familiares de cardiopatía isquémica, diabetes mellitus, hipertensión, tabaquismo activo, dislipemia).
Ajustada por lo previo más comorbilidades (insuficiencia renal crónica, enfermedad pulmonar obstructiva crónica, neoplasia, New York Heart Association ≥ II basal, cardiopatía isquémica previa, accidente cerebrovascular previo, arteriopatía periférica previa).
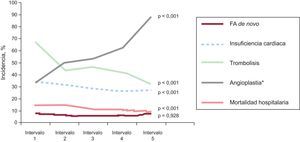
Durante los 10 años de reclutamiento (figura 2), la incidencia de FA de novo se mantuvo constante; no así la incidencia de IC durante el ingreso hospitalario, que descendió significativamente (periodo 1 frente a periodo 5, el 34 frente al 27%; tendencia, p<0,001). La angioplastia durante el ingreso aumentó de manera significativa (el 33,3 frente al 88,2%; tendencia, p<0,001). Puede observarse que hubo un descenso sustancial y significativo de la mortalidad hospitalaria (el 14,5 frente al 9,6%; tendencia, p<0,001).
Tendencias en incidencia de fibrilación auricular de novo durante la hospitalización, insuficiencia cardiaca durante el ingreso y tratamiento de reperfusión. Se presentan los valores de p para el test de tendencias. FA: fibrilación auricular. *Suma de angioplastia primaria más la realizada durante el ingreso (angioplastia diferida o del día siguiente tras fibrinolisis exitosa).
Los pacientes con FA de novo > 24h tenían un perfil clínico diferente respecto de aquellos con aparición más precoz; las diferencias más relevantes (todo, p<0,05) eran mayor edad, mayor presión arterial sistólica al ingreso, peor clase Killip, peor fracción de eyección del ventrículo izquierdo, mayor número de vasos coronarios enfermos, menor reperfusión y mayor incidencia de complicaciones hospitalarias (IC complicada, bloqueo auriculoventricular completo y angina o reinfarto) (tablas 1–3). Estos pacientes no presentaron una mortalidad hospitalaria significativamente distinta (p=0,321), pero sí mayor mortalidad a largo plazo (log rank test, χ2=4,60; p=0,032).
DISCUSIÓNEste estudio ilustra que, en pacientes no seleccionados que ingresan con diagnóstico de IAMCEST, la FA de novo supone un factor independiente de mortalidad hospitalaria, en contraste con la FA previa. A largo plazo ninguna de las dos resultó ser factor independiente de mayor mortalidad. Se observó además que tanto la IC como la mortalidad hospitalaria se redujeron significativamente durante el periodo de estudio, a diferencia de la FA de novo, que se mantuvo constante.
Diferentes estudios han citado distintos predictores de FA de novo. Sin embargo, hay consenso en que las mayores edad e incidencia de IC son los factores de riesgo principales3,4, en concordancia con los resultados de este estudio. Además, otros factores que pueden estar reflejando cierta alteración hemodinámica asociada a disfunción ventricular, como una mayor frecuencia cardiaca y cierta hipotensión arterial, se muestran también como predictores en este estudio y en otros3,4.
Se ha afirmado que la FA conlleva un incremento en la morbilidad y la mortalidad3–19, pero también que esta asociación está mediada en mayor o menor medida por las comorbilidades (the company it keeps)3,4. Otro factor crucial es el perfil de riesgo del paciente con síndrome coronario agudo, pues el impacto pronóstico de la FA podría ser menor cuanto mayor sea el riesgo basal5. Además, se ha apuntado que, a diferencia de la FA previa, es la FA de novo lo que potencialmente conllevaría mayor mortalidad hospitalaria, aunque se ha advertido que podría ser una variable intermedia de IC7,16,23. En el presente estudio, la FA de novo, especialmente la que aparece en las primeras 24h, es predictora de mortalidad hospitalaria después de un ajuste cuidadoso. Además, dicha asociación con un pronóstico adverso es similar al estratificar por la presencia de IC. Esta observación está en consonancia con el registro registro GRACE (Global Registry of Acute Coronary Events)6 y otros7–10, pero en contra de algunos20. En el estudio OACIS, Kinjo et al20 no encontraron asociación entre la FA de novo y la mortalidad hospitalaria (OR=1,42; IC95%, 0,88-2,31). A juicio de los investigadores del presente estudio, varias diferencias entre dicho estudio y el que se presenta aquí pueden justificar los diferentes hallazgos. El estudio de Kinjo et al20 incluyó a pacientes con infarto agudo de miocardio con y sin elevación del segmento ST, en contraste con el presente estudio; en ese estudio, los análisis se restringieron a pacientes sometidos a cateterismo cardiaco, no se pudo distinguir entre la FA puramente de novo, es decir, la propia de los pacientes sin antecedentes de FA previa, y para terminar, los autores de ese estudio incluyeron como una única categoría el flutter y la FA.
Respecto de la mortalidad a largo plazo tras el alta, no se encontró asociación independiente de la FA previa y la FA de novo con la mortalidad por cualquier causa, lo cual está en línea con algún estudio previo19, pero en contraposición con otros previamente publicados (GUSTO–110, GUSTO–311, VALIANT (VALsartan In Acute myocardial iNfarcTion)9, OPTIMAAL12, GISSI–313 y TRACE14). Estos estudios comparten el hallazgo de un efecto independiente de la FA en la mortalidad tras el alta, pero también el hecho de tratarse de subanálisis de estudios realizados por otro motivo y sobre poblaciones específicas o antiguas, con escasa comorbilidad, con criterios de exclusión y que, por lo tanto, difieren de la población reclutada en el presente estudio, tipo all-comers. Algunas otras diferencias son también relevantes: a) en los estudios OPTIMAAL12, GUSTO-311, GISSI-313 y TRACE14, se consideró la FA y el flutter en la misma categoría; b) en OPTIMAAL12 y GISSI-313, se incluyó a cualquier paciente con infarto agudo de miocardio, con y sin elevación del segmento ST, y no se hizo distinción entre los pacientes que contraen FA de novo; c) el ajuste por importantes confusores como la comorbilidad en estos estudios es en general pobre (GUSTO-311, TRACE14) o inexistente (GISSI-313). De los estudios citados, el VALIANT9 tiene el ajuste estadístico más completo, pero no distingue entre la FA presente al ingreso de la FA de novo propiamente.
Estos resultados entran en controversia con los del registro Cooperative Cardiovascular Project15, que informó de un impacto pronóstico independiente de la FA tanto al ingreso como tras el alta hospitalaria. Sin embargo, y a diferencia del presente estudio, ese estudio incluyó infarto agudo de miocardio con y sin elevación del segmento ST, excluyó a todos los pacientes con edad<65 años, no tuvo en consideración para el análisis a los pacientes con FA previa y el seguimiento se realizó únicamente hasta 1 año.
A diferencia del presente estudio, el de Asanin et al16 encontró un efecto adverso en la mortalidad a largo plazo (7 años) de la FA de novo que aparece tras las primeras 24h. Sin embargo en este pequeño estudio de 650 pacientes se incluyeron infartos con y sin elevación del segmento ST, y los autores no consideraron en el modelo multivariable la fracción de eyección del ventrículo izquierdo ni las comorbilidades. Similar apreciación (un pobre ajuste por factores relacionados con la comorbilidad) merecen otros registros publicados17,21,25.
Hasta donde se sabe, solo hay un registro contemporáneo publicado, el Worcester Heart Attack Study, que ha distinguido entre FA previa y realmente de novo durante el ingreso18. En ese interesante estudio, los autores concluyeron que la FA de novo, especialmente la permanente, pudiera asociarse con peor pronóstico hospitalario y a largo plazo. El citado estudio, sin embargo, a diferencia del que se presenta aquí, incluyó a pacientes con y sin ST elevado y manejados mediante cateterismo cardiaco.
Como ya se ha señalado, algunos estudios previos indicaban que la FA de novo podría ser simplemente un reflejo de la presencia de IC3,22 y otros han especulado que se podría reducir tanto la frecuencia de presentación como el impacto pronóstico adverso de aquella según se optimiza el tratamiento médico3. En el análisis de tendencias, sin embargo, la incidencia de FA de novo se mantuvo prácticamente constante durante los 10 años de reclutamiento, en concordancia con un estudio6 y a pesar de un aumento sustancial y significativo de la angioplastia coronaria y una reducción de la IC. Estos resultados son concordantes con un estudio previo, pero son distintos de los publicados por McManus et al24, quienes mostraron, en pacientes incluidos en el GRACE, una reducción discreta de la incidencia de FA de novo y previa paralela a una disminución de la IC y la mortalidad hospitalaria, y atribuyen estos hallazgos a mejoras en el tratamiento. A diferencia del presente estudio, en ese se incluyó cualquier tipo de síndrome coronario agudo. En pacientes con IAMCEST incluidos en un estudio reciente en España26, se encontró una reducción de la FA complicada sobre todo en los pacientes del registro MASCARA27 respecto a PRIAMHO I y II, además de una reducción de la IC. Sin embargo, esos pacientes eran diferentes de los del actual estudio, sobre todo por la menor proporción de diabéticos y por presentar menos comorbilidades.
LimitacionesNo se dispuso de información relativa a la duración de la FA que aparece durante el ingreso, así como su carácter persistente o permanente, lo cual puede ser relevante16.
No es posible descartar que la FA previa pueda asociarse con la mortalidad a largo plazo y, por lo tanto, ser clínicamente relevante, dado el pequeño número de pacientes con FA previa en relación con el tamaño muestral total, lo cual ha condicionado un error de tipo 2 estimado de 0,42 para HR=1,24.
CONCLUSIONESLa FA previa y de novo son marcadores de mal pronóstico en el IAMCEST, pero solo la segunda es un factor independiente de mortalidad hospitalaria, tanto para los pacientes que adquieren IC como para los que no.
CONFLICTO DE INTERESESNinguno.
Se puede consultar material suplementario a este artículo en su versión electrónica disponible en doi:10.1016/j.recesp.2014.03.017.