Evaluar el uso de los recursos sanitarios y sus costes según la influencia de la insuficiencia renal en sujetos con insuficiencia cardiaca durante un periodo de seguimiento de 2 años en un ámbito poblacional.
MétodosSe efectuó un diseño observacional-retrospectivo realizado a partir de la revisión de registros médicos. Se incluyó a sujetos ≥ 45 años que demandaron atención durante 2008-2010. Se constituyeron dos grupos según los pacientes tuvieran insuficiencia renal o no. Principales mediciones: comorbilidad, clínicas (clase funcional, etiología), síndrome metabólico, costes y nuevos casos de eventos cardiovasculares e insuficiencia renal. El modelo de costes incluyó los costes sanitarios directos e indirectos. El análisis estadístico incluyó modelos de regresión múltiple.
ResultadosSe reclutó a 1.600 sujetos (prevalencia, 4,0%; media de edad, 72,4 años; mujeres, 59,7%). El 70,1% tenía hipertensión; el 47,1%, dislipemia y el 36,2%, diabetes mellitus. Se analizó a 433 pacientes (27,1%) con insuficiencia renal y a 1.167 (72,9%) sin ella. Los pacientes con insuficiencia renal se asociaron a la clase funcional III-IV (el 54,1 frente al 40,8%) y síndrome metabólico (el 65,3 frente al 51,9%; p<0,01). El promedio unitario del coste fue 10.711,4 euros. El coste corregido en presencia de insuficiencia renal fue 14.868,2 frente a 9.364,5 euros (p=0,001). Durante el seguimiento, el 11,7% sufrió cardiopatía isquémica; el 18,8%, insuficiencia renal y el 36,1%, reagudización de la insuficiencia cardiaca.
ConclusionesLa comorbilidad asociada a la insuficiencia cardiaca es elevada. La presencia de insuficiencia renal ocasiona más utilización de recursos sanitarios y mayores costes para el Sistema Nacional de Salud.
Palabras clave
Las enfermedades cardiovasculares son la principal causa de morbimortalidad en los países desarrollados1. La detección y el control de los diferentes factores de riesgo cardiovascular sigue siendo la estrategia fundamental para prevenirlas2. La insuficiencia cardiaca (IC) es un problema de salud pública importante que se caracteriza por una mortalidad relevante, hospitalizaciones frecuentes y escasa calidad de vida, con una prevalencia global que está aumentando. En Europa, la prevalencia de IC se sitúa en un 2-3%, y se calcula que afecta a un 10-20% de los pacientes > 65 años3. La mortalidad intrahospitalaria es elevada y los reingresos, frecuentes4,5.
La cardiopatía isquémica es la causa más frecuente para un 60-70% de los pacientes, especialmente los de edad avanzada2. En pacientes con IC, es frecuente la disfunción renal, cuya prevalencia aumenta con la gravedad de la IC, la edad, los antecedentes de hipertensión o la diabetes mellitus1. La insuficiencia renal (IR) está aceptada como un factor de mal pronóstico en el desarrollo de la enfermedad y se estima que pueden sufrirla un 30-50% de los de los pacientes ingresados6.
La IC es una de las enfermedades con mayor impacto sociosanitario —no solo por su alta prevalencia, sino también por las complicaciones agudas y crónicas que produce—, pues ocasiona un elevado consumo de recursos sanitarios2,5,7. En general, el manejo de la IC consume un 1-2% del gasto sanitario de los países europeos, del que un 75% aproximadamente corresponde a gastos de hospitalización2,8.
Los estudios disponibles en España sobre el uso de los recursos sanitarios y sus costes en pacientes con IC y su posible relación con la IR (factor de mal pronóstico de la enfermedad) en población general son escasos, por lo que la realización de este estudio puede ser relevante.
El objetivo principal del estudio es evaluar el uso de recursos sanitarios y sus costes según la influencia de la IR en sujetos con IC, durante un periodo de seguimiento de 2 años en un ámbito poblacional. Como objetivos secundarios, se determinan la comorbilidad y la mortalidad asociadas con estos pacientes.
MÉTODOSDiseño y ámbito del estudioSe efectuó un estudio observacional multicéntrico longitudinal (carácter retrospectivo), realizado a partir de los registros médicos pertenecientes a las historias clínicas informatizadas de pacientes seguidos en régimen ambulatorio (OMIAPWIN, Stacks CIS) y hospitalario (GesDohc, Cibal Sistemas). Formaron la población de estudio personas pertenecientes a seis centros de atención primaria (AP) y dos hospitales de agudos. La población asignada a los centros era en su mayoría urbana, de nivel socioeconómico medio-bajo, con predominio industrial.
Criterios de inclusión y exclusiónSe incluyó en el estudio a todos los pacientes que demandaron atención por un episodio (prevalente o incidente) de IC durante los años 2008-2010 (fecha de inclusión) y que reunieran las siguientes características: a) edad ≥ 40 años; b) seguir regularmente (> 1 contacto anual) el protocolo/guía de riego cardiovascular establecido en los centros, y c) que se pudiera garantizar el seguimiento de los pacientes. Se excluyó a los sujetos trasladados o desplazados a otras zonas geográficas. Se formaron dos grupos de estudio en función de que los pacientes tuvieran IR o no.
Diagnóstico de insuficiencia cardiaca e insuficiencia renalEl diagnóstico de IC se obtuvo a partir de la CIAP-2 (Clasificación Internacional de la Atención Primaria, segunda edición)9 (código: K77) y/o de la CIE-9-MC (Clasificación Internacional de Enfermedades, Novena Revisión, Modificación Clínica) (código: 428). El diagnóstico de IC aguda (reagudización hospitalaria) se obtuvo a partir de la codificación diagnóstica como una inferencia de los criterios diagnósticos de Framingham10, y siguiendo las directrices de la guía de la Sociedad Europea de Cardiología2. Se consideró IR (filtrado glomerular estimado) cuando había deterioro de la función renal (creatinina sérica; varones, >133 mmol/l; mujeres, >124 mmol/l o filtrado glomerular estimado <60ml/min) según el primer valor disponible a partir de la fecha de inclusión.
Variables sociodemográficas y de comorbilidadLas principales variables de estudio fueron: edad, sexo y tiempo de evolución de la IC (desde el diagnóstico), así como los antecedentes personales obtenidos a partir de la CIAP-29: hipertensión arterial, diabetes mellitus, dislipemia, obesidad, tabaquismo, alcoholismo, insuficiencia hepática, cardiopatía isquémica, accidente cerebrovascular, enfermedad pulmonar obstructiva crónica, asma bronquial, demencias o trastornos de memoria, enfermedades neurológicas: enfermedad de Parkinson, epilepsia, esclerosis múltiple y otras enfermedades neurológicas, síndrome depresivo, neoplasias malignas, cardiopatía valvular, fibrilación auricular, anemia y alteraciones tiroideas. Como variable resumen de la comorbilidad general para cada paciente atendido, se utilizó: a) el índice de comorbilidad de Charlson11 como una aproximación a la gravedad del paciente; b) el número de diagnósticos, y c) el índice de casuística individual, obtenido a partir de los Adjusted Clinical Groups, que es un sistema de clasificación de pacientes por isoconsumo de recursos12. El aplicativo Adjusted Clinical Groups proporciona las bandas de utilización de recursos, con lo que cada paciente en función de su morbilidad general queda agrupado en una de las cinco categorías mutuamente excluyentes.
Parámetros bioquímicos, antropométricos y definición de síndrome metabólicoLos parámetros fueron: presión arterial sistólica y diastólica, índice de masa corporal, glucemia basal, glucohemoglobina, triglicéridos séricos, colesterol total, colesterol unido a lipoproteínas de alta densidad, colesterol unido a lipoproteínas de baja densidad y creatinina sérica. La definición de síndrome metabólico se estableció cuando se cumplieron tres de los cinco criterios diagnósticos modificados National Cholesterol Education Program-Adult Treatment Panel III13. En este estudio se reemplazó la medida de la circunferencia de la cintura por un valor de índice de masa corporal ≥ 28,8, criterio original seguido por diferentes autores14. Se consideró el primer valor disponible a partir de la fecha de inclusión de los pacientes.
Otras variables clínicasSe obtuvieron los registros de: a) fracción de eyección del ventrículo izquierdo conservada ≥ 45% o deprimida <45% (con cualquier etiología); b) clase funcional de la NYHA (New Association (NYHA) I-II y III-IV; c) IC de novo o primera descompensación crónica, y d) causa de la IC (isquémica, hipertensiva, valvulopatía, miocardiopatía dilatada idiopática u otras), según criterio del médico responsable. Estos datos se obtuvieron de las historias clínicas informatizadas, y se consideró el primer valor disponible a partir de la fecha de inclusión.
Descripción del tratamientoSe obtuvo la información del tratamiento administrado según el sistema ATC/DDD15. Los datos del tratamiento farmacológico se obtuvieron de la prescripción del médico de AP o el cardiólogo de referencia: diuréticos, digoxina, inhibidores de la enzima de conversión de la angiotensina, antagonistas de los receptores de la angiotensina II, bloqueadores beta, espironolactona, nitratos, antagonistas del calcio, antiarrítmicos, antiagregantes, anticoagulantes y estatinas. Estos registros se obtuvieron durante la inclusión de los pacientes en el estudio.
Seguimiento de los pacientesDurante el periodo de seguimiento (2 años), se contabilizaron los nuevos episodios de evento cardiovascular e IR: a) cardiopatía isquémica —angina (K74, K76) e infarto agudo de miocardio (K75)—; b) enfermedad cerebrovascular —ictus (isquémico/hemorrágico (K90), accidente isquémico transitorio (K91) y enfermedad arterial periférica (K92)—; c) enfermedad renal; d) revascularización coronaria, cirugía valvular o trasplante cardiaco, y e) reingresos por IC (K77) y mortalidad (por todas las causas).
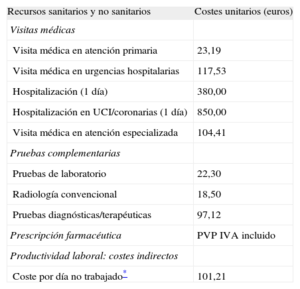
Uso de recursos y modelo de costesA partir de la fecha de inclusión, se consideró costes sanitarios (costes directos) los relacionados con la actividad asistencial (visitas médicas, días de hospitalización, urgencias, solicitudes diagnósticas o terapéuticas, medicación ambulatoria) efectuada por los profesionales, y se consideró costes no sanitarios (indirectos) los relativos a las pérdidas de productividad laboral (días de incapacidad). El coste se expresó como coste medio por paciente (coste unitario). Los diferentes conceptos de estudio y su valoración económica (correspondientes al año 2012) se detallan en la tabla 1. Los días de incapacidad laboral o pérdidas de productividad se cuantificaron según el salario medio interprofesional (Instituto Nacional de Estadística)16.
Detalle de los costes unitarios y de las pérdidas de productividad laboral (año 2012)
| Recursos sanitarios y no sanitarios | Costes unitarios (euros) |
| Visitas médicas | |
| Visita médica en atención primaria | 23,19 |
| Visita médica en urgencias hospitalarias | 117,53 |
| Hospitalización (1 día) | 380,00 |
| Hospitalización en UCI/coronarias (1 día) | 850,00 |
| Visita médica en atención especializada | 104,41 |
| Pruebas complementarias | |
| Pruebas de laboratorio | 22,30 |
| Radiología convencional | 18,50 |
| Pruebas diagnósticas/terapéuticas | 97,12 |
| Prescripción farmacéutica | PVP IVA incluido |
| Productividad laboral: costes indirectos | |
| Coste por día no trabajado* | 101,21 |
IVA: Impuesto sobre el Valor Añadido; PVP: precio de venta al público; UCI: unidad de cuidados intensivos.
Instituto Nacional de Estadística: encuesta de costes laborales del año 201116. Costes pertenecientes al año 2012. Fuente de los recursos sanitarios: Badalona Serveis Assistencials, una entidad con financiación pública y provisión privada de servicios, circunstancia que facilita disponer de una contabilidad analítica propia repartida por centros de coste.
El estudio fue clasificado por la Agencia Española del Medicamento y Productos Sanitarios (No-EPA [estudio postautorización]), y posteriormente fue aprobado por el Comité de Ética de Investigación Clínica del Hospital Universitari Germans Trias i Pujol de Badalona.
Análisis estadísticoSe efectuó un análisis estadístico descriptivo con intervalos de confianza del 95% (IC95%), y se comprobó la normalidad de la distribución con la prueba de Kolmogorov-Smirnov. En el análisis bivariable se utilizaron las pruebas de análisis de la varianza y de la χ2. Se efectuó un modelo de regresión logística binaria para obtener las variables asociadas a presencia/ausencia de IR, con procedimiento enter (estadístico de Wald). Para obtener las variables asociadas al coste sanitario, se creó un modelo de regresión lineal múltiple (por pasos consecutivos). La comparación del coste (sanitario y no sanitario) se realizó, según las recomendaciones de Thompson y Barber17, mediante el análisis de la covarianza con sexo, edad, bandas de utilización de recursos, índice de Charlson y tiempo desde el diagnóstico como covariables (estimación de medias marginales con ajuste de Bonferroni). Se utilizó el programa SPSSWIN versión 19, y se estableció la significación estadística en p<0,05.
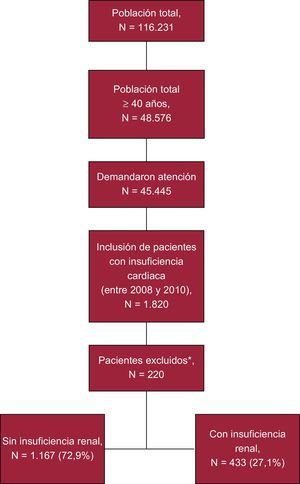
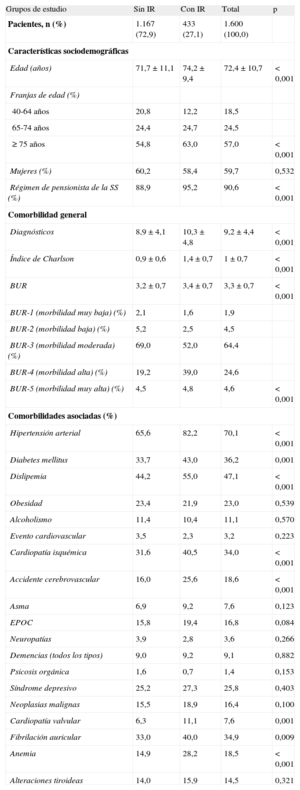
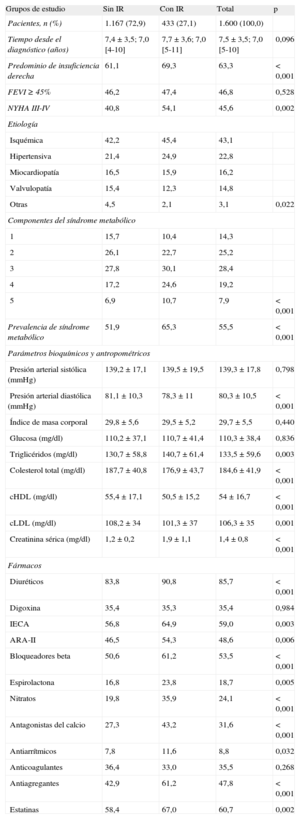
RESULTADOSCaracterísticas generales y clínicasDe una selección inicial de 48.576 sujetos ≥ 45 años asignados a los centros, 1.820 tenían diagnóstico de IC (figura 1). Se reclutó para el estudio a 1.600 pacientes. Se consideraron dos grupos; el 27,1% (n=433; IC95%, 24,9-29,3%) de los pacientes tenían deterioro de la función renal. En la tabla 2 se describen las características generales de la serie estudiada según los dos grupos de estudio. La media de edad de todos los pacientes era 72,4±10,7 años y el 59,7% eran mujeres. La morbilidad asociada a la IC fue importante; del conjunto de pacientes, el 70,1% tenía hipertensión arterial; el 47,1%, dislipemia; el 36,2%, diabetes mellitus; el 34,9%, fibrilación auricular y el 34,0%, cardiopatía isquémica. En el modelo logístico, la presencia de IR se asoció a la comorbilidad general (índice de Charlson; odds ratio [OR]=3,2; IC95%, 2,6-4,0), hipertensión arterial (OR=2,3; IC95%, 1,7-3,1), anemia (OR=1,9; IC95%, 1,4-2,5), cardiopatía valvular (OR=1,8; IC95%, 1,2-2,8), cardiopatía isquémica (OR=1,6; IC95%, 1,1-2,5) y diabetes mellitus (OR=1,4; IC95%, 1,1-1,9) (p<0,05).
Esquema general del estudio. Diseño observacional de carácter retrospectivo para determinar las consecuencias económicas de los pacientes con insuficiencia cardiaca. El seguimiento de todos los pacientes fue de 2 años a partir de la fecha de inclusión. *Los pacientes excluidos lo fueron por: falta o inconsistencia de los datos, 87 (39,5%); ausencia de seguimiento, 75 (34,1%), y desplazados a otras zonas geográficas o por otras causas, 58 (26,4%).
Características generales de la serie por grupos de estudio
| Grupos de estudio | Sin IR | Con IR | Total | p |
| Pacientes, n (%) | 1.167 (72,9) | 433 (27,1) | 1.600 (100,0) | |
| Características sociodemográficas | ||||
| Edad (años) | 71,7±11,1 | 74,2±9,4 | 72,4±10,7 | <0,001 |
| Franjas de edad (%) | ||||
| 40-64 años | 20,8 | 12,2 | 18,5 | |
| 65-74 años | 24,4 | 24,7 | 24,5 | |
| ≥ 75 años | 54,8 | 63,0 | 57,0 | <0,001 |
| Mujeres (%) | 60,2 | 58,4 | 59,7 | 0,532 |
| Régimen de pensionista de la SS (%) | 88,9 | 95,2 | 90,6 | <0,001 |
| Comorbilidad general | ||||
| Diagnósticos | 8,9±4,1 | 10,3±4,8 | 9,2±4,4 | <0,001 |
| Índice de Charlson | 0,9±0,6 | 1,4±0,7 | 1±0,7 | <0,001 |
| BUR | 3,2±0,7 | 3,4±0,7 | 3,3±0,7 | <0,001 |
| BUR-1 (morbilidad muy baja) (%) | 2,1 | 1,6 | 1,9 | |
| BUR-2 (morbilidad baja) (%) | 5,2 | 2,5 | 4,5 | |
| BUR-3 (morbilidad moderada) (%) | 69,0 | 52,0 | 64,4 | |
| BUR-4 (morbilidad alta) (%) | 19,2 | 39,0 | 24,6 | |
| BUR-5 (morbilidad muy alta) (%) | 4,5 | 4,8 | 4,6 | <0,001 |
| Comorbilidades asociadas (%) | ||||
| Hipertensión arterial | 65,6 | 82,2 | 70,1 | <0,001 |
| Diabetes mellitus | 33,7 | 43,0 | 36,2 | 0,001 |
| Dislipemia | 44,2 | 55,0 | 47,1 | <0,001 |
| Obesidad | 23,4 | 21,9 | 23,0 | 0,539 |
| Alcoholismo | 11,4 | 10,4 | 11,1 | 0,570 |
| Evento cardiovascular | 3,5 | 2,3 | 3,2 | 0,223 |
| Cardiopatía isquémica | 31,6 | 40,5 | 34,0 | <0,001 |
| Accidente cerebrovascular | 16,0 | 25,6 | 18,6 | <0,001 |
| Asma | 6,9 | 9,2 | 7,6 | 0,123 |
| EPOC | 15,8 | 19,4 | 16,8 | 0,084 |
| Neuropatías | 3,9 | 2,8 | 3,6 | 0,266 |
| Demencias (todos los tipos) | 9,0 | 9,2 | 9,1 | 0,882 |
| Psicosis orgánica | 1,6 | 0,7 | 1,4 | 0,153 |
| Síndrome depresivo | 25,2 | 27,3 | 25,8 | 0,403 |
| Neoplasias malignas | 15,5 | 18,9 | 16,4 | 0,100 |
| Cardiopatía valvular | 6,3 | 11,1 | 7,6 | 0,001 |
| Fibrilación auricular | 33,0 | 40,0 | 34,9 | 0,009 |
| Anemia | 14,9 | 28,2 | 18,5 | <0,001 |
| Alteraciones tiroideas | 14,0 | 15,9 | 14,5 | 0,321 |
BUR: bandas de utilización de recursos; EPOC: enfermedad pulmonar obstructiva crónica; IR: insuficiencia renal; SS: Seguridad Social.
Salvo otra indicación, los valores expresan n (%) o media±desviación estándar.
La distribución de las variables clínicas, síndrome metabólico y medicación según los grupos de estudio se detallan en la tabla 3. En general, la media de tiempo desde el diagnóstico fue de 7,5 años y la etiología más frecuente de la IC fue la isquémica (43,1%). Los pacientes con IR (en comparación con los que no la tenían) mostraron mayor proporción de NYHA III-IV (el 54,1 frente al 40,8%; p=0,002) y síndrome metabólico (el 65,3 frente al 51,9%; p<0,001). El consumo de medicamentos, excepto digoxina y anticoagulantes, fue mayor entre los pacientes con IR. Los fármacos más utilizados fueron diuréticos (85,7%), estatinas (60,7%), inhibidores de la enzima de conversión de la angiotensina (59,0%), bloqueadores beta (53,5%) y antagonistas del receptor de la angiotensina II (48,6%).
Distribución de las variables clínicas, síndrome metabólico y fármacos según los grupos de estudio
| Grupos de estudio | Sin IR | Con IR | Total | p |
| Pacientes, n (%) | 1.167 (72,9) | 433 (27,1) | 1.600 (100,0) | |
| Tiempo desde el diagnóstico (años) | 7,4±3,5; 7,0 [4-10] | 7,7±3,6; 7,0 [5-11] | 7,5±3,5; 7,0 [5-10] | 0,096 |
| Predominio de insuficiencia derecha | 61,1 | 69,3 | 63,3 | <0,001 |
| FEVI ≥ 45% | 46,2 | 47,4 | 46,8 | 0,528 |
| NYHA III-IV | 40,8 | 54,1 | 45,6 | 0,002 |
| Etiología | ||||
| Isquémica | 42,2 | 45,4 | 43,1 | |
| Hipertensiva | 21,4 | 24,9 | 22,8 | |
| Miocardiopatía | 16,5 | 15,9 | 16,2 | |
| Valvulopatía | 15,4 | 12,3 | 14,8 | |
| Otras | 4,5 | 2,1 | 3,1 | 0,022 |
| Componentes del síndrome metabólico | ||||
| 1 | 15,7 | 10,4 | 14,3 | |
| 2 | 26,1 | 22,7 | 25,2 | |
| 3 | 27,8 | 30,1 | 28,4 | |
| 4 | 17,2 | 24,6 | 19,2 | |
| 5 | 6,9 | 10,7 | 7,9 | <0,001 |
| Prevalencia de síndrome metabólico | 51,9 | 65,3 | 55,5 | <0,001 |
| Parámetros bioquímicos y antropométricos | ||||
| Presión arterial sistólica (mmHg) | 139,2±17,1 | 139,5±19,5 | 139,3±17,8 | 0,798 |
| Presión arterial diastólica (mmHg) | 81,1±10,3 | 78,3±11 | 80,3±10,5 | <0,001 |
| Índice de masa corporal | 29,8±5,6 | 29,5±5,2 | 29,7±5,5 | 0,440 |
| Glucosa (mg/dl) | 110,2±37,1 | 110,7±41,4 | 110,3±38,4 | 0,836 |
| Triglicéridos (mg/dl) | 130,7±58,8 | 140,7±61,4 | 133,5±59,6 | 0,003 |
| Colesterol total (mg/dl) | 187,7±40,8 | 176,9±43,7 | 184,6±41,9 | <0,001 |
| cHDL (mg/dl) | 55,4±17,1 | 50,5±15,2 | 54±16,7 | <0,001 |
| cLDL (mg/dl) | 108,2±34 | 101,3±37 | 106,3±35 | 0,001 |
| Creatinina sérica (mg/dl) | 1,2±0,2 | 1,9±1,1 | 1,4±0,8 | <0,001 |
| Fármacos | ||||
| Diuréticos | 83,8 | 90,8 | 85,7 | <0,001 |
| Digoxina | 35,4 | 35,3 | 35,4 | 0,984 |
| IECA | 56,8 | 64,9 | 59,0 | 0,003 |
| ARA-II | 46,5 | 54,3 | 48,6 | 0,006 |
| Bloqueadores beta | 50,6 | 61,2 | 53,5 | <0,001 |
| Espirolactona | 16,8 | 23,8 | 18,7 | 0,005 |
| Nitratos | 19,8 | 35,9 | 24,1 | <0,001 |
| Antagonistas del calcio | 27,3 | 43,2 | 31,6 | <0,001 |
| Antiarrítmicos | 7,8 | 11,6 | 8,8 | 0,032 |
| Anticoagulantes | 36,4 | 33,0 | 35,5 | 0,268 |
| Antiagregantes | 42,9 | 61,2 | 47,8 | <0,001 |
| Estatinas | 58,4 | 67,0 | 60,7 | 0,002 |
ARA-II: antagonistas del receptor de la angiotensina II; cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; FEVI: fracción de eyección del ventrículo izquierdo, IECA: inhibidores de la enzima de conversión de la angiotensina; IR: insuficiencia renal; NYHA: New York Heart Association.
Salvo otra indicación, los valores expresan porcentaje, media±desviación estándar o mediana [intervalo intercuartílico].
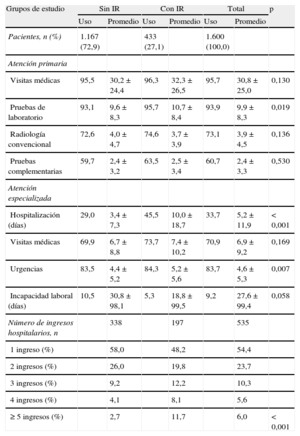
En la tabla 4 se describe el uso de los recursos sanitarios y no sanitarios según los grupos de estudio. Los pacientes con IR utilizaron más recursos sanitarios, especialmente en visitas médicas en AP (32,3 frente a 30,2; p=0,013), días de hospitalización (10,0 frente 3,4; p<0,001) y urgencias hospitalarias (5,2 frente a 4,4; p=0,007). La estancia media de los pacientes hospitalizados fue de 8,6±8,8 días, más larga para los sujetos con IR (9,7 frente a 8,2 días; p=0,002). El promedio de ingresos fue 1,1 frente a 0,50 (p<0,001).
Uso de recursos sanitarios y no sanitarios (promedio unitario) según los grupos de estudio
| Grupos de estudio | Sin IR | Con IR | Total | p | |||
| Uso | Promedio | Uso | Promedio | Uso | Promedio | ||
| Pacientes, n (%) | 1.167 (72,9) | 433 (27,1) | 1.600 (100,0) | ||||
| Atención primaria | |||||||
| Visitas médicas | 95,5 | 30,2±24,4 | 96,3 | 32,3±26,5 | 95,7 | 30,8±25,0 | 0,130 |
| Pruebas de laboratorio | 93,1 | 9,6±8,3 | 95,7 | 10,7±8,4 | 93,9 | 9,9±8,3 | 0,019 |
| Radiología convencional | 72,6 | 4,0±4,7 | 74,6 | 3,7±3,9 | 73,1 | 3,9±4,5 | 0,136 |
| Pruebas complementarias | 59,7 | 2,4±3,2 | 63,5 | 2,5±3,4 | 60,7 | 2,4±3,3 | 0,530 |
| Atención especializada | |||||||
| Hospitalización (días) | 29,0 | 3,4±7,3 | 45,5 | 10,0±18,7 | 33,7 | 5,2±11,9 | <0,001 |
| Visitas médicas | 69,9 | 6,7±8,8 | 73,7 | 7,4±10,2 | 70,9 | 6,9±9,2 | 0,169 |
| Urgencias | 83,5 | 4,4±5,2 | 84,3 | 5,2±5,6 | 83,7 | 4,6±5,3 | 0,007 |
| Incapacidad laboral (días) | 10,5 | 30,8±98,1 | 5,3 | 18,8±99,5 | 9,2 | 27,6±99,4 | 0,058 |
| Número de ingresos hospitalarios, n | 338 | 197 | 535 | ||||
| 1 ingreso (%) | 58,0 | 48,2 | 54,4 | ||||
| 2 ingresos (%) | 26,0 | 19,8 | 23,7 | ||||
| 3 ingresos (%) | 9,2 | 12,2 | 10,3 | ||||
| 4 ingresos (%) | 4,1 | 8,1 | 5,6 | ||||
| ≥ 5 ingresos (%) | 2,7 | 11,7 | 6,0 | <0,001 | |||
IR: insuficiencia renal.
Salvo otra indicación, los valores expresan porcentaje o media±desviación estándar.
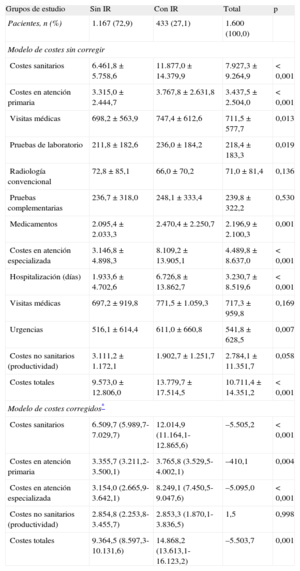
El coste total del tratamiento de los pacientes incluidos en el estudio ascendió a 17,1 millones de euros, de los cuales el 74,0% corresponde a costes sanitarios y el 26,0%, a costes no sanitarios (pérdidas de productividad). La descripción de los costes sanitarios por paciente según los grupos de estudio se describe en la tabla 5. Del total de los costes sanitarios, el 43,4% se produjo en AP y el 56,6%, en atención especializada. Los ingresos hospitalarios generaron el mayor componente de los costes totales (30,2%). La distribución en AP fue del 6,6% en visitas y el 20,5% en prescripción farmacéutica.
Costes brutos y corregidos (euros) según los grupos de estudio durante los 2 años de seguimiento
| Grupos de estudio | Sin IR | Con IR | Total | p |
| Pacientes, n (%) | 1.167 (72,9) | 433 (27,1) | 1.600 (100,0) | |
| Modelo de costes sin corregir | ||||
| Costes sanitarios | 6.461,8±5.758,6 | 11.877,0±14.379,9 | 7.927,3±9.264,9 | <0,001 |
| Costes en atención primaria | 3.315,0±2.444,7 | 3.767,8±2.631,8 | 3.437,5±2.504,0 | <0,001 |
| Visitas médicas | 698,2±563,9 | 747,4±612,6 | 711,5±577,7 | 0,013 |
| Pruebas de laboratorio | 211,8±182,6 | 236,0±184,2 | 218,4±183,3 | 0,019 |
| Radiología convencional | 72,8±85,1 | 66,0±70,2 | 71,0±81,4 | 0,136 |
| Pruebas complementarias | 236,7±318,0 | 248,1±333,4 | 239,8±322,2 | 0,530 |
| Medicamentos | 2.095,4±2.033,3 | 2.470,4±2.250,7 | 2.196,9±2.100,3 | 0,001 |
| Costes en atención especializada | 3.146,8±4.898,3 | 8.109,2±13.905,1 | 4.489,8±8.637,0 | <0,001 |
| Hospitalización (días) | 1.933,6±4.702,6 | 6.726,8±13.862,7 | 3.230,7±8.519,6 | <0,001 |
| Visitas médicas | 697,2±919,8 | 771,5±1.059,3 | 717,3±959,8 | 0,169 |
| Urgencias | 516,1±614,4 | 611,0±660,8 | 541,8±628,5 | 0,007 |
| Costes no sanitarios (productividad) | 3.111,2±1.172,1 | 1.902,7±1.251,7 | 2.784,1±11.351,7 | 0,058 |
| Costes totales | 9.573,0±12.806,0 | 13.779,7±17.514,5 | 10.711,4±14.351,2 | <0,001 |
| Modelo de costes corregidos* | ||||
| Costes sanitarios | 6.509,7 (5.989,7-7.029,7) | 12.014,9 (11.164,1-12.865,6) | –5.505,2 | <0,001 |
| Costes en atención primaria | 3.355,7 (3.211,2-3.500,1) | 3.765,8 (3.529,5-4.002,1) | –410,1 | 0,004 |
| Costes en atención especializada | 3.154,0 (2.665,9-3.642,1) | 8.249,1 (7.450,5-9.047,6) | –5.095,0 | <0,001 |
| Costes no sanitarios (productividad) | 2.854,8 (2.253,8-3.455,7) | 2.853,3 (1.870,1-3.836,5) | 1,5 | 0,998 |
| Costes totales | 9.364,5 (8.597,3-10.131,6) | 14.868,2 (13.613,1-16.123,2) | –5.503,7 | 0,001 |
IR: insuficiencia renal; IC95%: intervalo de confianza del 95%.
Salvo otra indicación, los valores expresan n (%) o media±desviación estándar.
Modelo de análisis de la covarianza: comparaciones por pares linealmente independientes entre las medias marginales estimadas con sus respectivos intervalos de confianza del 95% y la diferencia. Componentes aleatorios: presencia/ausencia de insuficiencia renal y sexo. Covariables: edad, sexo, morbilidad general (índice de Charlson; bandas de utilización de recursos) y tiempo desde el diagnóstico (años). El promedio unitario del coste total/paciente-año fue de 5.356 euros.
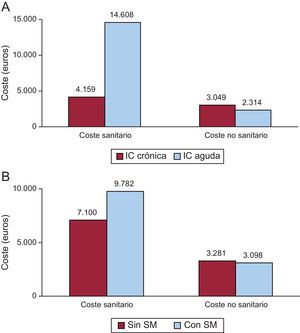
En el estudio, el promedio unitario del coste total de la IC fue 10.711,4 euros. Los promedios unitarios del coste sanitario de los sujetos con y sin IR fueron 13.779,7 y 9.573,0 euros (p<0,001) respectivamente. Los promedios unitarios corregidos por las covariables (análisis de la covarianza) del coste total en presencia y ausencia de IR fueron 14.868,2 y 9.364,5 euros (p=0,001) y los del sanitario, 12.014,9 y 6.509,7 euros (p<0,001). En la figura 2 se detalla la distribución del coste sanitario y no sanitario en función del tipo de IC (aguda o crónica) y el síndrome metabólico (presencia o ausencia).
Coste sanitario y no sanitario. A: por tipo de insuficiencia cardiaca (aguda o crónica). B: por síndrome metabólico (presencia o ausencia). Valores expresados en euros. Diferencias estadísticamente significativas en los costes sanitarios (p<0,001); en los costes no sanitarios, no fueron concluyentes. IC: insuficiencia cardiaca; SM: síndrome metabólico.
Con el propósito de complementar el estudio de costes de la IC, se realizaron diferentes subanálisis a partir del promedio unitario de los costes totales: según el sexo (varones frente a mujeres, 12.997,0 frente a 9.167,7 euros), clase funcional de la NYHA (I-II frente a III-IV, 7.781,1 frente a 14.284,5 euros), hospitalización por IC durante el seguimiento (sí frente a no, 17.147,7 frente a 7.478,2 euros) y fracción de eyección del ventrículo izquierdo (preservada frente a deprimida, 9.621,3 frente a 11.049,8 euros) (p<0,01 en todos los casos).
Incidencia de eventos cardiovasculares, mortalidad y supervivenciaDurante el seguimiento, las tasas de casos nuevos fueron: de cardiopatía isquémica, el 11,7% (con IR frente a sin IR, el 14,5 frente al 10,7%; p=0,032); de accidente cerebrovascular, el 6,6% (el 9,1 frente al 5,1%; p=0,048); de revascularización, el 12,1% (el 11,4 frente al 12,4%; p=0,766), y de IR, el 18,8%. La mortalidad por cualquier causa fue del 23,7% (el 30,7 frente al 21,1%; p<0,001). El 36,1% de los pacientes (n=535) mostraron una reagudización de la IC (tabla 4) superior en presencia de IR (el 48,3 frente al 31,5%; p<0,001). De estos pacientes, 189 se presentaron como casos nuevos (IC de novo o aguda, el 35,3%). La supervivencia de los pacientes con IC era del 57,0% a los 5 años.
DISCUSIÓNEl estudio pone de manifiesto el impacto económico en el uso de los recursos y los costes que la IC implica en nuestro medio. La IR es muy prevalente entre los pacientes con alto riesgo cardiovascular6. Es un factor importante en el pronóstico de los pacientes; incluso se ha considerado más determinante que otros parámetros como la fracción de eyección del ventrículo izquierdo o la clase funcional2. Además, en los pacientes hospitalizados se asocia a más tiempo de hospitalización, mortalidad y reingresos por IC6. En este aspecto, Belziti et al6 analizaron retrospectivamente los datos de 200 pacientes ingresados por IC, y observaron que el 23% tenía diagnóstico de IR. La mortalidad y los reingresos fueron más entre los pacientes con IR. Estos resultados concuerdan con la bibliografía consultada2,7 y también realzan la importancia de la IR para predecir el progreso de la enfermedad.
Los resultados del modelo logístico muestran que IR en presencia de IC se asocia con comorbilidad general y específica. Estos resultados coinciden con los descritos en las revisiones efectuadas por Triposkiadis y Skoularigis18 y Shah y Agarwal19, que detallan que la comorbilidad asociada a la IC desempeña un papel fundamental en la progresión de la enfermedad y la respuesta al tratamiento. Esta carga de comorbilidad se asocia con mayores tasas de hospitalización20–22. En la bibliografía consultada, los datos sobre costes de la enfermedad son escasos y las comparaciones ofrecen cierta dificultad. Las excelentes revisiones generales efectuadas por Liao et al23 y Norton et al24 evidenciaron que los pacientes con IC tienen altas morbilidad y mortalidad, pues ocasiona deterioro de la calidad de vida y es una de las enfermedades crónicas más costosas en los países desarrollados; estos destinan a ella un 1-2% de todo el gasto sanitario. Con el envejecimiento de la población y las tendencias epidemiológicas actuales (aumento de diabetes mellitus y obesidad), es probable que los costes de la IC aumenten.
En cuanto al coste específico de la enfermedad, destacan algunos estudios. Bogner et al25, en un estudio observacional con pacientes hospitalizados, muestra que la combinación de IC y diabetes mellitus tiene mayor coste (32.676 frente a 22.230 dólares). Para Dall et al26, el coste medio anual fue 33.247 dólares. Los autores estiman un aumento de la prevalencia de la enfermedad del 26% entre 2013 y 2022, con el correspondiente incremento en el uso de los recursos sanitarios. Mejhert et al27, en un reciente estudio con 208 pacientes ≥ 60 años de un ámbito poblacional parecido al del presente estudio (AP y hospitalaria), obtuvieron un promedio anual del coste sanitario de unos 5.700 euros. Los datos obtenidos están más en consonancia con estos resultados. A modo de comparación, con una metodología similar a la empleada en este estudio (ámbito poblacional, seguimiento de 2 años), el coste total de los pacientes con diabetes mellitus fue de unos 2.500 euros, circunstancia que realza el elevado coste de la IC en España28.
En el seguimiento de los pacientes, también hay una importante variabilidad. En este estudio, la mortalidad fue alta y las reagudizaciones y las complicaciones cardiovasculares y renales frecuentes. Estos hallazgos están en consonancia con algunos estudios en que la mortalidad por IC fue de aproximadamente el 12% anual (el 31% en 3 años), como los datos procedentes del estudio de Lund et al29 (el 34% en 3 años) o el de Núñez et al30 (el 15% sufrió infarto de miocardio, el 20,8% falleció), por citar algunos ejemplos.
LimitacionesLas posibles limitaciones del estudio son las propias de los estudios retrospectivos, como, por ejemplo, el infrarregistro de la enfermedad, la posible variabilidad entre los profesionales y los pacientes por el diseño observacional o incluso el sistema de costes empleado. En este aspecto, se debe considerar entre las limitaciones del estudio la posible inexactitud de la codificación diagnóstica en cuanto al diagnóstico de IC y otras comorbilidades o la fiabilidad en la evaluación de los criterios de Framingham. Además, hay otras limitaciones: a) no se identificó a los pacientes con formas subclínicas o leves de IC y/o IR, puesto que no a todos se los manejó en atención hospitalaria; b) la ausencia de ciertos biomarcadores pronósticos, como el péptido natriurético cerebral, puesto que no se determinó sistemáticamente; c) algunas variables, como la fracción de eyección del ventrículo izquierdo o la clase funcional, no se determinaron durante todo el seguimiento, y d) aunque se obtuvo información de los principales grupos farmacológicos, durante el seguimiento no se registraron los cambios terapéuticos ni se evaluó el grado de adherencia al tratamiento. En este estudio no se contemplaron los costes directos no sanitarios, es decir, los considerados «costes de bolsillo» o pagados por el propio paciente o su familia porque no estaban registrados en la base de datos y no se tenía acceso (por el diseño del estudio) al propio paciente, por lo que se debe interpretar como otra limitación del estudio.
Futuros estudios harán necesario disponer de ensayos de coste-efectividad y de tratamiento, además de replicar este en otras organizaciones sanitarias.
CONCLUSIONESLa comorbilidad asociada a la IC es alta. La presencia de IR ocasiona mayor utilización de recursos sanitarios y costes para el Sistema Nacional de Salud.
CONFLICTO DE INTERESESEste estudio fue financiado por Novartis, que no influyó en los resultados finales. El análisis estadístico lo realizó Antoni Sicras Mainar y lo financió Novartis. Todos los autores declaran no tener conflictos de intereses. Los financiadores no han tenido intervención alguna en el diseño, la recogida y el análisis de los datos, la decisión de publicar o la preparación del manuscrito.