Las mutaciones somáticas causantes de la expansión clonal de las células hematopoyéticas (hematopoyesis clonal de potencial indeterminado [CHIP]) aumentan con la edad y se relacionan con mayor riesgo de aparición de neoplasias hematológicas1. En el ámbito cardiovascular, se ha visto que se relacionan con la ateroesclerosis y la inflamación2. En la insuficiencia cardiaca (IC) crónica, la información es escasa.
Se investigó a una cohorte consecutiva formada por 60 pacientes con IC crónica sin antecedentes de cáncer. Las características basales se detallan en la tabla 1. El estudio se llevó a cabo conforme al comité de ética del Hospital Universitari Germans Trias i Pujol y todos los pacientes firmaron el consentimiento informado. Se realizó secuenciación exhaustiva dirigida con una serie hecha a medida de 43 genes asociados con trastorno mieloide y CHIP, con ácido desoxirribonucleico extraído de muestras de sangre periférica. Las genotecas se prepararon con el método de captura de SureSelect QXT (Agilent Technologies, Estados Unidos) y la secuenciación se llevó a cabo con un secuenciador HiSeq2500 siguiendo un protocolo estándar de lecturas emparejadas de a 2 × 75pb (Illumina, Estados Unidos) a una profundidad de cobertura media 2.905 veces mayor. Las lecturas se alinearon con BWA 0.7.12. Se utilizaron los softwares SAMtools 1.2 y VarScan 2.4.0 para identificar variantes sin el umbral de frecuencia alélica de la variante (VAF). Se eliminaron los errores de secuenciación y cartografía genética y se descartaron las variantes con poca calidad de cartografiado (< 20), las variantes localizadas en regiones muy variables y las variantes que aparecían en la cohorte con frecuencia ≥ 5%. También se excluyeron las variantes sinónimas y aquellas con una frecuencia alélica del alelo menor> 0,01 según las bases de datos de población disponibles. Los análisis estadísticos se hicieron con el paquete estadístico SPSS, versión 23.0 (SPSS Inc., Estados Unidos). Se revisaron las cohortes CHIP más grandes para determinar el predominio de la CHIP.
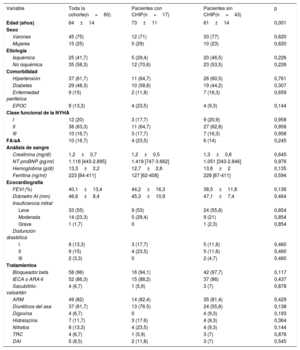
Características clínicas, bioquímicas, ecocardiográficas y relativas al tratamiento de la cohorte entera (n=60) y de los pacientes con CHIP (n=17) o sin CHIP (n=43)
| Variable | Toda la cohorte(n=60) | Pacientes con CHIP(n=17) | Pacientes sin CHIP(n=43) | p |
|---|---|---|---|---|
| Edad (años) | 64±14 | 73±11 | 61±14 | 0,001 |
| Sexo | ||||
| Varones | 45 (75) | 12 (71) | 33 (77) | 0,620 |
| Mujeres | 15 (25) | 5 (29) | 10 (23) | 0,620 |
| Etiología | ||||
| Isquémica | 25 (41,7) | 5 (29,4) | 20 (46,5) | 0,226 |
| No isquémica | 35 (58,3) | 12 (70,6) | 23 (53,5) | 0,226 |
| Comorbilidad | ||||
| Hipertensión | 37 (61,7) | 11 (64,7) | 26 (60,5) | 0,761 |
| Diabetes | 29 (48,3) | 10 (58,8) | 19 (44,2) | 0,307 |
| Enfermedad periférica | 9 (15) | 2 (11,8) | 7 (16,3) | 0,659 |
| EPOC | 8 (13,3) | 4 (23,5) | 4 (9,3) | 0,144 |
| Clase funcional de la NYHA | ||||
| I | 12 (20) | 3 (17,7) | 9 (20,9) | 0,958 |
| II | 38 (63,3) | 11 (64,7) | 27 (62,8) | 0,958 |
| III | 10 (16,7) | 3 (17,7) | 7 (16,3) | 0,958 |
| FA/aA | 10 (16,7) | 4 (23,5) | 6 (14) | 0,245 |
| Análisis de sangre | ||||
| Creatinina (mg/dl) | 1,2±0,7 | 1,2±0,5 | 1,3±0,8 | 0,645 |
| NT-proBNP (pg/ml) | 1.116 [443-2.895] | 1.419 [747-3.662] | 1.051 [343-2.846] | 0,976 |
| Hemoglobina (g/dl) | 13,3±2,2 | 12,7±2,6 | 13,6±2 | 0,135 |
| Ferritina (ng/ml) | 223 [84-411] | 127 [62-408] | 228 [87-411] | 0,594 |
| Ecocardiografía | ||||
| FEVI (%) | 40,1±13,4 | 44,2±16,3 | 38,5±11,8 | 0,136 |
| Diámetro AI (mm) | 46,6±8,4 | 45,3±10,9 | 47,1±7,4 | 0,464 |
| Insuficiencia mitral | ||||
| Leve | 33 (55) | 9 (53) | 24 (55,8) | 0,854 |
| Moderada | 14 (23,3) | 5 (29,4) | 9 (21) | 0,854 |
| Grave | 1 (1,7) | 0 | 1 (2,3) | 0,854 |
| Disfunción diastólica | ||||
| I | 8 (13,3) | 3 (17,7) | 5 (11,6) | 0,460 |
| II | 9 (15) | 4 (23,5) | 5 (11,6) | 0,460 |
| III | 2 (3,3) | 0 | 2 (4,7) | 0,460 |
| Tratamientos | ||||
| Bloqueador beta | 58 (96) | 16 (94,1) | 42 (97,7) | 0,117 |
| IECA o ARA-II | 52 (86,3) | 15 (88,2) | 37 (86) | 0,437 |
| Sacubitrilo-valsartán | 4 (6,7) | 1 (5,9) | 3 (7) | 0,878 |
| ARM | 49 (82) | 14 (82,4) | 35 (81,4) | 0,429 |
| Diuréticos del asa | 37 (61,7) | 13 (76.5) | 24 (55,8) | 0,138 |
| Digoxina | 4 (6,7) | 0 | 4 (9,3) | 0,193 |
| Hidralazina | 7 (11,7) | 3 (17.6) | 4 (9,3) | 0,364 |
| Nitratos | 8 (13,3) | 4 (23,5) | 4 (9,3) | 0,144 |
| TRC | 4 (6,7) | 1 (5,9) | 3 (7) | 0,878 |
| DAI | 5 (8,5) | 2 (11,8) | 3 (7) | 0,545 |
AI: aurícula izquierda; ARA-II: antagonistas de los receptores de la angiotensina II; ARM: antagonista de los receptores mineralocorticoideos; DAI: desfibrilador automático implantable; EPOC: enfermedad pulmonar obstructiva crónica; FA/aA: fibrilación auricular/aleteo auricular; FEVI: fracción de eyección del ventrículo izquierdo; IECA: inhibidores de la enzima de conversión de la angiotensina; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; NYHA: New York Heart Association; TRC: terapia de resincronización cardiaca.
Los valores expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
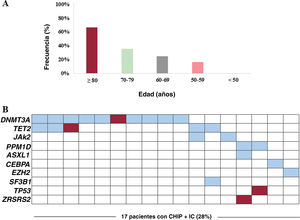
Se halló CHIP en el 28% de los pacientes y se detectó un total de 30 variantes. En conjunto, 9 pacientes (15%) eran portadores de una mutación, 4 (7%) presentaban 2 mutaciones simultáneas, 3 (5%) tenían 3 mutaciones y 1 (2%), 4. Según los estudios anteriores, el predominio de la CHIP aumentaba con la edad: el 67% en los pacientes de 80 o más años (n=8), el 36% en los de 70-79 años (n=15), el 25% en los de 60-69 años (n=16) y el 17% en los de 50-59 años (n=12) (p=0,01) (figura 1A). Cabe destacar que no se detectaron portadores de CHIP entre los menores de 50 años (n=9). El promedio de mutaciones detectadas por paciente también aumentaba con la edad: 2,3 (≥ 80 años), 1,7 (70-79 años), 1,4 (60-69 años) y 1 (< 60 años). La frecuencia de CHIP en la IC fue en todos los grupos de edad considerablemente mayor que en las cohortes publicadas antes, especialmente las poblaciones no seleccionadas y los pacientes con enfermedad coronaria2. No obstante, hay que interpretar esta observación con cautela, ya que el predominio de CHIP en las cohortes puede estar influido por la variedad de técnicas de secuenciación utilizadas en estos estudios, algunos de los cuales no alcanzaron la sensibilidad señalada para algunas de las variantes detectadas en el estudio actual. Según estudios anteriores, el gen afectado con mayor frecuencia fue DNMT3A (17%), seguido de TET2 (8%). Los estudios experimentales han señalado que las mutaciones de estos 2 genes favorecen la disfunción cardiaca en modelos murinos de IC3,4. En 2 pacientes (3%) también se detectaron mutaciones simultáneas en los genes JAK2 y PPM1D, mientras que se identificaron mutaciones específicas en los genes ASXL1, CEBPA, EZH2, SF3B1, TP53 y ZRSR2 (figure 1B). La VAF media fue del 1,96% con valores que oscilaban entre el 1,05 y el 37,25%. La mayoría de las variantes (77%) presentaban valores de VAF <5%. Cabe destacar que 3 pacientes eran portadores de un clon que esconde conocidas mutaciones mieloides patógenas con una VAF> 20%, pero no mostraron signos de citopenia ni otros síntomas hematológicos: mutación p.R882H del gen DNMT3A (VAF, 37%); un clon que esconde tanto la mutación p.R882H del gen DNMT3A (VAF, 30%) como la mutación interruptora del gen TET2 (VAF, 30%), y una eliminación o deleción de 27pb en el gen CEBPA (VAF, 27%). No hubo diferencias en las características clínicas basales, los perfiles hematológicos y el tratamiento entre los pacientes con IC portadores de CHIP y los no portadores (tabla 1). La presencia de mutaciones en el gen DNMT3A se relacionó con disfunción diastólica (el 35 frente al 16%; p=0,031). El tiempo de seguimiento fue de 43±11 meses, sin diferencias entre los pacientes con y sin CHIP (p=0,500). Hubo 4 defunciones (23,5%) de pacientes con CHIP y 7 (16,3%) sin CHIP (p=0,513). El objetivo combinado (hospitalización o muerte por IC) se produjo en 7 pacientes (41,2%) con CHIP y en 9 (20,9%) sin CHIP (p=0,110). La CHIP no se relacionó con la mortalidad (hazard ratio [HR] = 1,53; intervalo de confianza del 95% [IC95%], 0,45-5,24; p=0,497) ni con el objetivo combinado (HR = 2,12; IC95%, 0,79-5,71; p=0,137) según un análisis de regresión de Cox con modelo de riesgos proporcionales. En los pacientes con CHIP, no hubo diferencias en los resultados clínicos entre los pacientes con y sin etiología isquémica (p=0,861). No se produjo ningún nuevo inicio de cáncer durante el seguimiento.
Predominio de la CHIP. A: predominio de la CHIP según la edad. B: distribución de los genes mutados en la cohorte. Cada columna representa 1 paciente y cada fila representa 1 gen. Los recuadros azules indican la presencia de CHIP (el rojo indica la presencia de 2 o 3 mutaciones en el mismo gen). IC: insuficiencia cardiaca. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Los registros contemporáneos muestran que actualmente un porcentaje alto de los pacientes con IC fallecen por causas no cardiacas, principalmente enfermedades concomitantes y cáncer. Además, los estudios recientes indican que los pacientes con IC son más propensos a sufrir cáncer de nuevo diagnóstico5 y, por lo tanto, es necesario comprender mejor la relación causal entre la IC y el crecimiento del tumor. Asimismo, los estudios recientes indican que la CHIP constituye un nuevo factor de riesgo causal de IC y se relaciona con malos resultados6.
FINANCIACIÓNEste estudio recibió subvención de la Generalitat de Catalunya (Departament de Salut)PERIS: Acció instrumental de programes de recerca orientats (SLT002/16/00234) y ayuda económica de la AGAUR (2017-SGR288 y 2017-SGR-483) proveniente del Programa CERCA/Generalitat de Catalunya, Fundació Internacional Josep Carreras, Societat Catalana de Cardiologia, Fundación bancaria «la Caixa» y Red de Terapia Celular-TerCel (RD16/00111/0006), proyectos CIBER de Enfermedades Cardiovasculares (CB16/11/00403), como parte del Plan Nacional de I+D+I, y fue cofinanciado por el ISCIII-Subdirección General de Evaluación y el Fondo Europeo de Desarrollo Regional (FEDER). La investigación que condujo a esta invención ha recibido financiación de la Fundación «la Caixa». El CNIC está financiado por el Instituto de Salud Carlos III (ISCIII), el Ministerio de Ciencia e Innovación (MCIN) y la Fundación Pro CNIC.
CONTRIBUCIÓN DE LOS AUTORESL. Palomo llevó a cabo los estudios de secuenciación, interpretó los datos y realizó el análisis; E. Santiago-Vacas recogió las muestras y los datos clínicos y realizó el análisis; D. Pascual-Figal y J.J. Fuster revisaron la secuenciación y los análisis estadísticos; F. Solé y A. Bayés-Genis diseñaron el estudio y proporcionaron las muestras. Todos los autores revisaron el artículo y dieron su aprobación final.
CONFLICTO DE INTERESESLos autores afirman no tener ningún conflicto de intereses.