La incidencia descrita de estenosis de venas pulmonares tras la ablación por radiofrecuencia es muy variable. Además, la mayoría de los estudios se han centrado en las estenosis graves y han prestado poca atención a las de carácter leve. El objetivo de este trabajo es estudiar los cambios morfológicos de las venas pulmonares después de la ablación y los posibles factores predictivos de estenosis en la resonancia magnética previa a la ablación.
MétodosSe examinó mediante resonancia magnética cardiaca a un total de 80 pacientes consecutivos con fibrilación auricular antes de practicarles una ablación por radiofrecuencia. Se repitió la resonancia magnética una mediana de 95 días después de la ablación. Entre las variable estudiadas, se midió, utilizando un diseño ciego, el área/elipticidad del ostium, así como el volumen auricular. Se evaluó la presencia de estenosis y se clasificó como leve (< 50% de reducción del área), moderada (50-70%) o grave (> 70%).
ResultadosSe identificó estenosis tras la ablación en 78 de 322 venas analizadas (24,2%). La estenosis fue leve en 66 (84,6%) venas, moderada en 11 (14,1%) y grave en 1 (1,3%). Todas estaban asintomáticas. La vena pulmonar inferior izquierda es la que presentó la mayor frecuencia de estenosis: se detectó en un 26% de ellas (p < 0,001). Un análisis de regresión múltiple reveló que el tipo de vena (vena pulmonar inferior izquierda, odds ratio = 3,089; p = 0,02) y una mayor área del ostium antes de la ablación (odds ratio = 1,009; p < 0,001) eran factores independientes predictivos de estenosis tras la ablación. La edad (odds ratio = 1,033) mostró una tendencia fuerte hacia la significación estadística (p = 0,06).
ConclusionesDespués de la ablación se produce una disminución del tamaño del ostium de las venas pulmonares y se detecta algún grado de estenosis en menos de una tercera parte de los pacientes. La mayoría son leves y las estenosis graves son excepcionales. Los pacientes de más edad, aquellos con venas de mayor tamaño y las venas inferiores izquierdas tienen mayor probabilidad de presentar estenosis.
Palabras clave
La fibrilación auricular (FA) es la arritmia más frecuente. Es probable que se produzca un aumento de la incidencia de FA debido al aumento progresivo de la edad de la población1. La aurícula izquierda y las venas pulmonares (VP) proximales desempeñan un papel clave en el inicio y el mantenimiento de la FA2. Este trastorno puede ser iniciado por latidos ectópicos rápidos originados en manguitos de miocardio de la aurícula izquierda que se extienden hacia el interior de las VP3. Durante la última década, el aislamiento de las VP por medio de múltiples aplicaciones consecutivas de energía de radiofrecuencia alrededor del ostium se ha establecido como una opción terapéutica eficaz y de importancia creciente en el tratamiento de la FA3–6.
La estenosis de las VP se ha identificado como complicación de este procedimiento7–9. Su riesgo puede minimizarse reduciendo la energía de radiofrecuencia aplicada y evitando las aplicaciones en el interior de las VP6,10,11. Por consiguiente, el conocimiento detallado de la anatomía de las VP de cada paciente puede ser esencial para optimizar el aislamiento de las venas12.
En varios estudios se ha evaluado la incidencia de estenosis grave de las VP tras la ablación; los porcentajes descritos han sido muy variables (entre el 0.0 y el 42,4%9,13–16). Sin embargo, se sabe poco sobre los grados menores de pérdida luminal tras la ablación.
Los objetivos del presente estudio son: a) evaluar el remodelado anatómico de las VP tras la ablación, y b) estudiar los posibles factores predictivos del riesgo de estenosis de las VP basados en estudios de resonancia magnética (RM) realizados antes y después de la ablación por radiofrecuencia de la FA.
MÉTODOSPacientes y procedimiento de ablaciónSe estudió a 80 pacientes consecutivos con FA recurrente sintomática (paroxística o persistente), refractaria a los fármacos antiarrítmicos, remitidos para ablación por radiofrecuencia de la FA, en los que se obtuvo una RM con contraste antes y aproximadamente 3 meses después del procedimiento (mediana de 95 [intervalo intercuartílico, 90-104] días).
El método de ablación consistió en el aislamiento del ostium de la VP usando catéteres con punta irrigada (Navistar y Navistar Thermo-cool; Biosense Webster) y catéteres circulares decapolares (Lasso; Biosense Webster) con empleo simultáneo de un sistema de cartografía electroanatómica (CARTO; Biosense-Webster) integrado con las imágenes tridimensionales de RM. El objetivo de la ablación era producir un bloqueo bidireccional de la conducción de la VP en todas las VP.
El comité ético local aprobó el protocolo del estudio y los pacientes del estudio dieron su consentimiento informado por escrito para la RM y para el procedimiento de ablación.
Adquisición de las imágenesLa RM cardiaca se realizó con un sistema de 1 T (Signa LX; GE Medical Systems) o de 1,5 T (Sigma Excite; GE Medical Systems). La inyección del contraste de gadolinio para la secuencia angiográfica se realizó con una técnica de rastreo del bolo (bolus tracking) o con una adquisición de imagen del bolo (bolus timing) (2ml de contraste de gadolinio a una velocidad de 2ml/s, seguidos de un bolo de 20–30ml de solución fisiológica a una velocidad de 2ml/s) previa a una angiografía tridimensional con contraste de gadolinio y en apnea, en un plano coronal que incluía la aurícula izquierda y las VP (20ml de gadopentetato de dimeglumina a una velocidad de 2ml/s, seguido de un bolo de 20–30ml de solución fisiológica a una velocidad de 2ml/s).
Se realizó estudio de cine-RM con sincronización electrocardiográfica para la medición de los volúmenes de la aurícula izquierda mediante secuencias de eco-gradiente (sistema de 1 T) o secuencias de precesión libre en estado de equilibrio estable (sistema de 1,5 T) adquiridas en apnea en planos axiales adyacentes que cubrían la aurícula izquierda y las VP proximales.
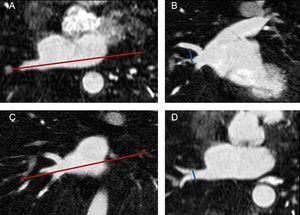
Mediciones morfométricas de venas pulmonares y de la aurícula izquierdaUn observador que desconocía si la exploración se había llevado a cabo antes o después de la ablación evaluó las imágenes obtenidas en todos los estudios. Tal como se muestra en la figura 1, se determinaron los diámetros superoinferior y anteroposterior de cada VP en cortes de 8–10mm de grosor en dos imágenes MIP (proyección de intensidad máxima) de las VP (maximum intensity projection) basadas en el eje longitudinal de la VP. El ostium de la VP se definió como el punto de inflexión entre la pared de la aurícula izquierda y la pared de la VP. Se estimó el área seccional transversal del ostium con la siguiente fórmula:
Medición de los diámetros de las venas pulmonares. Eje longitudinal de la vena pulmonar en un plano axial (A). El diámetro superoinferior de cada vena pulmonar se midió en una reconstrucción de imagen coronal oblicua (B) basada en el plano que se muestra en A. Eje longitudinal de la vena pulmonar en un plazo coronal (C). El diámetro anteroposterior se midió en una imagen axial oblicua (D) basada en el plano que se muestra en C. El ostium de la vena pulmonar se definió como el punto de inflexión entre la pared de la aurícula izquierda y la pared de la vena pulmonar.
Se determinó el área de la sección transversal de la VP en la situación basal y después de la ablación a nivel del ostium de la VP, a intervalos de 3mm y en el punto de máxima reducción.
Se calculó la elipticidad del ostium de la siguiente forma:
Esta fórmula proporciona un valor entre 0 (circunferencia) y 1 (línea recta). Se midió también la distancia del ostium de la VP a la primera ramificación y los ángulos de la VP respecto a los planos axial y coronal del cuerpo.
Se midieron los diámetros de la aurícula izquierda (anteroposterior, transversal y longitudinal) y los volúmenes (telesistólico y telediastólico).
Se realizaron reconstrucciones MIP y MPVR (multiprojection volume reconstruction) con la ayuda de un programa informático comercial de visualización de volumen (Advantage Workstation 4.2; GE Medical Systems).
Para determinar el grado de acuerdo interobservador, un evaluador con 15 años de experiencia en RM realizó las mediciones de las VP de manera independiente. Para determinar la concordancia intraobservador, el evaluador inicial volvió a realizar las mediciones 1 año después utilizando un diseño ciego.
Estenosis de venas pulmonaresLa estenosis de VP se definió como una disminución del diámetro de la VP de más del doble de la desviación estándar de las diferencias intraobservador. Las estenosis se clasificaron como concéntricas (reducción tanto del diámetro superoinferior como del anteroposterior) o excéntricas (reducción de solo uno de los diámetros). Según el grado de reducción del área de la sección transversal de la VP, las estenosis se clasificaron como leves (< 50%), moderadas (50–70%) o graves (> 70%).
Análisis estadísticoLas variables continuas no seguían una distribución normal según la prueba de Shapiro-Wilk, por lo que se presentan en forma de mediana [intervalo intercuartílico], y se compararon con la prueba de la U de Mann-Whitney. Las variables discretas se compararon con la prueba de la χ2. Se utilizó un análisis de ecuaciones de estimación generalizada para identificar los factores clínicos y anatómicos que predecían la estenosis de las VP tras la ablación. A diferencia de la regresión logística convencional, que utiliza la asunción de casos independientes, el método empleado aquí (ecuaciones de estimación generalizada) tiene en cuenta que los casos están correlacionados (mediciones de varias venas en cada paciente), lo que proporciona estimaciones más fiables de la ratio. ratio (OR). Se probaron en el análisis multivariable las variables clínicamente relevantes (edad, sexo, hipertensión, cardiopatía estructural y tipo de FA) y las variables morfométricas que podían estar asociadas a la pérdida luminal tras la ablación (volúmenes de la aurícula izquierda, tipo de VP, área del ostium de la VP, elipticidad del ostium de VP, angulación de las VP y distancia hasta la primera ramificación). Inicialmente se incluyeron en el modelo todas las variables, y luego se aplicó una selección retrógrada escalonada de las variables, fijando un valor de p = 0,25 para la inclusión y p = 0,10 para la exclusión. Se calculó el coeficiente de correlación intraclase para evaluar la reproducibilidad interobservador e intraobservador de las mediciones. Las categorías de Fleiss describen la fuerza de la concordancia: > 0,75, concordancia alta; 0,41-0,75, concordancia moderada; < 0,40, concordancia baja. Para los análisis de los datos, se emplearon los programas informáticos JMP (7.0) y SPSS (19.0), con un nivel de significación bilateral de 0,05.
RESULTADOSLas características basales de la población del estudio se incluyen en la tabla 1. Se realizó ablación en un total de 304 VP de 80 pacientes. Se consiguió un bloqueo bidireccional de la VP en la totalidad de las VP abordadas. Se produjeron complicaciones asociadas a la ablación en 5 (6,3%) de 80 pacientes (fístula arteriovenosa femoral en 2 pacientes, hematoma femoral en 1, embolia gaseosa con coronariografía normal en 1 y lesión de cuerda tendinosa mitral en 1).
Características de la población de estudio
| Edad (años) | 54 [47-60] |
| Sexo | |
| Varones | 66 (82,5) |
| Mujeres | 14 (17,5) |
| Hipertensión arterial | 28 (35) |
| Cardiopatía estructural | 14 (18) |
| Isquémica | 4 (5) |
| Hipertensiva | 4 (5) |
| Taquimiocardiopatía | 3 (3,8) |
| Valvular | 1 (1,3) |
| Dilatada | 1 (1,3) |
| Congénita | 1 (1,3) |
| Tipo de fibrilación auricular | |
| Paroxística | 54 (68) |
| Persistente | 26 (32) |
| Fármacos antiarrítmicos previos a la ablación | 68 (85) |
Los datos expresan n (%) o mediana [intervalo intercuartílico].
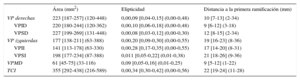
El patrón clásico de 4 VP distintas estaba presente en 51 (64%) de 80 pacientes; 15 de 80 (19%) tenían un tronco común izquierdo, 17 de 80 (21%) presentaban una VP media derecha independiente y en 3 de 80 (4%) había a la vez un tronco común izquierdo y una VP media derecha independiente. Como se indica en la tabla 2, los ostium de las VP del lado derecho eran mayores y más circulares que los de las VP del lado izquierdo (p < 0,001 para ambas comparaciones). Las VP inferiores eran de menor tamaño que las superiores (área de los ostium de las VP inferiores, 182 [141-227] mm2, frente a la de los de las superiores, 215 [188-247] mm2; p < 0,001) y eran más ovaladas (elipticidad de las VP inferiores, 0,16 [0,07-0,28], frente a la de las superiores, 0,09 [0,04-0,17]; p < 0,001). Los ostium más elípticos y más pequeños de las 4 VP fueron los observados en la VP inferior izquierda (p < 0,001 para ambas comparaciones). La VP superior derecha fue la que mostró un ostium más circular y más grande, pero la diferencia no alcanzó significación estadística. La distancia máxima entre el ostium de la VP y la primera ramificación fue la observada en la VP superior izquierda (p < 0,001) y la distancia mínima fue la de la VP inferior derecha (p < 0,001). La distancia fue mayor en las venas del lado izquierdo que en las del lado derecho (media de la diferencia, 8,7 [intervalo de confianza del 95%,] mm; p < 0,001).
Morfometría de las venas pulmonares
| Área (mm2) | Elipticidad | Distancia a la primera ramificación (mm) | |
|---|---|---|---|
| VP derechas | 223 [187-257] (120-448) | 0,00,09 [0,04-0,15] (0,00-0,48) | 10 [7-13] (2-34) |
| VPID | 220 [180-244] (120-362) | 0,00,10 [0,06-0,18] (0,00-0,48) | 9 [6-12] (3-18) |
| VPSD | 227 [199-269] (131-448) | 0,00,08 [0,03-0,12] (0,00-0,30) | 12 [8-15] (2-34) |
| VP izquierdas | 177 [138-211] (63-388) | 0,00,20 [0,09-0,30] (0,00-0,55) | 19 [16-23] (8-36) |
| VPII | 141 [113-178] (63-330) | 0,00,28 [0,17-0,35] (0,00-0,55) | 17 [14-20] (8-31) |
| VPSI | 198 [177-234] (87-388) | 0,011 [0,05-0,22] (0,01-0,38) | 21 [18-26] (9-36) |
| VPMD | 61 [45-75] (33-116) | 0,09 [0,05-0,16] (0,01-0,25) | 9 [5-12] (1-22) |
| TCI | 355 [292-438] (216-589) | 0,00,34 [0,30-0,42] (0,00-0,56) | 22 [19-24] (11-28) |
TCI: tronco común izquierdo; VP: venas pulmonares; VPID: vena pulmonar inferior derecha; VPII: vena pulmonar inferior izquierda; VPMD: vena pulmonar media derecha; VPSD: vena pulmonar superior derecha; VPSI: vena pulmonar superior izquierda.
Los datos expresan mediana [intervalo intercuartílico] (intervalo).
El análisis univariable mostró unos ostium de mayor tamaño en los varones (209 [173-241] mm2) que en las mujeres (185 [143-216] mm2; p = 0,002), con hipertensión (214 [173-246] frente a 198 [161-233] mm2; p = 0,05), con miocardiopatías estructurales (p = 0,03), con FA persistente (222 [180-258] frente a 194 [161-230] mm2; p < 0,001) y con mayor tamaño de la aurícula izquierda. El análisis de regresión múltiple reveló que solo el tamaño auricular izquierdo era un predictor independiente del tamaño de las VP.
Estenosis de venas pulmonaresEl coeficiente de correlación intraclase fue de 0,96 para la reproducibilidad intraobservador y de 0,85 para la variabilidad interobservador en la medición de los diámetros de las VP (concordancia alta según las categorías de Fleiss). La desviación estándar de las diferencias intraobservador e interobservador fue de 1,625mm, sin diferencias en los diámetros superoinferior y anteroposterior. Así pues, la estenosis de VP se definió como la reducción de cualquier diámetro de la VP (superoinferior o anteroposterior) > 3,25mm.
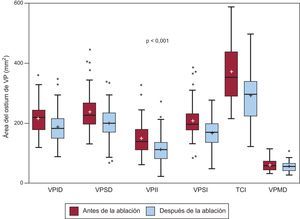
Globalmente, hubo una mediana de reducción de 32 [7,7-57,7] mm2 en el área del ostium de las VP después de la ablación (figura 2). No se encontró asociación entre esta reducción y los cambios en el volumen de la aurícula izquierda.
Área del ostium de la vena pulmonar antes y después de la ablación. Gráficos de cajas que muestran la diferencia entre las áreas de la sección transversal de las venas pulmonares antes y después de la ablación. Los recuadros indican mediana [intervalo intercuartílico]. TCI: tronco común izquierdo; VP: vena pulmonar; VPID: vena pulmonar inferior derecha; VPII: vena pulmonar inferior izquierda; VPMD: vena pulmonar media derecha; VPSD: vena pulmonar superior derecha; VPSI: vena pulmonar superior izquierda. Los recuadros indican mediana [intervalo intercuartílico]. Las líneas indican los valores mínimo y máximo, excepto cuando hay un valor extremo, que se indica con un punto. La media se indica con +.
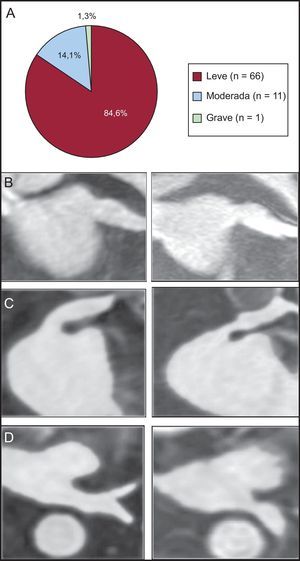
Se observó estenosis en 78 (24,2%) de las 322 venas analizadas. La estenosis fue leve en 66 (84,6%) de 78 VP, moderada en 11 (14,1%) de 78 venas y grave en 1 (1,3%) de 78 venas (figura 3A). Todos los pacientes con estenosis venosa estaban asintomáticos y ninguno necesitó tratamiento. La tasa más alta de estenosis fue la observada en la VP inferior izquierda (24 de 65). De hecho, la única estenosis grave se identificó en una VP inferior izquierda (reducción del área de la sección transversal del 78%) (figuras 3B-D).
Estenosis de venas pulmonares. A: frecuencia de estenosis según el porcentaje de reducción del área de la sección transversal (leve, < 50%; moderada, 50-70%; grave, > 70%). B–D: reconstrucciones de la secuencia de resonancia magnética tridimensional con contraste de gadolinio. B: estenosis leve de una vena pulmonar superior izquierda, plano coronal oblicuo. C: estenosis moderada de una vena pulmonar superior izquierda, plano coronal oblicuo. D: estenosis grave de una vena pulmonar inferior izquierda, plano axial.
Las estenosis de las VP fueron excéntricas en 58 VP (74%) y concéntricas en 20 (26%). No se observaron diferencias en la frecuencia de reducción de los diámetros superoinferior o anteroposterior. El cociente de estenosis de VP excéntricas respecto a las concéntricas fue similar en todas las VP. La mayoría de las estenosis moderadas (8 de 78, 73%) y el único caso de estenosis grave fueron de tipo concéntrico, mientras que la mayoría de los casos de estenosis leves (55 de 66, 83%) fueron de tipo excéntrico (p < 0,001).
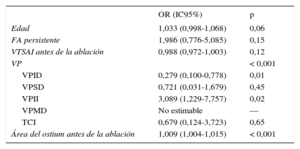
Un modelo de regresión múltiple que incluía factores clínicos y características morfométricas de las VP y de la aurícula izquierda reveló que la VP inferior izquierda (odds ratio = 3,089; intervalo de confianza del 95%, 1,229-7,757; p = 0,02) y una mayor área de la sección transversal de los ostium antes de la ablación (odds ratio = 1,009; intervalo de confianza del 95%, 1,004-1,015, por 1mm2 de aumento; p < 0,001) eran factores independientes predictivos de estenosis de VP (tabla 3). La edad avanzada (odds ratio = 1,033; intervalo de confianza del 95%, 0,998-1,068, por cada 1 año de edad más) mostró una tendencia muy marcada a la significación estadística (p = 0,06).
Factores predictivos de estenosis tras la ablación
| OR (IC95%) | p | |
|---|---|---|
| Edad | 1,033 (0,998-1,068) | 0,06 |
| FA persistente | 1,986 (0,776-5,085) | 0,15 |
| VTSAI antes de la ablación | 0,988 (0,972-1,003) | 0,12 |
| VP | < 0,001 | |
| VPID | 0,279 (0,100-0,778) | 0,01 |
| VPSD | 0,721 (0,031-1,679) | 0,45 |
| VPII | 3,089 (1,229-7,757) | 0,02 |
| VPMD | No estimable | — |
| TCI | 0,679 (0,124-3,723) | 0,65 |
| Área del ostium antes de la ablación | 1,009 (1,004-1,015) | < 0,001 |
FA: fibrilación auricular; IC95%: intervalo de confianza del 95%; OR: odds ratio; TCI: tronco común izquierdo; VP: vena pulmonar; VPID: vena pulmonar inferior derecha; VPII: vena pulmonar inferior izquierda; VPMD: vena pulmonar media derecha; VPSD: vena pulmonar superior derecha; VTSAI: volumen telesistólico auricular izquierdo.
Estos resultados indican que la RM realizada antes de la ablación percutánea de VP en pacientes con FA puede ser útil no solo para la evaluación del número, la posición y el tamaño de los ostium venosos, sino también para predecir el riesgo de estenosis tras ablación por radiofrecuencia.
La tomografía computarizada y la RM son buenas técnicas para evaluar la anatomía de las VP2,8,17,18. La información aportada por la RM previa a la ablación resulta muy útil a los cardiólogos intervencionistas, ya que les permite no solo elegir el catéter apropiado, sino también asegurarse de que se evalúan todos los ostium de las VP durante el procedimiento. La evaluación de estas características en la angiografía convencional puede no ser óptima, puesto que solo se muestran los bordes superior e inferior de los ostium de las VP.
Caracterización morfométrica de las venas pulmonares y las aurículasPor lo que respecta al patrón anatómico, el tamaño y la forma de las VP, los resultados de este estudio concuerdan con lo referido por la mayoría de los estudios previos en los que se ha utilizado la tomografía computarizada o la RM17,19–23. Sin embargo, estas mediciones de los diámetros de las VP en pacientes del sudoeste de Europa son ligeramente inferiores a las descritas en pacientes de Norteamérica y Europa central.
Coincidiendo con lo descrito por un amplio estudio reciente19, los ostium de las VP fueron mayores en los pacientes con FA persistente. Otros estudios no han observado diferencias entre los dos grupos2,8,22. Sin embargo, en el presente estudio, esta asociación perdió la significación estadística al ajustar según el volumen de la aurícula izquierda, lo que indica que el aumento de tamaño de las VP es un proceso ligado al crecimiento de la aurícula izquierda como consecuencia del remodelado auricular que se produce en estos pacientes.
Incidencia de estenosisLa incidencia real de la estenosis de VP tras la ablación sigue siendo incierta; se han publicado porcentajes que van de 0 al 42,4%15,16,24–26. En el presente estudio se observó una estenosis leve en 66 (20,5%) de las 322 venas analizadas, moderada en 11 (3,4%) y grave en 1. Entre las posibles causas de estas diferencias se encuentran los criterios para la definición de la estenosis (p. ej., la medición de solo un diámetro frente al área de la sección transversal o la consideración de que hay estenosis solo cuando la reducción es > 50%), el uso de métodos diagnósticos diferentes y de técnicas de ablación diversas.
Factores predictivos de estenosis previos a la ablaciónLos pacientes de más edad, los que tenían ostium de VP de mayor tamaño y las VP inferiores izquierdas se asociaron a mayor riesgo de estenosis de VP tras la ablación. Aunque los factores técnicos de la ablación, como el número, la duración, la temperatura y la potencia de las aplicaciones en las VP, influyen en las estenosis7,27,28, es poco lo que se sabe acerca de los factores morfométricos predictivos de las estenosis.
Por lo que respecta a la edad, se ha descrito una mayor frecuencia de discontinuidad y de hipertrofia y un mayor grado de fibrosis del miocardio auricular en las VP de los pacientes con FA29 y en los pacientes ancianos30. Al parecer, la fibrosis adicional inducida por las aplicaciones de radiofrecuencia en estas VP potencialmente patológicas de los pacientes de más edad podría contribuir al desarrollo de estenosis.
Además, se observó que la presencia de ostium venosos de mayor tamaño antes de la ablación era un predictor de estenosis. Hay varios factores que pueden influir en este resultado aparentemente sorprendente: a) las VP grandes suelen necesitar más aplicaciones para conseguir el aislamiento, y b) el operador, de forma consciente o no, puede haber sido menos conservador al aplicar la ablación en las VP de mayor tamaño. En concordancia con lo indicado por estos datos, se ha descrito que el tamaño (mayor) de las VP es un factor predictivo de estenosis14.
Por último, tal como se ha descrito en estudios previos27,31, la mayoría de las estenosis se produjeron en la VP inferior izquierda. Sin embargo, que nosotros sepamos, no se ha descrito anteriormente que sea un factor predictivo de estenosis en RM. La forma oval de la mayoría de los ostium de la VP inferior izquierda puede contribuir a producir un contacto prolongado del catéter de ablación con las paredes anterior y posterior de la VP, lo que podría conducir a una ablación más extensa de lo pretendido. De hecho, la mayoría de las estenosis moderadas o graves observadas en las VP inferiores izquierdas mostraron una mayor reducción del diámetro anteroposterior.
LimitacionesLa principal limitación del presente estudio fue que la RM posterior a la ablación se obtuvo tras una mediana de 95 días; por lo tanto, las mediciones podrían variar en una evaluación a más largo plazo. Además, las RM cardiacas se realizaron con sistemas de 1 o 1,5 T, que no corresponden a la tecnología más moderna. Sin embargo, estos son los sistemas que se emplean en la práctica clínica en la mayoría de los hospitales de todo el mundo. Además, estos sistemas permiten alcanzar vóxeles de resoluciones de 1,5 × 1,25 × 1,78mm, más que suficiente para los objetivos de este estudio. Hay que señalar que solo se ha considerado reducciones de la estenosis de más de 3,25mm (el doble de la desviación estándar de la variabilidad intraobservador), aproximadamente el doble de la resolución de la técnica en cualquier dimensión, por lo que no es un factor limitante de importancia. Por último, las exploraciones de tomografía computarizada habrían proporcionado mejor resolución, pero a costa de irradiar al paciente dos veces (antes y después de la ablación).
CONCLUSIONESDespués de la ablación, se observa una pérdida luminal de las VP, y se detecta estenosis en menos de una tercera parte de los pacientes. La mayoría de las estenosis son leves, y las estenosis graves son excepcionales. En pacientes ancianos, en aquellos con ostium de VP de mayor tamaño, así como en las VP inferiores izquierdas, es más probable la aparición de estenosis tras la ablación.
FINANCIACIÓNJorge G. Quintanilla contó con la financiación del FEDER (Fondo Europeo de Desarrollo Regional) y del Instituto de Salud Carlos III: RD06/0003/0009 (REDINSCOR [Red Española de Insuficiencia Cardiaca]) y RD12/0042/0036 (RIC [Red de Investigación Cardiovascular]).
CONFLICTO DE INTERESESNinguno.




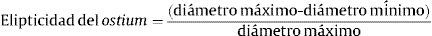
![Área del ostium de la vena pulmonar antes y después de la ablación. Gráficos de cajas que muestran la diferencia entre las áreas de la sección transversal de las venas pulmonares antes y después de la ablación. Los recuadros indican mediana [intervalo intercuartílico]. TCI: tronco común izquierdo; VP: vena pulmonar; VPID: vena pulmonar inferior derecha; VPII: vena pulmonar inferior izquierda; VPMD: vena pulmonar media derecha; VPSD: vena pulmonar superior derecha; VPSI: vena pulmonar superior izquierda. Los recuadros indican mediana [intervalo intercuartílico]. Las líneas indican los valores mínimo y máximo, excepto cuando hay un valor extremo, que se indica con un punto. La media se indica con +. Área del ostium de la vena pulmonar antes y después de la ablación. Gráficos de cajas que muestran la diferencia entre las áreas de la sección transversal de las venas pulmonares antes y después de la ablación. Los recuadros indican mediana [intervalo intercuartílico]. TCI: tronco común izquierdo; VP: vena pulmonar; VPID: vena pulmonar inferior derecha; VPII: vena pulmonar inferior izquierda; VPMD: vena pulmonar media derecha; VPSD: vena pulmonar superior derecha; VPSI: vena pulmonar superior izquierda. Los recuadros indican mediana [intervalo intercuartílico]. Las líneas indican los valores mínimo y máximo, excepto cuando hay un valor extremo, que se indica con un punto. La media se indica con +.](https://static.elsevier.es/multimedia/03008932/0000006800000012/v2_201607190336/S0300893215001049/v2_201607190336/es/main.assets/thumbnail/gr2.jpeg?xkr=eyJpdiI6ImRON0g1bzE0eEJkWklhS2ZscGJTbmc9PSIsInZhbHVlIjoiL1pjL1oyN1B3M0l2MGV5UDdNR25lUkt6NGFDYzZPVHdaelB3UTB5K3YwWT0iLCJtYWMiOiI0ZjdlYTBhZDNlMzJhZTRhNGVlODkyMzI0ZTkwYjU5MzA3YmM5MTNlZThlN2JhZDBmNzczYWRjMWQ0M2RhNjliIiwidGFnIjoiIn0=)
