La neprilisina degrada numerosos péptidos vasoactivos. La forma soluble de neprilisina, que se ha identificado recientemente en la insuficiencia cardiaca, se asocia con eventos cardiovasculares. Se compararon de manera directa la neprilisina soluble y la fracción aminoterminal del propéptido natriurético cerebral como estratificadores de riesgo, dentro de una estrategia multimarcadores, en una cohorte de pacientes con insuficiencia cardiaca de la práctica clínica real.
MétodosSe determinaron las concentraciones de neprilisina soluble, la fracción aminoterminal del propéptido natriurético cerebral, ST2 y troponina T de alta sensibilidad en 797 pacientes ambulatorios consecutivos con insuficiencia cardiaca seguidos durante 4,7 años. Se llevaron a cabo análisis multivariables exhaustivos y se realizaron comparaciones directas de neprilisina soluble frente a la fracción aminoterminal del propéptido natriurético cerebral mediante estadísticas de rendimiento. El objetivo final principal fue el compuesto por muerte cardiovascular u hospitalización por insuficiencia cardiaca. Un objetivo secundario exploró la muerte cardiovascular sola.
ResultadosLas medianas de concentración de neprilisina soluble y la fracción aminoterminal del propéptido natriurético cerebral fueron de 0,64 ng/ml y 1.187 ng/l respectivamente. Ambos biomarcadores presentaron una correlación significativa con la edad (p<0,001) y las cifras de ST2 (p<0,001), pero solo la fracción aminoterminal del propéptido natriurético cerebral mostró una correlación significativa con el filtrado glomerular estimado (p<0,001), el índice de masa corporal (p<0,001), la fracción de eyección del ventrículo izquierdo (p=0,02) y la troponina T de alta sensibilidad (p<0,001). En los análisis de regresión de Cox multivariables, la neprilisina soluble continuó mostrando una asociación independiente con el objetivo compuesto (hazard ratio=1,14; intervalo de confianza del 95%, 1,02-1,27; p=0,03) y la muerte cardiovascular (hazard ratio=1,15; intervalo de confianza del 95%, 1,01-1,31; p=0,04), pero no así la fracción aminoterminal del propéptido natriurético cerebral. La comparación directa de la neprilisina soluble con la fracción aminoterminal del propéptido natriurético cerebral puso de manifiesto buena calibración y discriminación y reclasificación similares con ambos biomarcadores neurohormonales, pero solo la neprilisina soluble mejoró la bondad de ajuste global.
ConclusionesLa neprilisina soluble mantuvo el valor pronóstico independiente al incluirlo en una estrategia multimarcadores, mientras que la fracción aminoterminal del propéptido natriurético cerebral perdió la significación en la estratificación del riesgo en los pacientes ambulatorios con insuficiencia cardiaca. Ambos biomarcadores obtuvieron medidas de rendimiento similares en los análisis de comparación directa.
Palabras clave
Vídeo del artículo

La insuficiencia cardiaca (IC) es una epidemia creciente, con incidencia y prevalencia cada vez más altas1. A pesar de los avances sustanciales que se han realizado en las últimas décadas, la mortalidad de los pacientes con IC continúa siendo alta. La valoración pronóstica puede perfeccionarse con el uso de biomarcadores de procesos fisiopatológicos bien definidos, que no se reflejan en los factores de riesgo de mortalidad establecidos. En 2008, Braunwald2 clasificó los biomarcadores circulantes en siete categorías basadas en sus efectos fisiopatológicos en la IC y planteó la hipótesis de que el uso combinado de múltiples biomarcadores podría tener utilidad para la estratificación del riesgo3. Estos procesos evaluados son la distensión miocárdica, la lesión miocitaria, la matriz extracelular, la inflamación, la disfunción renal, la activación neurohormonal y el estrés oxidativo.
Actualmente, todos los métodos multimarcadores incluyen los péptidos natriuréticos como indicadores indirectos de la vía de activación neurohormonal4. Sin embargo, recientemente ha surgido como posible alternativa la neprilisina soluble (sNEP). La neprilisina (NEP) es una enzima unida a la membrana que fragmenta numerosos péptidos vasoactivos, incluidos los péptidos natriuréticos, la adrenomedulina, la angiotensina I y II, la bradiquinina y la sustancia P5,6. Esta enzima es ubicua y se expresa principalmente en el interior de las membranas celulares, pero recientemente se ha descrito una forma soluble circulante de NEP en la IC7. En una cohorte de pacientes ambulatorios con IC, se observó que la sNEP era un factor independiente predictivo de muerte cardiovascular (CV) y hospitalización por IC7. Dado el papel central que desempeña en la regulación neurohormonal, la sNEP aporta valor pronóstico respecto al estado en que se encuentran diversas vías fisiopatológicas involucradas en la IC. Así pues, se ha comparado de manera directa la sNEP, que es un indicador de la activación neurohormonal general, con la fracción aminoterminal del propéptido natriurético cerebral (NT-proBNP), un indicador indirecto de la liberación de péptido natriurético que constituye el método estándar actual, en combinación con la troponina T de alta sensibilidad (hsTnT) (lesión miocitaria), el ST2 (fibrosis miocárdica e inflamación) y el filtrado glomerular estimado (FGe) (disfunción renal) en lo relativo al pronóstico de la IC.
MÉTODOSPoblación en estudioEl presente estudio es un subanálisis por multimarcadores de la cohorte total estudiada previamente7. El subanálisis se llevó a cabo con los pacientes con determinaciones disponibles de todos los biomarcadores examinados (sNEP, NT-proBNP, hsTnT y ST2). Entre mayo de 2006 y mayo de 2013, se incluyó en el estudio a los pacientes ambulatorios tratados consecutivamente en una clínica multidisciplinaria de IC. Los criterios de inclusión para la derivación de los pacientes y la obtención de muestras de sangre se han descrito ya en otra publicación7,8. Todos los biomarcadores se analizaron en la misma muestra de sangre conservada a –80°C sin ningún ciclo de congelación-descongelación previo. Todas las muestras se obtuvieron entre las 9.00 y las 24.00.
Todos los participantes dieron su consentimiento informado por escrito, y el estudio fue aprobado por el comité ético local. Todos los procedimientos del estudio se llevaron a cabo cumpliendo las normas éticas establecidas en la Declaración de Helsinki de 1975 y la modificación de 1983.
Seguimiento y objetivosTodos los pacientes fueron objeto de seguimiento a intervalos regulares predefinidos, y se realizaron otras visitas adicionales según fuera necesario en caso de descompensación. La programación de visitas regulares incluyó como mínimo visitas de enfermería trimestrales, visitas médicas bianuales y visitas electivas de geriatras, psiquiatras y médicos rehabilitadores9. Se contactó por teléfono con los pacientes que no acudieron a las visitas regulares.
El objetivo principal fue la combinación de eventos de muerte CV u hospitalización por IC. Se exploraron también como objetivos secundarios las muertes de causa cardiovascular y las muertes por cualquier causa. Se consideró que una muerte era de origen CV si la causa era IC (IC descompensada o IC resistente al tratamiento en ausencia de otra causa), muerte súbita (muerte inesperada, presenciada o no, de un paciente previamente estable, sin signos de empeoramiento de la IC u otra causa de muerte), infarto agudo de miocardio (directamente relacionado desde un punto de vista temporal con un infarto agudo de miocardio, como consecuencia de complicaciones mecánicas, hemodinámicas o arrítmicas), ictus (asociada a un déficit neurológico de aparición reciente), una intervención (muerte ocurrida después de una intervención diagnóstica o terapéutica) y otras causas CV (p. ej., rotura de un aneurisma, isquemia periférica o disección aórtica). Las hospitalizaciones se identificaron a partir de los registros clínicos de los pacientes con IC, las salas del hospital y la historia clínica electrónica de Cataluña. Se identificaron los acontecimientos mortales a partir de los registros clínicos de los pacientes con IC, las salas del hospital, el servicio de urgencias, médicos generales y contactando con los familiares de los pacientes. Los datos se verificaron mediante consulta de las bases de datos de los sistemas de salud de Cataluña y España. Los eventos los validaron dos de los autores (M. Domingo y J. Lupón). El seguimiento se finalizó el 31 de marzo de 2014.
Análisis de neprilisinaSe determinó la NEP humana empleando un inmunoanálisis de tipo sandwich (HUMAN NEP/CD10 ELISA KIT [referencia, SK00724-01; número de lote, 20111893], Aviscera Biosciences; Santa Clara, California, Estados Unidos). Se introdujeron varias modificaciones para mejorar la sensibilidad analítica del método y obtener un límite inferior de la cuantificación de la muestra, según lo descrito en otra publicación7. El protocolo modificado mostró una linealidad analítica en el intervalo de valores de 0,250-4ng/ml. Las muestras que tenían una concentración > 4ng/ml se diluyeron hasta una concentración final de entre 0,250 y 64ng/ml. A un valor de un control positivo de 1,4ng/ml, los coeficientes de variación intraanalítica e interanalítica fueron del 3,7 y el 8,9% respectivamente.
Determinación de la fracción aminoterminal del propéptido natriurético cerebralLa concentración de NT-proBNP se determinó mediante un método de inmunoelectroquimioluminiscencia (Elecsys®, Roche Diagnostics; Basilea, Suiza). Este análisis tiene una reactividad cruzada < 0,001% con el péptido natriurético cerebral (BNP) bioactivo, y en los estudios que forman este informe la prueba tuvo unos coeficientes de variación interanalítica que oscilaron entre el 0,9 y el 5,5%.
Prueba de la troponina T cardiaca de alta sensibilidadLa concentración de troponina se determinó con inmunoelectroquimioluminiscencia empleando un test de hsTnT en el Modular Analytics E 170 (Roche Diagnostics). El análisis de hsTnT obtuvo una banda de valores analíticos de 3-10.000 ng/l. En el valor del percentil 99 de 13 ng/l, el coeficiente de variación fue del 9%. Los análisis se llevaron a cabo con reactivos del lote 157123 y no se vieron afectados por los problemas analíticos que han surgido con los tests de hsTnT de Roche.
Prueba de ST2El ST2 se determinó a partir de muestras de sangre empleando un inmunoanálisis monoclonal de tipo sandwich de alta sensibilidad (Presage® ST2 assay, Critical Diagnostics; San Diego, California, Estados Unidos). El test de ST2 tuvo un coeficiente de variación intraanalítica < 2,5% y un coeficiente de variación total del 4%.
Análisis estadísticoLas variables discretas se expresan en forma de porcentajes. Las variables continuas se expresan como media ± desviación estándar o mediana [intervalo intercuartílico] según tengan distribución normal o no normal. Se evaluó la normalidad de la distribución con gráficos Q-Q. La correlación de las concentraciones de sNEP y NT-proBNP con la edad, la fracción de eyección del ventrículo izquierdo (FEVI), el FGe evaluado con la ecuación CKD-EPI (Chronic Kidney Disease EPIdemiology Collaboration), la urea en sangre y el índice de masa corporal (IMC) se analizó con el coeficiente rho de Spearman debido a la distribución asimétrica de los datos. Las diferencias estadísticas (valor de p para la tendencia) en las concentraciones de NT-proBNP y sNEP entre los diversos subgrupos definidos por FGe (≥ 60, < 60 a 30, y<30ml/min/1,73m2) y los subgrupos definidos por el IMC (20,5 a < 25,5, 25,5 a < 30 y≥30 kg/m2) se determinaron mediante la prueba de Spearman.
Se llevó a cabo un análisis de regresión de Cox multivariable empleando el método escalonado retrógrado. Con objeto de satisfacer el supuesto de linealidad de las covariables sNEP, NT-proBNP, hsTnT y ST2, se utilizaron en los modelos de Cox las funciones logarítmicas de sNEP, NT-proBNP y hsTnT, y un término cuadrático de log (hsTnT) y de ST2. Para el cálculo de la hazard ratio (HR) en las tres variables con transformación logarítmica, se utilizó un aumento de 1 desviación estándar, y los análisis del ST2 se realizaron por cada 10ng/ml de cambio. En los pacientes con cifras de sNEP por debajo del límite inferior de detección (0,250ng/ml), se introdujo una concentración de 0,249ng/ml como variable continua. Se incorporaron al modelo las siguientes variables: edad, sexo, etiología isquémica de la IC, FEVI, clase funcional de la New York Heart Association, presencia de diabetes mellitus, frecuencia cardiaca, presión arterial sistólica, hemoglobina, sodio sérico, FGe, NT-proBNP, hsTnT, ST2, tratamiento con bloqueadores beta, tratamiento con inhibidores de la enzima de conversión de la angiotensina o antagonistas de los receptores de la angiotensina II y sNEP. Con objeto de comparar el valor pronóstico de la sNEP y la NT-proBNP, se evaluaron diversos parámetros de rendimiento (discriminación, calibrado y reclasificación), según lo descrito en publicaciones anteriores9,10. Para calcular la mejora de reclasificación neta, se utilizaron categorías de riesgo basadas en los terciles de riesgo del objetivo compuesto (< 21%, 21-39% y>39%) y de muerte CV (< 11%, 11-23% y>23%).
Los análisis estadísticos se realizaron con el programa SPSS 15 (SPSS Inc.; Chicago, Illinois, Estados Unidos) y el paquete estadístico R versión 2.11.1 (Foundation for Statistical Computing; Viena, Austria). Se consideró significativo un valor de p bilateral < 0,05.
RESULTADOSSe determinaron las concentraciones de sNEP, NT-proBNP, hsTnT y ST2 circulantes en 797 pacientes con IC incluidos consecutivamente en el estudio entre mayo de 2006 y julio de 2010. En la tabla 1 se presentan las características basales y las determinaciones de biomarcadores de la cohorte en estudio. Durante un periodo de seguimiento medio de 4,7±2,4 años, fallecieron 393 pacientes, 216 por causas CV (54,9%), 147 por causas no CV (37,4%) y 30 por causas desconocidas (7,6%). De entre las causas de muerte CV conocidas, la IC refractaria lo fue en 110 (50,9%) pacientes, muerte súbita en 47 (21,8%), infarto agudo de miocardio en 19 (8,8%), ictus en 9 (4,2%), intervención CV en 5 (2,3%) y otras causas CV en 26 (12%). Durante el periodo de seguimiento, 193 pacientes ingresaron en el hospital a causa de una IC y 300 presentaron los eventos que constituían el objetivo de muerte CV u hospitalización por IC. Se perdió el seguimiento de 5 pacientes que se censuraron adecuadamente para el análisis.
Características demográficas y clínicas basales y tratamientos utilizados durante el seguimiento
| Cohorte total (n=797) | |
|---|---|
| Edad (años) | 66,5±12,3 |
| Varones | 579 (71,5) |
| Caucásicos | 791 (99,2) |
| Etiología | |
| Cardiopatía isquémica | 416 (52,2) |
| Miocardiopatía dilatada | 74 (9,3) |
| Hipertensiva | 74 (9,3) |
| Valvular | 101 (12,7) |
| Otras | 132 (16,5) |
| Tiempo de evolución de la IC (meses) | 27,2 [5,0-72,6] |
| FEVI (%) | 33,4±13,3 |
| Clase funcional de la NYHA | |
| I | 52 (6,5) |
| II | 535 (67,1) |
| III | 204 (25,6) |
| IV | 6 (0,8) |
| Hipertensión | 494 (62) |
| Diabetes mellitus | 275 (34,5) |
| Sodio (mmol/l) | 139,3±3,4 |
| Hemoglobina (g/dl) | 12,9±1,9 |
| FGe (ml/min/1,73 m2) | 53,7±26,4 |
| NT-proBNP (ng/l) | 1.187 [476-278] |
| Neprilisina (ng/ml) | 0,64 [0,42-1,23] |
| hsTnT (ng/l) | 22,3 [10,2-39,2] |
| ST2 (ng/ml) | 38,1 [30,7-50,4] |
| Tratamiento (seguimiento) | |
| IECA o ARA-II | 729 (91,5) |
| Bloqueadores beta | 717 (90) |
| ARM | 464 (58,2) |
| Diurético de asa | 738 (92,6) |
| Digoxina | 338 (42,4) |
| TRC | 60 (7,5) |
| DAI | 99 (12,4) |
ARA-II: antagonistas de los receptores de la angiotensina II; ARM: antagonistas de los receptores mineralcorticoideos; DAI: desfibrilador automático implantable; FEVI fracción de eyección del ventrículo izquierdo; FGe: filtrado glomerular estimado; IC: insuficiencia cardiaca; IECA: inhibidores de la enzima de conversión de la angiotensina; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; NYHA: New York Heart Association; TRC: terapia de resincronización cardiaca.
Los valores expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
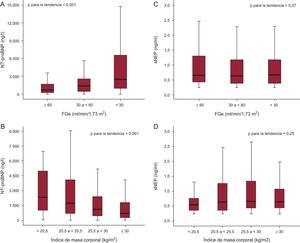
La mediana de concentración de sNEP soluble fue de 0,64 [0,42-1,23] ng/ml y la mediana de concentración de NT-proBNP fue de 1.187 [476-278] ng/l. Los valores de sNEP estuvieron por debajo de la franja evaluable del análisis en 101 pacientes (12,7%). Ambos biomarcadores mostraron una correlación significativa con la edad (ρ=0,41, p<0,001 y ρ=0,19, p<0,001), y la NT-proBNP presentó una correlación significativa con el FGe (ρ=–0,37, p<0,001), la urea en sangre (ρ=0,31, p<0,001) y el IMC (ρ=–0,29, p<0,001) y una correlación débil con la FEVI (ρ=–0,08, p=0,02); pero la sNEP no mostró estas correlaciones (respectivamente, ρ=–0,03, p=0,44; ρ=0,002, p=0,95; ρ=0,04, p=0,23, y ρ=0,008, p=0,88). En el análisis según los estratos predefinidos de FGe e IMC, la concentración sérica de NT-proBNP aumentaba a medida que empeoraba la función renal (figura 1A) y disminuía a medida que aumentaba el IMC (figura 1B), mientras que el sNEP no se veía influido por estas comorbilidades (figuras 1 C y D).
Gráficos de cajas de la fracción aminoterminal del propéptido natriurético cerebral y la neprilisina soluble en los subgrupos definidos según filtrado glomerular estimado e índice de masa corporal. A: concentración de fracción aminoterminal del propéptido natriurético cerebral según los grupos definidos por filtrado glomerular estimado. B: concentración de fracción aminoterminal del propéptido natriurético cerebral en suero según los grupos definidos por el índice de masa corporal. C: concentración de neprilisina soluble en suero según los grupos definidos por filtrado glomerular estimado. D: concentración de neprilisina soluble según los grupos definidos por el índice de masa corporal. FGe: filtrado glomerular estimado; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; sNEP: neprilisina soluble. El recuadro central corresponde a los valores de los cuartiles inferior y superior y la línea central, a la mediana. Las líneas verticales van del valor mínimo al máximo, excluidos los valores extremos inhabituales, que no se muestran.
Además, la NT-proBNP mostró alta correlación con la hsTnT (ρ=0,57, p<0,001) y también una correlación significativa con el ST2 (ρ=0,33, p<0,001), mientras que la sNEP no presentó correlación con la hsTnT (ρ<0,01, p=0,83) y tuvo moderada correlación con el ST2 (ρ=0,15, p<0,001).
Tal como se ha publicado ya anteriormente7, las concentraciones de sNEP y NT-proBNP no mostraron correlación en el conjunto de la muestra (ρ=0,01; p=0,68), y en el presente subestudio de multimarcadores los resultados continuaron sin ser significativos (ρ=0,04, p=0,28).
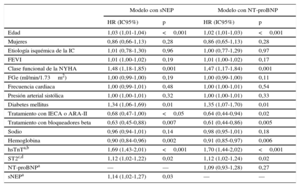
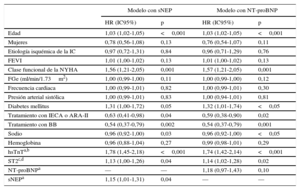
Valor pronóstico en los desenlacesEn los análisis de regresión de Cox multivariantes en los que se incluyeron parámetros clínicos y los biomarcadores de IC claramente establecidos, hsTnT y ST2, la sNEP continuó presentando una asociación independiente tanto con el objetivo compuesto (HR=1,14; intervalo de confianza del 95% [IC95%], 1,02-1,27; p=0,03) (tabla 2) como con la muerte de causa CV (HR=1,15; IC95%, 1,01-1,31; p=0,04) (tabla 3), pero no ocurrió así con la NT-proBNP, ni en el objetivo compuesto (HR=1,09; IC95%, 0,93-1,28; p=0,27) (tabla 2) ni en la muerte de causa CV (HR=1,18; IC95%, 0,97-1,43; p=0,1) (tabla 3).
Análisis multivariable de regresión de Cox del riesgo del parámetro de valoración principal compuesto (muerte de causa cardiovascular u hospitalización por insuficiencia cardiaca)
| Modelo con sNEP | Modelo con NT-proBNP | |||
|---|---|---|---|---|
| HR (IC95%) | p | HR (IC95%) | p | |
| Edad | 1,03 (1,01-1,04) | <0,001 | 1,02 (1,01-1,03) | <0,001 |
| Mujeres | 0,86 (0,66-1,13) | 0,28 | 0,86 (0,65-1,13) | 0,28 |
| Etiología isquémica de la IC | 1,01 (0,78-1,30) | 0,96 | 1,00 (0,77-1,29) | 0,97 |
| FEVI | 1,01 (1,00-1,02) | 0,19 | 1,01 (1,00-1,02) | 0,17 |
| Clase funcional de la NYHA | 1,48 (1,18-1,85) | 0,001 | 1,47 (1,17-1,84) | 0,001 |
| FGe (ml/min/1.73m2) | 1,00 (0,99-1,00) | 0,19 | 1,00 (0,99-1,00) | 0,11 |
| Frecuencia cardiaca | 1,00 (0,99-1,01) | 0,48 | 1,00 (1,00-1,01) | 0,54 |
| Presión arterial sistólica | 1,00 (1,00-1,01) | 0,32 | 1,00 (1,00-1,01) | 0,33 |
| Diabetes mellitus | 1,34 (1,06-1,69) | 0,01 | 1,35 (1,07-1,70) | 0,01 |
| Tratamiento con IECA o ARA-II | 0,68 (0,47-1,00) | <0,05 | 0,64 (0,44-0,94) | 0,02 |
| Tratamiento con bloqueadores beta | 0,63 (0,45-0,88) | 0,007 | 0,61 (0,44-0,86) | 0,005 |
| Sodio | 0,96 (0,94-1,01) | 0,14 | 0,98 (0,95-1,01) | 0,18 |
| Hemoglobina | 0,90 (0,84-0,96) | 0,002 | 0,91 (0,85-0,97) | 0,006 |
| hsTnTa,b | 1,69 (1,43-2,01) | <0,001 | 1,70 (1,44-2,02) | <0,001 |
| ST2c,d | 1,12 (1,02-1,22) | 0,02 | 1,12 (1,02-1,24) | 0,02 |
| NT-proBNPa | — | — | 1,09 (0,93-1,28) | 0,27 |
| sNEPa | 1,14 (1,02-1,27) | 0,03 | — | — |
ARA-II: antagonistas de los receptores de la angiotensina II; FEVI: fracción de eyección del ventrículo izquierdo; FGe: filtrado glomerular estimado; HR: hazard ratio; hsTnT: troponina T cardiaca de alta sensibilidad; IC: insuficiencia cardiaca; IC95%: intervalo de confianza del 95%; IECA: inhibidores de la enzima de conversión de la angiotensina; NEP: neprisilina; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; NYHA: New York Heart Association; sNEP: neprilisina soluble.
Troponina T cardiaca de alta sensibilidad expresada en forma de log (hsTnT); fracción aminoterminal del propéptido natriurético cerebral expresada en forma de log (NT-proBNP); neprilisina expresada en forma de log (NEP). Para el cálculo de la hazard ratio en las tres variables con transformación logarítmica, se utilizó un aumento de 1 desviación estándar.
Análisis multivariable de regresión de Cox del riesgo de muerte cardiovascular
| Modelo con sNEP | Modelo con NT-proBNP | |||
|---|---|---|---|---|
| HR (IC95%) | p | HR (IC95%) | p | |
| Edad | 1,03 (1,02-1,05) | <0,001 | 1,03 (1,02-1,05) | <0,001 |
| Mujeres | 0,78 (0,56-1,08) | 0,13 | 0,76 (0,54-1,07) | 0,11 |
| Etiología isquémica de la IC | 0,97 (0,72-1,31) | 0,84 | 0,96 (0,71-1,29) | 0,76 |
| FEVI | 1,01 (1,00-1,02) | 0,13 | 1,01 (1,00-1,02) | 0,13 |
| Clase funcional de la NYHA | 1,56 (1,21-2,05) | 0,001 | 1,57 (1,21-2,05) | 0,001 |
| FGe (ml/min/1.73m2) | 1,00 (0,99-1,00) | 0,11 | 1,00 (0,99-1,00) | 0,12 |
| Frecuencia cardiaca | 1,00 (0,99-1,01) | 0,82 | 1,00 (0,99-1,01) | 0,30 |
| Presión arterial sistólica | 1,00 (0,99-1,01) | 0,83 | 1,00 (0,94-1,01) | 0,81 |
| Diabetes mellitus | 1,31 (1,00-1,72) | 0,05 | 1,32 (1,01-1,74) | <0,05 |
| Tratamiento con IECA o ARA-II | 0,63 (0,41-0,98) | 0,04 | 0,59 (0,38-0,90) | 0,02 |
| Tratamiento con BB | 0,54 (0,37-0,79) | 0,002 | 0,54 (0,37-0,79) | 0,001 |
| Sodio | 0,96 (0,92-1,00) | 0,03 | 0,96 (0,92-1,00) | <0,05 |
| Hemoglobina | 0,96 (0,88-1,04) | 0,27 | 0,99 (0,98-1,01) | 0,29 |
| hsTnTa,b | 1,78 (1,45-2,18) | <0,001 | 1,74 (1,42-2,14) | <0,001 |
| ST2c,d | 1,13 (1,00-1,26) | 0,04 | 1,14 (1,02-1,28) | 0,02 |
| NT-proBNPa | — | — | 1,18 (0,97-1,43) | 0,10 |
| sNEPa | 1,15 (1,01-1,31) | 0,04 | — | — |
ARA-II: antagonistas de los receptores de la angiotensina II; BB: bloqueadores beta; FEVI: fracción de eyección del ventrículo izquierdo; FGe: filtrado glomerular estimado; HR: hazard ratio; hsTnT: troponina T cardiaca de alta sensibilidad; IC: insuficiencia cardiaca; IC95%: intervalo de confianza del 95%; IECA: inhibidores de la enzima de conversión de la angiotensina; NEP: neprisilina; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; NYHA: New York Heart Association; sNEP: neprilisina soluble.
Troponina T cardiaca de alta sensibilidad expresada en forma de log (hsTnT); fracción aminoterminal del propéptido natriurético cerebral expresada en forma de log (NT-proBNP); neprilisina expresada en forma de log (NEP). Para el cálculo de la hazard ratio en las 3 variables con transformación logarítmica se utilizó un aumento de 1 desviación estándar.
En el análisis multivariable, la sNEP (HR=1,02; IC95%, 0,92-1,14; p=0,68) y la NT-proBNP (HR=1,09; IC95%, 0,95-1,26; p=0,23) no presentaron asociación independiente con la muerte por cualquier causa. En cambio, en el análisis centrado tan solo en los objetivos de IC, la sNEP continuó mostrando asociación independiente tanto con la muerte relacionada con la IC (HR=1,31; IC95%, 1,11-1,55; p=0,001) como con el objetivo compuesto por muerte relacionada con IC y hospitalización por IC (HR=1,20; IC95%, 1,06-1,35; p=0,005), mientras que la NT-proBNP no mostró esta asociación (respectivamente, HR=1,18, IC95%, 0,97-1,43; p=0,1, y HR=1,07; IC95%, 0,89-1,29; p=0,48).
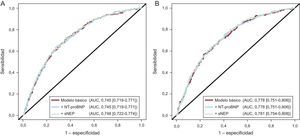
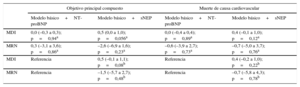
La comparación directa de la sNEP con la NT-proBNP en un modelo predictivo que contenía 11 variables clínicas junto con la hsTnT y el ST2 no mostró diferencias en la capacidad de discriminación (todas las diferencias de área bajo la curva, p>0,05) (figura 2) y de reclasificación (todos los valores de mejora de discriminación integrada y mejora de reclasificación neta, p>0,05) por lo que respecta a los dos objetivos, al añadirlos al modelo de referencia (tabla 4). La calibración fue buena, con una prueba de Hosmer-Lemeshow no significativa en todos los modelos (en todos los casos, p>0,05), aunque los modelos que incluían la sNEP mostraron valores ligeramente inferiores del criterio de información de Aikaike y el criterio de información bayesiano, mejor calibrado (datos no presentados). La adición de la sNEP mejoró la bondad de ajuste general evaluada con la prueba de cociente de verosimilitud tanto para el objetivo principal compuesto (p=0,02) como para el objetivo de muerte de causa CV (p=0,03), pero no ocurrió así con la adición de NT-proBNP (p=0,22 y p=0,11 respectivamente). Un valor de p significativo en esta prueba significa que la adición de una nueva variable al modelo mejora significativamente la exactitud del modelo de referencia.
Área bajo la curva de los modelos predictivos. Modelo básico (línea roja): edad, sexo, etiología isquémica de la insuficiencia cardiaca, fracción de eyección del ventrículo izquierdo, clase funcional de la New York Heart Association, presencia de diabetes mellitus, hemoglobina, sodio sérico, filtrado glomerular estimado, troponina T de alta sensibilidad, ST2, tratamiento con bloqueadores beta y tratamiento con inhibidores de la enzima de conversión de la angiotensina o antagonistas de los receptores de la angiotensina II. El modelo que contiene también la neprilisina soluble se muestra mediante una línea verde y el modelo que contiene también la fracción aminoterminal del propéptido natriurético cerebral se muestra con una línea azul. A: objetivo compuesto formado por muerte de causa cardiovascular y hospitalización por insuficiencia cardiaca (p=0,83 para la comparación del modelo básico frente al modelo que contiene también fracción aminoterminal del propéptido natriurético cerebral; p=0,24 para la comparación del modelo básico frente al modelo que contiene también neprilisina soluble, y p=0,22 para la comparación directa de los dos modelos que contienen los biomarcadores neurohormonales). B: muerte cardiovascular (p=0,87, p=0,26 y p=0,40 respectivamente para las mismas comparaciones). AUC: área bajo la curva; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; sNEP: neprilisina soluble. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Reclasificación para el objetivo compuesto por muerte de causa cardiovascular y hospitalización por insuficiencia cardiaca y para la muerte de causa cardiovascular, según se añada neprilisina soluble o fracción aminoterminal del propéptido natriurético cerebral al modelo básico
| Objetivo principal compuesto | Muerte de causa cardiovascular | |||
|---|---|---|---|---|
| Modelo básico+NT-proBNP | Modelo básico+sNEP | Modelo básico+NT-proBNP | Modelo básico+sNEP | |
| MDI | 0,0 (–0,3 a 0,3); p=0,94a | 0,5 (0,0 a 1,0); p=0,056a | 0,0 (–0,4 a 0,4); p=0,89a | 0,4 (–0,1 a 1,0); p=0,12a |
| MRN | 0,3 (–3,1 a 3,6); p=0,86a | –2,6 (–6,9 a 1,6); p=0,23a | –0,6 (–3,9 a 2,7); p=0,73a | –0,7 (–5,0 a 3,7); p=0,76a |
| MDI | Referencia | 0,5 (–0,1 a 1,1); p=0,08b | Referencia | 0,4 (–0,2 a 1,0); p=0,22b |
| MRN | Referencia | –1,5 (–5,7 a 2,7); p=0,48b | Referencia | –0,7 (–5,8 a 4,3); p=0,78b |
MDI: mejora de discriminación integrada; MRN: mejora de reclasificación neta; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; sNEP: neprilisina soluble.
Modelo básico: edad, sexo, clase funcional de la New York Heart Association, fracción de eyección del ventrículo izquierdo, etiología isquémica, diabetes mellitus, filtrado glomerular estimado, hemoglobina, sodio, tratamiento con bloqueadores beta, tratamiento con inhibidores de la enzima de conversión de la angiotensina o antagonistas de los receptores de la angiotensina II, ST2 y hsTNT.
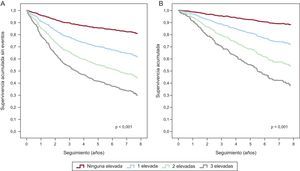
En la figura 3 se muestra la curva de supervivencia sin eventos de la regresión de Cox para el objetivo principal combinado de muerte de causa CV u hospitalización por IC (figura 3A) y la curva de supervivencia para la muerte de causa CV (figura 3B) según las concentraciones séricas inferiores o superiores a la mediana de sNEP, hsTnT y ST2.
Curvas de supervivencia con regresión de Cox según el número de biomarcadores elevados (neprilisina soluble, troponina T de alta sensibilidad y ST2; n=797). A: curva de supervivencia sin eventos correspondiente al objetivo principal compuesto por muerte de causa cardiovascular y hospitalización por insuficiencia cardiaca. B: curva de supervivencia para la muerte de causa cardiovascular. hsTnT: troponina T de alta sensibilidad; sNEP: neprilisina soluble. Se consideró elevado el biomarcador si su valor era igual o superior a las siguientes medianas: neprilisina soluble, 0,64 ng/ml; troponina T de alta sensibilidad, 22,3 ng/l; ST2, 38,1 ng/ml.
Los péptidos natriuréticos han pasado a ser biomarcadores que forman parte de la asistencia estándar en la IC y actualmente son los únicos biomarcadores que han superado los límites de la investigación para pasar a utilizarse habitualmente en la práctica clínica diaria. Los péptidos natriuréticos, que se emplean como parámetros de valoración indirecta de la distensión miocárdica, son tan solo uno de los múltiples mecanismos de contrarregulación que se activan en la IC. En cambio, la NEP es una enzima esencial que fragmenta la mayoría de las neurohormonas activadas por la IC, incluidos los péptidos natriuréticos, aunque sin limitarse a ellos. En consecuencia, la reciente identificación de una forma de NEP con alto valor pronóstico independiente7 ha planteado la posibilidad de que la sNEP sea un verdadero biomarcador neurohormonal exhaustivo en la IC. En este estudio se ha llevado a cabo una comparación directa de ambos biomarcadores en el marco de una estrategia multimarcadores que incluía también el empleo del ST2 y la hsTnT para el pronóstico de la IC. En el estudio surgieron tres conclusiones. En primer lugar, tanto la sNEP como la NT-proBNP tuvieron un rendimiento similar por lo que respecta a la estratificación del riesgo en una cohorte amplia con un seguimiento a largo plazo de pacientes con IC de la práctica clínica real. En segundo lugar, la sNEP no se vio afectada por la disfunción renal o el IMC. En tercer lugar, en el contexto de los análisis multimarcadores, en especial con la incorporación del ST2 y la hsTnT, sustancias ambas para las que se ha demostrado de manera uniforme un valor pronóstico elevado en la IC crónica, tan solo la sNEP conservó este valor pronóstico.
Los péptidos natriuréticos están reconocidos como biomarcadores de clase IA del pronóstico en la guía de IC de 2013 de American College of Cardiology/American Heart Association11. Multitud de estudios prospectivos y retrospectivos han confirmado de manera uniforme la utilidad tanto del BNP como de la NT-proBNP para predecir el riesgo en la IC12,13. No obstante, en la era posterior al estudio PARADIGM, la NT-proBNP puede aparecer como péptido natriurético biomarcador para usarlo solo. De hecho, con la introducción de los inhibidores de los receptores de la angiotensina II y la NEP, en especial tras los resultados innovadores del estudio PARADIGM-HF con LCZ69614, las concentraciones circulantes de BNP casi con seguridad no serán apropiadas para el pronóstico, la monitorización y la guía del tratamiento. Packer et al15 demostraron de manera elegante que el tratamiento con LCZ696 ejerce sus efectos beneficiosos mediante la inhibición de la NEP, con lo que se inhibe la degradación del BNP y las concentraciones de BNP se mantienen elevadas de manera persistente en los pacientes tratados. LCZ696 disocia el equilibrio molecular existente entre BNP y NT-proBNP de tal manera que las concentraciones circulantes de BNP pueden dejar de ser un reflejo de la distensión miocárdica real y serlo más bien de la persistente inhibición de la NEP15. En cambio, la NT-proBNP, que no es sustrato de la NEP, mostró una disminución progresiva en los pacientes tratados con LCZ696 a medida que mejoraba la IC.
En un estudio reciente7, este grupo demostró por primera vez que se observan altas concentraciones de sNEP en la circulación de los pacientes con IC y que estas son un indicador de los resultados adversos por lo que respecta tanto a la morbilidad como a la mortalidad de causa CV. Estos datos fueron importantes para comprender mejor la biopatología del sNEP en la IC y para situar en contexto los resultados obtenidos en el ensayo PARADIGM-HF. No obstante, los resultados presentados aquí muestran que la sNEP proporciona también una información independiente de la de otros biomarcadores utilizados con frecuencia para la estratificación del riesgo de la IC y puede constituir una alternativa a los péptidos natriuréticos. Una limitación actual es que el test utilizado para la determinación de la sNEP no está autorizado para el uso clínico y requiere un ajuste fino ad-hoc, aunque sí tiene unos coeficientes de variación intraanalítica e interanalítica adecuados. Este análisis muestra una reactividad cruzada del 0% con las dos metalopeptidasas más similares en su secuencia, que son las enzimas de conversión de la endotelina 1 y 2, y no presenta reactividad cruzada con el antígeno de superficie celular eritrocitaria (Kell), otra proteína que tiene una homología intensa con la NEP16.
La disfunción renal y el IMC elevado están pasando a tener magnitudes epidémicas en los pacientes con IC. Un informe reciente del registro de IC a largo plazo de la Sociedad Europea de Cardiología17 indica que el 26,4% de los pacientes hospitalizados por IC y el 18,2% de los pacientes con IC crónica tienen disfunción renal y una mediana de IMC de 28. Además, los datos del indican que, según cuál sea la ecuación utilizada para calcular el FGe, la prevalencia de insuficiencia renal (definida como FGe<60ml/min/1,73m2) puede ser de hasta un 64% de los pacientes ambulatorios con IC crónica18. El uso de un biomarcador que se vea influido de manera significativa por estas comorbilidades puede limitar la utilización clínica generalizada para determinar el pronóstico. Dado que la NT-proBNP plasmático se excreta a través del riñón, se observa, como era de prever, que la disminución de la función renal se asocia de manera independiente a unas concentraciones plasmáticas de NT-proBNP más altas. Estudios previos indicaron que las concentraciones plasmáticas de NT-proBNP aumentan en los pacientes con disfunción renal debida a disminución del aclaramiento19; sin embargo, otros estudios señalan que esta observación puede explicarse por el aumento de la secreción cardiaca debida a una enfermedad CV coexistente20. En este estudio, la sNEP no se vio afectada por la función renal, pero aún quedan muchas cuestiones pendientes de resolver, y en este momento no está claro el mecanismo exacto de excreción de la sNEP. Por lo que respecta al IMC, que es un factor clínico importante que influye en los resultados clínicos de los pacientes con IC21,22, la concentración de sNEP no se vio afectada en los diversos estratos de IMC, mientras que la NT-proBNP mostró una reducción claramente reconocida a los valores más altos del IMC23. Considerados conjuntamente, los datos indican que la sNEP es un nuevo biomarcador pronóstico independiente que no requiere ajustes respecto a las comorbilidades más frecuentes en la IC.
En las estrategias multimarcadores, cada vez es mayor el interés por examinar paneles de biomarcadores que evalúen vías fisiopatológicas diferentes24. Diversas puntuaciones de predicción del riesgo recientemente descritas han puesto de manifiesto que la puntuación basada en múltiples biomarcadores es superior a una puntuación de riesgo convencional que incluya parámetros clínicos y la NT-proBNP3,25. La información predictiva adicional procedente de diferentes vías biológicas refleja el carácter multisistémico de la IC. En este estudio se examina el valor del ST2, que es un indicador de fibrosis26, y de la hsTnT, que refleja la lesión miocitaria27 en combinación con la sNEP o la NT-proBNP, ambos indicadores de la activación neurohormonal, empleando un modelo clínico general que incluye 11 variables con valor pronóstico (edad, sexo, etiología isquémica de la IC, FEVI, clase funcional de la New York Heart Association, diabetes mellitus, hemoglobina, sodio, FGe, tratamiento con bloqueadores beta y tratamiento con inhibidores de la enzima de conversión de la angiotensina/antagonistas de los receptores de la angiotensina II). Es de destacar que la sNEP mantuvo su valor predictivo al combinarlo con ST2+hsTnT por lo que respecta a los resultados de tipo CV y relacionados con la IC, mientras que la NT-proBNP dejó de ser relevante en este contexto. Diversos paneles de biomarcadores pueden tener un rendimiento equivalente; la elección de uno de ellos para el uso en la práctica clínica dependerá de factores como el coste, la facilidad de análisis y las posibles consecuencias terapéuticas. El presente subestudio de multimarcadores, más allá de la descripción de la sNEP como un biomarcador valioso en la IC recientemente descrito7, indica que la tríada ST2, hsTnT y sNEP podría llegar a convertirse en una batería de elección cuando se haya perfeccionado el análisis para determinar la sNEP.
En el análisis multivariable, la sNEP y la NT-proBNP no se asociaron de manera independiente a la muerte por cualquier causa. Debe tenerse en cuenta que la muerte de causa no CV no tuvo una frecuencia desdeñable (el 37,4% de los pacientes) y esto podría haber influido en los resultados. Se optó por utilizar los mismos objetivos que se emplearon en el ensayo PARADIGM-HF, puesto que son los más ampliamente aceptados en los estudios de la IC recientes. Es de destacar que la sNEP mantuvo asociación independiente con la muerte relacionada con la IC y la hospitalización por IC, mientras que no ocurrió así en el caso de la NT-proBNP.
LimitacionesEl método de análisis experimental para la determinación de la sNEP que se describe aquí tiene un periodo de incubación prolongado, lo cual hace que no sea apropiado para el uso clínico diario. No se dispone de datos sobre la estabilidad de la sNEP mientras está congelada, por lo que no se puede descartar la posibilidad de que las concentraciones de sNEP halladas hubieran sido diferentes en muestras analizadas en fresco. Las muestras se obtuvieron durante las visitas ordinarias y no se recogieron datos sobre la estabilidad clínica de los pacientes (es decir, la posible descompensación durante los 3 meses previos). Sin embargo, la muestra es representativa de los pacientes ambulatorios con IC crónica de la práctica clínica real. Aunque la población en estudio eran pacientes con IC de la práctica clínica real, con diferentes etiologías de la IC, se trataron en unidades específicas de IC multidisciplinarias en un hospital de nivel terciario; la mayoría de los pacientes se habían derivado del servicio de cardiología y, por consiguiente, se trataba de varones relativamente jóvenes con IC de etiología isquémica y FEVI reducida. En consecuencia, estos resultados no son necesariamente extrapolables a una población más global de pacientes con IC. En un futuro próximo, con la probable generalización del uso de inhibidores de la NEP en pacientes con IC y FEVI reducida, es posible que se modifique el valor pronóstico y el uso de la sNEP y otros biomarcadores circulantes.
Serán necesarios estudios prospectivos para evaluar estrategias individualizadas para la inhibición farmacológica de la NEP basadas en la determinaciónde sNEP en pacientes con IC. El uso apropiado de biomarcadores para respaldar el tratamiento de los pacientes con IC deberá facilitar la reducción de los costes de una enfermedad cuya asistencia resulta muy cara en los países desarrollados28.
CONCLUSIONESCuando se añadió a una estrategia multimarcadores que incorpora también el ST2 y la hsTnT, la sNEP continuó siendo un factor pronóstico independiente, mientras que la NT-proBNP dejó de ser significativa como estratificadora del riesgo para pacientes ambulatorios con IC. En los análisis de comparación directa, la sNEP mostró un rendimiento similar al de la NT-proBNP, pero se vio menos influida por las comorbilidades (función renal e IMC).
CONFLICTO DE INTERESESA. Bayes-Genis y J. Lupón han recibido honorarios de Roche Diagnostics y A. Bayes-Genis de Critical Diagnostics. A. Bayes-Genis y J. Lupón declaran relación con Critical Diagnostics.
Damos las gracias a Beatriz González, Roser Cabanes, Margarita Rodríguez, Nuria Benito y Alba Ros por la recogida de los datos y su inestimable trabajo en la clínica de IC.
También queremos dar las gracias a Redes Temáticas de Investigación Cooperativa en Salud, Red de Investigación Cardiovascular (RD12/0042/0047; beca posdoctoral), Red de Terapia Celular (RD12/0019/0029) y Ministerio de Economía y Competitividad (Juan de la Cierva, JCI-2012-14025).