Palabras clave
INTRODUCCIÓN
Desde su introducción en la práctica clínica hace 40 años, la cirugía de revascularización mediante bypass aortocoronario (CABG) es un tratamiento ampliamente reconocido para la enfermedad coronaria estable, con una importante repercusión en la supervivencia1. Además, los estudios de seguimiento a largo plazo indican una supervivencia libre de infarto de miocardio (IM) del 67% a los 20 años de la intervención2. Algunos datos más recientes han encontrado una tasa de IM de un 2-3% al año durante los primeros 5 años, con una incidencia acumulada a 5 años de IM no mortales del 15%3, y nuevos infartos en hasta un 36% de los pacientes a los 10 años4. Por otra parte, la CABG tiene además una influencia favorable en la calidad de vida a largo plazo y en la capacidad funcional5.
Sin embargo, los registros observacionales de pacientes con síndrome coronario agudo (SCA) han detectado un 20% de pacientes con CABG previa6,7. Esta prevalencia tiene dos posibles explicaciones, que no son mutuamente excluyentes: la progresión de la enfermedad aterosclerótica en arterias nativas y la aparición de enfermedad vascular en los injertos. Estudios angiográficos han descrito un 8% de oclusiones de los injertos venosos en el plazo de 1 año, un 38% a los 5 años y un 75% a los 10 años8, así como una progresión del proceso aterosclerótico en hasta un 51% de los casos 15 años después de la cirugía9.
El pronóstico de estos pacientes continúa siendo motivo de controversia. En el subgrupo de TIMI III del registro de SCA, no hubo diferencias durante la hospitalización y a los 6 meses, pero al llegar al año el subgrupo de pacientes con bypass coronario previo presentó un peor pronóstico (tasa de eventos, el 39,3 frente al 30,2%; p = 0,002)10. A pesar de esta mala evolución, el bypass coronario previo no fue un factor independiente predictivo de muerte en las puntuaciones del Thrombolysis in Myocardial Infarction (TIMI)11, el Global Registry of Acute Coronary Events (GRACE)12 o el PURSUIT13. En cambio, algunas series pequeñas indican un pronóstico más favorable en este grupo de pacientes, tanto para el IM14 como para la angina inestable (AI)15.
Aunque no se ha realizado ningún estudio aleatorizado diseñado para evaluar las posibles ventajas de una estrategia invasiva frente a la conservadora en los pacientes con SCA que tienen antecedentes de CABG, las guías recientes recomiendan una coronariografía, una intervención preferible en la circulación nativa y un tratamiento médico similar al de la población general (recomendación de clase I, nivel de evidencia C)16.
Dada la falta de datos respecto a este importante subgrupo de pacientes con SCA, en comparación con otros grupos, optamos por realizar un análisis del pronóstico durante la hospitalización y a medio plazo en una población no seleccionada de pacientes con SCA y antecedentes de CABG de un único centro.
MÉTODOS
Estudio prospectivo, observacional y continuo de 1.495 ingresos consecutivos por SCA, entre mayo de 2004 y diciembre de 2006, en una misma unidad coronaria. Excluimos 130 casos porque correspondían a reingresos y otros 33 debido a que los datos eran incompletos. Formaron la población final 1.296 pacientes.
El IM con elevación del ST (IAMCEST) se definió por la presencia de un dolor torácico isquémico con aparición de una elevación del ST > 1 mm en el ECG, en al menos dos derivaciones contiguas. El IM sin elevación del ST (IAMSEST) se consideró en caso de un dolor torácico isquémico, de duración > 5 min y con biomarcadores cardiacos (troponina I) positivos, con o sin alteraciones isquémicas en el ECG (es decir, depresión del ST o inversión de la onda T). La AI se definió por una angina de nueva aparición (al menos de clase III de la CCS), angina progresiva o angina en reposo, con o sin alteraciones isquémicas en el ECG. Todos los pacientes dieron su consentimiento informado para participar en el estudio, que fue aprobado por el comité ético local.
Analizamos los siguientes datos: características demográficas y clínicas, ECG, ecocardiograma, datos de laboratorio, tratamiento médico, cateterismo, evolución intrahospitalaria y medicación al alta.
Tras el alta hospitalaria se realizó un seguimiento clínico de una mediana de 19 meses. La información se obtuvo mediante llamadas telefónicas, en la consulta ambulatoria o a partir de la historia clínica del hospital en el caso de que hubiera un nuevo ingreso en un hospital local. La variable principal fue la mortalidad por cualquier causa y la combinación de eventos de muerte cardiovascular, infarto no mortal, reingreso por AI e intervención coronaria percutánea (ICP). Registramos también el reingreso por insuficiencia cardiaca o ictus.
Análisis estadístico
Los datos de variables continuas se presentan en forma de mediana [intervalo intercuartílico] y las correspondientes comparaciones, con la prueba de Mann-Whitney o en forma de media ± desviación estándar, y una comparación con la prueba de la t de Student. Las variables discretas se presentan en forma de frecuencias y porcentajes, y se utiliza para su comparación la prueba de la χ2 o la prueba exacta de Fisher cuando ello es apropiado.
Se elaboraron curvas de supervivencia acumulada por los métodos de Kaplan-Meier, y se compararon los grupos mediante el log-rank test. El periodo de observación se inició en el momento del alta y finalizó un año después del SCA.
Se realizó un análisis de regresión de Cox para la variable de valoración clínica de la AI 1 año después del SCA. Las variables incluidas en el modelo fueron significativas al nivel de 0,05 en el análisis univariable; estas variables fueron las siguientes: CABG previa, diabetes mellitus (DM), edad > 75 años, IAMCEST, fracción de eyección ventricular izquierda (FEVI) < 40% y uso de una estrategia invasiva.
Se consideró significativo un valor de p < 0,05. El análisis se llevó a cabo con el programa SPSS 15 (Statistical Package for Social Sciences) de SPSS Inc. (Chicago, Illinois, Estados Unidos).
RESULTADOS
La población se dividió en dos grupos en función de los antecedentes de CABG. El grupo A lo formaron 73 pacientes con CABG previa y el grupo B, 1.223 pacientes sin antecedentes de cirugía de revascularización miocárdica.
Características basales
La cohorte de estudio la formaron 908 varones y 388 mujeres, con una media de edad de 67 ± 12,6 años. Había antecedentes de CABG en un 5,6% de la población.
En las tablas 1 y 2 se presentan las características demográficas y clínicas basales de ambos grupos. Los pacientes con antecedentes de CABG tenían mayor probabilidad de ser varones, más frecuencia de IAMSEST y AI y antecedentes más frecuentes de DM, infarto previo e intervención percutánea. El bloqueo de rama izquierda del haz de His y la puntuación de riesgo TIMI más alta se asociaban con mayor frecuencia a los antecedentes de CABG, al igual que ocurría con un valor inferior de la FEVI (el 50 [42%-55%] frente al 53% [46,75%-60%]; p < 0,001). Por el contrario, en los pacientes del grupo B había un valor máximo de troponina I más alto.
Historia previa
El SCA que motivaba la inclusión se había producido tras una mediana de 9 [4-12,5] años del bypass coronario. La enfermedad coronaria multivaso fue la alteración anatómica más frecuente antes de la cirugía, y en el 13 y el 37% de los pacientes, respectivamente, había lesiones del tronco coronario izquierdo y segmento proximal de la arteria descendente anterior.
Los bypass arteriales (solamente se realizaron bypass de mamaria interna) fueron más frecuentes que los venosos, y el 83,3% de los pacientes fueron tratados con ambos tipos de bypass. La opción más frecuente fue el bypass triple (38,9%) o doble (37,0%) (tabla 3). Todos los pacientes fueron operados con circulación extracorpórea.
Tratamiento intrahospitalario
Se siguió una estrategia invasiva en 38 pacientes con CABG previa (38/73; 52,1%), y en 732 de los pacientes sin CABG previa (732/1.233; 59,9%). A pesar de estas diferencias en términos absolutos, ambos grupos tenían una probabilidad similar de recibir un tratamiento invasivo. No hubo diferencias significativas en cuanto al tratamiento en las primeras 24 h (tabla 4).
Por lo que respecta a los datos del cateterismo cardiaco, los pacientes con antecedentes de CABG, tal como se esperaba, presentaban una afección coronaria más extensa (tabla 5). En el 50% de los pacientes se consideró que las lesiones de los injertos eran causa del SCA. Se efectuó una ICP en el 73,2% de los pacientes sin bypass coronario previo (460/628; 73,2%), en comparación con el 47,1% de los pacientes que sí tenían CABG previa (16/34; 47,1%) (p = 0,001). Los pacientes del grupo B tenían también una mayor probabilidad de ser tratados con una revascularización total y de implantación de un stent. No obstante, la probabilidad de implantación de un stent liberador de fármaco (SLF) fue similar en los dos grupos. En ninguno de los pacientes del grupo A se realizó una segunda intervención quirúrgica de revascularización.
Analizamos 55 injertos venosos de los 38 pacientes ingresados para una estrategia invasiva. Hubo un 54,2% de oclusiones totales, y la mayoría de las lesiones se encontraban en el ostium y en segmentos proximales. Por lo que respecta a los injertos arteriales, se analizó un total de 30 injertos. Solamente en 6 de ellos se identificaron lesiones ateroscleróticas significativas, y en la mitad había también oclusiones totales. Se practicó una ICP en los injertos venosos en 7 pacientes (tabla 6).
En el momento del alta, a pesar de la menor frecuencia de uso del tratamiento antiagregante plaquetario combinado doble, no hubo otras diferencias entre los grupos en cuanto al tratamiento con ácido acetilsalicílico, estatinas, inhibidores de la enzima de conversión de angiotensina (IECA) o bloqueadores beta.
Seguimiento
La mortalidad en el hospital fue similar en ambos grupos (el 9,6 frente al 5,9%; p = 0,2). La tasa de pérdidas de seguimiento fue del 6,3%, con lo que se dispuso de datos de 1.140 pacientes.
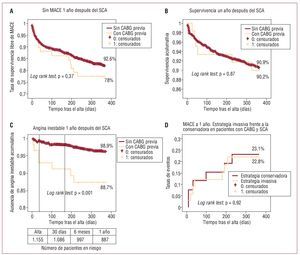
No se detectaron diferencias en cuanto a la mortalidad por todas las causas a 30 días, 6 meses y 1 año (fig. 1B). La tasa de eventos adversos cardiovasculares mayores (MACE) a 1 año fue también similar (el 22 frente al 17,4%; p = 0,37) (fig. 1A), y lo mismo ocurrió con los reingresos por insuficiencia cardiaca y por IM (mortal o no mortal) (tabla 7).
Fig. 1. A: curvas de Kaplan-Meier correspondientes a la supervivencia acumulada libre de eventos adversos cardiovasculares mayores (MACE) para pacientes con síndrome coronario agudo (SCA) y cirugía de revascularización mediante bypass aortocoronario (CABG) previa en comparación con los que no tenían CABG previa. B: curvas de Kaplan-Meier correspondientes a la supervivencia total de pacientes con SCA y CABG previa en comparación con los que no tenían CABG previa. C: curvas de Kaplan-Meier correspondientes a la ausencia acumulada de reingreso por angina inestable (AI) de pacientes con SCA y CABG previa en comparación con los que no tenían CABG previa. D: curvas de Kaplan-Meier correspondientes a la incidencia de MACE a 1 año en los pacientes con CABG previa ingresados para tratamiento con una estrategia invasiva o conservadora.
La frecuencia de reingresos por AI fue significativamente mayor en los pacientes con antecedentes de CABG (el 11,3 frente al 3,1%; p = 0,001) (fig. 1C), y los resultados continuaron siendo significativos en el análisis de regresión multivariable de Cox (hazard ratio [HR] = 4,49; intervalo de confianza [IC] del 95%, 1,7-12,1), en un modelo que incluía las siguientes variables: CABG previa, DM (HR = 1,76; IC del 95%, 0,8-3,87), edad > 75 años (HR = 0,98, IC del 95%, 0,41-2,34), fracción de eyección ventricular izquierda < 40% (HR = 0,8; IC del 95%, 0,27-2,36) y estrategia invasiva (HR = 0,84; IC del 95%, 0,37-1,91) (total, χ2 = 14,9).
En el grupo de CABG previa, una estrategia invasiva durante la fase aguda no influyó en la tasa de MACE al final del primer año (fig. 1D).
DISCUSIÓN
Datos basales
Observamos una prevalencia de antecedentes de CABG en nuestra población de pacientes con SCA no seleccionados (5,6%) que fue inferior a las tasas del 20% descritas anteriormente en estudios observacionales6,7, pero similar a la de los datos más recientes publicados del ensayo Valiant (7%)17.
Además, es de destacar que la prevalencia de la revascularización percutánea previa fue mayor (9,6%, datos no presentados) para el conjunto de la población, lo cual refleje probablemente un cambio general en el tratamiento de la enfermedad coronaria.
Al igual que en otras series publicadas, nuestros pacientes con antecedentes de CABG eran de mayor edad y con mayor frecuencia varones y diabéticos, y tenían una mayor frecuencia de antecedentes de ICP e IM. Esto podría explicarse por el seguimiento en nuestra serie de las guías relativas a la revascularización quirúrgica y porque este subgrupo de pacientes tuviera unos antecedentes más prolongados de enfermedad aterosclerótica. El tiempo transcurrido entre la CABG y el SCA fue similar al descrito anteriormente en la literatura18 y osciló entre 4 y 12,5 años.
Los pacientes con antecedentes de bypass coronario ingresaron con mayor frecuencia por SCA sin elevación del ST, y los valores máximos de los biomarcadores cardiacos de necrosis fueron inferiores. Esto ya fue descrito anteriormente y es probable que esté relacionado con la importancia de la doble circulación (un mecanismo de protección para los pacientes con SCA y antecedentes de CABG previa). La protección conferida por el bypass para las arterias coronarias principales y la más frecuente oclusión de una rama secundaria como causa del SCA, un hecho descrito por Crean et al desde 1985, podrían explicar esta observación19.
Pronóstico
En nuestra población, aunque la CABG previa se asoció en términos absolutos a una peor evolución en cuanto a la mortalidad hospitalaria y a 1 año, los resultados no alcanzaban una diferencia estadística. Es probable que un mayor número de pacientes y un seguimiento más prolongado pudieran haber aumentado la diferencia, lo que nos permitiría concluir, como otros autores antes, que los pacientes con antecedentes de CABG evolucionan peor al sufrir un SCA10,17,20-22 (aunque los antecedentes de CABG no predijeron de manera independiente la evolución, según lo determinado en las cohortes de los estudios GRACE y Valiant). No obstante, planteamos la siguiente hipótesis para explicar esta evolución más favorable de nuestra población con SCA y antecedentes de CABG en comparación con los datos publicados anteriormente:
- La prevalencia elevada de un tratamiento previo con ácido acetilsalicílico (78,9%), estatinas, bloqueadores beta e IECA (frecuencia del 50% en los tres casos) antes del SCA actual. Esta frecuencia fue superior a la publicada por el estudio TIMI10, en el que solamente un 60% de los pacientes recibían ácido acetilsalicílico y únicamente un 20% estaban en tratamiento con IECA, pero es comparable a la de un subanálisis del registro GRACE23. Esto refuerza la importancia del efecto protector a largo plazo de estas cuatro clases de fármacos.
- La adherencia a las guías de tratamiento médico fue muy alta en nuestro subgrupo de pacientes, tanto en el hospital como al ser dados de alta, con unas tasas superiores a las de las European Heart Survey de 200424.
- Otro aspecto importante de nuestro análisis fue el tratamiento antiagregante plaquetario agresivo (53,4%), sobre todo con inhibidores de la glucoproteína IIb/IIIa (anti-GPIIb/IIIa). Solamente a un 19% de la población con antecedentes de CABG del ensayo Valiant se le ofreció la administración de anti-GPIIb/IIIa17. Creemos que estos fármacos son un tratamiento crucial para abordar las lesiones coronarias inestables, con independencia de cuál sea la lesión causal, tal como se ha descrito recientemente en un análisis de subgrupos del ensayo PRISM-PLUS y PURSUIT21.
- La tasa de ICP primaria similar en los dos grupos. En los pacientes con antecedentes de CABG del ensayo Valiant, la tasa de ICP primaria fue de tan sólo un 14%.
Revascularización
En casi un 50% de los pacientes con antecedentes de CABG se utilizó una estrategia invasiva en el hospital, y la mayoría de las intervenciones se realizaron sobre vasos nativos y con el empleo de SLF. Es de destacar que había múltiples posibilidades anatómicas para la lesión causal en estos pacientes y que el ECG puede no ser de tanta utilidad para definir la localización de la isquemia. En consecuencia, las decisiones relativas a la revascularización en el CABG fueron difíciles, puesto que el daño causado por una ICP (sobre todo porque estábamos tratando con una lesión compleja) podía afectar al delicado equilibrio de la circulación por los vasos nativos frente a la del injerto. Según los datos de un subestudio del GRACE, publicado por Gurfinkel et al, sobre los beneficios de la estrategia conservadora frente a la invasiva para el subgrupo de pacientes con antecedentes de CABG previa, no hubo beneficio alguno con los datos ajustados a los 6 meses, y la proporción de pacientes que requirió intervenciones invasivas no programadas y terapéuticas fue superior en el grupo de tratamiento invasivo, lo cual indica que la revascularización motiva más revascularización (aunque no se presentaron datos angiográficos relativos a las lesiones coronarias)23.
Además, los datos relativos a la revascularización percutánea de injertos de vena safena continúan siendo controvertidos. En la literatura hay estudios aleatorizados en los que se compara el uso de stents con la angioplastia con balón para la estenosis de vena safena, y en ellos no se observaron diferencias estadísticamente significativas de la reestenosis durante un periodo de 6 meses, pero sí hubo una mejora de los resultados clínicos con los stents en un contexto de uso electivo de éstos25. Un reciente estudio español de 237 estenosis de injertos de safena tratados con SLF o stent metálico sin recubrimiento (SMNR) llegó a la conclusión de que el pronóstico a 30 meses era similar en ambos grupos26. En otro estudio se analizó la evolución tras la ICP en los pacientes con o sin antecedentes de CABG, y se observó que en los casos tratados después de un CABG había, a los 6 meses, unas tasas más altas de eventos, incluida la muerte y el IM, y que los resultados eran peores para la ACTP aplicada a lesiones de los injertos que para la aplicada a lesiones de los vasos nativos. Este peor resultado se explicaba no sólo por las características basales de los pacientes, sino también porque la ICP de los injertos resultaba difícil, con más lesiones complejas y con presencia de más trombos luminales27. En un reciente estudio retrospectivo, Lei Ge et al observaron unos efectos beneficiosos de una ICP con un SLF en comparación con el uso de un SMNR en las estenosis de injertos venosos (supervivencia libre de MACE del 88,5% a los 6 meses con el SLF frente al 71,9% con el SMNR); el uso de un SMNR fue un factor independiente predictivo de MACE28. En dicho estudio, los autores describieron una tasa de oclusiones totales baja, de tan sólo un 4,3% para el SLF y del 3,3% para el SMNR, y en 1/3 pacientes utilizaron dispositivos de protección distal. En cambio, los datos de un ensayo aleatorizado (con control angiográfico) en el que se comparó un SLF con sirolimus con un SMNR para lesiones similares, se observó un efecto beneficioso significativo con el SLF en cuanto a la pérdida de diámetro luminal en el stent y la revascularización del vaso diana, pero sin diferencias significativas en cuanto a las variables de valoración clínicas29. En ese ensayo, se excluyó a los pacientes con disfunción ventricular izquierda, deterioro de la función renal o lesiones con oclusión total de injertos. A pesar de estos efectos beneficiosos, un reciente estudio retrospectivo de los SLF en injertos de vena safena de la práctica clínica real describió una tasa de acontecimientos adversos superior a 1 año, y los autores identificaron dos factores independientes predictivos de evolución adversa (muerte o infarto a 1 año): la presencia de un trombo luminal y la longitud del segmento tratado con el stent30. Un metaanálisis de comparación de los SLF frente a los SMNR para los injertos de safena mostró una menor incidencia de eventos cardiacos adversos mayores en el grupo de SLF en un periodo de 6-12 meses, debido principalmente a una reducción de la revascularización del vaso diana31. No obstante, no hay datos relativos a las intervenciones percutáneas sobre injertos, en situación estable o inestable, y sólo hay unos pocos ensayos aleatorizados, con una potencia estadística insuficiente y un seguimiento de corta duración.
En nuestro subgrupo de pacientes con SCA y antecedentes de CABG previa, optamos por un cumplimiento estricto de las directrices de tratamiento médico, y aplicamos una revascularización percutánea siempre que ello fue técnicamente factible, de manera preferente en los vasos nativos y con el empleo de un SLF, basándonos en datos publicados anteriormente. Nuestros injertos venosos mostraron un elevado porcentaje de oclusiones totales (situación de «práctica clínica real») que impedían la intervención percutánea. Además, ninguno de los pacientes fue remitido a una segunda revascularización quirúrgica.
Por último, los antecedentes de CABG fueron un factor independiente predictivo de un futuro reingreso por angina estable. Este hecho podría estar relacionado con una isquemia más grave, que probablemente no podía tratarse con revascularización, pero curiosamente no equivalía a un peor pronóstico a medio plazo. Creemos, pues, que esta cohorte de pacientes con SCA constituye un buen ejemplo del beneficio obtenido a largo plazo con el precondicionamiento isquémico y la circulación colateral que es la evaluación natural de un proceso de enfermedad aterosclerótica más prolongada.
Limitaciones
El número de pacientes con SCA que tenían antecedentes de CABG fue bajo. Comparamos dos grupos que tenían diferencias basales importantes, y los resultados deberían ser considerados con cautela, puesto que la potencia estadística es insuficiente (para la mortalidad en el hospital, la potencia era del 35,5%; para la mortalidad a 1 año, tan sólo del 3,6%; para los MACE a 1 año, del 12,3%, y para el reingreso por AI, del 50%). No dispusimos de datos sobre el tratamiento durante el seguimiento, y el periodo de observación se limitó a 12 meses. Además, hubo una pérdida del seguimiento del 6,3%.
CONCLUSIONES
En nuestra población, el antecedente de CABG fue un factor independiente predictivo de reingreso hospitalario por AI 1 año después del SCA, aunque no influyó de manera significativa en la supervivencia ni en otras variables de valoración isquémicas a corto ni a medio plazo. Estos datos resaltan la necesidad de un tratamiento médico enérgico en esta población con SCA de alto riesgo.
ABREVIATURAS
AI: angina inestable.
CABG: cirugía de revascularización mediante bypass aortocoronario.
IAMCEST: infarto agudo de miocardio con elevación del ST.
IAMSEST: infarto agudo de miocardio sin elevación del ST.
IM: infarto de miocardio.
SCA: síndromes coronarios agudos.
SLF: stent liberador de fármaco.
SMNR: stent metálico no recubierto.
Full English text available from: www.revespcardiol.org
Véaseeditorialenpágs. 516-7
Correspondencia:
Dr. R. Paiva Cardoso Teixeira.
Cardiology Department. Coimbra University Hospitals.
Praceta Prof. Mota Pinto. 3000 - 050 Coimbra. Portugal.
Correo electrónico: rogeriopteixeira@gmail.com
Recibido el 25 de julio de 2009.
Aceptado para su publicación el 30 de noviembre de 2009.