La amiloidosis cardiaca (AC) se caracteriza por el depósito extracelular de fibrillas de amiloide en el miocardio y otras estructuras cardiacas. Se desconoce su prevalencia real y se estima que la AC por transtiretina estaría presente en un 15-30% de los pacientes con estenosis aortica (EA) sometidos a implante percutáneo de una válvula aórtica (TAVI) protésica, lo cual podría identificar un subgrupo de peor pronóstico. La ecocardiografía es un instrumento fundamental para establecer la sospecha diagnóstica inicial. Sin embargo, la coexistencia de EA y AC podría enmascarar el diagnóstico de esta, ya que comparten características comunes1.
Se han publicado índices ecocardiográficos avanzados basados en la deformación (strain) miocárdica longitudinal del ventrículo izquierdo que podrían discriminar la AC de otras formas de hipertrofia, como el RELAPS (strain longitudinal relativo apical)2, el SAB3 (cociente entre el strain longitudinal septal apical y el basal) o el cociente entre la fracción de eyección del ventrículo izquierdo (FEVI) y el strain longitudinal global (GLS)4 (EFSR).
Nuestro objetivo es valorar la rentabilidad diagnóstica de la aplicación de estos criterios ecocardiográficos derivados del strain longitudinal (SL) descritos para la sospecha de AC en pacientes con EA grave sin amiloidosis.
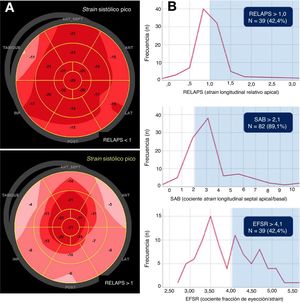
Como parte del estudio AMY-TAVI (NCT03984877), cuyo objetivo es estudiar el impacto pronóstico de la AC en los pacientes con EA grave sometidos a TAVI, entre enero y agosto de 2019 se incluyó prospectivamente a 109 pacientes consecutivos con diagnóstico de EA grave sintomática sin AC para quienes estaba indicado el TAVI. Antes del procedimiento, se realizó un ecocardiograma que incluyó parámetros convencionales y parámetros de deformación miocárdica mediante ecocardiografía de speckle-tracking (2DSTE); solo se pudo obtener estos parámetros de 92 pacientes por la mala ventana acústica que ocasionó un tracking inadecuado en los 17 restantes. El mismo operador experto realizó todos los estudios (enmascarados) en un equipo Vivid E95 y se analizaron offline mediante el EchoPAC Clinical Workstation v202 Software (GE Healthcare, Noruega). El mapa polar se adquirió mediante algoritmos AFI con la información cuantitativa del SL generada desde los 3 planos apicales, con un frame rate entre 50 y 80 cps y se configuró en 17 segmentos. Se promedió el strain de los 6 segmentos basales, 6 medios y 4 apicales (excluido el segmento 17). Se calculó el SL relativo apical mediante la fórmula: RELAPS=SL promediado apical / SL promediado basal + SL promediado medio. Según lo publicado2, se consideró que un valor del RELAPS> 1 indica AC, que en el mapa polar mostró un patrón rojo brillante en los segmentos apicales y más rosado en los segmentos basales y medioventriculares (figura 1A). Se calculó el cociente SAB como SL septal-apical / septal-basal y se consideró que un valor> 2,1 indica AC3. Se obtuvo el cociente EFSR como FEVI / GLS. Se estableció el punto de corte de 4,1 como indicativo de AC4.
A: fenotipos de SL en el mapa polar en la EA grave según el valor del RELAPS. El patrón RELAPS> 1 representa un strain apical conservado. B: pacientes con EA grave y sintomática e índices de deformación miocárdica en la banda que indica AC (n=92). Distribución de los pacientes según los valores de RELAPS, SAB y EFSR. AC: amiloidosis cardiaca; EA: estenosis aórtica; EFSR: cociente fracción de eyección/strain; RELAPS: strain longitudinal relativo apical; SAB: cociente strain longitudinal septal apical/basal; SL: strain longitudinal.
Tras el TAVI, se realizó una gammagrafía con pirofosfato de 99Tc y electroforesis de proteínas séricas para el cribado de AC, y se excluyó del análisis a los positivos.
Las variables categóricas se expresan como frecuencias y porcentajes y las variables continuas como medias±desviación típica. Las variables cualitativas se compararon con la prueba de la χ2 y las variables continuas con la prueba de la t de Student para muestras independientes. Para identificar factores predictivos del patrón de conservación apical (RELAPS> 1), se construyó un modelo de regresión logística con el método de máxima verosimilitud por pasos hacia atrás, que incluía las variables estadísticamente significativas o con p <0,1 en el análisis bivariado. Se calcularon las odds ratio (OR) y sus intervalos de confianza del 95% (IC95%). Se consideró significativo un valor de p <0,05. Los datos se analizaron utilizando SPSS versión 25.
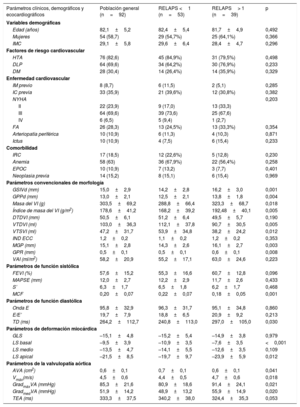
Las características basales de toda la cohorte analizada con parámetros de deformación miocárdica y las diferencias entre los subgrupos con RELAPS <1 y> 1 se muestran en la tabla 1.
Características de los pacientes según el fenotipo del strain sistólico en el mapa polar
| Parámetros clínicos, demográficos y ecocardiográficos | Población general (n=92) | RELAPS <1 (n=53) | RELAPS> 1 (n=39) | p |
|---|---|---|---|---|
| Variables demográficas | ||||
| Edad (años) | 82,1±5,2 | 82,4±5,4 | 81,7±4,9 | 0,492 |
| Mujeres | 54 (58,7) | 29 (54,7%) | 25 (64,1%) | 0,366 |
| IMC | 29,1±5,8 | 29,6±6,4 | 28,4±4,7 | 0,296 |
| Factores de riesgo cardiovascular | ||||
| HTA | 76 (82,6) | 45 (84,9%) | 31 (79,5%) | 0,498 |
| DLP | 64 (69,6) | 34 (64,2%) | 30 (76,9%) | 0,233 |
| DM | 28 (30,4) | 14 (26,4%) | 14 (35,9%) | 0,329 |
| Enfermedad cardiovascular | ||||
| IM previo | 8 (8,7) | 6 (11,5) | 2 (5,1) | 0,285 |
| IC previa | 33 (35,9) | 21 (39,6%) | 12 (30,8%) | 0,382 |
| NYHA | 0,203 | |||
| II | 22 (23,9) | 9 (17,0) | 13 (33,3) | |
| III | 64 (69,6) | 39 (73,6) | 25 (67,6) | |
| IV | 6 (6,5) | 5 (9,4) | 1 (2,7) | |
| FA | 26 (28,3) | 13 (24,5%) | 13 (33,3%) | 0,354 |
| Arteriopatía periférica | 10 (10,9) | 6 (11,3) | 4 (10,3) | 0,871 |
| Ictus | 10 (10,9) | 4 (7,5) | 6 (15,4) | 0,233 |
| Comorbilidad | ||||
| IRC | 17 (18,5) | 12 (22,6%) | 5 (12,8) | 0,230 |
| Anemia | 58 (63) | 36 (67,9%) | 22 (56,4%) | 0,258 |
| EPOC | 10 (10,9) | 7 (13,2) | 3 (7,7) | 0,401 |
| Neoplasia previa | 14 (15,2) | 8 (15,1) | 6 (15,4) | 0,969 |
| Parámetros convencionales de morfología | ||||
| GSIVd (mm) | 15,0±2,9 | 14,2±2,8 | 16,2±3,0 | 0,001 |
| GPPd (mm) | 13,0±2,1 | 12,5±2,1 | 13,8±1,8 | 0,004 |
| Masa del VI (g) | 303,5±69,2 | 288,8±66,4 | 323,3±68,7 | 0,018 |
| Índice de masa del VI (g/m2) | 178,6±41,2 | 168,2±39,2 | 192,48±40,1 | 0,005 |
| DTDVI (mm) | 50,5±6,1 | 51,2±6,4 | 49,5±5,7 | 0,190 |
| VTDVI (ml) | 103,0±36,3 | 112,1±37,8 | 90,7±30,5 | 0,005 |
| VTSVI (ml) | 47,2±31,7 | 53,9±34,8 | 38,2±24,2 | 0,012 |
| IND ECC | 1,2±0,2 | 1,1±0,2 | 1,2±0,2 | 0,353 |
| MGP (mm) | 15,1±2,8 | 14,3±2,6 | 16,1±2,7 | 0,003 |
| GPR (mm) | 0,5±0,1 | 0,5±0,1 | 0,6±0,1 | 0,008 |
| VAI (ml/m2) | 58,2±20,9 | 55,2±17,1 | 63,0±24,6 | 0,223 |
| Parámetros de función sistólica | ||||
| FEVI (%) | 57,6±15,2 | 55,3±16,6 | 60,7±12,8 | 0,096 |
| MAPSE (mm) | 12,0±2,7 | 12,2±2,9 | 11,7±2,6 | 0,433 |
| S’ | 6,3±1,7 | 6,5±1,8 | 6,2±1,7 | 0,468 |
| MCF | 0,20±0,07 | 0,22±0,07 | 0,18±0,05 | 0,001 |
| Parámetros de función diastólica | ||||
| Onda E | 95,8±32,9 | 96,3±31,7 | 95,1±34,8 | 0,860 |
| E/E’ | 19,7±7,9 | 18,8±6,5 | 20,9±9,2 | 0,213 |
| TD (ms) | 264,2±112,7 | 240,8±113,0 | 297,0±105,0 | 0,030 |
| Parámetros de deformación miocárdica | ||||
| GLS | –15,1±4,8 | –15,2±5,4 | –14,9±3,8 | 0,979 |
| LS basal | –9,5±3,9 | –10,9±3,5 | –7,6±3,5 | <0,001 |
| LS medio | –13,5±4,7 | –14,1±5,5 | –12,6±3,5 | 0,109 |
| LS apical | –21,5±8,5 | –19,7±9,7 | –23,9±5,9 | 0,012 |
| Parámetros de la valvulopatía aórtica | ||||
| AVA (cm2) | 0,6±0,1 | 0,7±0,1 | 0,6±0,1 | 0,041 |
| Vmáx(m/s) | 4,5±0,6 | 4,4±0,5 | 4,7±0,6 | 0,018 |
| GradmáxVA (mmHg) | 85,3±21,6 | 80,9±18,6 | 91,4±24,1 | 0,021 |
| GradmedVA (mmHg) | 51,9±14,2 | 48,9±13,2 | 55,9±14,9 | 0,020 |
| TEA (ms) | 333,3±37,5 | 340,2±38,0 | 324,4±35,3 | 0,053 |
AVA: área valvular aórtica; DM: diabetes mellitus; DPL: dislipemia; DTDVI: diámetro telediastólico del ventrículo izquierdo; E/E’: cociente de la onda E de llenado mitral precoz sobre la onda E’ del anillo mitral con Doppler tisular pulsado; EPOC: enfermedad pulmonar obstructiva crónica; FA: fibrilación auricular; GLS: strain longitudinal global; Gradmáx VA: gradiente máximo transvalvular aórtico; Gradmed VA: gradiente medio transvalvular aórtico; GPPd: grosor de la pared posterior en telediástole; GPR: grosor de pared relativo (2 × GPP / DTDVI); GSIVd: grosor del septo interventricular en telediástole; HTA: hipertensión arterial; IC: ingreso previo por insuficiencia cardiaca; ictus: antecedente de ictus isquémico; IM: antecedente de infarto de miocardio; IMC: índice de masa corporal; IND ECC: índice de excentricidad (cociente GSIVd / GPPd); IRC: insuficiencia renal crónica; LS apical: strain longitudinal sistólico pico promediado de los segmentos apicales; LS basal: strain longitudinal sistólico pico promediado de los segmentos basales; LS medio: strain longitudinal sistólico pico promediado de los segmentos medios; MCF: fracción de contracción miocárdica (cociente volumen latido/volumen miocárdico, que es el cociente masa del VI/1,05) (densidad miocárdica); MGP: máximo grosor de pared; S’: onda S’ del anillo mitral lateral con Doppler tisular pulsado; TD: tiempo de desaceleración de la onda E transmitral; TEA: tiempo de eyección aórtica; VAI: volumen biplanar de la aurícula izquierda indexado; Vmáx: velocidad máxima transvalvular aórtica; VTDVI: volumen telediastólico del VI; VTSVI: volumen telesistólico del VI.
Los valores expresan n (%) o media±desviación estándar.
De los pacientes en los que fue posible el análisis del strain (n=92), el GLS promedio fue del –15,1%; 39 pacientes (42%) mostraron un valor de RELAPS> 1; se obtuvo un cociente SAB> 2,1 en 82 pacientes (89%) y 39 (42%) tuvieron un EFSR> 4,1. La figura 1B presenta la distribución de los pacientes según los valores de estos 3 índices derivados del SL.
No se encontraron diferencias en las variables clínicas o demográficas entre los grupos con RELAPS <1 o> 1. Con respecto a las variables ecocardiográficas, el grupo de RELAPS> 1 presentó significativamente mayor gravedad de la EA y mayor remodelado hipertrófico del VI. En la valoración de la función sistólica no hubo diferencias en los parámetros convencionales; sin embargo, la fracción de contracción miocárdica fue significativamente menor en el grupo con strain apical conservado. No se encontraron diferencias en los parámetros de función diastólica.
En el análisis multivariado, las variables ecocardiográficas predictoras del patrón de strain con conservación apical fueron: la masa del VI (OR=1,02; IC95%, 1,01-1,03; p=0,002), el volumen telesistólico del VI (OR=0,97; IC95%, 0,94-0,99); p=0,014), el área de la válvula aórtica (OR=0,10; IC95%, 0,01-0,38; p=0,018) y el tiempo de eyección aórtica (OR = 0,98; IC95%, 0,96-0,99; p=0,010). El estadístico C fue del 85,6% (IC95%, 76,6%-94,7%).
En nuestra serie, los pacientes con EA grave y sintomática sin AC presentan con gran frecuencia un fenotipo de strain con conservación apical y un EFSR similares a los descritos en la AC. Estos hallazgos podrían tener una implicación clínica relevante, ya que no serían aplicables en la práctica clínica habitual para el cribado de AC en pacientes con una enfermedad tan prevalente como la EA grave.