Palabras clave
INTRODUCCIÓN
La enfermedad de Chagas es una parasitosis crónica endémica en Centroamérica y Suramérica, aunque se ha observado también su avance en áreas de Estados Unidos como consecuencia del aumento de la población inmigrante de origen latinoamericano1,2. La miocardiopatía crónica de Chagas (MCC) causa alteraciones de la conducción, dilatación ventricular, arritmias ventriculares y muerte súbita3,4 y es la causa de muerte más frecuente en muchas zonas endémicas3,5.
Los pacientes con MCC presentan el sustrato anatómico propicio para la aparición de una taquicardia ventricular por reentrada6 y tienen una elevada incidencia de arritmias ventriculares4,7. En este contexto, los complejos ventriculares prematuros (CVP) de acoplamiento temprano o el fenómeno R sobre T son observaciones frecuentes y se sospecha que actúan como desencadenantes de la taquicardia ventricular4. Sin embargo, no se ha investigado aún el modo de inicio de la taquicardia ventricular monomórfica espontánea (TVME) en la MCC. Los desfibriladores cardiacos implantables (DCI) de tercera generación permiten registrar electrogramas intracardiacos que son útiles para el diagnóstico de las arritmias y pueden utilizarse para comprender mejor la forma de inicio de la taquicardia ventricular. El objetivo de este estudio fue examinar el modo de inicio de la TVME utilizando los electrogramas intracardiacos registrados en este grupo de pacientes.
MÉTODOS
Pacientes
Se llevó a cabo un estudio retrospectivo desde 1998 en el que se incluyó a 22 pacientes con MCC a los que se implantó un DCI. Ninguno de los pacientes tenía síntomas que indicaran una enfermedad coronaria ni antecedentes de infarto de miocardio. Se descartó la cardiopatía isquémica por los resultados negativos de la prueba de esfuerzo o la angiografía coronaria antes de la implantación del DCI en todos los casos. El diagnóstico de MCC se confirmó mediante 2 de 3 pruebas serológicas específicas positivas para la enfermedad de Chagas (enzimoinmunoanálisis, reacción de inmunofluorescencia indirecta y hemaglutinación indirecta) en todos los pacientes.
Dispositivos
Se implantaron siete modelos de DCI en los pacientes del estudio (modelos de DCI 1746, 1782, 1810, 1821, 1831, 1851 y 1861; Guidant Corp., St. Paul, Minnesota, Estados Unidos). Se registraron los electrogramas entre los dos electrodos de bobina, que se colocaron de la manera habitual en el ápice del ventrículo derecho y en la aurícula derecha. Se programaron dos zonas de detección y terapia de la frecuencia cardiaca rápida en todos los pacientes. Se estableció una zona de fibrilación ventricular (frecuencia cardiaca superior) con un valor de corte de la frecuencia para detectar un ritmo ventricular con una longitud del ciclo de entre 280 y 300 ms y de una duración de 1 s. Se programó también una zona de taquicardia ventricular (frecuencia cardiaca inferior) con una detección para una longitud del ciclo de entre 370 y 410 ms, y se programó una zona de frecuencia cardiaca lenta < 40 lat/min en todos los pacientes, excepto en 2 para quienes se programó un valor < 50 lat/min. La detección de la TVME se basó en la frecuencia, la morfología y la estabilidad del electrograma ventricular y la variabilidad del primer intervalo tras la estimulación. Se comparó, además, el patrón del electrograma ventricular con un patrón de ritmo sinusal. Por otra parte, se realizó un análisis de pauta de las relaciones del electrograma auricular y ventricular en los DCI de doble cámara. Se analizaron todos los episodios registrados que indicaban una TVME en los electrogramas intracardiacos y fueron interrumpidos eficazmente por el dispositivo y se habían precedido y seguido de al menos 7 y 10 electrogramas de ritmo basal, respectivamente. Se utilizaron para este análisis los primeros 50 episodios de TVME consecutivos por paciente. Los CVP anteriores a la taquicardia se clasificaron según su morfología y el número de los que eran aislados, dobletes o múltiples. Si el primer latido de la taquicardia tenía la misma morfología que la taquicardia que le seguía, se consideró aislado, a menos que hubiera variaciones considerables en la longitud del ciclo de la TVME (> 10%) al inicio de la taquicardia. En esta última situación, los latidos relacionados con una longitud del ciclo más prolongada se consideraron CVP dobletes o múltiples. La prematuridad se evaluó mediante el intervalo de acoplamiento y con un cociente de prematuridad (CP). Una TVME se consideró precedida de un CVP de acoplamiento largo si el CP era ≥ 0,5 y precedida de un CVP de acoplamiento corto si el CP era < 0,58. Además, se evaluó también la presencia de secuencias corto-largo-corto (CLC) en todos los episodios.
Obtención de datos
Las visitas de seguimiento se programaron para el primer mes siguiente al alta y luego a intervalos de 6 meses. Los datos clínicos y de DCI fueron obtenidos por un cardiólogo en cada visita. Se registraron todos los episodios en disquetes. Todos los episodios fueron almacenados y revisados por dos observadores independientes. En los casos de discrepancia se llegó a un consenso respecto al modo de inicio.
Definiciones
Se definió TVME como un cambio súbito en la frecuencia y la morfología del electrograma respecto al ritmo basal con una longitud del ciclo estable que no fluctúe en más de un 10% y con una morfología del electrograma que no varíe durante la taquicardia, excepto en los primeros cuatro latidos.
La aparición súbita fue diagnosticada cuando se produjo un primer latido de la TVME con la misma morfología que la taquicardia que le sigue y con variaciones de la longitud del ciclo ¾ 10% al inicio (4 latidos iniciales) de la taquicardia y sin complejos ventriculares prematuros precedentes.
Se definió aparición extrasistólica como una TVME desencadenada por CVP con una morfología diferente de la taquicardia siguiente o por CVP con una morfología similar a la de la TVME con variaciones > 10% en la longitud del ciclo de la TVME al inicio (4 latidos iniciales) de la taquicardia.
El cociente de prematuridad fue definido como un intervalo de acoplamiento del CVP que inicia la TVME dividido por la longitud del ciclo inmediatamente anterior9.
Secuencia corto-largo-corto fue definida como la interrupción del ritmo basal por un CVP (corto) seguido de una pausa (intervalo de acoplamiento > 1,2 veces el intervalo de acoplamiento previo y por otro CVP «corto» que inicia la TVME)8.
Análisis estadístico
Las variables continuas se expresaron en forma de media ± desviación estándar (DE) o en forma de mediana e intervalo intercuartílico según fuera apropiado para el tipo de distribución de los datos y el intervalo de confianza. Se consideró que había significación estadística si la hipótesis nula podía rechazarse para un nivel de probabilidad de 0,05. Todos los valores de p presentados son bilaterales. Los datos se compararon con el empleo de pruebas de la t para dos muestras para las variables continuas y con la prueba de la χ2 o la prueba exacta de Fisher para las variables categóricas, según fuera apropiado. Dado que el número de episodios de TVME difiere de un paciente a otro, se realizó también un análisis estadístico específico utilizando la técnica de ecuaciones de estimación generalizadas (EEG), que tiene en cuenta la diferencia en el número de observaciones obtenidas en cada paciente.
RESULTADOS
Características clínicas y episodios arrítmicos
Un total de 14 de los 22 pacientes a los que se habían implantado dispositivos DCI de tercera generación presentaron al menos un episodio espontáneo de TVME. La media de edad de los pacientes de nuestro estudio era 56 ± 12 años. La fracción de eyección media fue del 46% ± 11% (IC del 95%, 40,2-51,7). Las características clínicas de los pacientes se indican en la tabla 1. Todos los pacientes estaban en ritmo sinusal y, en el momento de la detección de la TVME, 4 pacientes recibían tratamiento con bloqueadores beta, mientras que 10 recibieron simultáneamente amiodarona para reducir el número de terapias. La dosis media de amiodarona fue de 300 ± 170 mg (IC del 95%, 195-405).
Se registró un total de 672 episodios de TVME, y 222 de ellos cumplían los criterios de inclusión, mientras que 450 fueron excluidos debido a un número de episodios superior al límite metodológico de los primeros 50 de cada paciente (322), la falta de registro del electrograma (66), un ritmo basal escaso (47) o el aspecto polimórfico (15).
Modo de aparición de la taquicardia ventricular
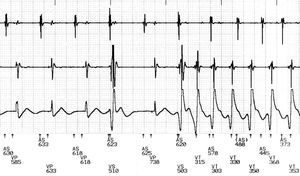
El patrón de comienzo de la TVME más frecuente fue la aparición súbita (129 episodios, el 58%) seguido de la aparición extrasistólica (93 episodios, el 42%) (fig. 1A). De estos últimos, 45 (48%), 36 (39%) y 12 (13%) se debieron a CVP aislados, dobletes y múltiples, respectivamente. La morfología de los CVP fue diferente de la TVME que se producía a continuación en 88 (95%) episodios del grupo extrasistólico. La arritmia fue precedida de una secuencia CLC en 95/222 (43%) episodios en los grupos de aparición extrasistólica y de aparición súbita (tabla 1 y fig. 1A). Todas las secuencias CLC se debían a CVP que causaban un intervalo corto seguido de un latido sinusal en 65 (68%) casos y de un latido de marcapasos en 26 (32%) y a continuación otro CVP (grupo extrasistólico) o el primer latido de la TVME (aparición súbita) produciendo el segundo intervalo corto (fig. 2). En la tabla 2 se presenta una comparación entre el inicio de la arritmia mediante secuencias CLC y otras formas de inicio.
Fig. 1. Representación gráfica de las ecuaciones estimadas generalizadas (EEG) utilizadas para comparar la proporción de episodios de aparición súbita y aparición extrasistólica de la taquicardia ventricular (TV) y la presencia o no de secuencias corto-largo-corto (CLC) al inicio de la TV (A) con los intervalos de confianza y la media de las variables de longitud del ciclo de TV (LCTV) (B), longitud del ciclo de ritmo sinusal (LCRS) (C) y el índice de prematuridad (D), según las categorías de (A). Los valores de B y C se expresan en milisegundos.
Fig. 2. Electrogramas registrados por un desfibrilador durante la taquicardia ventricular monomórfica sostenida. El trazado muestra la aparición de taquicardia ventricular precedida por una secuencia corto-largo-corto.
La media de longitud del ritmo sinusal de los 7 latidos previos a la aparición de la TVME fue de 737 ± 139 ms. En total 36 (16%) episodios se desencadenaron a una longitud del ciclo de ritmo sinusal < 600 ms. Tan sólo 5 (2%) episodios
se desencadenaron a una longitud del ciclo > 1.000 ms. El número medio de morfologías de TVME por paciente fue de 2,3 ± 1,2. La media de longitud del ciclo de la TVME fue de 342 ± 52 ms. Al clasificarla según el modo de inicio, la media de longitud del ciclo para la TVME con aparición súbita, en comparación con la aparición extrasistólica, presentaba una diferencia significativa (347 ± 60 y 333 ± 36 ms, respectivamente; p = 0,05), sin que, en cambio, hubiera diferencias en la media de la frecuencia sinusal (731 ± 138 y 745 ± 140 ms, respectivamente; p = 0,47). En las figuras 1B y 1C se presenta además el análisis de EEG de las variables.
En 13 (93%) de 14 pacientes hubo al menos un episodio iniciado por una secuencia de CLC. De los 11 pacientes con más de un episodio, en 9 (82%) hubo una TVME desencadenada por una aparición súbita o extrasistólica, mientras que en 2 (16%) hubo un único patrón de inicio durante todos los episodios.
Grado de prematuridad
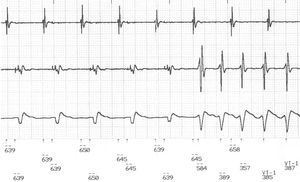
La media global del intervalo de acoplamiento del latido de inicio de la TVME fue de 570 ± 119 ms, con una media de CP de 0,72 ± 0,15. En la tabla 1 se resumen los datos de los diversos pacientes. Hubo 209 (94%) episodios iniciados por CVP de acoplamiento tardío (fig. 3). En 10 (77%) de los 13 episodios desencadenados por un intervalo de acoplamiento corto, el latido inicial de la TVME fue precedido de una longitud de ciclo larga en una secuencia CLC, y no de un CVP de acoplamiento corto real. La media del intervalo largo fue de 915 ± 235 ms. Las diferencias entre los episodios relacionados y los no relacionados con una secuencia CLC se muestran en la tabla 2. Al clasificarlos según el modo de inicio, la media de CP de los CVP que desencadenaban una aparición súbita (0,67 ± 0,13) fue significativamente inferior a la media de CP de los CVP que desencadenaron una aparición extrasistólica (0,77 ± 0,15; p < 0,0001). El análisis de EEG de estas variables se presenta en la figura 1D.
Fig. 3. Electrogramas registrados por un desfibrilador durante la taquicardia ventricular monomórfica sostenida. El trazado muestra un inicio súbito con el intervalo habitual de acoplamiento largo.
DISCUSIÓN
El principal resultado obtenido en este estudio es que la TVME se inicia habitualmente por CVP de acoplamiento tardío en casi todos los pacientes con MCC portadores de DCI. En general, se acepta que la TVME en los pacientes con MCC se debe a un mecanismo de reentrada6. Este modelo se basa en un desencadenante adecuadamente sincronizado (CVP) que interacciona con un sustrato, generando un retraso de la conducción y un movimiento circular alrededor de un obstáculo fijo. Los pacientes con MCC tienen un sustrato anatómico que favorece la aparición de una TVME de reentrada6. También sabemos que los CVP se observan con frecuencia en los pacientes con MCC y que algunos de estos pacientes presentan CVP multiformes y fenómenos de R sobre T4. Aunque no hay datos sobre el modo de inicio de la TVME en los pacientes con MCC, cabría sospechar que el fenómeno R sobre T fuera su desencadenante. Sin embargo, en este estudio, la observación de CVP de acoplamiento corto fue excepcional. Lo mismo ha ocurrido en algunos estudios previos en pacientes portadores de DCI pero sin MCC, que han mostrado que el inicio de la TVME suele ir precedido de un intervalo de acoplamiento tardío8,10-12. A este respecto, Roelke et al10 señalaron que, en 22 pacientes con infarto previo, el inicio de la TVME fue precedido de un CVP de acoplamiento tardío en el 86% de los episodios. Otros autores han indicado que el inicio de la TVME se caracterizó por la presencia de un CP medio > 0,7 (intervalo, 0,7-0,8) en una población general portadora de DCI8,11,12.
Observamos también que la aparición súbita era la forma más frecuente (58%) de comienzo de la TVME, seguido de la aparición extrasistólica. Esto contrasta con lo indicado por un estudio realizado en la población general con DCI, que reveló una aparición súbita de la TVME en un 28% del total de episodios y una aparición extrasistólica en el 66% de los casos12. En ese estudio, la aparición súbita fue más frecuente en los pacientes con una función sistólica relativamente preservada. Dado que en nuestro estudio la media de la fracción de eyección era mayor que en la experiencia de Saeed et al12 (el 46 frente al 29%, respectivamente), esto podría explicar en parte las diferencias, aunque esta cuestión merece una investigación más detallada. Además, la longitud del ciclo de TVME en los episodios con una aparición súbita fue mayor que en los de aparición extrasistólica en nuestro estudio. Estos resultados concuerdan con los presentados por Saeed et al12, que observaron que la media de longitud del ciclo para la TVME con un patrón de aparición súbita era de 383 ± 97 ms, en comparación con 336 ± 88 ms en los casos de aparición extrasistólica (p < 0,002).
Aunque los resultados de este estudio observacional no pueden utilizarse para elaborar teorías mecanicistas, sí pueden hacerse varias inferencias acerca de los posibles mecanismos directos de inicio de la TVME. A este respecto, una aparición súbita podría ser el resultado de una conducción lenta y oculta del latido sinusal previo a través del tejido afectado, y su aparición en el sitio de salida como primer latido de la TVME. Por su parte, una aparición extrasistólica con una morfología diferente de la de la TVME aparecida a continuación podría deberse a una actividad focal originada en un sitio diferente y que entrara en el circuito para iniciar la reentrada o, de manera similar a la aparición súbita, podría ser el resultado de un latido sinusal previo que, después de atravesar la zona de conducción lenta, saliera del circuito en un sitio diferente que el primer latido de TVME. Además, las diferencias en los modos de inicio de la TVME en comparación con otros sustratos podrían estar relacionadas con un origen epicárdico, lo cual es frecuente en la MCC13.
Es interesante señalar que la TVME se asoció también con frecuencia (43%) a secuencias CLC en el momento de inicio de la taquicardia en este estudio. La frecuencia descrita de intervalos CLC desencadenantes de TVME osciló entre el 2 y el 29% en una población portadora de DCI no seleccionada8,12,14,15. Aunque este patrón de aparición de la taquicardia ventricular a menudo está relacionado con una taquicardia ventricular polimórfica, también puede facilitar la inducción de una TVME, especialmente una macrorreentrada dentro del sistema de His-Purkinje, favorecida por un aumento de la dispersión de la refractariedad entre lugares adyacentes16. El inicio frecuente de la TVME precedida de una secuencia CLC podría tener consecuencias terapéuticas. Cabe plantear la hipótesis de que la programación de algoritmos de uniformización de la frecuencia para evitar pausas pudiera prevenir un número considerable de episodios precedidos de una secuencia CLC, aunque en dos estudios previos en los que se ha evaluado la utilidad de los algoritmos de estimulación antibradicárdica en una población general portadora de DCI los resultados han sido controvertidos17-19. Otra posible consecuencia es la relativa a facilitar la inducción de la taquicardia ventricular por un protocolo de estimulación ventricular programado que incluya cambios rápidos de la longitud del ciclo ventricular, que no se había utilizado hasta ahora20. Serán necesarios más estudios al respecto en este grupo específico de pacientes.
Limitaciones
Esta cohorte retrospectiva y observacional incluyó tan sólo a pacientes portadores de DCI que presentaban TVME y MCC. Por consiguiente, las conclusiones no deben extenderse a otros tipos de taquicardia ventricular ni al conjunto de la población portadora de DCI.
El reducido número de pacientes y la exclusión de un número elevado de electrogramas por episodios múltiples en el mismo paciente y la capacidad de almacenamiento limitada del dispositivo constituyen otra limitación. Sin embargo, el gran predominio de CVP de acoplamiento tardío como desencadenantes de la TVME y la alta prevalencia de secuencias CLC en casi todos los pacientes respaldan las conclusiones del estudio.
El efecto de los fármacos antiarrítmicos (10/14 pacientes) y las posibles diferencias entre los pacientes con una fracción de eyección normal o reducida son otros posibles factores que podrían haber influido en el inicio de la arritmia y que justifican una investigación adicional.
Por último, otra limitación importante es la probabilidad de que la arritmia no fuera de origen monomórfico o ventricular, puesto que la interpretación de los electrogramas se basó en los registros obtenidos entre los electrodos utilizados para la desfibrilación. No se realizó un análisis estricto de electrogramas locales, por lo que es posible que latidos aparentemente similares tuvieran de hecho su origen en otras partes del ventrículo, como también electrogramas con morfología diferente podrían corresponder a latidos de fusión con un lugar de origen real similar.
CONCLUSIONES
En este grupo seleccionado de pacientes con MCC portadores de un DCI, las TVME se inician habitualmente mediante CVP de acoplamiento tardío. Además, el inicio de la TVME va precedido con frecuencia por una secuencia CLC.
AGRADECIMIENTOS
Los investigadores desean agradecer la ayuda bioestadística de Xavier Navarro, Erik Cobos, Francesc Miras y Medtronic Ibérica.
ABREVIATURAS
CLC: corto-largo-corto.
CP: cociente de prematuridad.
CVP: complejos ventriculares prematuros.
DCI: desfibrilador cardiaco implantable.
EEG: ecuaciones de estimación generalizadas.
MCC: miocardiopatía chagásica crónica.
TVME: taquicardia ventricular monomórfica espontánea.
Full English text available from: www.revespcardiol.org
Correspondencia: Dr. M. Abello.
Montañeses 2325. (C1428AQK) Buenos Aires. Argentina.
Correo electrónico: mabello@fleni.org.ar
Recibido el 2 de julio de 2007.
Aceptado para su publicación el 27 de noviembre de 2007.