Los stents farmacoactivos son una herramienta útil para prevenir la reestenosis, pero los mecanismos involucrados en la respuesta proliferativa tras su implante aún no son conocidos en su totalidad. El objetivo de este estudio es comparar la histomorfometría vascular coronaria tras el implante de stents sin recubrir o stents farmacoactivos en un modelo porcino.
MétodosEn 20 hembras de cerdos de la raza Large White de 2 meses de edad se implantó de forma aleatoria un total de 60 stents distribuidos en dos grupos: convencionales (n=20) y farmacoactivos (paclitaxel) (n=40). A los 28 días se procedió a eutanasia y análisis histomorfométrico. Se clasificó el grado de daño vascular en función de integridad o rotura de la túnica limitante elástica interna.
ResultadosEn el grupo de integridad de lámina elástica interna no se encontraron diferencias significativas entre stents farmacoactivos y stents convencionales para las variables área de neoíntima y porcentaje de reestenosis (1,3 [1,1-2,2] frente a 2 [1,3-2,5] mm2; p=0,6; y 14 [12,1-20,8] frente a 22,2 [14,1-23,3] %; p=0,5). En cambio, en el grupo de rotura de la lámina elástica interna sí se encontraron diferencias significativas (área de neoíntima, 1,2 [0,8-2] frente a 2,9 [2,3-3,7] mm2; p=0,001 y porcentaje de reestenosis, 16,63 [11,2-23,5] frente a 30,4 [26,4-45,7] %; p=0,001).
ConclusionesEn el modelo porcino de coronarias sanas, la integridad de la lámina elástica interna no permite apreciar diferencias en la respuesta proliferativa entre stent farmacoactivo y convencional; la diferencia se establece sólo cuando el daño vascular es más profundo.
Palabras clave
En la actualidad, el modelo porcino de coronarias sanas es el modelo animal experimental considerado como estándar en la evaluación de las distintas plataformas, polímeros y principios de los stents liberadores de fármaco, tanto por la conocida similitud anatómica y fisiológica como por la rápida evolución de los procesos biológicos en este animal.
Esta similitud entre humanos y los modelos porcinos no se limita a la anatomía y la fisiología, sino que también se extiende al sistema de reparación tisular de las lesiones producidas a nivel miocárdico1, 2, 3 y la respuesta proliferativa o reestenosis tras la implantación de un stent coronario3, 4, 5.
Esta respuesta proliferativa, principal determinante del resultado a largo plazo de los stents, ha sido considerablemente disminuida con la introducción de los stents farmacoactivos (SFA). De todos modos, a pesar de los resultados alentadores de los ensayos clínicos6, 7, 8, 9, 10, durante los últimos años se ha planteado la posibilidad de que los SFA, por su mecanismo de acción, puedan presentar tasas superiores de trombosis tardía secundaria a problemas, como la retirada de terapia antiagregante11, la mala posición tardía12, la falta de endotelización13 o la inflamación crónica14, 15. Es por este motivo que la valoración en el modelo experimental de la reacción endotelial e intimal de los nuevos dispositivos antes de su salida al mercado ha experimentado un incremento de su relevancia.
En este sentido, el estudio histomorfométrico de los stents a los 28 días de su implante es un capítulo obligatorio en la evaluación preclínica de estos dispositivos. Los factores que puedan modificar la respuesta biológica al implante de diferentes dispositivos intravasculares en este modelo experimental han de ser tenidos en cuenta muy cuidadosamente antes de trasladar las conclusiones de los estudios experimentales al humano.
Si bien la relación entre grado de daño vascular y reestenosis es un fenómeno descrito16, los estudios preclínicos no siempre aportan este dato por la dificultad que entraña su adquisición.
El objetivo de este estudio fue estudiar las diferencias observadas en un modelo de stent coronario porcino entre stents convencionales y SFA y relacionarlas con el grado de daño vascular inducido durante el implante.
MétodosMuestraSe seleccionaron 20 animales hembra de la raza porcina Large White de 2 meses de edad para un peso de 25-30kg. Todo su manejo se realizó cumpliendo la legislación vigente de la Unión Europea en materia de experimentación animal, siguiendo las directrices establecidas en el RD 223/98, de 14 de marzo, sobre protección de animales utilizados para experimentación y otros fines científicos.
Se realizó implante múltiple de stents en los segmentos proximales de las tres arterias coronarias para obtener un tamaño muestral total de 60 segmentos tratados.
Además, se realizaron 22 extracciones de segmentos arteriales no tratados para ser utilizados como grupo control de las variables histomorfométricas de arterias sanas.
ProcedimientoMedicación y monitorizaciónEl día previo al procedimiento los animales eran aislados y se iniciaba medicación antiagregante oral con 100 mg de ácido acetilsalicílico y dosis de carga de 300 mg de clopidogrel. Posteriormente, se mantuvo dosis de mantenimiento de 100 mg y 75 mg, respectivamente, cada 24 h durante todo el tiempo de seguimiento, así como 20 mg/kg de ciprofloxacino como profilaxis antibiótica.
El día del procedimiento, se premedicó a los animales con 0,35 mg/kg de midazolam, 5 mg/kg de ketamina y 0,02mg/kg de atropina vía intramuscular. Una vez comprobado que el grado de sedación era el adecuado, se procedió a inducción anestésica con propofol, a dosis de 2 a 4 mg/kg vía intravenosa lenta, intubación endotraqueal y conexión a sistema de ventilación controlada por volumen y manteniendo la anestesia con isofluorano al 2%.
Durante todo el procedimiento se realizó monitorización de pulsioximetría, electrocardiografía y presión arterial invasiva. Como medicación intraoperatoria se administraron 5.000 UI de heparina sódica, 2,5 mg/kg de cefquinona vía intramuscular como antibioterapia profiláctica y 0,01mg/kg de buprenorfina vía intramuscular como medida analgésica.
ImplanteTras acceso quirúrgico a la arteria carótida derecha, se procedió a canalizarla con introductor arterial de 6 F y cateterización selectiva de los ostia coronarios con catéter guía tipo Amplatz modificado específicamente diseñado para este estudio (Iberhospitex, S.A.), que permite la canalización adecuada de ambos ostia con el mismo catéter. Tras avance de la guía hacia el lecho distal, se procedió al implante de stents siguiendo una tabla de asignación aleatoria previamente diseñada.
Todos los stents implantados fueron de iguales calibre y longitud (3,5×18 mm) y se les aplicó una presión de inflado del balón suficiente para alcanzar una relación diámetro del stent:diámetro de la arteria de entre 1,2:1 y 1,3:1 (entre 12 y 16 atmósferas, siendo la presión nominal del dispositivo de 10 atmósferas). En total se implantaron 60 stents distribuidos en dos grupos:
– GRUPO SC: 20 segmentos arteriales con stent convencional.
– GRUPO SFA: 40 segmentos arteriales con stent recubierto de paclitaxel.
Al cabo de 28 días de seguimiento se procedió al sacrificio mediante la administración intravenosa del agente T61® (0,3 ml/kg; Intervet, España), previa sedación con midazolam (0,35 mg/kg) y ketamina (5 mg/kg) administrados vía intramuscular. Se suministró una dosis de 10.000 UI de heparina sódica para facilitar la limpieza de los preparados.
Las arterias coronarias se perfundieron in situ con suero salino tamponado con fosfato a una presión aproximada de 100-110mmHg. Tras ello, se realizó su disección de la superficie epicárdica, respetando los 5 mm proximales y distales al stent. A continuación, se procedió a su fijación en formol tamponado al 10% durante 24-48 h a temperatura ambiente.
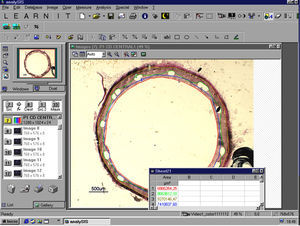
Análisis histomorfométricoPara su estudio histológico, las secciones se incluyeron en resina y, tras el corte con micrótomo, se tiñeron mediante la técnica de tricrómico de Masson y técnica de Verhoeff-Van-Gieson para fibras elásticas y posterior análisis histomorfométrico a un aumento fijo (×15), mediante un microscopio estereoscópico trifocal (Olimpus SZ61) con cámara digital incorporada conectada a sistema de computación. Para la adquisición de las imágenes se utilizaron las herramientas proporcionadas por el programa de análisis de imágenes Image-Pro Plus 4.0 (Media Cybernetics S.A.) (Figura 1).
Figura 1. Ejemplo de análisis histomorfométrico, cuantificación computarizada de áreas. Captura de pantalla del programa Image-Pro Plus 4.0 (Media Cybernetics S.A.) durante el análisis de una de las muestras con stent implantado.
Se obtuvieron las siguientes medidas directas o primarias:
– LEE: área incluida dentro de la lámina elástica externa.
– LEI: área delimitada por la lámina elástica interna.
– AL: área ocupada por la luz de la arteria.
A partir de estas áreas se calculaban cuatro nuevas medidas indirectas o secundarias:
– ATM: área de la túnica media (LEE-LEI).
– AN: área de la neoíntima (LEI-AL).
– Porcentaje de reestenosis por área: [1 – (AL / LEI)]×100 (porcentaje de neoíntima que ocupa el área de la LEI.
– Índice AN/LEE (relación entre el AN y el área de LEE).
También para cada corte se calculó el grado de daño vascular o Injury Score (IS) de cada uno de los struts del stent, únicamente atendiendo a la integridad o no de la LEI (según el IS modificado de las clasificaciones de Schwartz et al16 y Gunn et al17), de tal forma que se consideró IS-1 ante integridad de lámina limitante elástica interna e IS-2 ante su rotura.
Toda la evaluación histomorfométrica fue realizada por un anatomopatólogo cualificado que en todo momento desconocía a qué tipo de stent correspondían los cortes.
Análisis estadísticoLa estadística descriptiva univariable se resolvió con medidas de tendencia central y dispersión cuando los datos eran cuantitativos y con frecuencias/porcentajes cuando eran cualitativos.
La normalidad de las variables se determinó mediante el test de Kolmogorov-Smirnov.
En la estadística analítica bivariable se emplearon pruebas paramétricas y no paramétricas según procedía. En las pruebas paramétricas para la comparación de las variables cualitativas se empleó el test de la χ2 y para la comparación de variables cuantitativas, el test ANOVA con el test de comparaciones múltiples a posteriori de Tukey. La homogeneidad de las varianzas se determinó mediante el test de Barlett. Para todos los análisis se consideraron las diferencias como estadísticamente significativas si p=0,05.
Análisis multivariablePara añadir una mayor consistencia a los datos se comprobó a través de un modelo de regresión lineal la correlación y la significación de las diferentes variables histomorfométricas y su proporcionalidad al grado de daño vascular.
El estudio de la influencia de las variables discretas sobre el grado de reestenosis y de AN se realizó mediante la aplicación de modelos multivariables de splines adaptativos regresivos (MARS).
La explotación de los datos se llevó a cabo con el programa SPSS versión 15.0 (http://www.spss.com/es/) para Windows y el programa Minitab versión 15.0 (http://www.minitab.com/es-ES/default.aspx).
ResultadosProcedimientoLa tasa de éxito primario del procedimiento fue del 100%. Fallecieron 2 animales (con 6 segmentos tratados con stent en total) a las pocas horas tras el procedimiento por causa arrítmica y se completó el seguimiento de 4 semanas en los 18 animales restantes.
Además, se eliminaron del análisis 10 segmentos arteriales: 7 por sobreexpansión del stent que rompió la capa media (3 casos) y adventicia (4 casos) de la arteria, con una gran reacción granulomatosa. Otros 3 segmentos se destruyeron en el proceso de inclusión en resina.
Por lo tanto, el análisis final se realizó sobre 18 animales y 44 segmentos arteriales tratados, más 22 segmentos arteriales no tratados como controles sanos.
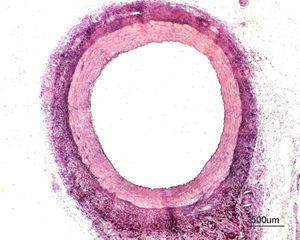
HistomorfometríaGrupo control: se extrajeron 22 segmentos arteriales proximales a las zonas de implante para servir como grupo control (Figura 2). Al no presentar stent, las variables LEI y AL coinciden. Las características observadas se resumen en la Tabla 1.
Figura 2. Corte histológico de una arteria coronaria porcina sana (segmento proximal)×10 aumentos tras tinción con hematoxilina-eosina y tinción de Van-Gieson, que permite la visualización de las 3 capas arteriales, así como las láminas limitantes elástica interna y externa (en negro).
Tabla 1. Características histomorfométricas de una arteria coronaria porcina sana (n=22)
| Variables | Mediana [intervalo intercuartílico] |
| LEE (mm2) | 3,64 [2,94-4,45] |
| LEI (mm2) | 2,44 [1,83-2,68] |
| ATM (mm2) | 1,36 [1-1,76] |
| AL (mm2) | 2,44 [1,83-2,68] |
AL: área luminal; ATM: area de la túnica media; LEE: lámina elástica externa; LEI: lámina elástica interna.
Grupo de estudio: en los segmentos tratados se encontró un incremento significativo del tamaño del vaso con respecto a los segmentos control. No se encontraron diferencias en el grado de daño vascular en función de la arteria tratada (Tabla 2) y se graduó como IS-1, con integridad de la LEI en el 55% de los casos e IS-2 en el 45%.
Tabla 2. Tabla de contingencia de daño vascular en función de la arteria tratada
| Arteria circunfleja | Coronaria derecha | Descendente anterior | Total | |
| IS-1 | 6 | 12 | 6 | 24 |
| IS-2 | 8 | 4 | 8 | 20 |
| Total | 14 | 16 | 14 | 44 |
IS: Injury Score.
χ2=4,243; p=0,12.
Al comparar los SC con los SFA, independientemente del grado de daño vascular, los stents liberadores de paclitaxel presentaron significativamente menor AN y reestenosis y mayor AL que los stents sin recubrir (AN, 1,26 [0,99-2,09] frente a 2,54 [2,26-3,14] mm2; p<0,001. Reestenosis, 15,4 [12,13-21,44] frente a 29 [23,54-38,66] %; p<0,001; AL, 7,84 [6,87-8,24] frente a 5,96 [5,14-6,94]; p=0,006).
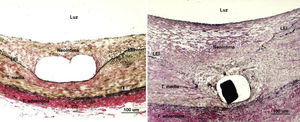
Analizados en función del grado de daño vascular (Figura 3), los segmentos con daño vascular más profundo (IS-2) presentaron un menor tamaño de luz vascular y un mayor porcentaje de reestenosis con respecto al grupo de IS-1 (Tabla 3). En cuanto al tipo de stent implantado, en el grupo de IS-1 no se encontraron diferencias significativas en los parámetros de proliferación neointimal, mientras que estas diferencias sí aparecieron, y de forma estadísticamente significativa, dentro del grupo de IS-2 (Tabla 4).
Figura 3. Histología. Cortes×100 aumentos con tinción con hematoxilina-eosina más tinción de Van-Gieson sobre la zona de aposición de uno de los struts para la identificación de la lámina elástica interna. A la izquierda, daño vascular tipo 1 (integridad de la lámina elástica interna). A la derecha, daño vascular tipo 2 (rotura de lámina elástica interna). LEE: lámina elástica externa; LEI: lámina elástica interna.
Tabla 3. Características histomorfométricas de los segmentos tratados en función del daño vascular
| IS-1 (n=24) | IS-2 (n=20) | p | |
| LEE (mm2) | 11,04 [10,24-12,27] | 10,99 [9,48-12,13] | 0,005 |
| LEI (mm2) | 9,4 [8,69-10,35] | 8,57 [7,54-9,36] | 0,01 |
| ATM (mm2) | 1,81 [1,47-2,07] | 1,61 [1,43-1,7] | 0,044 |
| AN (mm2) | 1,37 [1,13-2,32] | 2,3 [1,24-3,06] | 0,062 |
| AL (mm2) | 8,03 [7,29-8,36] | 6,03 [4,98-7,18] | 0,001 |
| PI (atm) | 14 [12,25-15,75] | 14 [13-16] | 0,461 |
| AN/LEE | 0,13 [0,1-0,19] | 0,22 [0,14-0,31] | 0,003 |
| Reestenosis (%) | 15,27 [12,09-22,34] | 26,38 [17,33-35,17] | 0,003 |
AL: área luminal; AN: área de neoíntima; AN/LEE: índice entre área de neoíntima y área de lámina elástica externa; ATM: área de la túnica media; IS: Injury Score; LEE: lámina elástica externa; LEI: lámina elástica interna; PI: presión de implante.
Los resultados de las variables se expresan como mediana [intervalo intercuartílico].
Tabla 4. Características histomorfométricas de los segmentos tratados en función del daño vascular y el tipo de stent implantado
| IS-1 | p | IS-2 | p | |||
| SFA (n=20) | SC (n=4) | SFA (n=9) | SC (n=11) | |||
| AN (mm2) | 1,32 [1,1-2,15] | 2,02 [1,26-2,49] | 0,6 | 1,22 [0,8-1,95] | 2,9 [2,27-3,66] | 0,001 |
| AL (mm2) | 7,91 [7,29-8,35] | 8,21 [6,51-8,6] | 0,99 | 7,26 [5,17-8,15] | 5,4 [4,93-6,48] | 0,054 |
| Reestenosis (%) | 13,96 [12,09-20,8] | 22,23 [14,07-23,27] | 0,45 | 16,63 [11,16-23,47] | 30,44 [26,38-45,74] | 0,001 |
AL: área luminal; AN: área de neoíntima; IS: Injury Score; SC: stent convencional; SFA: stent farmacoactivo.
Los resultados de las variables se expresan como mediana [intervalo intercuartílico].
Se realizó un modelo de regresión lineal de la variable reestenosis calculado en función de las variables LEI, LEE, ATM, AN, AL, AN/LEE y presión de inflado (PI). Una vez eliminadas las variables que presentaban valor más elevado del coeficiente p, se adquirió un modelo óptimo formado por las variables ATM, AL y AN/LEE, con un R2 del 98,9% (el mismo valor que el modelo realizado con las siete variables).
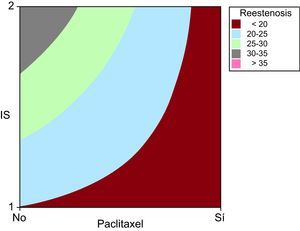
Al analizar cómo la presencia o ausencia de paclitaxel influía en la variable reestenosis, se observó que la presencia de paclitaxel, de forma independiente, disminuyó el grado de reestenosis, si bien este efecto era más apreciable a mayor grado de daño vascular, como queda reflejado en la Figura 4.
Figura 4. Gráfico de contorno realizado mediante el software estadístico Minitab15.0 de las variables Injury Score y paclitaxel frente a la variable reestenosis, que muestra la relación proporcional de influencia del daño vascular durante el implante y la presencia o ausencia de fármaco en el stent sobre el grado de respuesta proliferativa neointimal. Se observa que los valores más altos de reestenosis pertenecen a los stents sin fármaco y con IS cualitativo igual a 2. Nótese que si bien para stents sin fármaco el valor de la reestenosis puede tener cualquier valor dentro del rango, los stents con fármaco sólo presentan los valores más bajos de reestenosis. IS: Injury Score.
Se efectuó, a su vez, un modelo MARS de la variable «reestenosis» en función de LEE, LEI, AL, ATM, AN, AN/LEE, PI, tipo de stent, IS y arteria tratada. Este modelo permite no sólo incluir las variables continuas, sino también las discretas, que este tipo de modelos puede procesar de forma adecuada. Tras la etapa inicial de descarte de variables, el modelo MARS resultante sólo encontró como significativas las variables AN/LEE, LEI, AN, ATM e IS.
DiscusiónModeloEn la actualidad no existe un modelo animal ideal de enfermedad cardiovascular humana, aunque el daño vascular y la respuesta proliferativa neointimal en el modelo porcino de lesión de la arteria coronaria y en el modelo de lesión de la arteria iliaca de conejo son similares a los procesos que ocurren durante la reestenosis humana16, 18. A pesar de que el daño vascular provocado en las arterias de ambos modelos difiere del provocado en las arterias ateroescleróticas humanas, los estudios experimentales señalan una importante relación entre inflamación, daño vascular y crecimiento neointimal, al igual que sucede en las arterias coronarias humanas19, 20. Los resultados histológicos de este estudio confirman que la respuesta proliferativa observada es proporcional al daño vascular provocado por la sobreexpansión del stent.
Daño vascularEl hallazgo más interesante de este estudio es la relación encontrada entre la profundidad del daño vascular durante el implante del stent y la reacción proliferativa de la íntima o, lo que es lo mismo, entre el IS y la reestenosis.
En nuestra muestra el daño vascular se graduó como IS-1 en un 55% de los casos y como IS-2 en un 45%. En esta línea, nuestros datos están de acuerdo con los datos publicados por Gunn et al17 que mostraron, en modelos porcinos, que la compresión de la capa media con integridad de la LEI era incluso más frecuente que daños vasculares más profundos.
Según esta teoría, esta compresión de la túnica media debe considerarse como el «estímulo global» más importante tras el daño vascular de grado moderado y, lo que es más trascendente, tiene una correlación positiva con la intensidad de la respuesta de formación de neoíntima. Nuestros resultados confirman, pues, que la variabilidad de la respuesta proliferativa es proporcional al grado de daño vascular, a pesar de que en el grupo de SFA esta respuesta se encuentre atenuada.
La explicación a los posibles mecanismos por los que la compresión de la capa túnica media induce proliferación neointimal se centra en que el impacto del stent comprime las células musculares lisas alrededor de cada strut, pudiendo llegar a causar atrofia de la media y las células muertas, ya sea por necrosis o por apoptosis, entonces pueden desencadenar los procesos biológicos de cicatrización que conducen a la formación de neoíntima. Otra posibilidad es que la compresión sea transmitida célula a célula por moléculas de adhesión o integrinas intracitoplasmáticas que pueden activar quinasas o metaloproteasas que conducen a la proliferación neointimal y/o a la formación de tejido conectivo21, 22, 23.
Eficacia de los stents farmacoactivosEl grupo de SFA tuvo una respuesta proliferativa significativamente menor que el grupo de SC, referido a un incremento de la luz del vaso y una reducción en el AN y de la reestenosis. No obstante, al comparar los stents con o sin paclitaxel en función del grado de daño vascular, las diferencias significativas en las variables de proliferación se mantienen exclusivamente en el subgrupo de mayor daño vascular. Así, al comparar independientemente cada grupo en función del daño vascular, el grupo de SC mostró diferencias significativas en las variables de proliferación, pero no así el grupo con fármaco.
Un estudio recientemente publicado por Eshtehardi et al24, realizado en humanos tras implante de SFA, mostró precisamente una ausencia de relación entre el grado de daño vascular analizado mediante ultrasonografía intravascular y la respuesta proliferativa al utilizar este tipo de stents. Esto refuerza la conclusión de que la presencia de fármaco en el dispositivo implantado inhibe eficazmente la respuesta proliferativa desencadenada por la agresión vascular, de manera que tras el implante de SFA no se encuentran diferencias en cuanto a reestenosis entre los grupos con o sin rotura de la LEI, ya que esta se encuentra muy atenuada.
Según esto, en nuestro estudio podemos afirmar que el stent recubierto de paclitaxel es significativamente superior al stent sin recubrir en términos globales de eficacia antiproliferativa, con una reducción del 55% de la hiperplasia neointimal y del 52% de reestenosis; sin embargo, cuando existe integridad de la LEI, no se aprecia un beneficio significativo con respecto al SC.
Al aplicar los modelos de análisis multivariable a los datos obtenidos en este modelo, comprobamos que la respuesta proliferativa de los SFA en función del daño vascular no guarda el mismo grado de proporcionalidad que los stents convencionales, pues a partir de un punto de corte definido por la rotura de la LEI la respuesta proliferativa está marcada no por el grado de daño vascular, sino por la eficacia antiproliferativa del fármaco. Esta observación, aparentemente obvia, conlleva implicaciones clínicas y de eficiencia considerables, pues aunque en la práctica clínica no es una situación frecuente, cuando existe integridad de la LEI no existiría un beneficio adicional significativo con el uso de SFA.
Teniendo en cuenta estos datos a la hora de diseñar los estudios experimentales preclínicos, el grado de daño vascular durante el implante debe ser minuciosamente evaluado para tener en cuenta su posible modificación de la reacción proliferativa de la íntima.
Algunos autores señalan que la integridad de la LEI ejerce de barrera y previene la migración de las células musculares lisas o sus progenitoras y que con su rotura se perdería esta función25, 26. Hasta hace poco se admitía que la reestenosis condicionaba un cambio fenotípico de las células musculares lisas, desde células contráctiles hacia células con capacidad de síntesis. Sin embargo, se está incrementando la evidencia de que los componentes celulares de la neoíntima se originan desde los miofibroblastos adventiciales26, 27, 28, 29 o de células madre derivadas de la médula ósea que migran a través de la adventicia a las capas media e íntima30, 31, por lo que parece lógico suponer que, a mayor proximidad de la agresión vascular a esta zona, mayor será el estímulo proliferativo.
Es posible que en el futuro estas observaciones lleven la investigación sobre SFA hacia la búsqueda de distintos mecanismos de liberación del fármaco que puedan hacerlo más efectivo.
Limitaciones del estudioEste trabajo presenta las limitaciones propias de los modelos experimentales de reestenosis en mamífero grande, como son el relativamente escaso número de animales de experimentación, la utilización exclusivamente de animales hembras para evitar la mortalidad arrítmica y el hecho de inducir una lesión sobre una arteria sana. Si bien la respuesta proliferativa obtenida permite evaluar la actividad del fármaco, desconocemos si este efecto sería el mismo en coronarias con alto contenido de material aterosclerótico y en las que, por lo tanto, aparecen ya de forma espontánea zonas de fragmentación de la LEI como parte del proceso global de inflamación de la placa, especialmente en caso de placa vulnerable32, y presentan participación de otros mediadores bioquímicos en el proceso de reparación vascular. Además, otros factores moleculares o genéticos de los pacientes con aterosclerosis como la mayor presencia de lipoproteínas de baja densidad oxidadas, la hiperglucemia o la hipertensión arterial, pueden intervenir directamente en el proceso. A pesar de ello, el modelo coronario porcino sigue siendo el recomendado por consenso para la evaluación de este tipo de dispositivos.
ConclusionesLos stents coronarios recubiertos de paclitaxel disminuyen de forma significativa la reestenosis con respecto a los stents sin recubrir en un modelo experimental porcino. Esta diferencia en la intensidad de la respuesta proliferativa se establece en los casos de daño vascular profundo con rotura de la LEI durante el implante. Sin embargo, este beneficio no es objetivable en el caso de que la LEI permanezca íntegra.
Estos datos deberán ser tenidos en cuenta a la hora de plantear el diseño y análisis de futuros estudios experimentales dirigidos a evaluar la capacidad antiproliferativa de los diferentes fármacos citostáticos utilizados en la prevención de la reestenosis de dispositivos intracoronarios.
Conflicto de interesesNinguno.
Recibido 5 Noviembre 2010
Aceptado 17 Marzo 2011
Autor para correspondencia: Sección de Hemodinámica y Cardiología Intervencionista, Servicio de Cardiología, Hospital de León, Altos de Nava s/n, 24071 León, España. alejandrodiego@secardiologia.es