«Les han de traer ejemplos palpables, fáciles, inteligibles, demostrativos, indubitables, con demostraciones matemáticas que no se pueden negar»
(El ingenioso hidalgo Don Quijote de La Mancha, 1, XXXIII)
Cervantes comprendió que los modelos (tanto si son físicos como si se trata de enseñanzas morales) sólo son válidos en la medida en que reflejan aquello que pretenden simular. Esta es la cuestión esencial que presentan Diego et al1 en el artículo publicado en Revista Española de Cardiología. Los stents liberadores de fármacos han cambiado la práctica de la medicina y son tal vez la intervención más comúnmente utilizada en la actualidad. Cada año se implantan millones de stents y, sin embargo, sigue habiendo dudas cruciales respecto a si un diseño es mejor que otro. La dificultad reside en gran parte en que, aunque los diseños de los dispositivos puedan ser notablemente diferentes entre sí, la detección de una diferencia clínica resulta difícil, dada la muy baja frecuencia de los efectos secundarios. Los ensayos clínicos humanos son de un tamaño demasiado pequeño y de una duración demasiado breve para permitir la detección de diferencias incluso en los eventos mortales que se producen en 1 de cada 100 pacientes al año. El recurso al que se acude de modo natural es los modelos en animales, aunque continúa sin estar claro cuál es la mejor manera de utilizarlos. Diego et al1 describen un estudio que compara la respuesta proliferativa desencadenada tras el despliegue de stents liberadores de paclitaxel y stents metálicos sin recubrimiento en arterias coronarias porcinas. Estos autores señalan que la capacidad de la estructura del stent para influir significativamente en la cicatrización vascular tardía depende del grado de lesión causado en el momento de la implantación. Un resultado de este tipo tiene profundas repercusiones en la forma en que consideramos los modelos animales para las tecnologías cruciales, nuestra perspectiva sobre la biología vascular y la reparación vascular y nuestra apreciación de la historia de los trabajos en este campo. Además, el estudio pone de relieve cómo un parámetro difícil y que rara vez se controla en las intervenciones humanas (el grado de lesión) es un regulador tan potente del efecto clínico y el efecto secundario de reestenosis.
El desarrollo de la angioplastia fructificó clínicamente en 1979 con el trabajo pionero de Gruntzig et al2 y la implantación endovascular de stents a finales de la década de los ochenta como resultado de los esfuerzos igualmente heroicos de Palmaz et al3 y Gianturco et al4. Fue fascinante asistir al rápido reconocimento de su impacto clínico, pero fue necesario desarrollar modelos preclínicos precisos5, 6, 7, 8 antes de que pudiera apreciarse plenamente su potencial clínico, y el examen detallado de los aspectos de seguridad requería un conocimiento más completo de la biología básica. Esto último es lo que constituye la adición más reciente a la biología de los stents, mientras que otros elementos de su biología se basan en mayor medida en contribuciones históricas. De hecho, Santiago Ramón y Cajal, al inicio de su carrera, propuso lo que en ese momento fue una cuestión controvertida: el origen de la inflamación y la migración de los leucocitos; posteriormente trabajó en el estudio de la morfología y la anatomía de las células endoteliales y su interacción con los leucocitos9. Sin embargo, fueron necesarios 75 años para que el papel de la inflamación en la enfermedad vascular pasara a un primer plano y ocupara un lugar central (en gran parte porque era difícil medir la inflamación en el ser humano y había pocos modelos animales exactos de la inflamación y la enfermedad vascular). En 1908, Ignatowski10 desarrolló el primer modelo animal de enfermedad aterosclerótica alimentando a conejos con una dieta especial rica en carne, leche y huevos. A este siguieron otros muchos modelos y, a finales de los años setenta, Vesselinovitch11 enumeró una amplia serie de características deseables para los modelos animales de la aterosclerosis: «deben ser ampliamente disponibles y baratos […], desarrollar lesiones típicas con relativa facilidad en un periodo de tiempo que sea práctico, […] tener cierta semejanza con la anatomía, la fisiología y la bioquímica humanas, incluido un metabolismo de los lípidos y las lipoproteínas del suero similar al humano, […] y deben mostrar complicaciones clínicas de la rotura de la lesión semejantes a las observadas en el hombre». La búsqueda de modelos animales apropiados para comprender y tratar la enfermedad coronaria ha conducido al empleo de una alimentación con dietas ricas en grasas, solas o en combinación con una lesión física, química o inmunológica del endotelio. Parece que siempre hay alguna característica de la enfermedad inducida en esos modelos animales que difiere de las de la enfermedad que se observa de modo natural en el ser humano, y es necesario un cierto compromiso al elegir un modelo animal. El objetivo consiste en establecer la mejor correspondencia posible entre el modelo y la hipótesis específica que se estudia.
Con el nacimiento de la cardiología intervencionista y la adopción masiva de los stents para el tratamiento de la enfermedad vascular aterosclerótica, los procesos proliferativos como la hiperplasia de la íntima llevaron a la reestenosis, un fenómeno de una relevancia clínica tan profunda como la de la propia placa ateromatosa obstructiva. El despliegue de un balón en el interior de una arteria semiocluida reabre la arteria, pero se acompaña de una amplia retracción, denudación de células endoteliales, crecimiento de tejido en el interior del vaso y remodelado vascular. Los stents reducen significativamente la retracción, y la liberación local del fármaco elimina prácticamente por completo la neoformación de tejido, pero el dispositivo y el propio fármaco pueden intensificar la lesión endotelial y la posterior trombosis. ¿Cuál es, pues, el modelo correcto a utilizar y cuáles son los parámetros a considerar respecto a las estructuras multilaminares complejas que son los vasos sanguíneos y cuya afección comporta una alteración de la arquitectura a través de la denudación endotelial, la adhesión, la transmigración y la transformación leucocitarias, la insudación lipídica y la destrucción local? ¿Qué aspectos de la reparación vascular son, pues, más importantes y tal vez predicen mejor la seguridad en el ser humano? ¿Cuándo y dónde examinamos en los modelos animales?
Diego et al1 amplían estas preguntas aún más, al mostrar que el impacto tardío se ve intensamente influido por las condiciones iniciales. Estos autores ponen de manifiesto que el grado de lesión causado por el despliegue del dispositivo dicta la respuesta proliferativa y la respuesta vascular a stents específicos. A la vista de sus resultados, plantean una cuestión muy interesante: «¿los modelos experimentales actuales son válidos para analizar los stents liberadores de fármacos?». Bien es verdad que los modelos animales han sido muy útiles tanto para aclarar la patobiología y los complejos procesos de la aterosclerosis como para valorar la toxicidad de un dispositivo, pero su uso para predecir la eficacia de los stents continúa siendo limitado. Debemos dar un paso atrás y examinar el problema desde ángulos diferentes, retomando las definiciones iniciales de Ramón y Cajal de las células endoteliales y las células inflamatorias.
Posiblemente no haya ningún modelo animal para ninguna enfermedad humana. Es imposible que un roedor u otro cuadrúpedo de mayor tamaño puedan simular los procesos que afectan al ser humano en la fase avanzada de la vida. Probablemente, la enfermedad vascular en los animales nunca podrá reflejar plenamente la suma acumulativa de los efectos de la exposición a factores ambientales como el abuso del tabaco, décadas de hipertensión, anomalías del metabolismo de los lípidos y la glucosa y la transmisión de defectos genéticos específicos. Tal como se evidencia aquí, los modelos animales son de un inestimable valor para abordar preguntas limitadas, cuando interviene un mecanismo específico (p. ej., ¿la lesión vascular profunda comporta un conjunto de limitaciones respecto a la reparación vascular diferente del de una lesión superficial?). En este caso, los modelos animales no sólo son apropiados y relevantes, sino que probablemente sean la única forma de abordar la cuestión. El espectro y la heterogeneidad de la enfermedad humana no permiten que pueda responderse a una pregunta como esta mediante ensayos clínicos. De hecho, la heterogeneidad de las lesiones en la misma persona introduce una confusión en la premisa de usar un único modelo.
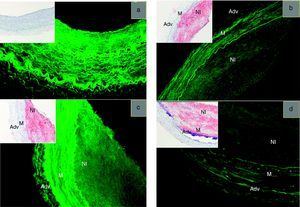
La composición y la distribución de los componentes celulares y de la matriz extracelular del tejido en el que se realiza la intervención vascular y la implantación del stent liberador de fármacos evolucionan con el tiempo y difieren significativamente del escenario inicial previo a la implantación. Los datos recientemente publicados ponen de relieve que los cambios inducidos por la enfermedad en la distribución de las proteínas transportadoras del fármaco y los lípidos intersticiales modifican la distribución de esos fármacos12, lo que nos obliga a considerar cómo podría afectar la enfermedad a la evaluación y la eficacia de la liberación local de fármacos y compuestos similares (Figura 1). Así pues, no sólo hay espectros de células dentro de la arteria enferma, sino que para cada célula existe toda una gama de posibles estados celulares. Las células musculares lisas pueden encontrarse en un fenotipo de síntesis o proliferativo, alineadas con el endotelio que las recubre o separadas de él, empaquetadas en grupos densos o dispersas aleatoriamente dentro de una matriz rica en colágeno. Las células inflamatorias desempeñan también diversos papeles. Los monocitos son reclutados por las células endoteliales activadas hacia las lesiones vasculares. La implantación de stents potencia estas señales de reclutamiento y atrae también a células polimorfonucleares, cada una de las cuales puede fomentar o retardar la cicatrización o la lesión. Por ejemplo, los monocitos pueden exacerbar la lesión endotelial o fomentar una proliferación de células endoteliales13, dependiendo del estado en que se encuentren. El endotelio regula la homeostasis de los vasos sanguíneos de manera dependiente de la densidad, el flujo y la frecuencia del flujo. Ramón y Cajal lo sabía y no debe extrañarnos que las alteraciones de la disposición estructural plana de las células endoteliales sanas puedan verse afectadas en el contexto de la enfermedad. En pocas palabras, las lesiones no sólo difieren de una especie a otra y de una persona a otra, sino también en una misma persona; no es extraño que no podamos establecer un modelo de estos fenómenos en un animal.
Figura 1. El depósito local de paclitaxel es inversamente proporcional al contenido de lípido en las arterias de control (lesión+dieta normal, n=2) y las arterias enfermas (lesión+dieta con colesterol/aceite+dieta normal, n=2). Distribución del paclitaxel fluorescente (verde) y de los lípidos (recuadro, rojo) en una arteria control (a) y en lesiones de diversa complejidad (b-d). Todas las muestras se visualizan con el mismo nivel de intensidad y han sido procesadas para eliminar el fondo y los artefactos, con una autofluorescencia residual mínima de las arterias control incubadas en solución salina de fosfato.Reproducido de Tzafriri et al 12 , con permiso del editor. Adv: adventicia; M: media; NI: neoíntima.
¿Qué se puede hacer? Como se ha indicado antes, podemos plantear preguntas adecuadas y apreciar los resultados interesantes como han hecho Diego et al1. También podemos apreciar que, aunque no haya ningún modelo que aporte un resumen preciso de la experiencia en el ser humano, sí se puede obtener una perspectiva clara a través de la integración de los resultados de múltiples modelos. No tenemos que centrarnos solamente en la biología de las células aisladas en una placa de cultivo celular o en los resultados obtenidos en un determinado modelo animal. Los modelos computacionales serán instrumentos cada vez más potentes para simular el entorno mecánico líquido y para predecir la distribución de los fármacos a lo largo del vaso y la evolución del dispositivo de una forma específica tanto para el paciente como para el dispositivo14. Hemos visto ya biorreactores sofisticados in vitro que resumen no sólo los componentes celulares y de la matriz, sino también los entornos mecánicos a los que están expuestos los vasos sanguíneos15. Sólo se puede obtener datos clínicamente relevantes mediante la interconexión de disciplinas para desarrollar nuevos métodos potentes. Cada vez es más evidente que la mejor forma de aclarar los problemas clínicos cruciales y las interacciones complejas entre células, tejidos y dispositivos es utilizar un enfoque pandisciplinario en el que participen ingenieros de todos los tipos: matemáticos, biólogos y médicos (Figura 2). Únicamente los enfoques integrados (computacionales, in vitro e in vivo) nos permitirán cubrir la distancia entre los resultados científicos y las aplicaciones clínicas. Tal vez sea esto lo que debemos aprender de Cervantes. En primer lugar, tenemos que traer «ejemplos que sean palpables, fáciles, inteligibles, demostrativos», y luego respaldarlos «con demostraciones matemáticas que no se puedan negar». Parece que supiéramos lo que hay que hacer desde hace mucho tiempo.
Figura 2. La solución de un problema clínico requiere enfoques pandisciplinarios y comunicación para ver el problema integralmente. En paralelo con ello, debemos formular preguntas específicas y responderlas desde diferentes ángulos aplicando métodos diversos. La aplicación de estos enfoques nos facilitará la traslación de los síntomas clínicos de enfermedades complejas a objetivos biológicos y tratamientos que sean específicos para cada paciente.
FinanciaciónEl trabajo del Dr. Edelman ha sido financiado por el NIH/NIGMS RO1/GM049039 y el de la Dra. Balcells, por el Ministerio de Innovación de España (Plan Nacional BFU2009-09804), la Cámara de Comercio de Barcelona y la Fundació Empreses Institut Químic de Sarrià.
Conflicto de interesesNinguno.
Agradecimientos
Los autores desean expresar su agradecimiento a Elsevier por el permiso para utilizar materiales del artículo original de Tzafriri et al12.
Full English text available from: www.revespcardiol.org
Autor para correspondencia: Harvard-MIT Division of Health Sciences and Technology, Massachusetts Institute of Technology, 77 Massachusetts Avenue, E25-438, Cambridge, MA 02139, Estados Unidos. merche@MIT.EDU