Palabras clave
INTRODUCCIÓN
Tradicionalmente, se ha concedido al ventrículoderecho y la circulación pulmonar un papel muy secundario en la cardiología en general y en la insuficiencia cardiaca en particular1.
Sin embargo, a día de hoy podemos afirmar quetanto la función del ventrículo derecho (VD) comoel estado de la circulación pulmonar son elementosde primer orden en cardiología. En concreto, en elpaciente con insuficiencia cardiaca, la hipertensiónpulmonar (HP) y la función del VD son factores determinantes del cuadro clínico, elementos esencialesen la valoración pronóstica y variables indispensables para algunas de las más importantes decisionesterapéuticas.
Se estima2 que aproximadamente el 60% de lospacientes con disfunción sistólica severa del ventrículo izquierdo y el 70% de los que presentan disfunción diastólica aislada sufren HP. Dada la elevadaprevalencia de estas entidades, es posible afirmar que la HP causada por cardiopatía izquierda y enconcreto por insuficiencia cardiaca es una de lasformas más frecuentes de HP.
DEFINICIONES
La nueva guía de práctica clínica para el diagnóstico y tratamiento de la hipertensión pulmonar define la HP causada por cardiopatía izquierda comouna entidad fisiopatológica y hemodinámica quepuede presentarse en una amplia variedad de entidades clínicas que afectan a las cavidades y las estructuras cardiacas izquierdas3.
La HP causada por cardiopatía izquierda representa el grupo 2 de la nueva clasificación (tabla 1),modificada de Dana Point4, y es uno de los gruposprotagonistas de las denominadas formas de HP noarterial5.
La definición de HP causada por cardiopatía izquierda lleva aparejada la necesidad de un estudiohemodinámico en el que se compruebe una presiónarterial pulmonar media (PAPm) ≥ 25 mmHg en reposo y una presión capilar pulmonar (PCP)> 15 mmHg.
El límite de 25 mmHg se ha utilizado probablemente para hacer más uniforme el límite hemodinámico en todas las formas de HP y porque es el valorque se ha empleado como límite en ensayos clínicosy registros de HP. Sin embargo, la reciente reevaluación de los datos hemodinámicos disponibles en sujetos sanos, ha demostrado que la PAPm normal enreposo es 14 ± 3 mmHg, con un límite máximonormal que raramente excede 20 mmHg6. De hecho,definiciones previamente aceptadas consideraban ellímite alto de la normalidad de la PAPm en19 mmHg7. Por lo tanto, la importancia de unaPAPm entre 20 y 24 mmHg no está clara y los pacientes con una PAPm en esa gama necesitan de másevaluaciones en futuros estudios epidemiológicos3.
FISIOPATOLOGÍA DE LA HIPERTENSIÓNPULMONAR EN LA INSUFICIENCIACARDIACA
El pulmón, además de oxigenar la sangre venosa,tiene la singular característica de ser el único órgano por el que pasa todo el volumen minuto a«baja presión», incluso cuando durante el ejerciciose puede hasta quintuplicar el volumen minuto.Ello es posible gracias a la enorme reserva del lechovascular pulmonar. Esta capacidad, además, contribuye a regular el llenado del ventrículo izquierdomanteniendo el gradiente transpulmonar (GTP)(GTP = PAPm - PCP) en valores normales,próximos a 5-7 mmHg.
HP pasiva y reactiva
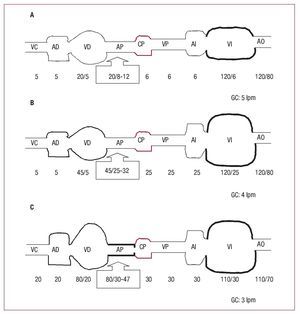
La HP en el paciente con insuficiencia cardiaca puede ser pasiva o reactiva (y ésta, a su vez, reversible o fija), aunque en la práctica clínica la mayorparte de las veces es mixta, es decir, pasiva con uncomponente reactivo asociado (fig. 1).
Fig. 1. Esquema de la circulación pulmonar. A: individuo sano. B: insuficiencia cardiaca e hipertensión pulmonar leve «pasiva». C: insuficiencia cardiaca avanzada ehipertensión pulmonar severa «reactiva».Se reflejan las presiones (mmHg) desdevena cava (VC), aurícula derecha (AD),ventrículo derecho (VD), arteria pulmonar(AP), capilar pulmonar (CP), vena pulmonar (VP), aurícula izquierda (AI), ventrículoizquierdo (VI) y aorta (AO). GC: gasto cardiaco en cada situación.
Cuando en el paciente con insuficiencia cardiacade mecanismo sistólico, diastólico o mixto (tabla 2)se produce una elevación de la PCP, inicialmentehay un aumento «pasivo» de la PAPm, con objetode mantener un GTP normal que sea suficiente parafacilitar el flujo de la circulación pulmonar hacia elcorazón izquierdo.
Sin embargo, la elevación crónica de la PCP seacompaña de un aumento «reactivo» de la PAPm,que se añade al componente pasivo, con lo que aumenta el GTP. La guía de práctica clínica en HP3 introduce una definición hemodinámica adicionalen esta entidad: HP pasiva cuando el GTP es ≤ 12 mmHg y reactiva o desproporcionada cuandoel GTP es > 12 mmHg.
El componente reactivo, a su vez, tiene un componente dinámico o funcional producido por estímulos vasoconstrictores y un componente fijo. Elprimero es, en general, reversible ante estímulos vasodilatadores. Sin embargo, el componente fijo refleja remodelado en la arteria muscular pulmonar, fundamentalmente hipertrofia de la media y enmenor grado, fibrosis de la íntima. Por ello, el vasoarterial pulmonar pierde parcialmente su capacidadvasodilatadora. Dependiendo de la cuantía de esapérdida, la HP reactiva será más o menos reversible(o fija) ante los fármacos vasodilatadores.
La HP reactiva finalmente produce disfuncióndel VD (ya que la presión pulmonar es el principaldeterminante de su poscarga) y, al final, disminución del volumen minuto e insuficiencia cardiacaderecha.
Ventrículo derecho
El VD, en el contexto de la insuficiencia cardiaca,puede estar afectado primariamente por la cardiopatía de origen (miocardiopatía idiopática o isquémica) y/o verse afectado por el aumento de la poscarga que suponen la HP y su progresión. A medidaque el VD se dilata en respuesta a una sobrecargade presión que tolera con dificultad, la restriccióndel pericardio y de los fascículos de fibras musculares compartidas entre ambos ventrículos (relaciónde interdependencia interventricular) limitan unamayor dilatación del VD. Esto hace que aumente lapendiente de la curva de presión-volumen diastólicadel VD, de modo que a un mayor incremento en lapresión del VD no le corresponde un mayor estiramiento de su pared libre. Al mismo tiempo, el desplazamiento del septo interventricular disminuye laeyección del ventrículo izquierdo. La combinaciónde ambos hechos genera una reducción neta delgasto cardiaco. Una vez que el gasto cardiaco comienza a declinar, el fracaso ventricular avanza rápidamente. Tras la reducción del gasto cardiaco sobreviene hipotensión sistémica; ello reduce lapresión de perfusión del VD y facilita la isquemiade su pared libre. La isquemia del VD deterioramás su función contráctil, se reduce más el gastocardiaco y se inicia una rápida espiral que progresahacia el colapso hemodinámico8.
Protección contra el edema pulmonar
El desarrollo de HP fija es uno de los mecanismosde protección contra el edema pulmonar en presencia de una precarga ventricular izquierda crónicamente elevada. Se conocen tres mecanismos fundamentales de protección contra el edema pulmonaren la insuficiencia cardiaca: aumento del drenajelinfático intersticial, engrosamiento de la barrera alveolointersticial y remodelado vascular pulmonar.
Por los mecanismos comentados, la HP reactivaconlleva una reducción significativa del gasto delVD9. Este hecho reduce a su vez el aporte de sangreal lecho capilar pulmonar y protege del edema,además de matizar la evolución clínica del paciente:se reducen las manifestaciones clínicas de congestión pulmonar y aparecen progresivamente las decongestión sistémica.
En la HP causada por insuficiencia cardiaca, cabeanalizar dos aspectos fisiopatológicos: ¿qué factorescontribuyen a elevar la presión venosa pulmonar? y ¿qué ocurre en el vaso pulmonar para que la HPpase de ser pasiva a reactiva?
Factores que contribuyen a elevar y mantenerelevada la presión venosa pulmonar
La mayoría de los pacientes con insuficiencia cardiaca crónica sufren algún grado de HP. Sin embargo, aunque se desconocen muchos aspectos deesta asociación, es conocido que las mayores severidad y duración de la enfermedad cardiológica seasocian a un mayor grado de HP.
Los factores esenciales que contribuyen a mantener crónicamente elevada la presión venosa pulmonar son la disfunción diastólica del ventrículo izquierdo, la enfermedad de la válvula mitral y lafunción y el remodelado de la aurícula izquierda.
En presencia de disfunción y dilatación ventricular izquierda, sin duda la disfunción sistólica contribuye a la elevación de la presión venosa pulmonar. Sin embargo, el mayor grado de disfuncióndiastólica y de insuficiencia mitral funcional se relacionan más estrechamente con el desarrollo y la severidad de la HP10.
En presencia de enfermedad de la válvula mitral,el área funcional en caso de estenosis y el tamañodel orificio regurgitarte cuando la válvula es incompetente se relacionan con el grado de hipertensiónvenosa. Sin embargo, los orificios regurgitantes oefectivos no tienen una relación estrecha con elgrado de HP y otros factores, como la complianceauriculoventricular, intervienen en el desarrollo deHP11.
La aurícula izquierda también participa activamente en la fisiopatología de la HP12. Como se hademostrado en un modelo canino de insuficienciacardiaca, el aumento de la presión telediastólica delventrículo izquierdo produce cambios estructuralesen la pared auricular: hipertrofia de los miocitos yaumento en la matriz de colágeno. Se ha demostrado una correlación positiva entre los marcadoresde mayor síntesis de colágeno auricular (mayor rigidez auricular) y la PAPm13. Este remodelado auricular modifica la función sistólica auricular, perosobre todo su compliance. La mayor rigidez de laaurícula izquierda trasmite retrógradamente sinamortiguar la elevada presión telediastólica del ventrículo izquierdo14.
A pesar de todos estos factores mencionados, haygran variabilidad en el grado de HP asociada a insuficiencia cardiaca. Aunque se desconocen los mecanismos implicados en esta variable respuesta, esposible que intervengan factores genéticos. Dehecho, elevaciones severas de la presión arterial pulmonar (sistólica ≥ 80 mmHg), sólo ocurren enmenos de un tercio de los pacientes con elevacióncrónica de la presión venosa pulmonar.
Factores que contribuyen a que la HP pasivase haga reactiva
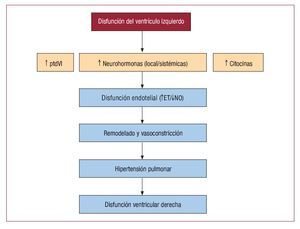
Si en la hipertensión arterial pulmonar (HAP)idiopática se produce inicialmente daño vascular deorigen incierto, lo que provoca secundariamente remodelado y finalmente HAP, en la HP causada porinsuficiencia cardiaca ocurre lo contrario: el desencadenante inicial es una hipertensión arterial pasiva, que probablemente a través del daño endotelial inicie el proceso de remodelado vascular queterminará en HP severa y fija (fig. 2).
Fig. 2. Posible relación entre la presenciade disfunción ventricular izquierda y loseventos secundarios que pueden producirhipertensión arterial pulmonar. ET: endotelina; NO: óxido nítrico; ptdVI:presión telediastólica del ventrículo izquierdo.
La HP asociada a insuficiencia cardiaca crónica de mecanismo sistólico es la forma más estudiada a escala molecular. Parece que el estrés hemodinámico generado por el componente pasivo de la HP, la activación neurohormonal propia de la insuficiencia cardiaca y la producción local y sistémica de citocinas desencadenan daño endotelial que inicia elremodelado en el vaso arterial pulmonar.
El óxido nítrico (NO) generado en la célula endotelial del lecho vascular pulmonar actúa en la célulamuscular lisa y produce relajación, inhibe su proliferación e hipertrofia y, mediante una acción conjunta con la prostaciclina, inhibe la agregación yadhesión plaquetaria.
Hay modelos experimentales y estudios clínicosen insuficiencia cardiaca que indican una deficienteproducción pulmonar basal de NO y que esta pérdida de vasodilatación dependiente de NO puedecontribuir al desarrollo de HP15,16.
La endotelina (ET) es un péptido vasoactivo producido también por la célula endotelial. Existen dos tipos de receptores para la ET: ETA y ETB. Los receptores ETA se localizan en la célula muscular lisay median vasoconstricción y crecimiento celular.Por el contrario, los receptores ETB se encuentransobre todo en la célula endotelial y su estímulo produce vasodilatación a través de la liberación de NOy prostaciclina. La relación de receptores ETA:ETB en las arterias pulmonares es de 9:1, por lo que elefecto neto de la ET es la vasoconstricción y favorecer la proliferación celular.
En la insuficiencia cardiaca la concentración plasmática de ET está elevada y su valor se correlacionaestrechamente con la PAPm y la resistencia vascularpulmonar (RVP)17.
Ambos factores dependientes del daño endotelial(reducción de NO y aumento de ET), son los mediadores conocidos que, a través de vasoconstricción yproliferación celular, inician el remodelado vascular.
Histopatología de la HP asociadaa cardiopatías izquierdas
Existen pocos estudios que analicen la histopatología pulmonar en la hipertensión venosa pulmonarcrónica, además son antiguos y se limitan a la estenosis mitral.
El examen microscópico del tejido pulmonar dela HP venosa muestra distensión de los capilares,engrosamiento y rotura de las membranas basales ytrasudación de eritrocitos a través de las membranas dañadas hasta los espacios alveolares. Confrecuencia se observa hemosiderosis pulmonar, yésta puede progresar a marcada fibrosis. Pero los cambios más característicos de la hipertensión pulmonar venosa se producen en los vasos arteriales,venosos y linfáticos (tabla 3). El término empleadopara describir estos cambios histopatológicos esvasculopatía congestiva y se ha estudiado sobretodo en la valvulopatía mitral18.
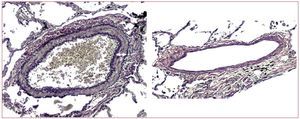
Los cambios arteriales más característicos se producen en las arterias pulmonares musculares. El elemento más llamativo es la hipertrofia de la media,que a menudo es severa y generalmente mayor quela que puede observarse en pacientes con HAP,para grados comparables de HP19.
En la estenosis mitral no se ha encontrado unaestrecha correlación entre el grado de hipertrofia dela media y el grado de HP20. Sin embargo, en la insuficiencia cardiaca avanzada de mecanismo sistólico, el grado de hipertrofia de la media se relacionacon el grado de HP (fig. 3)21.
Fig. 3. Marcada hipertrofia de la media de una arteria muscular pulmonar, en un paciente con insuficiencia cardiaca crónica (izquierda, flecha a señala el espesor de la media), frente a otra de similar tamaño y con mínimo engrosamiento de la media (derecha) en un paciente con insuficiencia cardiaca sin hipertensión pulmonar (tinción de Van Gieson, x100).
La hipertrofia de la media de las arterias musculares se asocia con muscularización de las arteriolas.Otro factor arterial habitualmente presente es la fibrosis de la íntima, generalmente excéntrica y noobstructiva.
En venas y vénulas se produce hipertrofia de lamedia y, con ello, arterialización del vaso venoso yfibrosis de la íntima. Los vasos linfáticos muestranmarcada dilatación, con apariencia de linfangiectasias, sobre todo cuando la presión venosa superacrónicamente los 30 mmHg.
Todos estos cambios estructurales en los vasospulmonares originan que la HP sea reactiva fija oirreversible. El término HP fija o irreversible traduce que el grado de HP no se revierte con fármacos vasodilatadores y resulta útil, pues es unaaproximación al grado de HP que se puede atribuira remodelado vascular. Sin embargo, el término irreversible no es del todo correcto, porque una vezque se resuelve la causa de la hipertensión venosa (p. ej., tras el trasplante cardiaco en la insuficienciacardiaca crónica o tras la valvuloplastia mitral o cirugía de reemplazo valvular, en el caso de la estenosis mitral), probablemente se inicie un proceso deremodelado vascular inverso porque, tras meses oaños de estos procedimientos terapéuticos, la presión pulmonar tiende a normalizarse22-26.
En la insuficiencia cardiaca con fracción de eyección del ventrículo izquierdo (FEVI) normal, los aspectos fisiopatológicos e histopatológicos han sidomucho menos estudiados. Sin embargo, en un reciente estudio poblacional, en el que la prevalenciade HP en este tipo de pacientes se estudió medianteecocardiografía Doppler, se demostró la presenciade HP en el 83% de los pacientes, y en muchos casosde grado severo. En ese mismo estudio se comprobócomo el grado de HP en muchos casos era desproporcionado para el grado de precarga izquierda, loque apuntaría a un componente reactivo vascular,como en los pacientes con insuficiencia cardiaca demecanismo sistólico27.
DIAGNÓSTICO DE HIPERTENSIÓNPULMONAR EN LA INSUFICIENCIACARDIACA
La definición de HP causada por insuficienciacardiaca conlleva la necesidad de un estudio hemodinámico en el que se compruebe la presencia deuna PAPm ≥ 25 mmHg en reposo y una PCP > 15 mmHg3.
Sin embargo, no en todas las circunstancias enque se advierte HP asociada a insuficiencia cardiacaes necesario un estudio hemodinámico diagnóstico,ya que un estudio ecocardiográfico puede proporcionar información suficiente para un manejo clínico adecuado.
En la insuficiencia cardiaca de mecanismo sistólico, los hallazgos ecocardiográficos generalmentehacen obvia la causa de la HP. Además, medianteel flujo de regurgitación tricuspídeo podemos estimar la presión sistólica pulmonar y con la herramienta del Doppler tisular, a través del cocienteE/E', podemos obtener una aproximación adecuadaa la presión de llenado del ventrículo izquierdo.Sólo en circunstancias en que sea necesario afinarla severidad y/o reversibilidad de la HP (pacientecandidato a trasplante o asistencia ventricular) esimprescindible un estudio hemodinámico específicamente dirigido a conocer el grado de HP.
Sin embargo, en el paciente con insuficienciacardiaca y FEVI normal puede ser extremadamente difícil distinguir entre HP causada por disfunción diastólica del ventrículo izquierdo e HAP.Los hallazgos ecocardiográficos que apuntan adisfunción diastólica del ventrículo izquierdo incluyen dilatación de la aurícula izquierda, fibrilación auricular, patrón anormal de llenado mitraldel ventrículo izquierdo e hipertrofia ventricular28. En este grupo de pacientes, y aunque el estudioecocardiográfico proporciona información muyvaliosa, a veces se precisa una determinación hemodinámica de la PCP o de la presión telediastólica del ventrículo izquierdo para documentar queestán elevadas28.
A pesar de ello y aun en caso de disfunción diastólica del ventrículo izquierdo, la presión de llenado ventricular puede ser normal, sobre todo enpacientes tratados con diuréticos. Se ha propuestoun estudio de ejercicio o una sobrecarga de volumen para desenmascarar una disfunción diastólica «oculta». Sin embargo, estas herramientas noestán estandarizadas y requieren una mejor evaluación para su validación5. Por otro lado, en algunos pacientes puede resultar difícil distinguir laHAP de la HP asociada a disfunción diastólica delventrículo izquierdo, sobre todo en aquellos convalores límite de precarga ventricular izquierda(15-18 mmHg)3.
TRASCENDENCIA CLÍNICA DE LA HP EN ELPACIENTE CON INSUFICIENCIA CARDIACA
En general, la HP asociada a cardiopatía izquierda es un factor que deteriora la capacidad funcional, ensombrece el pronóstico y empeora los resultados quirúrgicos.
En la insuficiencia cardiaca de mecanismo sistólico, la presencia de HP tiene importantes implicaciones funcionales y pronósticas29,30. Hay relacióninversa entre el consumo máximo de oxígeno (durante el test ergoespirométrico) y la presión arterialpulmonar en reposo. En la insuficiencia cardiaca,durante el ejercicio se produce una caída de las resistencias vasculares sistémicas; sin embargo, lasRVP permanecen elevadas. Todo ello implica quela HP contribuye a reducir la capacidad funcionalmediante un aumento de la poscarga del VD31. Estahipótesis se basa en la estrecha correlación queexiste entre el consumo máximo de oxígeno y lafracción de eyección del ventrículo derecho en reposo y durante el ejercicio32.
Además, la HP en la insuficiencia cardiaca estáestrechamente relacionada con una ventilación pulmonar ineficiente, que contribuye a hiperpnea ydisnea de esfuerzo en estos pacientes33,34.
Pero la HP en el paciente con insuficiencia cardiaca de mecanismo sistólico no sólo contribuye asu deterioro funcional y matiza la situación clínica,sino que ensombrece el pronóstico y es una variableindependiente de mortalidad30,35. Probablemente elimpacto negativo de la HP en la supervivencia sedeba a su influencia en la función del VD, que a suvez es un importante marcador pronóstico en la insuficiencia cardiaca avanzada36.
Menos conocida es la trascendencia clínica de laHP en el paciente con insuficiencia cardiaca y FEVInormal. Datos recientes, basados en una serie poblacional de 244 pacientes con insuficiencia cardiaca y FEVI normal, muestran una estrecha relación entre la presencia de HP estimada poreocardiografía y mortalidad. Cuando se comparó aesta población con un grupo control de pacienteshipertensos sin insuficiencia cardiaca, la presenciade HP tuvo un alto valor predictivo a la hora dediscriminar entre pacientes con y sin insuficienciacardiaca. Además, la HP en caso de insuficienciacardiaca y FEVI normal fue la única variable ecocardiográfica asociada a mortalidad27.
TRATAMIENTO DE LA HIPERTENSIÓNPULMONAR EN EL PACIENTE CON INSUFICIENCIA CARDIACA
La HP asociada a insuficiencia cardiaca carece detratamiento específico. De igual manera, ningúnfármaco aprobado para el tratamiento de la insuficiencia cardiaca está contraindicado por la presencia de HP3.
En una proporción importante de pacientes, laHP de la insuficiencia cardiaca de mecanismo sistólico es reversible con fármacos, al menos parcialmente, ya que predomina el componente pasivo.Por ello, la optimización del tratamiento médico(oxígeno, diuréticos, nitratos, inhibidores de la enzima de conversión de angiotensina [IECA], antagonistas de los receptores de la angiotensina II[ARA-II] y bloqueadores beta) y la terapia de resincronización reducen de forma significativa la PCP ysecundariamente la PAPm3,37,38.
La optimización del tratamiento médico precisaen ocasiones un ciclo de tratamiento inotrópico(dobutamina, milrinona o levosimendán)39.
Sin embargo, los fármacos con efecto vasodilatador «selectivo» del lecho vascular pulmonar y sonútiles en la HAP idiopática han tenido un efecto negativo o neutro en la HP asociada a insuficienciacardiaca.
La prostaciclina es muy útil en la evaluación de lavasorreactividad del lecho vascular pulmonar en lainsuficiencia cardiaca: reduce la PCP y las RVP y aumenta el índice cardiaco. Sin embargo, por mecanismo desconocido, la administración crónica mediante infusión intravenosa continua (estudio FIRST[Flolan International Randomized Survival Trial])aumentó la mortalidad en los pacientes tratados40.
La inhalación de NO a dosis de 5-80 partes pormillón en la insuficiencia cardiaca moderada o se-vera con HP reduce el GTP y las RVP, pero sorprendentemente no reduce la presión pulmonar. Esmás, la reducción del GTP se asocia a un aumentode la presión de llenado de ventrículo izquierdo. Talvez, la selectividad del NO en el lecho vascular pulmonar hace que aumente el retorno venoso a unventrículo izquierdo disfuncionante y, como consecuencia, aumente su precarga41. Por ello, el NO inhalado no está indicado en el manejo de la HP de lainsuficiencia cardiaca42. Sin embargo, se ha usadocon éxito para valorar la vasorreactividad pulmonar43, como soporte perioperatorio en cirugíavalvular o coronaria de alto riesgo44 y para preveniro tratar la insuficiencia ventricular derecha tras eltrasplante cardiaco o tras el implante de un dispositivo de asistencia ventricular izquierda45.
El citrato de sildenafilo es un potente inhibidorselectivo de la fosfodiesterasa tipo 5 (enzima muypresente en el lecho vascular pulmonar), que através de un aumento de las concentraciones deGMP cíclico produce relajación de la célula muscular lisa y causa vasodilatación. Sus efectos hemodinámicos agudos (dosis oral, 50-100 mg) son: reducción de la PAPm y RVP (en mayor grado que lasistémica), sin apenas modificar la PCP ni el índicecardiaco. Estas propiedades hacen del sildenafilo un fármaco útil para la valoración de la vasorreactividad del paciente con insuficiencia cardiaca46-48.
Datos más recientes han mostrado que una dosisoral de 50 mg de sildenafilo mejora la capacidadfuncional en el paciente con insuficiencia cardiacade mecanismo sistólico49 y que un tratamiento crónico durante 3 y 6 meses mejora la hemodinámica,la capacidad funcional y la calidad de vida de estospacientes50,51. No obstante, son necesarios estudiosque evalúen el mecanismo de acción del sildenafiloen la insuficiencia cardiaca y se descarte un efectoinotrópico positivo a través de la inhibición indirecta de la fosfodiesterasa 3 (recordemos que elefecto inotrópico positivo en la insuficiencia cardiaca se ha asociado a aumento de mortalidad),como paso previo a estudios diseñados para evaluarmortalidad52.
Los antagonistas de los receptores de la ET(ARE) selectivos y no selectivos demostraron, enmodelos experimentales de insuficiencia cardiaca,que mejoraban la hemodinámica, el remodeladoventricular y la supervivencia53. Sin embargo, lostrabajos clínicos han sido decepcionantes. El AREmás estudiado en la HP de la insuficiencia cardiacaes el antagonista no selectivo tezosentán (estudiosRandomized Intravenous Tezosentan [RITZ] 1, 2, 4y 5). Administrado por vía intravenosa a dosis de50-100 mg/h, mejora la hemodinámica pero no lossíntomas clínicos ni el pronóstico de la insuficienciacardiaca reagudizada54. Tal vez la dosis administrada de este fármaco no haya sido la adecuada, yrecientemente se ha comprobado que la administración de dosis bajas de tezosentán (1-25 mg/h) es hemodinámicamente activa y puede reducir las concentraciones de BNP55. Aunque los efectoshemodinámicos con 1 mg/h son mínimos y aparecen tardíamente, pueden ser persistentes. Nuevosestudios son necesarios para comprobar si estasdosis pueden producir mejoría clínica.
El segundo ARE no selectivo, estudiado en la insuficiencia cardiaca crónica y administrado por víaoral, es bosentán. En el estudio REACH-1 se administraron 250 mg/12 h de bosentán frente a placebo;el estudio se suspendió precozmente tras detectarseuna alta incidencia de elevación de transaminasasen el grupo tratado56. Al cierre del estudio no hubocambios significativos en el estado clínico de pacientes tratados y no tratados. En el estudioENABLE I/II, se administraron dosis de125 mg/12 h de bosentán frente a placebo a pacientes con insuficiencia cardiaca en clase III-IV dela New York Heart Association. Tras 9 meses deseguimiento no se encontraron diferencias clínicasni de mortalidad en el grupo tratado respecto algrupo placebo53.
El darusentán, ARE selectivo de los receptoresETA, fue evaluado en el ensayo HEAT y se comprobó que su administración en la insuficiencia cardiaca crónica mejoraba el índice cardiaco57. Sin embargo, su administración en dosis de 10-300 mg/díadurante 6 meses (estudio Endothelina ReceptorAntagonist Trial in Heart Failure [EARTH]) nomejoró el remodelado ventricular izquierdo, los síntomas clínicos ni el pronóstico58.
Muchas han sido las hipótesis para explicar laausencia de eficacia de los ARE en el paciente coninsuficiencia cardiaca, y una de ellas puede ser lainadecuada selección de los pacientes incluidos enlos ensayos clínicos2. Es posible que añadir un AREsea eficaz sólo en algún subgrupo de pacientes coninsuficiencia cardiaca crónica59.
Por todo lo expuesto y en el momento actual,ninguna de las formas de tratamiento médico quese han mostrado eficaces en la HAP pueden recomendarse en el paciente con insuficiencia cardiacade mecanismo sistólico e HP. Sin embargo, es muyimportante avanzar en el estudio de esta vía terapéutica, sobre todo con sildenafilo y ARE. Si la HPes un marcador de mal pronóstico en este tipo depacientes, es preciso mantener la búsqueda de alguna forma de tratamiento específico, eficaz y seguro, sobre todo para el subgrupo de pacientes conlas formas más severas (HP desproporcionada).
En pacientes con insuficiencia cardiaca y FEVInormal, las guías de práctica clínica recomiendan elcontrol de la hipertensión arterial, la prevención ointento de regresión de la hipertrofia ventricular izquierda mediante IECA o ARA-II, el adecuadocontrol de la volemia mediante restricción de sodioy diuréticos y finalmente, la prevención de la taquiarritmia o el control de la frecuencia cardiacapara optimizar el tiempo de llenado diastólico conbloqueadores beta o antagonistas del calcio. Enestos pacientes, puede obtenerse un modesto beneficio en reducción de hospitalizaciones mediante elempleo de candersartán37. Pero al margen de estasrecomendaciones generales, no hay datos sobre lainfluencia de tratamientos específicos que se hanmostrado eficaces en la HAP para el tratamiento dela insuficiencia cardiaca con FEVI normal. En elmomento actual está en marcha el estudioEvaluating the Effectiveness of Sildenafil atImproving Health Outcomes and Exercise Abilityin People With Diastolic Heart Failure (RELAX),que permitirá evaluar la eficacia de sildenafilo eneste grupo de pacientes60.
MANEJO DEL PACIENTE CON INSUFICIENCIA CARDIACA AVANZADAE HIPERTENSIÓN PULMONAR CANDIDATOA TRASPLANTE
Mención especial merece esta situación, ya que laHP asociada a insuficiencia cardiaca es un factor de riesgo de morbimortalidad tras el trasplante cardiaco, sobre todo por fallo precoz del injerto relacionado con disfunción del VD61-63. Y hemos detener en cuenta, que el fallo precoz del injerto cardiaco es la causa más frecuente de muerte duranteel primer mes tras el trasplante64.
Un GTP > 12 mmHg y/o unas RVP precapilares> 2,5 UW, tras estudio vasodilatador, son las cifraslímite de riesgo por encima de las cuales aumenta lamortalidad tras un trasplante cardiaco65-70. Las cifras de GTP y RVP por encima de estos valorestienen una correlación positiva continua con lamortalidad perioperatoria, aunque no se ha definido un valor límite por encima del cual el riesgosea inaceptable.
Y es que, aunque la HP es un importante factorde riesgo de insuficiencia ventricular derecha tras eltrasplante cardiaco, hay otros factores, algunos deellos dependientes del propio VD del donante, queinfluyen en la evolución perioperatoria (manejo hemodinámico del donante, daño isquémico durantela preservación y daño por reperfusión tras el implante). Esto explica que un grado leve de HPpueda tener una influencia nefasta en la evoluciónperioperatoria y que grados más importantes de HPpuedan ser trasplantados con éxito, incluso con escasa repercusión hemodinámica.
Por todo lo expuesto, en la insuficiencia cardiacaavanzada del paciente candidato a trasplante cardiaco, la evaluación hemodinámica es imprescindible. Antes de ello, es razonable inicialmente unaoptimización del tratamiento farmacológico parainsuficiencia cardiaca guiada por parámetros clínicos. Cuando mediante el examen clínico o conecocardiografía Doppler se detecta HP significativa, se puede considerar incluso un ciclo corto de48-72 h de tratamiento inotrópico intravenosoprevio al estudio hemodinámico inicial.
Si en ese estudio inicial las cifras de presión pulmonar superan los límites de riesgo, se aconseja realizar un estudio vasodilatador71. La guía de prácticaclínica de la International Society for Heart andLung Transplantation (ISHLT) recomienda realizarun estudio vasodilatador si la presión arterial sistólica pulmonar (PASP) es ≥ 50 mmHg y el GTP≥ 15 mmHg o las RVP son > 3 UW72. Para ello seemplea nitroglicerina, nitroprusiato, prostaglandinaE1, prostaciclina, NO, iloprost y sildenafilo. Sin embargo, ninguna pauta de actuación se ha mostradosuperior a otra y, por lo tanto, no hay recomendaciones específicas3. Tampoco existen parámetros hemodinámicos basales que permitan predecir la respuesta al estudio vasodilatador; sin embargo, uníndice cardiaco bajo y unas RVP muy elevadas(> 6 UW) son predictores de peor respuesta73.
Tras el estudio vasodilatador, una gran parte delos pacientes pasan a la categoría de HP «reversible» y pueden ser incluidos en lista de espera. Sinembargo, aunque es un tema controvertido, pareceque el pronóstico tras el trasplante cardiaco en estegrupo de pacientes con HP reversible es ligeramentedesfavorable respecto a los pacientes sin HP74. Lavigilancia hemodinámica de este tipo de pacientesmientras permanecen en lista de espera aconsejarealizar un cateterismo derecho cada 3-6 meses.
Si en el estudio vasodilatador no se ha conseguido reducir la PCP por debajo de 25 mmHg y laPASP por debajo de 60 mmHg, la reversibilidad dela HP no ha sido evaluada; por lo que antes de desestimar el trasplante cardiaco por HP, se deberíabuscar una forma más eficaz de tratar la congestiónpulmonar72.
Por otro lado, si las cifras de presión pulmonartras el estudio vasodilatador se sitúan en la franjade reversibilidad, pero lo hacen con una caída de lapresión arterial sistólica por debajo de 85 mmHg,no se reduce el riesgo tras el trasplante66.
Los pacientes en que persisten las cifras de HP deriesgo tras un estudio vasodilatador pueden ser susceptibles de un intensivo tratamiento farmacológicoinotrópico y vasodilatador (oral o intravenoso), quefinalmente pueda transformar su HP en «reversible». Esta transformación es lo que algunos autores han denominado «condicionamientovasodilatador»75, y para ello es necesario realizaruna escalada terapéutica de tratamiento inotrópicoy vasodilatador, bajo monitorización hemodinámica. No existe una pauta definida, pero se contempla la combinación de inotrópicos y vasodilatadores selectivos. Con esta pauta terapéutica sepuede minimizar el número de pacientes excluidospara trasplante por HP «irreversible».
Si a pesar de lo descrito en el paciente persisten lascifras de HP de riesgo, existe la posibilidad de añadiral tratamiento médico dispositivos de asistencia mecánica como el balón de contrapulsación intraaórticoy los dispositivos de asistencia ventricular72,76.
Los pacientes candidatos a trasplante con insuficiencia cardiaca e HP «reversible» que han precisado de un estudio vasodilatador requieren un manejo especial para el que tampoco existen pautasuniversalmente recomendadas, entre otras: reevaluación trimestral o semestral del grado de HPmientras permanecen en lista de espera72, mantenimiento del tratamiento vasodilatador hasta eltrasplante59, adecuada selección del donante (emparejando al alza el peso respecto del receptor, mantenimiento hemodinámico con bajas dosis o sin inotrópicos y tiempo de isquemia previsiblementecorto) y, finalmente, protección del ventrículo derecho inmediatamente tras la cirugía mediante NO,prostaciclina intravenosa, iloprost o sildenafilo.
A pesar de todas las opciones expuestas, algunospacientes no alcanzan los límites de reversibilidad de su HP que permitan un riesgo asumible paratrasplante cardiaco ortotópico. Según la guía depráctica clínica de la ISHLT, se debe consideraruna contraindicación relativa para trasplante cardiaco ortotópico la situación de los pacientes quetras las medidas anteriormente descritas tienen unaRVP > 5 UW, GTP > 16-20 mmHg, sobre todo sialguna de las dos determinaciones coexiste con unaPASP > 60 mmHg72.
ABREVIATURAS
GTP: gradiente transpulmonar capilar medio.
HAP: hipertensión arterial pulmonar.
HP: hipertensión pulmonar.
PAPm: presión arterial pulmonar media.
PCP: presión capilar pulmonar.
VD: ventrículo derecho.
Full English text available from: www.revespcardiol.org
El Dr. Juan F. Delgado es investigador de la red de investigacióncooperativa REDINSCOR, financiada por el Ministerio de Salud yConsumo, a través del Instituto de Salud Carlos III.
Correspondencia: Dr. J.F. Delgado.
Unidad de Insuficiencia Cardiaca y Trasplante. Servicio de Cardiología.Hospital Universitario 12 de Octubre.
Avda. de Córdoba, s/n. 28041 Madrid. España.
Correo electrónico: jdelgado.hdoc@salud.madrid.org