El intervencionismo coronario percutáneo primario (ICPp) es la estrategia de reperfusión preferida para la mayoría de los pacientes con infarto agudo de miocardio con elevación del segmento ST (IAMCEST). El tratamiento antitrombótico (antiagregante y anticoagulante) adyuvante en este contexto es fundamental para la prevención de eventos trombóticos mediados por activación plaquetaria o de la cascada de la coagulación1. En el ICPp se emplean diferentes fármacos anticoagulantes de uso parenteral, como heparina no fraccionada (HNF), enoxaparina y bivalirudina. Sin embargo, se desconoce cuál es el momento idóneo para iniciar la anticoagulación en pacientes con IAMCEST, si en el momento del diagnóstico o al iniciar el procedimiento, por lo que no existe una recomendación al respecto en las guías de práctica clínica actuales2,3. El objetivo del estudio es comparar el impacto de administrar precozmente (en el momento del diagnóstico) el tratamiento anticoagulante frente a aplicarlo en el laboratorio de hemodinámica al iniciar el procedimiento sobre la permeabilidad inicial de la arteria «responsable» del infarto (ARI) en pacientes para quienes se indica ICPp como estrategia de reperfusión.
Se registró prospectivamente a todos los pacientes consecutivos (entre octubre de 2009 y noviembre de 2011) ingresados en un centro terciario con diagnóstico de IAMCEST a los que se practicó ICPp. Se incluyó a los pacientes diagnosticados tanto en dicho centro como en centros secundarios o por el servicio de emergencias en domicilio y trasladados para ICPp. Se excluyó del análisis a los pacientes que habían recibido enoxaparina precozmente por el escaso número de pacientes a los que se administró y la heterogeneidad de dosis y vías de administración utilizadas. Por lo tanto, se dividió a los pacientes en dos grupos según el tratamiento recibido en el momento del diagnóstico (grupo 1: HNF precoz; grupo 2: no anticoagulados hasta su llegada al laboratorio de hemodinámica). Los inhibidores de la glucoproteína IIb/IIIa y el anticoagulante usado en la sala de hemodinámica (en pacientes del grupo 2) se emplearon según criterio del operador. Una vez en la sala de hemodinámica, de los pacientes del grupo 1 se determinó el ACT (activated clotting time), y podían recibir una dosis extra de HNF para conseguir un ACT de 250-350 s (para los que recibían inhibidores de la glucoproteína IIb/IIIa, el objetivo de ACT era de 200-250 s), mientras que los del grupo 2 recibieron HNF a dosis intravenosa de 1 mg/kg, excepto un 8% de los sujetos, que recibieron bivalirudina. La permeabilidad de la ARI se evaluó con la variable flujo Thrombolysis in Myocardial Infarction (TIMI) inicial dicotomizada en dos categorías arbitrarias: mal flujo (TIMI 0-1) frente a buen flujo (TIMI 2-3). Se utilizó esta categorización debido a que el flujo TIMI 2-3 permite la total visualización del campo distal a la lesión, lo cual facilita el procedimiento. El análisis estadístico se realizó mediante un modelo de regresión logística (método por pasos hacia atrás) que incluyó como variable dependiente el flujo TIMI inicial (dicotomizada) y como independiente el tratamiento anticoagulante (grupos 1-2), ajustando por variables consideradas de relevancia clínica y características basales no equilibradas entre grupos (p<0,20).
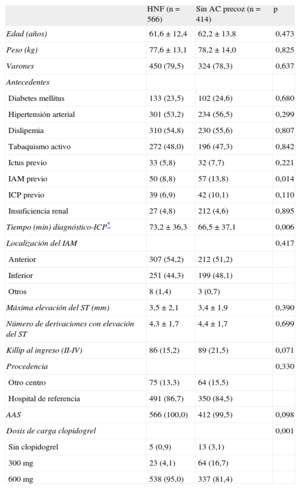
Se incluyó a 1.075 pacientes, de los que se excluyó a 95 que habían recibido enoxaparina precozmente, por lo que se incluyó en este análisis a un total de 980 distribuidos en: grupo 1, n=566 (HNF 0,75-1 mg/kg intravenosa), y grupo 2, n=414. No se administraron prehospitalariamente inhibidores de la glucoproteína IIb/IIIa en ningún caso. Entre las características basales (tabla), se apreciaron diferencias en las siguientes variables (incluidas en el modelo): infarto agudo de miocardio previo, ICP previa, grado Killip al ingreso, dosis de carga de clopidogrel y el tiempo entre la activación del sistema y la realización de la coronariografía. El análisis multivariable mostró como único predictor el uso precoz de HNF, que se asoció con un porcentaje significativamente superior de flujo TIMI 2-3 en la ARI (el 27 frente al 16,7%; odds ratio=1,84 [intervalo de confianza, 1,33-2,55]; p<0,001), comparado en ambos casos con la administración en la sala de hemodinámica.
Características previas al procedimiento
| HNF (n=566) | Sin AC precoz (n=414) | p | |
| Edad (años) | 61,6±12,4 | 62,2±13,8 | 0,473 |
| Peso (kg) | 77,6±13,1 | 78,2±14,0 | 0,825 |
| Varones | 450 (79,5) | 324 (78,3) | 0,637 |
| Antecedentes | |||
| Diabetes mellitus | 133 (23,5) | 102 (24,6) | 0,680 |
| Hipertensión arterial | 301 (53,2) | 234 (56,5) | 0,299 |
| Dislipemia | 310 (54,8) | 230 (55,6) | 0,807 |
| Tabaquismo activo | 272 (48,0) | 196 (47,3) | 0,842 |
| Ictus previo | 33 (5,8) | 32 (7,7) | 0,221 |
| IAM previo | 50 (8,8) | 57 (13,8) | 0,014 |
| ICP previo | 39 (6,9) | 42 (10,1) | 0,110 |
| Insuficiencia renal | 27 (4,8) | 212 (4,6) | 0,895 |
| Tiempo (min) diagnóstico-ICP* | 73,2±36,3 | 66,5±37,1 | 0,006 |
| Localización del IAM | 0,417 | ||
| Anterior | 307 (54,2) | 212 (51,2) | |
| Inferior | 251 (44,3) | 199 (48,1) | |
| Otros | 8 (1,4) | 3 (0,7) | |
| Máxima elevación del ST (mm) | 3,5±2,1 | 3,4±1,9 | 0,390 |
| Número de derivaciones con elevación del ST | 4,3±1,7 | 4,4±1,7 | 0,699 |
| Killip al ingreso (II-IV) | 86 (15,2) | 89 (21,5) | 0,071 |
| Procedencia | 0,330 | ||
| Otro centro | 75 (13,3) | 64 (15,5) | |
| Hospital de referencia | 491 (86,7) | 350 (84,5) | |
| AAS | 566 (100,0) | 412 (99,5) | 0,098 |
| Dosis de carga clopidogrel | 0,001 | ||
| Sin clopidogrel | 5 (0,9) | 13 (3,1) | |
| 300 mg | 23 (4,1) | 64 (16,7) | |
| 600 mg | 538 (95,0) | 337 (81,4) |
AAS: ácido acetilsalicílico; AC: anticoagulación; HNF: heparina no fraccionada; IAM: infarto agudo de miocardio; ICP: intervencionismo coronario percutáneo.
El tiempo del diagnóstico al ICP va desde el diagnóstico de IAM con elevación del segmento ST —momento en que se inicia doble antiagregación y anticoagulación (en los pacientes que la recibieron precozmente) y se activa el sistema de traslado al laboratorio de hemodinámica— hasta el inicio del procedimiento.
Los resultados de este estudio muestran que, en pacientes con IAMCEST a los que se realiza ICPp, la administración precoz del tratamiento anticoagulante parenteral (en el momento del diagnóstico y antes del traslado) se asocia con mejor permeabilidad de la ARI al empezar el procedimiento que iniciando la anticoagulación en el laboratorio de hemodinámica. La característica más importante y novedosa de la presente investigación es que compara directamente dos estrategias de administración (precoz o al inicio del procedimiento) del tratamiento anticoagulante, mientras que los estudios realizados hasta el momento en este ámbito se han centrado en comparar distintos agentes, y no el momento óptimo de administración4–6.
Reconocemos las limitaciones inherentes a este estudio por tratarse de un análisis observacional, y no se puede excluir un sesgo de selección a la hora de administrar el tratamiento anticoagulante precoz. Para confirmar estos resultados, sería preciso realizar un ensayo aleatorizado, justificado por las implicaciones clínicas que se derivarían de estos hallazgos.
CONFLICTO DE INTERESESEl Dr. José Luis Ferreiro ha recibido honorarios por conferencias de Astra Zeneca, Eli Lilly Co. y Daiichi Sankyo, Inc.