Los alelos CYP2C19*2 y *17 parecen relacionarse con la variabilidad en el metabolismo del clopidogrel. Los objetivos del presente estudio son valorar la relación fenotipo-genotipo asociada a los polimorfismos CYP2C19*2 y *17 y explorar el impacto clínico de estos polimorfismos durante 6 meses de seguimiento en una población no seleccionada con síndrome coronario agudo sin elevación del segmento ST.
MétodosSe reclutó a 40 pacientes estables doblemente antiagregados, 12 meses después del implante de stent coronario para el primer objetivo, y a 493 pacientes ingresados con síndrome coronario agudo sin elevación del segmento ST para el segundo. La reactividad plaquetaria se evaluó mediante agregometría óptica estimulando las plaquetas con adenosina difosfato o péptido activador del receptor de trombina, y valorando la fosfoproteína estimulada por vasodilatadores fosforilada mediante citometría de flujo. El genotipo para los polimorfismos CYP2C19*2 y *17 se analizó con sondas TaqMan.
ResultadosSólo el test de fosforilación de fosfoproteína estimulada por vasodilatadores mostró diferencias significativas en la reactividad plaquetaria entre los pacientes portadores y no portadores de los alelos CYP2C19*2 (p=0,020) y *17 (p=0,048). No se observó asociación con el pronóstico a 6 meses de los alelos CYP2C19*2 ([HR (IC95%): 1 (0,94-1,55)], p=0,984) y *17 ([HR (IC95%): 0,93 (0,61-1,43)], p=0,753).
ConclusionesLos polimorfismos de CYP2C19 *2 y *17 se relacionaron con la reactividad plaquetaria, pero no con el pronóstico a 6 meses, en el que multitud de variables deben influir.
Palabras clave
El clopidogrel es un profármaco que debe ser biotransformado para inhibir irreversiblemente al receptor de adenosina difosfato (ADP) P2Y12. La biotransformación del clopidogrel a su derivado tiol activo requiere dos pasos oxidativos en los que intervienen isoenzimas del citocromo P450 (CYP) hepático, como CYP2C19, 3A4/5, 1A2, 2B6 y 2C91. Algunos estudios indican que los polimorfismos del CYP pueden ser causa, al menos en parte, de la heterogeneidad de la respuesta al clopidogrel2. Recientemente, se ha analizado la contribución in vitro de cada CYP, y se ha demostrado1 que el metabolismo del clopidogrel depende principalmente del CYP2C19. Así, los alelos de pérdida de función del CYP2C19, como el alelo *2, se asocian a un deterioro de la conversión del clopidogrel en su metabolito activo, una mayor reactividad plaquetaria durante el tratamiento con clopidogrel y una mala evolución clínica, en especial por el aumento del riesgo de trombosis del stent3, 4, 5. En cambio, el alelo CYP2C19*17 se asocia a una potenciación de la respuesta plaquetaria al clopidogrel6, y los portadores de esta variante polimórfica podrían obtener mayor beneficio que los no portadores con tal tratamiento7. Sin embargo, no está clara todavía la trascendencia clínica de los alelos CYP2C19*2 y *17; los análisis recientes de otras series de pacientes han mostrado resultados contradictorios en cuanto a la relación entre la eficacia del clopidogrel y el estado de portador de los alelos3, 4, 5, 6, 7.
Los objetivos de nuestro estudio son evaluar la relación fenotipo-genotipo asociada a los polimorfismos CYP2C19*2 y *17 en 40 pacientes estables doblemente antiagregados mediante el empleo de diferentes métodos de valoración de la función plaquetaria y explorar la influencia pronóstica de estos polimorfismos en una cohorte no seleccionada de 493 pacientes con síndrome coronario agudo sin elevación del ST (SCASEST) a los 6 meses de seguimiento.
MÉTODOSPacientesPara el primer objetivo, incluimos a 40 pacientes caucásicos estables en tratamiento de antiagregación doble con ácido acetilsalicílico y clopidogrel. A todos ellos se les realizó intervención percutánea coronaria (ICP) e implante de stent, por recurrencia de eventos, en los 12 meses previos a la inclusión en el estudio. Los criterios de inclusión fueron los siguientes: edad > 18 años, ausencia de trastornos hemorrágicos o contraindicaciones para el tratamiento doble antiagregante y ausencia de eventos isquémicos que hubieran requerido hospitalización durante al menos los 6 meses previos a la inclusión en el estudio. Se obtuvieron las características clínicas y demográficas, así como información detallada de la ICP a partir de las historias clínicas. Se implantaron stents metálicos convencionales o liberadores de fármacos, siguiendo las recomendaciones actuales, según el criterio del cardiólogo intervencionista. Después de la intervención, se continuó con la administración de dosis de mantenimiento de ácido acetilsalicílico a razón de 100mg/día y clopidogrel a razón de 75mg/día, según los protocolos actuales8.
Para el segundo objetivo, reclutamos a 493 pacientes caucásicos consecutivos diagnosticados de SCASEST admitidos en tres hospitales terciarios españoles. Se excluyó a 65 pacientes a causa de una interrupción temprana del tratamiento con clopidogrel. Por ello, finalmente se dio seguimiento durante 6 meses a 428 pacientes. Incluimos a pacientes que acudieron al servicio de urgencias y cumplían al menos dos de los siguientes criterios: a) dolor torácico típico; b) alteraciones electrocardiográficas que indicaran isquemia, como la depresión del segmento ST ≥ 0,5mm en al menos dos derivaciones consecutivas o la inversión de la onda T ≥ 0,2mV, y c) elevación de los valores de troponina T por encima del punto de corte (≥ 0,1ng/ml). Se excluyó a los pacientes con enfermedades infecciosas/inflamatorias concomitantes, discrasias hematológicas o contraindicaciones para el tratamiento antiagregante. Todos los pacientes recibieron un tratamiento estándar según lo recomendado en las guías actuales para el SCA8, doble terapia antiagregante, inhibidores de la glucoproteína IIb/IIIa, así como bloqueadores beta, inhibidores de la enzima de conversión de la angiotensina, heparina de bajo peso molecular y estatinas cuando era apropiado. Además, se calculó la puntuación de riesgo TIMI para el SCASEST en todos los pacientes9. Posteriormente se realizó una angiografía coronaria y/o una ICP, a criterio del cardiólogo responsable. El seguimiento a 6 meses se realizó mediante visitas ambulatorias, contactos telefónicos y revisión de las historias clínicas. Identificamos como «eventos adversos»: muerte cardiovascular o síndrome coronario agudo recurrente que requiriera ingreso hospitalario. Todos los pacientes dieron su consentimiento informado por escrito y el estudio fue aprobado por el comité ético local.
Procedimientos de laboratorioPara el primer objetivo, se extrajeron muestras de sangre a las ocho de la mañana en la clínica ambulatoria, tras una noche en ayunas, sin haber fumado ni consumido bebidas con alcohol o cafeína. En el momento de obtención de las muestras, todos los pacientes recibían diariamente doble terapia antiagregante (100mg de ácido acetilsalicílico y 75mg de clopidogrel). Las muestras de sangre se obtuvieron mediante punción venosa, en tubos con citrato trisódico al 3,2% para las pruebas de reactividad plaquetaria o en tubos con ácido etilendiaminotetraacético (EDTA) para la obtención de ADN genómico. Se obtuvo plasma rico en plaquetas para los tests de agregación, a partir de sangre citrada, mediante centrifugación a 150/g durante 10min a temperatura ambiente, y se utilizó sin un ajuste para el recuento de plaquetas, en un plazo de 3h tras la obtención de la muestra de sangre.
Para el segundo objetivo, se obtuvieron muestras de sangre venosa en las primeras 48h tras el ingreso del paciente, siempre antes de la angiografía coronaria, utilizando suero y tubos con EDTA. Para los tests de ADN genómico (ambos objetivos), se utilizaron tubos con EDTA que se centrifugaron a 1.500 / g durante 12min a temperatura ambiente; se recogieron los estratos de leucocitos que se conservaron a –80°C hasta realizar el análisis por lotes. Las concentraciones de troponina T de los pacientes con SCASEST se determinaron en muestras séricas al ingreso y a las 6 y 12h posteriores, utilizando un enzimoinmunoanálisis de un solo paso, con tecnología de electroquimioluminiscencia (Elecsys, Roche Diagnostics, Basilea, Suiza).
Pruebas de función plaquetariaPruebas de agregación plaquetariaLa agregometría de transmisión óptica se realizó en un agregómetro estándar (Aggrecorder II, Menarini Diagnostics, Florencia, Italia) a 37°C y 1.000rpm. Se monitorizaron los cambios de la transmisión óptica durante 5min en plasma rico en plaquetas no ajustado para el recuento de plaquetas10 tras la estimulación con: ADP a concentraciones de 5μM y 10μM (DiaMed, Cressier, Suiza) y péptido activador del receptor de trombina (TRAP) a 25μM (Sigma-Aldrich Inc., St. Louis, Missouri, Estados Unidos). El criterio de valoración de la reactividad plaquetaria corresponde al máximo porcentaje de luz transmitida, tomando el plasma autólogo pobre en plaquetas como la referencia del 100%. La agregación inducida por TRAP se empleó como control intraanalítico positivo en cada paciente, ya que la respuesta plaquetaria al péptido está mediada por el receptor de trombina receptor 1 activador de proteasa, y las tienopiridinas no la bloquean.
Índice de reactividad plaquetaria-fosfoproteína estimulada por vasodilatadoresLa determinación de los valores de fosfoproteína estimulada por vasodilatadores (VASP) fosforilada es un indicador de la reactividad de P2Y12 y, por lo tanto, de la inhibición inducida por clopidogrel11. Los valores de VASP fosforilada se cuantificaron mediante la determinación del índice de reactividad plaquetaria (PRI) mediante citometría de flujo (Beckman Coulter FC500, Miami, Florida, Estados Unidos) utilizando anticuerpos monoclonales marcados y siguiendo las instrucciones del proveedor (Platelet VASP, Diagnostica Stago, Biocytex Inc., Marsella, Francia). La población de plaquetas se identificó por las distribuciones de dispersión frontal y lateral hasta objetivar 5.000 eventos. El grado de fosforilación de VASP se determinó mediante la diferencia en los valores de la media geométrica de la intensidad de fluorescencia media (IFM) en muestras incubadas con PGE1 en presencia o en ausencia de ADP (IFMPGE1+ADP e IFMPGE1, respectivamente). Después de sustraer los valores de control isotípicos negativos de los valores de fluorescencia correspondientes, se calculó el PRI(%) con la siguiente fórmula: PRI(%)=[(IFMPGE1) – (IFMPGE1+ADP) / (IFMPGE1)]×100. El cociente se expresó como reactividad plaquetaria porcentual media y es inversamente proporcional a la inhibición plaquetaria producida por clopidogrel.
Determinación del genotipoSe purificó el ADN genómico usando el Puragene Blood Core Kit B (QIAGEN Sciences, Germantown, Maryland, Estados Unidos). El análisis genotípico de los polimorfismos CYP2C19*2 (681G>A; rs4244285) y CYP2C19*17 (–806C>T; rs12248560) se realizó con TaqMan SNP Genotyping Assays (Applied Biosystems, Carlsbad, California, Estados Unidos) siguiendo las instrucciones del fabricante, utilizando LC480 Real Time PCR (Roche, Basilea, Suiza). Se analizaron los genotipos sin conocer los valores de agregación plaquetaria ni la evolución clínica de los pacientes. Con objeto de asegurar un manejo correcto de las muestras, se repitió la genotipificación en el 20% de los pacientes, y se obtuvieron idénticos resultados. Se efectuó la determinación genotípica de las dos variantes alélicas en todos los pacientes incluidos en el estudio; por consiguiente, la tasa de determinación inequívoca (call rate) fue del 100%.
Análisis estadísticoLas variables se presentan en forma de media±desviación estándar, recuentos (porcentajes) o mediana [intervalo intercuartílico]. Se utilizó la prueba de Kolmogorov-Smirnov para verificar la distribución normal de los datos de las variables continuas. Las variables discretas se compararon utilizando la prueba de la χ2. Las de variables continuas se compararon con la prueba de la t de Student para datos no apareados bilateral o con la prueba de la U de Mann-Whitney según la distribución de los datos. Los cálculos para las variables de valoración de interés se basaron en la comparación del estado de portador de los alelos CYP2C19*2 y CYP2C19*17 en los individuos de tipo silvestre (G/G o C/C, respectivamente) y los portadores del alelo polimórfico (combinación de G/A y A/A, así como C/T y T/T, respectivamente). Se eligió un modelo dominante en ambos casos, ya que los alelos polimórficos */A o */T producen pérdida o ganancia completa de la función enzimática, lo cual significa que un alelo polimórfico ejerce un efecto relevante en la actividad enzimática total. La desviación respecto al equilibrio de Hardy-Weinberg se evaluó en ambas poblaciones con la prueba de la χ2 para cada polimorfismo. Se analizó la proporción de riesgo relativo mediante regresión de Cox univariable sin ajustar, para comparar los eventos registrados durante el periodo de seguimiento entre los sujetos portadores de los alelos polimórficos y silvestres, tomando a los segundos como grupo de referencia en cada caso. Se calcularon las tasas de supervivencia totales con el método de Kaplan-Meier, y se determinaron las diferencias con log rank. Se aceptaron como estadísticamente significativos todos los valores de p<0,05. El análisis estadístico se realizó con el programa SPSS 17.0 para Windows (SPSS Inc., Chicago, Illinois, Estados Unidos).
RESULTADOSRelación entre el genotipo CYP2C19 y la reactividad plaquetaria durante el tratamientoLas características clínicas basales de los 40 pacientes en los que se evaluó la reactividad plaquetaria durante el tratamiento se presentan en la Tabla 1. De forma resumida, la media de edad de esa población era 65,8±10 años; 36 (90%) eran varones. A todos los pacientes se les había implantado al menos un stent; a 32 (80%) de ellos se les implantó stents liberadores de fármacos y a 8 (20%), stents convencionales. La distribución de genotipos fue la siguiente: el 77,5% GG, el 17,5% GA y el 5% AA para el polimorfismo CYP2C19*2, y el 67,5% CC, el 30% CT y el 2,5% TT para el polimorfismo CYP2C19*17. Para las distribuciones del genotipo CYP2C19*17, no se observó ninguna desviación significativa del equilibrio de Hardy-Weinberg (p=0,698), no así para el CYP2C19*2 (p=0,009).
Tabla 1. Características basales de 40 pacientes con síndrome coronario agudo sin elevación del segmento ST incluidos en el estudio del primer objetivo
| Variable | Alelo CYP2C19*2 | Alelo CYP2C19*17 | Total | ||
| G/G | */A | C/C | */T | ||
| Pacientes, n (%) | 31 (77,5) | 9 (22,5) | 27 (67,5) | 13 (32,5) | 40 (100) |
| Edad (años) | 65,9±8,9 | 65,6±13,7 | 66,5±10,7 | 64,1±8,6 | 65,8±10 |
| Edad ≥ 65 años (%) | 54,8 | 66,7 | 63 | 46,2 | 57,5 |
| Varones (%) | 93,5 | 77,8 | 85,2 | 100 | 90 |
| Hipertensión (%) | 78,6 | 66,7 | 68 | 91,7 | 75,7 |
| Dislipemia (%) | 64,3 | 44,4 | 52 | 75 | 59,5 |
| Diabetes mellitus (%) | 50 | 33,3 | 44 | 50 | 45,9 |
| Tabaquismo (%) | 25 | 0 | 16 | 25 | 18,9 |
| SMC (%) | 22,6 | 11,1 | 22,2 | 15,4 | 20 |
| SLF (%) | 77,4 | 88,9 | 77,8 | 84,6 | 80 |
SLF: stent recubierto de fármaco; SMC: stent metálico convencional.
La edad se expresa en media±desviación estándar.
La reactividad plaquetaria residual observada en los pacientes según los polimorfismos CYP2C19*2 y CYP2C19*17 se resume en la Tabla 2. Tal como puede apreciarse, no hubo diferencias significativas entre los individuos silvestres y los polimórficos en cuanto a la reactividad plaquetaria residual inducida por ADP 5 y 10μM, medida con agregometría óptica. La agregación inducida por TRAP medida con agregometría óptica estuvo en la franja de normalidad descrita para sujetos sanos tanto en los pacientes de tipo silvestre como en los polimórficos (datos no presentados).
Tabla 2. Efecto del genotipo CYP2C19 en la agregación plaquetaria máxima inducida por adenosina difosfato durante el tratamiento con clopidogrel en pacientes con una intervención coronaria percutánea e implantación de stent
| Polimorfismo | N | Agregación plaquetaria ADP 5μM | Agregación plaquetaria ADP 10μM |
| CYP2C19*2 | |||
| G/G | 31 | 47,1±14,3 | 54,2±15,5 |
| */A | 9 | 54,2±12,5 | 62,6±17,4 |
| p | 0,190 | 0,170 | |
| CYP2C19*17 | |||
| C/C | 27 | 50,3±14,6 | 58,1±16,4 |
| */T | 13 | 45,5±12,8 | 51,9±15,4 |
| p | 0,319 | 0,265 |
ADP: adenosina difosfato.
Los resultados se presentan como valores medios del porcentaje máximo de agregación, media±desviación estándar.
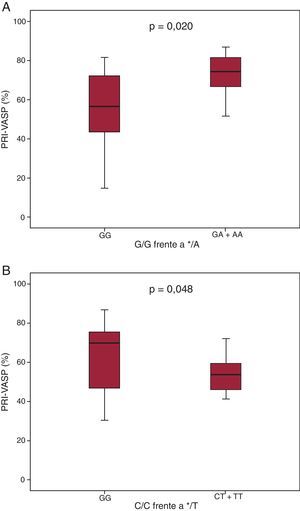
Por otro lado, los portadores del alelo CYP2C19*2 */A presentaron una reactividad plaquetaria en el test de PRI-VASP superior a la de los pacientes de tipo silvestre (G/G) (el 72,3±11,9% frente al 56,1±18,8%; p=0,02) (Figura 1A). De igual modo, se observó un PRI-VASP significativamente inferior en los portadores del alelo CYP2C19*17 */T en comparación con los pacientes de tipo silvestre (C/C) (el 51,3±17,8% frente al 63,8±18%; p=0,048) (Figura 1B).
Figura 1. Efecto del genotipo CYP2C19 en el test índice de reactividad plaquetaria-fosfoproteína estimulada por vasodilatadores en pacientes tratados con una intervención coronaria percutánea e implantación de stent. A: efecto de la variante alélica CYP2C19*2. B: efecto de la variante alélica CYP2C19*17. Los valores de fosforilación de fosfoproteína estimulada por vasodilatadores se evaluaron por citometría de flujo en sangre total citrada mediante un test comercial, tal como se describe en el apartado «Métodos». Los recuadros indican el intervalo intercuartílico. La línea continua corresponde a la mediana, y los límites inferior y superior indican los percentiles 2 y 98. PRI-VASP: índice de reactividad plaquetaria-fosfoproteína estimulada por vasodilatadores.
Analizamos a los pacientes con riesgo alto de trombosis según el punto de corte que se ha propuesto en un reciente consenso para la reactividad plaquetaria durante el tratamiento con clopidogrel en el contexto de la ICP12. En nuestra población, 26 (65%) y 29 (72,5%) pacientes presentaron una elevada reactividad plaquetaria residual, según las determinaciones realizadas con la agregación inducida por ADP y con el PRI-VASP, respectivamente. A pesar del bajo número de pacientes evaluados, los dos métodos utilizados para valorar la reactividad plaquetaria residual mostraron tendencia a una mayor representación de pacientes con aumento de la reactividad plaquetaria durante el empleo de clopidogrel en los portadores del alelo CYP2C19*2 */A, mientras que el estado de portador del alelo CYP2C19*17 */T mostró el efecto contrario (Tabla 3).
Tabla 3. Efecto de los genotipos CYP2C19*2 y CYP2C19*17 en la prevalencia de pacientes de alto riesgo, según la elevada reactividad plaquetaria residual durante el tratamiento con clopidogrel
| Polimorfismo | Pacientes, n (%) | LTA-ADP (5μM) ≥ 46%, n (%) | PRI-VASP ≥ 50%, n (%) | |
| CYP2C19*2 | CYP2C19*17 | |||
| A | ||||
| G/G | - | 31 (77,5) | 18 (58,1) | 20 (64,5) |
| */A | - | 9 (22,5) | 8 (88,9) | 9 (100) |
| p | 0,091 | 0,036 | ||
| - | C/C | 27 (67,5) | 20 (74,1) | 22 (81,5) |
| - | */T | 13 (32,5) | 6 (46,2) | 7 (53,9) |
| p | 0,084 | 0,074 | ||
| B | ||||
| G/G | C/C | 19 (47,5) | 13 (68,4) | 14 (73,7) |
| */A | C/C | 8 (20) | 7 (87,5) | 8 (100) |
| G/G | */T | 12 (30) | 5 (41,7) | 6 (50) |
| */A | */T | 1 (2,5) | 1 (100) | 1 (100) |
| Total | 26 (65) | 29 (72,5) | ||
LTA-ADP: agregación óptica máxima inducida con adenosina difosfato; PRI-VASP: índice de reactividad plaquetaria-fosfoproteína estimulada por vasodilatadores.
Los efectos de cada alelo polimórfico en las pruebas de la función plaquetaria se han evaluado de dos formas: A, efecto individual de cada polimorfismo, y B, combinación de ambos polimorfismos.
Los datos se presentan como recuentos (porcentaje de casos). Se clasificó a los pacientes incluidos en el estudio del primer objetivo como «pacientes de alto riesgo» cuando la agregación máxima inducida por adenosina difosfato 5μM era ≥ 46% o cuando los valores de PRI-VASP eran ≥ 50% según los puntos de corte establecidos por Bonello et al 12 en un reciente consenso. Se comparó la prevalencia de pacientes de alto riesgo en portadores y no portadores de las variantes alélicas con la prueba de la χ2.
Debido a la interrupción temprana del tratamiento con clopidogrel en 65 de los casos incluidos, finalmente 428 pacientes fueron recomendados por sus cardiólogos y se los evaluó en nuestro estudio. Las características demográficas y basales de estos 428 pacientes se detallan en la Tabla 4. La media de edad fue 67,3±12,2 años; 278 (65%) eran varones y 150 (35%), mujeres. Respecto a la forma de presentación del SCASEST, el 39,6% de los pacientes incluidos presentaron depresión del segmento ST y el 59,3%, un aumento de los valores de troponina T (por encima del límite estándar). La media de puntuación de riesgo TIMI para el conjunto de la cohorte fue 3,22±1,54. Las distribuciones genotípicas fueron las siguientes: el 71,96% G/G, el 24,77% G/A y el 3,27% A/A para el polimorfismo CYP2C19*2, y el 66,12% C/C, el 30,14% C/T y el 3,74% T/T para el CYP2C19*17. Para la distribución de los genotipos, no se observó ninguna desviación significativa del equilibrio de Hardy-Weinberg (p=0,527 y p=0,905, respectivamente). Así pues, hubo 120 pacientes portadores del alelo CYP2C19*2 */A (28%) en nuestra población, y 145 portadores del alelo CYP2C19*17 */T (33,9%) (Tabla 4). Tal como se indica, no hubo diferencias significativas (p>0,05) en las características demográficas y basales, la medicación y el manejo de los pacientes, independientemente del genotipo (Tabla 4), con la excepción de las diferencias significativas en la depresión del segmento ST en los portadores del alelo CYP2C19*17 (p=0,05), así como en la frecuencia de cateterismos (sin significación estadística en las tasas de implantación de stents) y de la prescripción de nitratos (p=0,034 y p=0,037, respectivamente).
Tabla 4. Características basales de los pacientes con síndrome coronario agudo sin elevación del segmento ST reclutados para el estudio del segundo objetivo según el genotipo CYP2C19
| Variable | CYP2C19*2 | CYP2C19*17 | Total | ||
| G/G | */A | C/C | */T | ||
| Pacientes, n (%) | 308 (72) | 120 (28) | 283 (66,1) | 145 (33,9) | 428 (100) |
| Edad (años) | 67,3±12 | 67,3±12,8 | 67,3±12,2 | 67,3±12,2 | 67,3±12,2 |
| Edad ≥ 65 años (%) | 65,6 | 58,3 | 65 | 60,7 | 63,6 |
| Varones (%) | 64,3 | 66,7 | 66,4 | 62,1 | 65 |
| Hipertensión (%) | 68,1 | 75 | 68,8 | 72,4 | 70 |
| Dislipemia (%) | 55,2 | 53,3 | 54,8 | 54,5 | 54,7 |
| Diabetes mellitus (%) | 42,7 | 41,7 | 40,1 | 46,9 | 42,4 |
| Tabaquismo (%) | 22,4 | 21 | 23,4 | 19,3 | 22 |
| Al menos 3 FRCV (%) | 39,2 | 40 | 37,7 | 42,8 | 39,4 |
| Depresión del segmento ST (%) | 37,8 | 44,2 | 42,9 | 33,1 | 39,6 |
| Troponina T ≥ 0,1 ng/ml (%) | 59,2 | 59,8 | 60,6 | 56,9 | 59,3 |
| Lesión significativa (%) | 30,2 | 31,3 | 29,9 | 31,7 | 30,5 |
| Síntomas de angina grave (%) | 29,4 | 37,4 | 29,2 | 36,4 | 31,6 |
| Puntuación TIMI | 3,2±1,5 | 3,4±1,6 | 3,2±1,5 | 3,2±1,6 | 3,2±1,5 |
| Tratamiento durante la hospitalización | |||||
| Cateterismo | 71,3 | 75,2 | 75,7 | 66 | 72,4 |
| Con stent | 46 | 44,6 | 48,3 | 40,7 | 45,6 |
| Sin stent | 25,3 | 30,6 | 27,4 | 25,3 | 26,8 |
| Bypass arterial coronario | 10,1 | 14,4 | 11,7 | 10,4 | 11,2 |
| Tratamiento durante el periodo de seguimiento a 6 meses | |||||
| AAS | 96,4 | 95,8 | 95,4 | 97,9 | 96,3 |
| Clopidogrel | 100 | 100 | 100 | 100 | 100 |
| Bloqueadores beta | 86,8 | 90,9 | 90 | 83,3 | 87,9 |
| IECA | 55,3 | 50 | 56,9 | 46,9 | 53,7 |
| Nitratos | 28,1 | 39,6 | 36 | 21 | 31 |
| ARA-II | 14,2 | 22,7 | 18 | 13,5 | 16,6 |
| Antagonistas del calcio | 20,1 | 20,4 | 22,3 | 15,6 | 20,2 |
| Estatinas | 89,5 | 90,9 | 92 | 85,4 | 89,9 |
AAS: ácido acetilsalicílico; ARA-II: antagonistas de los receptores de la angiotensina II; FRCV: factores de riesgo cardiovascular; IECA: inhibidores de la enzima de conversión de la angiotensina; lesión significativa: estenosis coronaria ≥ 50%.
Edad y puntuación TIMI se expresan como media±desviación estándar.
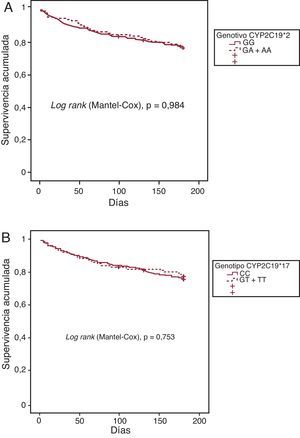
Se dispuso de datos completos de seguimiento a 6 meses en 412 (96,3%) de los 428 pacientes incluidos. De ellos, 97 (23,5%) presentaron eventos adversos en este periodo de seguimiento. El análisis univariable de la regresión de Cox (Tabla 5), demostró que el estado de portador del alelo de pérdida de función CYP2C19*2 (*/A) no era un predictor significativo de evolución adversa ([HR (IC95%): 0,99 (0,64-1,55)], p=0,984). Tampoco el alelo de ganancia de función CYP2C19*17 (*/T) mostró significación estadística en la reducción de la frecuencia de los eventos adversos durante los 6 meses de seguimiento ([HR (IC95%): 0,75 (0,61-1,43)], p=0,753). Tal como se muestra en la Figura 2, la supervivencia acumulada en este breve periodo de seguimiento no se vio significativamente influida por el genotipo CYP2C19, según el análisis univariable (Tabla 5). En cambio, varios de los factores de riesgo utilizados para el cálculo de la puntuación de riesgo TIMI mostraron influencia estadísticamente significativa en los resultados clínicos en el análisis univariable; por ejemplo, la edad ≥ 65 años, las anomalías electrocardiográficas con depresión del segmento ST y los síntomas graves de angina (Tabla 5). De hecho, la puntuación de riesgo TIMI resultó ser un potente predictor de la evolución clínica adversa en el conjunto de la población ([HR (IC95%): 1,41 (1,23-1,62)], p<0,001). Además, el sexo femenino mostró una asociación significativa con la evolución clínica adversa ([HR (IC95%): 1,62 (1,09-2,42)], p=0,018). No obstante, en el análisis multivariable, solamente la edad ≥ 65 años y las anomalías electrocardiográficas con depresión del segmento ST continuaron mostrando una asociación significativa con la evolución clínica adversa a los 6 meses de seguimiento (p=0,001 y p=0,028, respectivamente) (Tabla 5). Se demostró tendencia a una mala evolución clínica en relación con los síntomas graves de angina en las 24h previas (p=0,051).
Tabla 5. Análisis de regresión de Cox para los eventos adversos (sí/no) en un seguimiento de 6 meses, según el genotipo y los factores de la puntuación de riesgo TIMI (segundo objetivo)
| Variable | HR (IC95%) | p |
| Análisis univariable | ||
| CYP2C19*2; */A frente a G/G | 1 (0,94-1,55) | 0,984 |
| CYP2C19*17; */T frente a C/C | 0,93 (0,61-1,43) | 0,753 |
| Sexo femenino | 1,62 (1,09-2,42) | 0,018 |
| Edad ≥ 65 años | 2,45 (1,50-4,01) | < 0,001 |
| Tres o más factores de riesgo cardiovascular | 1,28 (0,86-1,91) | 0,225 |
| Estenosis coronaria ≥ 50% | 1,40 (0,91-2,10) | 0,132 |
| Depresión del segmento ST | 1,68 (1,13-2,51) | 0,011 |
| Ácido acetilsalicílico previo | 1,40 (0,92-2,10) | 0,113 |
| Síntomas de angina grave | 1,60 (1,04-2,50) | 0,034 |
| Troponina T ≥ 0,1 ng/ml | 1,34 (0,87-2,05) | 0,182 |
| Puntuación de riesgo TIMI | 1,41 (1,23-1,62) | < 0,001 |
| Análisis multivariable | ||
| Sexo femenino | 1,29 (0,82-2,02) | 0,272 |
| Edad ≥ 65 años | 2,52 (1,44-4,42) | 0,001 |
| Estenosis coronaria ≥ 50% | 1,47 (0,88-2,46) | 0,138 |
| Depresión del segmento ST | 1,63 (1,05-2,53) | 0,028 |
| Ácido acetilsalicílico previo | 1,10 (0,66-1,82) | 0,722 |
| Síntomas de angina grave | 1,56 (1-2,42) | 0,051 |
HR: hazard ratio; IC95%: intervalo de confianza del 95%.
El grupo de referencia utilizado para calcular la interacción entre el alelo subyacente de *2 y *17 en el análisis univariable fue la variante del alelo de tipo silvestre.
Figura 2. Curvas de Kaplan-Meier para los portadores y no portadores de alelos CYP2C19 *2 y *17 con seguimiento de 6 meses. A: supervivencia acumulada para los portadores del alelo CYP2C19*2 (GA+AA, línea discontinua) y los no portadores (GG, línea continua). B: supervivencia acumulada para los portadores del alelo CYP2C19*17 (TC+TT, línea discontinua) y los no portadores (CC, línea continua).
DISCUSIÓNLas discrepancias descritas en la reactividad plaquetaria durante el tratamiento con clopidogrel y el impacto de los polimorfismos CYP2C19*2 y *17 deben estar relacionados con el número de pacientes evaluados, pero también con el hecho de que la prueba de PRI-VASP evalúa específicamente la función del receptor P2Y12 y parece ser más sensible para evaluar los efectos biológicos de clopidogrel según el estado del CYP2C19 (Tabla 3), a diferencia de la agregación plaquetaria13 inducida por ADP y mediada por los receptores P2Y en la agregometría óptica. Además, la baja correlación entre las diversas pruebas de la función plaquetaria14, 15 parece variar en función de factores subyacentes que deben influir en la elevada reactividad plaquetaria residual16.
Muchos estudios han demostrado una asociación significativa del CYP2C19*2 con un mal pronóstico clínico3, 4, 17. Nuestros datos sugieren que, en pacientes con riesgo trombótico moderado, ya que menos del 50% recibió ICP7, 18 e implantación de stent, la repercusión clínica de un único polimorfismo debe reducirse18. Otros estudios han demostrado que los eventos isquémicos y la trombosis de stent ocurren pronto tras el inicio del tratamiento con clopidogrel en asociación con la ICP y la implantación del stent3, 4, 18, 19. Los pacientes a los que se practica una ICP deben mostrar un estado de reactividad plaquetaria diferente20. De hecho, muchos estudios han encontrado asociaciones positivas cuando se practicó ICP a más del 70% de los pacientes3, 4, 5, 19, independientemente del pequeño tamaño muestral2, 19. Por el contrario, para porcentajes de ICP menores (el 18% ICP, el 15,5% con stents), el análisis genético del test Clopidogrel in Unstable Angina to prevent Recurrent Events (CURE)7 no encontró asociación significativa entre la presencia de alelos polimórficos CYP2C19*2 (*2/*2, *2/*3 y *3/*3) y la ocurrencia de eventos adversos.
La diabetes mellitus se ha asociado con hiperreactividad plaquetaria y, junto con el polimorfismo CYP2C19*2, es el mejor factor discriminatorio para explicar la respuesta insuficiente a clopidogrel21. No obstante, los resultados de un reciente metaanálisis, en el que el 91% de los pacientes habían sido tratados con ICP, indican que el impacto de la presencia del alelo CYP2C19*2 se asocia a un riesgo elevado de un resultado clínico adverso, en mayor medida que otros factores clínicos5. En consonancia con estos resultados, la diabetes mellitus fue más frecuente (42,4%) en nuestra población que en otras (23-28%)5, 18. Sin embargo, en nuestra población, la mayor prevalencia de diabetes mellitus no parece ser suficiente para elevar significativamente el riesgo de los portadores del alelo *2, a pesar de que se combine con una frecuencia de ICP cercana al 70% y una tasa de implante de stent de casi un 50%. Así pues, la ICP y la implantación de stents, más que otras condiciones clínicas, deben considerarse factores de alto riesgo trombótico en pacientes portadores del alelo CYP2C19*2 */A doblemente antiagregados. En consecuencia, debemos ser muy cautos al definir «poblaciones de alto riesgo» dependiendo del escenario clínico subyacente. Aun así, el estado del alelo CYP2C19*2 sólo explica un 5-15,2% de la heterogeneidad de respuesta al clopidogrel2.
Por otro lado, la trascendencia clínica del estado de portador del CYP2C19*17 todavía está por esclarecer. Algunos estudios han relacionado este polimorfismo con una mayor respuesta al clopidogrel7 y un incremento del riesgo hemorrágico18, 22. Hay poco consenso acerca de un posible efecto neutro6 o protector respecto a la ocurrencia de eventos isquémicos22, 23. Nuestros resultados no indican una interacción significativa entre el estado del alelo *17 y los eventos adversos, a pesar de que se registraron tasas más bajas de cateterismo en los portadores del alelo *17 que en los no portadores (el 66 frente al 75,7%; p=0,034), probablemente debido al riesgo moderado de nuestra población. Los estudios con resultados positivos que asocian el polimorfismo CYP2C19*17 con una reducción en la tasa de eventos adversos se basan en un número bajo de pacientes tratados con ICP (18%)7 e implantación de stent (15,5%). No obstante, las tasas más altas de ICP (90-100%) se asocian a ausencia de reducción de los eventos isquémicos, independientemente del estado del alelo CYP2C19*174, 6. El test PLATO podría ser comparable al nuestro, dada la frecuencia de ICP (66%), pero sólo aporta información acerca de la asociación entre el alelo *17 y el riesgo hemorrágico18. Así pues, en pacientes con un riesgo trombótico moderado o mayor, el efecto clínico «protector» del CYP2C19*17 debe ser inferior. Lamentablemente, no registramos las tasas de hemorragia en nuestros pacientes para explorar la influencia de estos polimorfismos en las posibles complicaciones hemorrágicas4, 6, 7, 18 en nuestra cohorte.
La elevada variabilidad interindividual de respuesta al clopidogrel continúa siendo una cuestión clínicamente relevante24, 25, 26, 27. A pesar de que se ha demostrado que esta heterogeneidad es un proceso multifactorial24, 25, 28, 29, diversos estudios han señalado la existencia de una relación entre el genotipo CYP2C19 y las consecuencias pronósticas30, 31, 32. Sin embargo, el sexo femenino (35%) se ha asociado a eventos adversos, según los resultados de Mega et al5. La trascendencia pronóstica individual debe depender del contexto clínico21, 33. Las características demográficas y basales, junto con el estado del CYP2C1919, 21, 33, 34, en nuestra cohorte (el 42,2% diabetes, el 35% sexo femenino y el 45,6% implantación de stents) pueden explicar, al menos en parte, la tendencia (aunque sin significación estadística) de las curvas de supervivencia de Kaplan-Meier. El fenotipo es el resultado de la combinación del genotipo y el ambiente donde se expresa, lo que debe ser la variable más importante en la enfermedad cardiovascular21, 33.
LimitacionesEn primer lugar, observamos una gran incidencia de elevada reactividad plaquetaria residual en los pacientes estudiados para el primer objetivo, y ello puede ser una limitación para alcanzar diferencias significativas en función del genotipo en las pruebas de función plaquetaria por agregometría óptica. No encontramos una explicación clara para estos resultados. Sin embargo, una tasa más elevada de uso de stents farmacoactivos, relacionada con una cicatrización de la neoíntima defectuosa en las arterias coronarias, puede estar relacionada con una mayor reactividad plaquetaria.
En segundo lugar, el tamaño muestral de ambas poblaciones fue pequeño y se basó en el número máximo de pacientes que aceptaron participar. No podemos descartar que la potencia estadística fuera insuficiente, como ha ocurrido en estudios previos18. La prevalencia alélica fue muy similar a la de otros estudios3, 4, 5, 6, 7, con el 3,3 y el 3,7% de A/A (CYP2C19*2) y T/T (CYP2C19*17), respectivamente. Además, evaluamos poblaciones enteramente caucásicas; por consiguiente, nuestros resultados deben ser específicos para nuestras poblaciones de pacientes y la forma en que los tratamos. Por consiguiente, nuestro estudio podría subestimar la influencia de los polimorfismos genéticos en los efectos de clopidogrel en nuestro contexto específico. Además, la mayoría de los estudios en que se ha evaluado el impacto del CYP2C19 han tenido periodos de seguimiento más largos; nosotros realizamos un seguimiento relativamente corto, de 6 meses, similar al de un estudio previo5.
Estudiamos tan sólo los dos polimorfismos más comúnmente asociados con la evolución clínica; sin embargo, hay otros alelos o factores basales/demográficos que pueden ser relevantes para cada caso particular. Otra limitación en el segundo objetivo es el breve periodo de seguimiento. El hecho de que no se evaluara el cumplimiento de la terapia con clopidogrel en la población del segundo objetivo también puede ser una limitación. Por último, el empleo de dos poblaciones diferentes impide establecer asociaciones entre la reactividad plaquetaria durante el tratamiento, los eventos cardiovasculares y el estado de portador del alelo CYP2C19.
CONCLUSIONESLas variantes alélicas CYP2C19*2 */A y CYP2C19*17 */T se asocian significativamente a un aumento y una disminución, respectivamente, de la reactividad plaquetaria durante el tratamiento con clopidogrel, al evaluar el efecto específico de este fármaco en el P2Y12.
Sin embargo, el estado de portador del CYP2C19ha mostrado una influencia poco consistente en los eventos adversos en pacientes con SCASEST no seleccionados de riesgo moderado en un periodo de seguimiento de 6 meses. Estas poblaciones deben estar más influidas por otros factores clínicos/demográficos. Debe haber un beneficio diferente asociado al tratamiento con clopidogrel en la prevención de eventos adversos tales como la trombosis del stent y la recurrencia del síndrome coronario agudo. La trombosis arterial podría verse influida por multitud de variables. Los resultados obtenidos mediante un determinado test deben interpretarse con precaución en función de los diferentes contextos clínicos.
FINANCIACIÓNEste estudio ha sido financiado por el Instituto de Salud Carlos III (RECAVA RD 06/0014-0039), la Fundación Séneca (07703/GERM/07), y la Beca Fundación Uriach-Sociedad Española de Cardiología 2009.
CONFLICTO DE INTERESESNinguno.
Recibido 23 Febrero 2011
Aceptado 12 Julio 2011
Autor para correspondencia: Centro Regional de Hemodonación, Ronda de Garay s/n, 30003 Murcia, España. jose.rivera@carm.es