El conducto arterioso permeable (CAP) afecta al 70% de los recién nacidos prematuros y se asocia con frecuencia a graves complicaciones. Normalmente, al nacer, el aumento de la presión de O2 y la caída de la prostaglandina E2 producen la constricción del conducto arterioso, pero este hecho no ocurre en los prematuros en quienes la prostaglandina E2 permanece elevada. La ciclooxigenasa es una enzima crucial para la síntesis de prostaglandinas, y por eso sus inhibidores se utilizan para el tratamiento del CAP1. Muchos pacientes con CAP no responden al tratamiento, y este fracaso se ha asociado con corioamnionitis y sepsis, factores relacionados con una respuesta inflamatoria sistémica2,3. En consecuencia, se ha sugerido que la inflamación aumentaría la actividad de la ciclooxigenasa-1 y la producción de prostaglandina E24, lo que implica que la inflamación es un factor importante en la persistencia del CAP. En la actualidad, la prueba ultrasensible para la proteína C reactiva (PCRus) se puede utilizar para la cuantificación precisa de concentraciones bajas de proteína C reactiva (PCR), que se consideran unos marcadores para detectar inflamación de bajo grado5. Por ello, planteamos la hipótesis de que los pacientes con CAP tendrían valores más altos de PCRus que aquellos sin CAP en el momento del diagnóstico.
Se realizó un estudio retrospectivo, incluyendo todos los prematuros con peso ≤ 1.500 gramos y edad gestacional ≤ 30 semanas, nacidos entre el 1 de enero de 2009 y el 31 de diciembre de 2014 en el Hospital Privado Universitario de Córdoba (Argentina). Se excluyó a los pacientes con anomalías congénitas, cromosómicas, genéticas, fallecimiento precoz, gemelares, sepsis, enterocolitis necrotizante y hemorragia intestinal e intraventricular. Durante el periodo estudiado, se realizó sistemáticamente una ecocardiografía al tercer día de vida a todos los prematuros, y se consideró CAP significativo un diámetro ductal > 1,5mm y al menos dos de los siguientes criterios: relación aurícula izquierda/aorta > 1,5, flujo pulsátil en el conducto arterioso, flujo diastólico retrógrado o ausente en la arteria cerebral anterior, la aorta descendente o una fracción de acortamiento < 40%. Se recabaron datos de peso, edad gestacional, sexo, corioamnionitis, síndrome de dificultad respiratoria y administración de corticoesteroides prenatales. La PCR se midió con un límite de cuantificación de 0,06mg/dl.
Las variables se describieron como proporciones con intervalo de confianza del 95% (IC95%), medias (desviación estándar) o medianas (IC95%) de acuerdo con la fórmula m=[(n−tαn+1)/2] y m=[(n+tαn−1)/2], y las diferencias se evaluaron con las pruebas t de Student, U de Mann-Whitney o exacta de Fischer, según correspondiera. Se consideró significativo un valor de p < 0,05.
El estudio fue aprobado por el Comité Institucional de Ética y se guardó la confidencialidad de los datos personales.
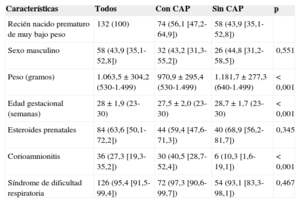
De 138 pacientes elegibles, cuatro se excluyeron por fallecimiento y dos por datos incompletos, por lo que quedaron 132. Ocurrieron 8/74 (10,8%; IC95%, 3,1-18,6) muertes en los pacientes con CAP y 4/58 (6,9%; IC95%, 1,9-16,7) en los pacientes sin CAP (p = 0,637). Las características clínicas basales y las diferencias entre ambos grupos pueden verse en la tabla, donde se observa que los pacientes con CAP presentaban un peso y una edad gestacional significativamente menores, y una frecuencia significativamente mayor de corioamnionitis.
Análisis bivariante de las características clínicas de los pacientes estudiados
| Características | Todos | Con CAP | Sin CAP | p |
|---|---|---|---|---|
| Recién nacido prematuro de muy bajo peso | 132 (100) | 74 (56,1 [47,2-64,9]) | 58 (43,9 [35,1-52,8]) | |
| Sexo masculino | 58 (43,9 [35,1-52,8]) | 32 (43,2 [31,3-55,2]) | 26 (44,8 [31,2-58,5]) | 0,551 |
| Peso (gramos) | 1.063,5 ± 304,2 (530-1.499) | 970,9 ± 295,4 (530-1.499) | 1.181,7 ± 277,3 (640-1.499) | < 0,001 |
| Edad gestacional (semanas) | 28 ± 1,9 (23-30) | 27,5 ± 2,0 (23-30) | 28,7 ± 1,7 (23-30) | < 0,001 |
| Esteroides prenatales | 84 (63,6 [50,1-72,2]) | 44 (59,4 [47,6-71,3]) | 40 (68,9 [56,2-81,7]) | 0,345 |
| Corioamnionitis | 36 (27,3 [19,3-35,2]) | 30 (40,5 [28,7-52,4]) | 6 (10,3 [1,6-19,1]) | < 0,001 |
| Síndrome de dificultad respiratoria | 126 (95,4 [91,5-99,4]) | 72 (97,3 [90,6-99,7]) | 54 (93,1 [83,3-98,1]) | 0,467 |
CAP: conducto arterioso permeable.
Los datos se expresan en n (%), intervalo de confianza del 95% o media ± desviación estándar [rango].
La PCRus al tercer día tuvo una mediana de 0,47mg/dl (IC95%, 0,36-0,58) en los pacientes con CAP, frente a 0,18mg/dl (IC95%, 0,05-0,31) en aquellos sin CAP (p < 0,001). Al séptimo día, el grupo con CAP presentó una PCRus mediana de 0,42mg/dl (IC95%, 0,31-0,53) y en el grupo sin CAP fue de 0,35mg/dl (IC95%, 0,22-0,48) (p=0,230).
Según nuestro conocimiento, este es el primer trabajo que investiga la relación existente entre la PCRus y el CAP, reportando que los pacientes con CAP tienen una PCRus significativamente más alta. Tal hallazgo sostendría la hipótesis de que los pacientes con CAP presentan una respuesta inflamatoria5 que incrementa la actividad de la ciclooxigenasa-1, eleva la producción de prostaglandina E2 y mantiene el CAP4. Cabe destacar que no se incluyeron pacientes con sepsis, lo que excluye la infección bacteriana como causa de la inflamación, de la que podría ser causa el intenso estrés oxidativo a que están sometidos estos pacientes6 o el remanente de una inflamación prenatal, pues la corioamnionitis se comportó en este estudio como un factor significativo para la persistencia del CAP, como también se ha señalado4.
Este estudio se ve limitado por su carácter retrospectivo y el tamaño muestral relativamente pequeño. Se trató de minimizar los sesgos de selección e información utilizando estrictas definiciones y puntos de corte. El tamaño muestral requerido para probar una diferencia de 0,30mg/dl de PCRus se calculó en 44 pacientes por grupo, lo que implica que la muestra estudiada tiene poder estadístico suficiente, aunque los resultados de este trabajo deberán ser confirmados por estudios prospectivos de mayor envergadura.