Palabras clave
GENERALIDADES
Hace 75 años, Saunders describió la tríada clínica de hipotensión arterial, presión venosa yugular elevada y campos pulmonares «limpios» en un paciente con necrosis extensa del ventrículo derecho (VD) y que involucraba mínimamente al ventrículo izquierdo (VI)1. En la actualidad, el diagnóstico de infarto agudo ventricular derecho (IAVD) se obtiene con el registro electrocardiográfico de las derivaciones unipolares torácicas derechas, su reconocimiento clínico es infravalorado y con frecuencia se subestima el requerimiento de un tratamiento específico, así como sus implicaciones pronósticas.
El IAVD no se consideraba una manifestación importante de los síndromes isquémicos coronarios agudos, debido en parte a que, en animales de experimentación, la isquemia aislada del VD no producía alteraciones significativas en la presión venosa sistémica ni en la presión arterial pulmonar2.
En estudios experimentales en perros se identificó el mecanismo fisiopatológico del gasto cardiaco disminuido después de ocluir la arteria coronaria derecha; se encontró una desproporción de la elevación de las presiones de llenado en las cavidades derechas, comparada con las presiones en las cavidades izquierdas, con un incremento en el tamaño del VD y una disminución en los diámetros del VI3,4.
La asociación del IAVD con el infarto de la pared inferior del VI se ha encontrado en el 10-50% de los pacientes, según los criterios de diagnóstico no invasivo, hemodinámico o post mórtem5,6.
El VD es una cámara en forma de luna creciente; su masa miocárdica es aproximadamente un sexto del miocardio ventricular izquierdo; desarrolla un cuarto del trabajo por latido del VI, debido a que los valores de la resistencia vascular pulmonar corresponden a una décima de la resistencia vascular sistémica7. Además, hay interdependencia entre los ventrículos, debido a que comparten el tabique interventricular y el pericardio que los envuelve, el gasto cardiaco es similar en ambos5,7.
La arteria coronaria derecha aporta predominantemente flujo sanguíneo al miocardio ventricular derecho; la arteria del cono irriga el tracto de salida; las ramas del margen agudo irrigan la pared posterior ventricular derecha. Según el patrón coronario dominante, la arteria descendente posterior puede irrigar en grado variable la pared posterior del VI. La arteria coronaria izquierda usualmente aporta poco flujo a la pared anterior del VD a través de pequeñas ramas de la arteria descendente anterior (fig. 1).
Fig. 1. Arteria coronaria derecha normal. Inicialmente da ramas a la aurícula derecha, la arteria del cono que irriga el tracto de salida del ventrículo derecho y la arteria del nodo sinusal. Las ramas ventriculares del margen agudo a la pared posterior. La arteria del nodo auriculoventricular. La descendente posterior da arterias perforantes septales que perfunden el segmento posterobasal del septo interventricular.
El flujo al miocardio auricular derecho procede de pequeñas ramas originadas en la porción proximal de la coronaria derecha; en ocasiones puede haber flujo suplementario procedente de ramas de la circunfleja izquierda.
INFARTO AURICULAR
El primer informe de infarto del miocardio de la aurícula derecha (AD) detectado en una autopsia fue efectuado por Clerc y Levy en 19258. En 1939, Langendorf9 demostró en un estudio necroscópico un infarto de la AD y, de forma retrospectiva, encontró alteraciones electrocardiográficas compatibles con una isquemia auricular. En 1942, Cushing10 publicó los datos clínicos y los hallazgos anatomopatológicos de 182 sujetos que fallecieron por infarto del miocardio ventricular. En el 17% se demostró un infarto auricular, 27 de la aurícula derecha y 4 de la izquierda. La presencia de trombosis mural auricular se evidenció en 26 de los 31 casos con infarto auricular.
En 1948, Söderstrom11 analizó 192 autopsias con trombosis auricular; en 47 casos (24%) encontró signos de infarto del miocardio auricular, que en casi la totalidad de la serie (46 casos) se localizó en la AD. Describió 2 tipos de infarto auricular, el tipo 1 o ventral, usualmente aislado y localizado en la orejuela o en sus porciones adyacentes, y el tipo 2 o dorsal, que habitualmente involucra una extensa zona auricular y se asocia con infartos biventriculares de localización posteroinferior.
Del 81 al 98% de los infartos auriculares se localizan en la AD, entre sus complicaciones están las arritmias y la tromboembolia pulmonar, también puede aparecer deterioro hemodinámico por la pérdida de la contribución auricular y en casos excepcionales puede producirse rotura parietal.
FISIOPATOLOGIA
El infarto inferior del VD ocurre por la obstrucción de la arteria coronaria derecha, proximal a las ramas del margen agudo. En pacientes con patrón coronario izquierdo dominante, ocasionalmente la oclusión de la arteria circunfleja puede producir un infarto ventricular derecho. Otra posibilidad, muy poco frecuente, es la producción de un infarto de la pared anterior del VD con la obstrucción proximal de la arteria descendente anterior. Sobre la base de la extensión anatómica de la necrosis del miocardio ventricular derecho (fig. 2), Isner y Roberts12 describieron una clasificación que incluye 4 grados: grado I cuando la necrosis abarca menos del 50% de la pared posterior del VD; grado II cuando el infarto afecta a más del 50% de la pared posterior del VD; grado III cuando la necrosis afecta a la pared posterior del VD y se extiende a menos del 50% del miocardio de la pared anterolateral, y grado IV cuando el infarto incluye la pared posterior y más del 50% de la pared anterolateral. En los 4 grupos de esta clasificación, el miocardio infartado incluye en mayor o menor grado la porción posterior del tabique interventricular.
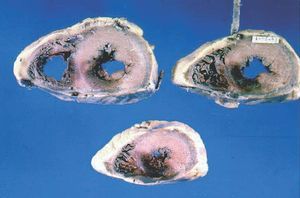
Fig. 2. Pieza anatomopatólogica que muestra infarto en la pared posterior del ventrículo izquierdo (basal, media y apical), con extensión a segmentos posteriores del ventrículo derecho (medial y apical).
De acuerdo con la clasificación descrita, en presencia de mayor masa ventricular derecha con necrosis, las alteraciones hemodinámicas serán mayores, al igual que los signos de infarto registrados con métodos de diagnóstico no invasivo. Esta clasificación no considera la extensión del proceso de isquemia o necrosis al miocardio de la pared auricular derecha, situación que no es infrecuente en los pacientes con infarto ventricular derecho, con deterioro hemodinámico importante y oclusión proximal de la arteria coronaria derecha.
Hay un grupo de pacientes en quienes, a pesar de haber oclusión completa de la arteria coronaria derecha, los infartos izquierdos no se acompañan de necrosis y disfunción ventricular derecha significativas. Esto se ha relacionado con diversos factores como: a) una menor demanda de oxígeno por el miocardio ventricular derecho; b) la relación de flujo coronario sistólico/diastólico es mucho mayor en las arterias que perfunden el VD13; c) mayor capacidad del VD para lograr la extracción de oxígeno en estados con estrés hemodinámico14; d) probable perfusión directa de la cavidad al miocardio ventricular derecho a través de las venas de Tebesio15, y e) presencia de una circulación coronaria colateral extensa16. A este respecto, se ha demostrado en estudios post mórtem que el 75% de las muestras con necrosis ventricular derecha tiene más del 75% de obstrucción de la arteria descendente anterior, lo cual indica que en la patogenia del infarto ventricular derecho puede estar involucrada la pérdida de suficiente circulación coronaria colateral de izquierda a derecha12,17. En pacientes con infarto inferior ventricular izquierdo y el antecedente de angina de pecho, se ha señalado el papel protector de la circulación colateral para explicar la baja incidencia de extensión del infarto al ventrículo derecho18.
Los pacientes con IAVD tienen disfunción ventricular derecha sistólica y diastólica. La disfunción sistólica se expresa por disminución del gasto cardiaco e hipotensión arterial; la disfunción diastólica, por elevación desproporcionada de las presiones de llenado del VD comparadas con las presiones del VI19-22. La disminución de la distensibilidad del VD provoca: a) elevación de la presión auricular derecha; b) incremento en la presión de llenado del VD durante la inspiración (signo de Kussmaul), y c) una morfología «no distensible» en la curva de presión auricular derecha, esta última caracterizada por ondas a y v iguales en amplitud (onda a disminuida), por un descenso de las ondas x e y. Estas anormalidades en las curvas de presión de las cavidades derechas no indican solamente una disminución en la distensibilidad diastólica del miocardio auricular y ventricular derechos, sino que también reflejan el efecto constrictivo del pericardio secundario a la distensión aguda del VD.
El criterio hemodinámico de IAVD fue establecido por López-Sendón et al23, quienes en 60 casos correlacionados los datos hemodinámicos con la presencia de necrosis ventricular derecha. La presión auricular derecha (PAD) > 10 mmHg y la relación PAD/presión capilar pulmonar > 0,86 indican IAVD con una sensibilidad del 82% y una especificidad del 97%. La baja sensibilidad de estos criterios se ha relacionado con la presencia de disfunción ventricular izquierda y su efecto sobre la presión capilar pulmonar. Los criterios hemodinámicos del IAVD pueden no estar presentes en pacientes con infarto inferior izquierdo y sólo hacerse evidentes después de la administración rápida de una carga de volumen (solución salina)24.
La elevación de las presiones en las cavidades derechas hasta igualar las izquierdas, no es privativa de IAVD. El diagnóstico diferencial incluye enfermedades que afectan predominantemente a la función diastólica, como el taponamiento cardiaco, la pericarditis constrictiva, las miocardiopatías restrictivas, o bien enfermedades que comprometen la función sistólica, como la hipertensión arterial pulmonar por tromboembolias25.
En estudios experimentales y en humanos26,27 se ha demostrado que el incremento en la contracción auricular derecha mejora el flujo de llenado ventricular derecho, la función sistólica ventricular y el gasto cardiaco. Por el contrario, la falta de contribución mecánica auricular derecha reduce el llenado ventricular y acentúa el efecto hemodinámico de la disfunción ventricular derecha. Es importante tener en cuenta que, en ausencia de isquemia del miocardio auricular derecho o de disincronía en la activación eléctrica auriculoventricular, el incremento en la contractilidad auricular derecha es un mecanismo compensatorio de la disfunción isquémica del VD.
CUADRO CLINICO Y EXPLORACION FISICA
En pacientes con infarto agudo de miocardio (IAM) de la pared inferior izquierda y extensión al VD es importante realizar un diagnóstico precoz, especialmente si hay hipotensión arterial o estado de choque. La identificación rápida del infarto ventricular derecho evitará el empleo de diuréticos o vasodilatadores. Los principales signos clínicos que acompañan al IAVD son: a) plétora yugular aumentada; b) falta de disminución de la presión venosa con la inspiración (signo de Kussmaul); c) hipotensión arterial; d) bradicardia o bloqueo auriculoventricular; e) insuficiencia tricuspídea; f) galope ventricular derecho (S3 y S4); g) pulso paradójico (descenso > 10 mmHg de la presión arterial con la inspiración). La presencia de plétora yugular aumentada y signo de Kussmaul como expresión de IAVD tiene una elevada sensibilidad (88%) y especificidad (100%)28. En pacientes con infarto inferior con o sin extensión al ventrículo derecho no es infrecuente que aparezcan hipotensión arterial y bradicardia, aparentemente mediadas por un reflejo cardioinhibidor (Bezold-Jarisch)29. Este reflejo cardioinhibidor se ha registrado después de reperfundir la arteria coronaria derecha con angioplastia30 o trombólisis31.
La presencia y la severidad de los signos físicos de IAVD dependerán de la magnitud de la disfunción ventricular derecha y de su dilatación; un infarto extenso se caracteriza por la aparición de signos de fallo cardiaco derecho severo, como hepatomegalia, hígado pulsátil, ascitis y edema periférico. Habitualmente, éstos no se observan en la fase aguda del infarto y su aparición en la segunda o tercera semanas de evolución señala una amplia necrosis del miocardio ventricular derecho con extensión al miocardio de la aurícula derecha.
ELECTROCARDIOGRAFIA
Infarto del VD
La elevación del segmento S-T > 1 mm en V3R y V4R es de gran utilidad para establecer el diagnóstico de IAVD. El supradesnivel del segmento S-T en V4R fue un signo muy específico de infarto ventricular derecho en 18 casos con confirmación post mórtem; los supervivientes con dicha alteración electrocardiográfica tuvieron mayor incidencia de hipotensión e insuficiencia cardiaca derecha que los pacientes con infarto inferior circunscrito al VI32.
La elevación del segmento S-T > 0,5 mm en la derivación V4R es indicativa de IAVD, con una sensibilidad del 83% y una especificidad del 77%33; cuando se considera que la elevación del segmento S-T es > 1 mm, estos porcentajes se incrementan. La elevación del segmento S-T en V3R y V4R puede ser transitoria y registrarse sólo en las primeras 24 o 48 h de evolución del infarto34.
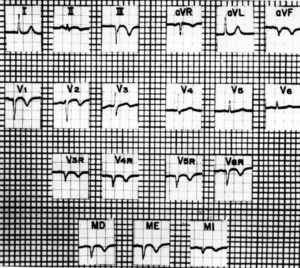
Medrano y De Micheli35-37 han estudiado con diseños experimentales en perros, así como en humanos, la utilidad del círculo torácico y de las derivaciones unipolares abdominales altas llamadas MD (hipocondrio derecho), ME (mesoepigastrio) y MI (hipocondrio izquierdo) en presencia de infarto del miocardio del VD (fig. 3). Al producir en el perro necrosis química (fenol) en la pared posterior del VD, registraron cambios en las derivaciones epicárdicas y torácicas relacionadas con la abolición de las fuerzas electromotrices originadas en dicha región. En las derivaciones DII, DIII, aVF, V3R a V5R, así como en las abdominales altas MD y ME, las morfologías electrocardiográficas encontradas fueron QS, Qr o rS, en lugar de RS, Rs o R.
Fig. 3. Electrocardiograma con derivaciones unipolares torácicas derechas y abdominales altas en el hipocondrio derecho (MD), en el epigastrio (ME) y en el hipocondrio izquierdo (MI), que pone de manifiesto signos de zona inactivable transmural en la cara diafragmática del ventrículo izquierdo: complejos QS en AVF y DIII. Indica la invasión de regiones posterolaterales del ventrículo derecho: complejos QS en las unipolares torácicas derechas de V6R hasta V3R y en las abdominales altas MD y ME. Las ondas T negativas de tipo primario en AVF, DII, DIII, de V6R a V2 y en las derivaciones abdominales altas, parecen deberse a isquemia subepicárdica o transmural extensa, que abarca regiones posteroinferiores izquierdas y posterolaterales derechas. Tomada de: Arch Inst Cardiol Mex. 1989;59:195-210.
Medrano y De Micheli38 también estudiaron experimentalmente el infarto de la pared libre anterior del VD y encontraron una disminución en el voltaje de la onda R, o complejos QS, en las derivaciones epicárdicas y torácicas derechas desde V5R hasta V2 y V3, con signos de lesión (segmento ST elevado) e isquemia (T negativa primaria) epicárdica.
El desarrollo de trastornos de la conducción intraventricular del tipo bloqueo de la rama derecha de haz de His (BRDHH) o de las subdivisiones izquierdas también ha sido estudiado con registros en el ECG y vectocardiograma después de producir necrosis química de las porciones anteriores del tabique interventricular y de la pared libre del ventrículo derecho39,40.
En relación con el diagnóstico electrocardiográfico de infarto posterior extendido al VD en el hombre, en la mayoría de los casos los signos de necrosis se reconocen en DIII, aVF y desde V3R o V4R hasta V6R, así como en MD y ME. Se registran complejos QR con R empastada en los casos con bloqueo derecho proximal o distal (ondas Q de 35-60 ms)41. Medrano y De Micheli42,43 han realizado descripciones muy útiles sobre las manifestaciones electrocardiográficas de los infartos biventriculares. Los infartos biventriculares posteriores son más frecuentes que los anteriores.
Los signos de zona inactivable de la pared libre del VD se observan con mayor frecuencia en los infartos biventriculares posteriores, mientras que son menos evidentes en los anteriores. En éstos, el voltaje del desnivel positivo del segmento ST es mayor en las unipolares torácicas derechas que en V2 y V3, lo que hace pensar en invasión de la cara anterior del VD.
Infarto de la aurícula derecha
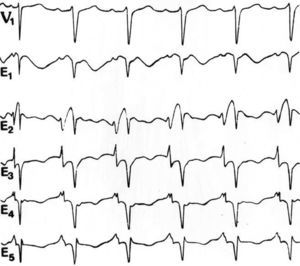
El interés por conocer las alteraciones electrocardiográficas del infarto auricular, especialmente de la onda P y el segmento ST-T auricular, tiene más de 65 años10; estos estudios cobraron mayor validez en años posteriores con el empleo de las derivaciones unipolares precordiales y de los miembros44. Medrano y De Micheli45-47 estudiaron perros con infarto auricular derecho producido con infiltración subepicárdica de alcohol; los cambios más significativos se observaron en las derivaciones torácicas derechas y a veces hasta V4-V5. El vector de lesión apunta hacia adelante elevando el segmento P-R en las derivaciones mencionadas y en las directas de aurícula derecha. Se registran ondas Qp o complejas en W. En casos aislados con sospecha de isquemia auricular derecha se han utilizado registros intraesofágicos para detectar cambios electrocardiográficos en la onda P y en el segmento ST auricular48 (fig. 4).
Fig. 4. Registros de un varón de 43 años, con 5 derivaciones unipolares intraesofágicas, desde E1 (la más craneal) hasta E5 (la más caudal), que se obtuvieron simultáneamente a la derivación precordial V1. Obsérvese el supradesnivel del segmento S-Ta en las derivaciones E1 y E2, lo que es indicativo de la existencia de lesión auricular derecha. Los registros se obtuvieron a la velocidad de 50 mm/s 1 cm = 10 mm. Tomada de: Arch Inst Cardiol Mex. 1992;62:277-88.
En relación con la presencia de arritmias ventriculares, hay estudios que indican su mayor incidencia en pacientes con infarto inferior biventricular49,50. También hay evidencia de que las arritmias ventriculares son más frecuentes en pacientes con fallo en el intento de reperfusión del miocardio biventricular51. El desarrollo de arritmias supraventriculares, incluida la fibrilación auricular, es más habitual en pacientes con disfunción isquémica del VD52; es posible que tengan relación con el desarrollo de isquemia o infarto auricular, con distensión de la cavidad auricular, o con incremento en la presión de la AD.
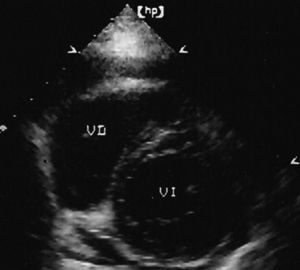
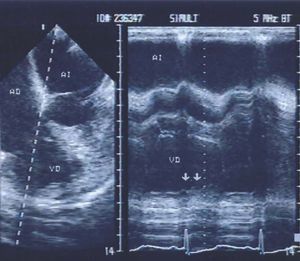
Fig. 5. Ecocardiograma paraesternal en el eje corto. Se observa el ventrículo derecho dilatado, con morfología de luna creciente. En las imágenes en tiempo real se demostró una disminución de la movilidad y/o falta de engrosamiento sistólico de las paredes comprometidas.
ECOCARDIOGRAFIA
Infarto del ventrículo derecho
La ecocardiografía es útil para mostrar la extensión del infarto al miocardio del VD; las imágenes que ofrecen mayor información son la paraesternal en el eje corto y la apical de las 4 cámaras. En la primera se observa al VD con morfología de luna creciente (fig. 5); en la segunda, la cavidad del VD normal tiende a ser triangular. Con estas imágenes es posible evaluar los diámetros de la cavidad ventricular derecha, así como la movilidad de sus paredes anterolateral, inferior y del tabique interventricular. La movilidad de las paredes inferior y lateral del VD también puede ser estudiada con imágenes subcostales.
En los pacientes con infarto del VD extenso y deterioro hemodinámico, los registros muestran dilatación de la cavidad y trastornos en la movilidad de sus paredes, habitualmente acinesia de la pared posteroinferior. La alteración en el movimiento del tabique interventricular puede ser en sístole (movimiento paradójico) o en diástole; esta última es indicativa de aumento en la presión ventricular derecha con inversión en el gradiente de presión transeptal53.
La demostración ecocardiográfica de disinergia parietal puede ser más sensible que los trastornos en la función hemodinámica para identificar el infarto ventricular derecho; sin embargo, las anormalidades en la movilidad parietal tienen baja especificidad, ya que puede haber disinergia segmentaria por isquemia sin que haya infarto del miocardio. Con el empleo de la ecocardiografía se corroboró que la extensión del infarto al VD tiene un amplio espectro, desde una pequeña zona hipocinética hasta la dilatación importante de la cavidad con una extensa zona de disinergia parietal.
En teoría, la repercusión hemodinámica del infarto ventricular derecho podría reconocerse a través del cálculo de los volúmenes ventriculares y de la fracción de eyección; esto no ha sido posible, ya que la morfología ventricular compleja ha limitado el empleo de fórmulas geométricas para calcular su volumen. No obstante, se han descrito algunos parámetros ecocardiográficos que tienen correlación con la fracción de eyección ventricular derecha obtenida en la ventriculografía con radionúclidos; entre estos parámetros ecocardiográficos se incluye la relación entre el tamaño telediastólico de ambos ventrículos, el descenso de la base ventricular derecha y el colapso inspiratorio de la vena cava inferior54,55.
En las imágenes apicales y subcostales se puede observar abombamiento del tabique interauricular hacia la izquierda; éste es un signo encontrado en infartos del VD muy extensos, o bien cuando el proceso isquémico se extiende a las paredes de la AD. Este signo ecocardiográfico indica mal pronóstico, ya que con frecuencia se asocia con hipotensión arterial, bloqueo auriculoventricular avanzado y mayor mortalidad56.
La fracción de eyección del VD se ha cuantificado en pacientes con IAM de la cara inferior, con y sin extensión al ventrículo derecho. La fórmula empleada ha sido el área de longitud de una pirámide, teniendo como referencia la fracción de eyección obtenida con radionúclidos (angiografía de equilibrio). La sensibilidad y la especificidad obtenidas para valores de la fracción de eyección < 30% fueron del 69 y el 97%57.
El estudio ecocardiográfico de la reperfusión miocárdica con ecorrealzadores, inyectados por vía venosa periférica o arterial coronaria después de angioplastia o trombólisis, se ha enfocado predominantemente al ventrículo izquierdo. Se han notificado comunicaciones aisladas de la utilidad de esta técnica para evaluar la perfusión miocárdica y la reserva contráctil (dobutamina) del VD después de una angioplastia coronaria postinfarto de miocardio58.
En pacientes con IAM del VD, la infusión intravenosa de dobutamina en dosis bajas (5-10 μg/kg/min) se ha empleado para detectar la viabilidad miocárdica después de un tratamiento de reperfusión; la mejoría significativa de la función global del VD posdobutamina representa la recuperación de un miocardio aturdido. Los criterios ecocardiográficos de viabilidad miocárdica del VD son: demostración de engrosamiento sistólico parietal de un segmento previamente acinético o la normalización del engrosamiento parietal en un segmento previamente hipocinético59.
Ecocardiografía Doppler
En presencia de infarto del VD, el estudio con Doppler del flujo en las cavidades derechas ofrece información relacionada con las alteraciones hemodinámicas. El análisis espectral del flujo de llenado del VD normalmente tiene 2 picos: el protodiastólico o de llenado rápido (onda E) y el telediastólico secundario a la contracción auricular (onda A). Cuando el proceso isquémico incluye la AD, su actividad mecánica disminuye o incluso puede desaparecer (necrosis auricular extensa); esto se traduce en una disminución o ausencia de la onda A. Es importante mencionar que hay otras condiciones en las que en el estudio con Doppler del flujo de llenado del VD sólo se observa la onda E; esto ocurre en pacientes con fibrilación auricular o en algunos trastornos en la conducción auriculoventricular.
Se ha descrito que en presencia de un infarto del VD muy extenso, el estudio con Doppler mostrar que los flujos de llenado y de expulsión ventricular son de muy baja velocidad y duran prácticamente todo el ciclo cardiaco. Este patrón de flujo, similar al de una vena, indica que el VD ha perdido la función de bomba y se comporta como un conducto pasivo60.
En la gran mayoría de los pacientes con infarto del VD, el estudio con Doppler demuestra regurgitación tricuspídea, la cual está relacionada con disfunción del aparato subvalvular y, en ocasiones, con dilatación anular. En pacientes con infarto inferior del VI se ha demostrado que, en presencia de regurgitación valvular pulmonar, el estudio con Doppler puede identificar a los que tienen extensión del infarto al VD61.
Con ecocardiografía Doppler a través del índice de Tei se puede evaluar de forma global la función sistólica y diastólica ventricular. Este índice se obtiene al sumar la duración de las fases de contracción (FCI) y de relajación (FRI) isovolumétricas ventriculares; el valor obtenido se divide entre el período expulsivo. Los diversos componentes de la fórmula se pueden cuantificar a través del registro con Doppler de los flujos de llenado y de expulsión del VD.
El valor normal del índice de Tei o índice de función miocárdica para el ventrículo derecho es de 0,25 ± 0,05; en pacientes con infarto inferior del VI, un índice de Tei > 0,30 indica la extensión del infarto al VD, con una sensibilidad del 82% y una especificidad del 95%62. La utilidad de este índice se anula en presencia de cardiopatía pulmonar, arritmias o disfunción ventricular izquierda importante. De igual manera, el índice de Tei, generalmente aumentado en los pacientes con infarto del miocardio ventricular derecho, puede seudonormalizarse cuando el infarto es muy extenso y la presión auricular derecha es > 15 mmHg. En estos pacientes con disfunción ventricular severa, la duración de la fase de contracción isovolumétrica puede ser normal, o aun muy breve, debido a que se igualan la presión diastólica del VD y de la arteria pulmonar63.
La disfunción diastólica isquémica del VD infartado reduce la distensibilidad miocárdica, con incremento en las presiones telediastólica ventricular y auricular derecha. En estas condiciones, cuando coexiste permeabilidad del foramen oval, la presión auricular derecha supera la presión auricular izquierda y se desarrolla un cortocircuito de derecha a izquierda arteriovenoso. La aparición de cianosis y de hipoxemia refractaria en un paciente con infarto del VD reciente obliga a considerar la presencia de un cortocircuito interauricular.
La confirmación de esta complicación se puede establecer con ecocardiografía Doppler, preferentemente con registros transesofágicos. Esta técnica permite, asimismo, diferenciar entre un foramen oval y un verdadero defecto septal, ayuda a elegir el tratamiento adecuado y, además, informa sobre la contractilidad de la AD. Laham et al64 informaron de una serie de 5 pacientes con cortocircuito arteriovenoso interauricular e infarto del miocardio del VD, 4 de ellos asociados a infarto inferior del VI y el otro a un infarto aislado ventricular derecho. En los 5 pacientes se confirmó la permeabilidad del foramen oval y en 2 casos el cortocircuito de derecha a izquierda se manifestó con un evento oclusivo cerebral por embolismo paradójico. El tratamiento de este cortocircuito interauricular puede ser farmacológico65, a través de un dispositivo oclusor percutáneo, o quirúrgico64.
Doppler tisular
Esta técnica ecocardiográfica cuantifica las velocidades miocárdicas y se ha utilizado para evaluar la función global de los ventrículos. La evaluación de la pared libre del VD se puede efectuar a partir de la imagen apical de las 4 cámaras; se recomienda que el miocardio en estudio se localice a 1 cm del anillo tricúspide, en dirección hacia el ápex ventricular. Con Doppler tisular, la velocidad miocárdica en sístole se registra como una curva positiva, secundaria al desplazamiento anular en dirección al ápex ventricular; en diástole, cuando el anillo tricuspídeo se desplaza del ápex hacia la base, se registran 2 curvas negativas protodiastólica y telediastólica.
En sujetos sanos, los valores de la velocidad del anillo tricúspide en sístole, protodiástole y telediástole son cercanos a 14,5, -14 y -16,5 cm/s; en pacientes con infarto inferior extendido al VD, los valores han sido de 10,3, -8,2 y -13,6 cm/s (p < 0,001)66. En pacientes con infarto inferior extendido al VD, otros autores han registrado con Doppler tisular velocidades del anillo tricúspide aún menores, especialmente de las velocidades sistólica y protodiastólica67,68.
En un estudio reciente, Dokainish et al69 corroboraron que las velocidades sistólica y protodiastólica del miocardio de la pared libre del VD permiten, en pacientes con infarto inferior, identificar la extensión al VD. Además, demostraron que la velocidad del miocardio en sístole < 8 cm/s puede predecir eventos adversos a un año (hospitalización o muerte) con una sensibilidad del 85% y una especificidad del 77% (área bajo la curva = 0,82; p < 0,001). Este parámetro de Doppler tisular es un predictor independiente asociado con obstrucción proximal de la arteria coronaria derecha69.
Con Doppler tisular y mediante el registro de la velocidad del movimiento del miocardio lateral al anillo tricuspídeo, es posible medir los intervalos sistólicos y diastólicos. De esta manera se puede cuantificar el índice de funcionamiento miocárdico o índice de Tei (descrito previamente), que valora la función ventricular global. En pacientes con infarto inferior extendido al ventrículo derecho y con obstrucción proximal de la arteria coronaria derecha, los valores del índice de Tei son > 0,7070.
Ecocardiografía transesofágica
En los pacientes con extensión del infarto al VD, la ecocardiografía transesofágica (ETE) es útil cuando hay expresión clínica de grave deterioro hemodinámico, se sospecha una isquemia o un infarto de la AD, o bien en presencia de una ventana acústica transtorácica inadecuada. El estudio se efectúa bajo sedación ligera del paciente, en la unidad de cuidados coronarios, con registro electrocardiográfico permanente y monitorización de la presión arterial y de la saturación periférica de oxígeno; su duración es aproximadamente de 15-20 min.
El ecocardiograma debe incluir registros transesofágicos y transgástricos. Con los primeros se debe evaluar la movilidad parietal segmentaria de ambos ventrículos, para lo que se utilizará la imagen de las 4 cámaras, así como del eje largo de cada ventrículo; a través de ellas es posible visualizar las diversas paredes ventriculares, excepto los segmentos apicales del VD.
El estudio transesofágico también debe incluir el análisis de la movilidad parietal de la AD, así como las características anatomofuncionales de las válvulas auriculoventriculares. El estudio se complementa con el análisis Doppler del flujo de llenado de ambos ventrículos y con registros en color se investiga la presencia de cortocircuito interauricular o regurgitación de las válvulas tricúspide y mitral.
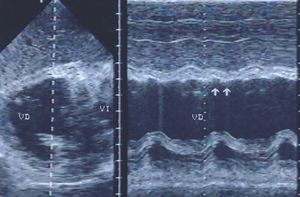
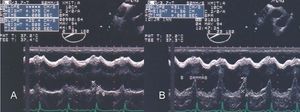
A través de las imágenes transgástricas (fig. 6) en diferentes planos se completa la evaluación de la movilidad parietal de los ventrículos; los segmentos apicales del VD se pueden visualizar selectivamente con el empleo de imágenes transgástricas a 110-130°°. Los registros transgástricos también ofrecen información completa del estado del aparato subvalvular mitral.
Fig. 6. Ecocardiografía transgástrica en un paciente con infarto posteroinferior del ventrículo izquierdo con extensión al ventrículo derecho. Con los registros en tiempo real y modo M se observó acinesia de la pared posterior del ventrículo derecho (flechas).
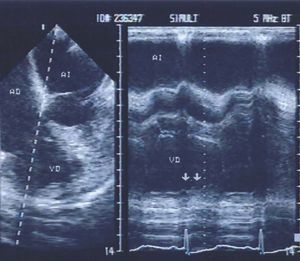
En la primera serie de 11 pacientes con infarto agudo de la pared inferior de ambos ventrículos que estudiamos con ecocardiografía encontramos que con registros transesofágicos y transgástricos se detectaron zonas de disinergia ventricular derecha en los 11 casos (fig. 7); en cambio, sólo en 6 pacientes se demostraron con registros transtorácicos. Además, en 2 pacientes, sólo la ETE mostró que el proceso isquémico involucraba la AD71.
Fig. 7. Ecocardiografía transesofágica de 4 cámaras en un paciente con infarto posteroinferior del ventrículo izquierdo con extensión a las paredes del ventrículo derecho. Los registros en tiempo real y de modo M mostraron disinergia de la pared ventricular derecha (flechas).
En otro estudio evaluamos con ETE a 38 pacientes con IAM extendido al VD. En este grupo se cuantificó el índice de movilidad parietal de ambos ventrículos; en los 38 pacientes se observaron alteraciones en la movilidad de la pared posteroinferior, y en algunos la disinergia se extendía a otras paredes de los ventrículos. Al comparar la evolución intrahospitalaria y extrahospitalaria (seguimiento de 6-60 meses) con el índice de movilidad parietal de ambos ventrículos se observó que los 6 pacientes con clase funcional III-IV de la New York Heart Association (NYHA) tenían los peores índices de movilidad; 4 de ellos fallecieron. En cambio, de los 32 pacientes en clase funcional I-II, 26 (81%) tuvieron mejores índices de movilidad; en este subgrupo no hubo muertes. Lo anterior es indicativo de que, en presencia de infarto biventricular, el índice de movilidad parietal obtenido con ETE se relaciona con la extensión del daño miocárdico, con la mortalidad hospitalaria y con la clase funcional al egresar del hospital72.
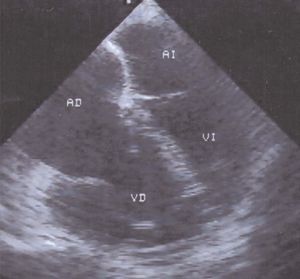
De igual manera, la simple relación de los diámetros ventriculares (VD/VI), obtenida en la imagen transesofágica de las 4 cámaras, identifica a los pacientes con mayor repercusión hemodinámica del infarto ventricular derecho (fig. 8). En 30 pacientes con una relación VD/VI de 1 o menor, la repercusión hemodinámica del infarto fue ligera y en la fase extrahospitalaria se mantuvieron con clase funcional I-II. En los 8 pacientes restantes, la relación VD/VI fue mayor de 1; 6 de ellos se encontraron en clase funcional III-IV y 4 fallecieron72.
Fig. 8. Ecocardiografía transesofágica de 4 cámaras en un paciente con infarto posteroinferior del ventrículo izquierdo, con extensión al ventrículo derecho. Muestra dilatación de las cavidades derechas, el septo interauricular se «abomba» hacia la izquierda. El ventrículo derecho está dilatado y sus dimensiones son mayores que las del ventrículo izquierdo.
La ETE no sólo ayuda a la identificación del proceso isquémico en la aurícula y el ventrículo derechos; también permite evaluar los diversos tratamientos efectuados en la fase temprana del infarto y ayuda a diferenciar el miocardio con daño irreversible del miocardio aturdido.
Hay indicios de que la ecocardiografía con dobutamina puede mostrar la disfunción miocárdica postisquémica reversible; sobre esta base, estudiamos a 9 pacientes con IAM de localización inferior extendido al VD. Con el propósito de identificar el miocardio viable postisquémico, se les efectuó una ETE durante la infusión de dobutamina en dosis bajas de 5 y 10 μg/kg/ min; los resultados se compararon con los obtenidos en el estudio cardiaco nuclear de perfusión miocárdica (sestambi-SPECT). Sobre la base de los cambios producidos por la dobutamina en el movimiento parietal y en su engrosamiento sistólico, el estudio ecocardiográfico proporcionó información comparable con la obtenida en el estudio cardiaco nuclear, específicamente en la identificación de viabilidad miocárdica de ambos ventrículos después de un infarto de miocardio73.
Infarto de la aurícula derecha
Este diagnóstico es difícil de establecer con la ecocardiografía transtorácica convencional, debido a la dificultad para evaluar la movilidad de las paredes auriculares. En los últimos años, de acuerdo con nuestra experiencia, la ETE se ha transformado en el método diagnóstico de elección para confirmar su presencia.
Los registros transesofágicos (fig. 9) permiten establecer el diagnóstico de infarto de miocardio auricular derecho según los siguientes datos: a) acinesia de la pared auricular derecha, en presencia de contracción de la AI; b) efecto de contraste espontáneo en la cavidad auricular derecha; c) trombosis en el sitio de la acinesia parietal auricular; d) ausencia de onda A en la curva de flujo transvalvular tricuspídeo, con onda A presente en el flujo mitral74. Cuando los signos mencionados se detectan en un paciente con infarto del miocardio ventricular, el diagnóstico de isquemia o infarto auricular derecho es válido.
Fig. 9. Ecocardiografía transesofágica de 4 cámaras en un paciente con infarto posteroinferior del ventrículo izquierdo, con extensión al ventrículo y la aurícula derechos. El registro de modo M orientado muestra acinesia de la pared auricular derecha (flechas). Hay efecto de contraste espontáneo en la cavidad, así como un pequeño derrame pericárdico
Es importante mencionar que, como ocurre con el miocardio ventricular, la evidencia ecocardiográfica de hipocinesia y acinesia no necesariamente significa isquemia o necrosis miocárdica. En pacientes con infarto de miocardio en evolución y evidencia electrocardiográfica de paros sinusales, hemos observado ausencia de movimiento en las paredes de ambas aurículas; la administración de atropina restaura el ritmo sinusal y normaliza el movimiento parietal auricular. Otros pacientes con trastornos en la conducción auriculoventricular pueden tener alteraciones en el movimiento parietal, sin que haya infarto auricular. Con ETE es posible estudiar con detalle la contracción normal de la pared auricular; ésta se caracteriza por aumento del grosor y excursión de su endocardio hacia el centro de la cavidad (fig. 10A). La estimulación farmacológica del miocardio auricular con dobutamina también aumenta la amplitud de la contracción de la pared (fig. 10B).
Fig. 10. A: ecocardiografía transesofágica a 30°, orientada para visualizar el septo interauricular y la pared auricular derecha. Estudio realizado en un sujeto con corazón normal. Muestra la amplitud de contracción normal de la pared auricular (onda A). B: respuesta normal a la estimulación con dobutamina intravenosa en dosis de 5 gammas; se demuestra una movilidad muy amplia de la pared auricular derecha.
En los pacientes con infarto posterior del VD o de ambos ventrículos, si la ETE muestra alteraciones en el movimiento de la AD, se debe aclarar el origen de la disinergia parietal; la alteración en la contractilidad puede ser secundaria a isquemia transitoria en un miocardio auricular aturdido (stunned), o puede ser expresión de un infarto sin miocardio viable; su diferenciación es posible con ecocardiografía y estimulación farmacológica con dobutamina. El incremento de la movilidad auricular con dobutamina en una zona previamente hipocinética es indicativo de miocardio aturdido; en estos casos, la angiografía coronaria demuestra que la circulación auricular derecha no está completamente interrumpida. En cambio, en presencia de necrosis uricular, la acinesia parietal no se modifica con dobutamina y en la angiografía coronaria no se identifican ramas auriculares derechas75.
La utilidad de la ETE para evidenciar isquemia y necrosis auricular derecha, así como el efecto inotrópico positivo de la dobutamina sobre el miocardio auricular derecho, también ha sido demostrada mediante modelos experimentales en perros76.
La ETE es útil para evaluar las implicaciones pronósticas de la terapia de reperfusión (trombólisis y/o angioplastia coronaria) en pacientes con infarto de la pared inferior de ambos ventrículos, con y sin extensión del proceso isquémico a la AD77. En este estudio se demostró que la evidencia ecocardiográfica de isquemia auricular derecha se correlaciona con índices mayores de anormalidad en el movimiento ventricular derecho, dilatación de la cavidad ventricular derecha y obstrucción proximal de la arteria coronaria derecha, así como mayor incidencia de arritmias, bloqueo auriculoventricular y muerte. El tratamiento rápido con trombólisis o angioplastia se asoció con menor alteración en la movilidad parietal y menor dilatación del VD77.
CARDIOLOGIA NUCLEAR
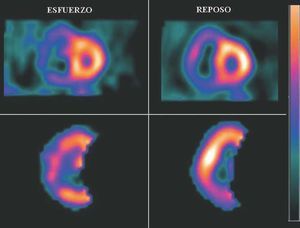
El estudio centelleográfico de la perfusión miocárdica con SPECT (tomografía computarizada por emisión de fotón único) o con gated-SPECT sincronizada al ECG, es de gran utilidad para el diagnóstico de isquemia o IAM, en la estratificación de su riesgo y pronóstico, así como en el reconocimiento de la extensión del proceso isquémico al miocardio del VD (fig. 11).
Fig. 11. Estudio de cardiología nuclear con tomografía computarizada con fotón único marcada con sestamibi (SPECT-sestamibi) en un paciente que presentó infarto pequeño del ventrículo izquierdo con extensión al ventrículo derecho. Tanto en reposo como con esfuerzo se observa dilatación importante del ventrículo derecho; en reposo hay hipoperfusión de su pared inferior; con esfuerzo, la zona de hipoperfusión se extiende hacia la pared lateral, lo que es indicativo de isquemia en esa localización.
En el empleo de estas técnicas se han diseñado protocolos con diversos radiotrazadores, los más empleados son 99mTc-sestamibi en reposo, complementado con ejercicio o estrés farmacológico, o protocolo Dual, que incluye talio-201 en reposo y 99mTc-sestamibi en la fase farmacológica o de ejercicio.
El estudio con SPECT permite evaluar selectivamente el VD, lo cual incrementa la concentración miocárdica del radiofármaco y facilita el análisis de la perfusión y de la movilidad de las paredes anterior, lateral e inferior, así como de los segmentos inferolateral y anterolateral. Se puede precisar la extensión del miocardio en riesgo, así como los segmentos parietales con viabilidad. Con la gated-SPECT, además de observar las alteraciones en la movilidad regional o generalizada, se demuestra el engrosamiento sistólico.
La cuantificación de los volúmenes telediastólico, telesistólico y de la fracción de eyección del ventrículo derecho a través de la cardiología nuclear ofrece ventajas en relación con otras técnicas como la ecocardiografía, ya que no depende de la geometría ventricular y se basa en el recuento y la densidad del radionúclido. Con el empleo de las técnicas de primer paso o de equilibrio, se ha demostrado en pacientes con infarto inferior del VI que la incidencia de disfunción isquémica del VD ocurre en el 40-50% de ellos78,79. Existen causas diferentes a un proceso isquémico del VD que pueden disminuir su fracción de eyección, entre ellas la enfermedad pulmonar obstructiva crónica, las embolias pulmonares y las lesiones valvulares con hipertensión arterial pulmonar.
En un trabajo prospectivo, la ventriculografía con radionúclidos identificó el infarto de miocardio del VD hemodinámicamente significativo sobre la base de una fracción de eyección < 40%, asociada con anormalidades segmentarias en su movilidad parietal (acinesia o discinesia); la sensibilidad obtenida fue del 92% y la especificidad, del 82%24. En la tabla 1 se comparan estos resultados con los de otras técnicas diagnósticas.
Otra modalidad empleada en el diagnóstico de infarto del miocardio del VD es la SPECT dual con 201Ta y 99Tc. Con esta técnica efectuada de 2 a 9 días postinfarto se encontró una menor prevalencia del proceso isquémico ventricular derecho en pacientes con tratamiento trombolítico precoz, a diferencia de los que no recibieron el trombolítico (el 26,7 frente al 68,4%; p < 0,01)80.
En otro grupo de 30 pacientes81 con infarto inferior, con el empleo de 201Ta e 111I antimiosina se demostró la presencia de Indio antimiosina en 14 pacientes (47%); en 13 de ellos coexistían defectos de perfusión demostrados con el 201Ta.
Finalmente, en 33 pacientes con infarto inferior, el empleo de SPECT marcada con sestamibi con ejercicio físico de bajo grado, aplicada 6-14 días después del infarto de miocardio, permitió detectar defectos de perfusión en el VD en 10 casos (30%); en la fase de reposo, la mitad de estos defectos de reperfusión no existía o eran menores82.
RESONANCIA MAGNÉTICA
El estudio del VD se puede efectuar con el paciente en reposo, durante ejercicio o con estimulación farmacológica. Los estudios en tiempo real requieren la sincronización del ECG. La valoración de la anatomía ventricular puede efectuarse con la técnica secuencial spin-echo; la evaluación funcional se realiza con cinerresonancia (gradient-echo). El estudio de la función sistólica se ha efectuado preferentemente con imágenes en el eje corto o plano transversal; se debe recordar que el verdadero eje corto del VD tiene una orientación diferente del eje corto ventricular izquierdo.
Hay diversos protocolos en el estudio del VD que incluyen la adquisición de imágenes en los ejes largo y corto de los ventrículos, así como en los registros de las 4 cámaras; el análisis diagnóstico de las imágenes debe incluir el empleo de la regla de Simpson con planimetría manual o semiautomática de los bordes endocárdicos de cada ventrículo durante la telediástole y la telesístole, así como del borde epicárdico en telediástole; de esta manera se cuantifican los volúmenes ventriculares y es posible calcular el volumen/latido, la fracción de eyección y la masa del VD83,84.
La evaluación de la función sistólica de cada uno de los segmentos parietales del VD se puede obtener con resonancia magnética (RM) (CMR tagging). Con esta técnica es posible cuantificar el acortamiento porcentual segmentario y su análisis vectorial permite precisar la trayectoria del miocardio de la pared libre ventricular durante la sístole; se ha demostrado que se dirige hacia la vía de salida ventricular y el tabique interventricular; el acortamiento porcentual es mayor en los segmentos apicales y menor en los basales85. La reconstrucción bidimensional obtenida a través de esta técnica mostró que el VD, además de su contracción circunferencial, tiene un ligero movimiento giratorio86.
En el estudio de la perfusión miocárdica con RM se emplea el mismo concepto utilizado en cardiología nuclear, en la ecocardiografía con contraste y en la densitometría con rayos X, que consiste en administrar un «trazador» y detectar su tránsito y distribución a través del corazón. Las técnicas con inyección de un agente exógeno son las más empleadas; hay otras técnicas con mecanismos de contraste endógenos.
Los estudios de RM de primer paso ofrecen resolución espacial y temporal de la perfusión miocárdica, lo cual los ha convertido en el método no invasivo de elección. Debido a que la resolución espacial de la RM es de 2 mm o menor, es posible identificar isquemia limitada al subendocardio, región con una mayor susceptibilidad a la isquemia y la necrosis.
En relación con el estudio de RM con contraste y refuerzo tardío de la señal, es útil no solamente para identificar la viabilidad miocárdica; también ayuda a reconocer si la isquemia miocárdica es transmural o subendocárdica. Sin embargo, su registro no es específico de infarto del miocardio, ya que se obtienen imágenes parecidas en procesos inflamatorios del corazón como la sarcoidosis o la fibrosis endomiocárdica, y también en la miocardiopatía hipertrófica; la diferencia es que en estas anormalidades miocárdicas diferentes del infarto del miocardio isquémico, el reforzamiento tardío detectado en la RM, no afectan al subendocardio87.
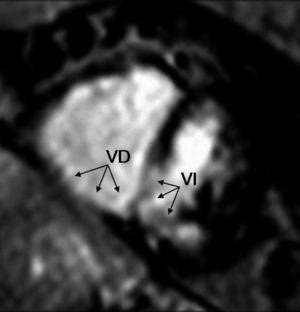
El diagnóstico de infarto del miocardio del VD con RM y gadolinio se puede establecer con las mismas sensibilidad y especificidad que con el empleo del protocolo DUAL SPECT de cardiología nuclear e incluso con menor tiempo en la adquisición de las imágenes88,89 (fig. 12).
Fig. 12. Estudio de resonancia magnética en un paciente con infarto transmuraterobasal del ventrículo izquierdo, con extensión a los segmentos basales del ventrículo derecho (flechas). Se observa dilatación del VD, así como hipoperfusión de la pared inferior de ambos ventrículos y de la porción posteroinferior del tabique interventricular.
En pacientes con infarto del VD no reciente, el estudio de RM ha mostrado ser de utilidad para cuantificar los volúmenes y la fracción de eyección ventricular derecha, y los resultados obtenidos han sido similares a los recabados por termodilución mediante catéteres de Swan-Ganz90.
En pacientes con infarto de la pared inferior del VI, los estudios con RM (spin-echo) muestran los cambios secundarios a la remodelación postinfarto, los cuales, debido a la interdependencia ventricular, afectan también al VD (disfunción diastólica) y a la aurícula derecha (aumento en los volúmenes y disminución en la fracción de vaciamiento); la remodelación inversa de los ventrículos también se puede evidenciar con RM después de un tratamiento de reperfusión miocárdica exitoso91,92. La fase tardía de la remodelación ventricular derecha, es decir, el desarrollo de aneurisma postinfarto, también se ha diagnosticado con RM93.
PRONOSTICO
La evolución del paciente con infarto del VD está relacionada con la extensión de la necrosis ventricular izquierda; la mortalidad temprana puede asociarse con complicaciones mecánicas o eléctricas de la disfunción ventricular izquierda94. Sin embargo, también se ha informado de múltiples pacientes que fallecieron por un infarto del VD con importante repercusión hemodinámica y en los que tanto la circulación coronaria izquierda como la función sistólica del ventrículo izquierdo eran normales.
Algunos estudios demuestran la importancia de las curvas de presión de la AD en el pronóstico inicial del infarto del VD27. La presencia de ondas A prominentes se ha relacionado con un mejor pronóstico; en cambio, cuando la onda A está disminuida, el pronóstico es sombrío y el angiograma coronario muestra obstrucciones proximales de las arterias coronaria derecha o circunfleja que comprometen el flujo miocárdico de la AD.
De acuerdo con nuestros estudios con ecocardiografía, la expresión de ondas A prominentes en la AD es la hipercinesia de la pared libre de la aurícula; este incremento en la actividad mecánica auricular intenta compensar la disfunción isquémica sistólica y diastólica del VD. Por el contrario, la onda A disminuida o ausente expresa la falta de actividad mecánica auricular, secundaria a isquemia o infarto de la AD75.
Los pacientes con infarto inferior del VI y extensión del proceso isquémico al VD y a la AD tienen un pronóstico sombrío, ya que el tiempo de hospitalización es mayor, así como las arritmias supraventriculares y ventriculares, el bloqueo auriculoventricular completo y la mortalidad77.
El pronóstico a medio y largo plazo es, en general, bueno cuando la extensión del infarto inferior se limita a porciones del VD y la fase de hospitalización transcurre sin complicaciones serias. En otro pequeño grupo de pacientes, la extensión del proceso isquémico al VD produce mayor morbimortalidad por disfunción ventricular y disminución del gasto cardiaco. Es precisamente en estos pacientes en los que el tratamiento trombolítico o la angioplastia coronaria primaria reducen las complicaciones durante la hospitalización y determinan un pronóstico a largo plazo excelente; esta buena evolución es independiente del tipo de reperfusión miocárdica empleada y del grado de extensión del infarto al VD95.
Los pacientes con choque cardiogénico secundario a infarto de miocardio predominantemente del VD tienen una mortalidad hospitalaria elevada (53,1%), similar a la de los pacientes con infarto del miocardio predominantemente del VI (60,8%)96. En este grupo de pacientes con choque cardiogénico se ha observado que, una vez superada la etapa de hospitalización, la presencia de dilatación ventricular derecha (relación de área telediastólica VI/VD < 2) identifica a un subgrupo de pacientes con infarto inferior, con obstrucción habitualmente única de la coronaria derecha y que tienen mayor supervivencia a 1 año (el 70 frente al 34%)97.
En un estudio de 302 pacientes con IAM ventricular derecho, divididos en 3 grupos de acuerdo con la presencia de disfunción ventricular derecha o de choque cardiogénico (36 pacientes), se identificó que en el grupo con choque cardiogénico, la angioplastia coronaria primaria reduce la mortalidad del 89,5 al 58%98.
TRATAMIENTO
Se basa en 4 puntos: a) mantener la precarga; b) disminuir la poscarga; c) soporte inotrópico al VD disfuncionante, y d) revascularización temprana (tabla 2). El tratamiento del paciente con infarto del miocardio extendido al VD ha incluido cargas de volumen; este tratamiento con infusión de líquidos se debe limitar a los pacientes con bajo volumen intravascular. La administración de 300-600 ml de solución salina en 10-15 min puede incrementar la presión arterial y el índice cardiaco; la monitorización invasiva (Swan-Ganz) o no invasiva (ecocardiografía Doppler) de las presiones intracavitarias y pulmonares, así como del gasto cardiaco, ayudará a realizar una indicación adecuada de los líquidos parenterales.
En el tratamiento con fármacos inotrópicos se ha incluido preferentemente a la dobutamina, la cual mantiene la precarga y aumenta la función sistólica, hecho que se traduce en incremento de la movilidad ventricular derecha y del volumen/latido. Es necesario tener en mente que dosis excesivas de inotrópicos pueden provocar isquemia al incrementar la pérdida en el balance demanda-aporte de oxígeno miocárdico por incremento de la frecuencia cardiaca y la contractilidad. En algunos pacientes con deterioro hemodinámico importante se puede emplear dopamina, la cual tiene mayor efecto alfaconstrictivo.
El tratamiento de reperfusión miocárdica con agentes trombolíticos o con angioplastia coronaria en pacientes con infarto del VD ha mostrado que puede disminuir las complicaciones en la etapa inicial de hospitalización, así como la mortalidad (tabla 2). Las publicaciones relacionadas con este tratamiento han incluido a pacientes con obstrucciones en varias arterias coronarias, así como infarto previo en otras paredes miocárdicas; por lo anterior, en estos pacientes no puede precisarse el beneficio potencial de la reperfusión de la arteria causante del infarto.
Nuestro grupo diseñó un estudio para evaluar a corto y largo plazo los efectos de la reperfusión temprana en 122 pacientes con obstrucción única de la arteria coronaria derecha e infarto de miocardio inferior con y sin extensión al VD (52 y 70 pacientes, respectivamente). Todos los pacientes recibieron tratamiento de reperfusión con angioplastia coronaria primaria, o con trombólisis seguida de angioplastia electiva. En 16 de los 122 pacientes (el 8%; 7 sin infarto y 9 con infarto del VD) se detectó una oclusión persistente de la arteria causante del infarto; al comparar este subgrupo con los pacientes con arteria permeable se encon tró una mayor incidencia de arritmias ventriculares, supraventriculares y de bloqueo auriculoventricular. En el seguimiento clínico de 8 a 36 meses, la evolución de los 118 supervivientes fue satisfactoria, excepto en un paciente con infarto de VD y rotura del tabique interventricular, que murió un año después; los 117 restantes se encontraron en clase funcional I95. De acuerdo con estos resultados, en pacientes con infarto de miocardio inferior con y sin extensión al VD, la reperfusión aguda con trombólisis o angioplastia primaria es el tratamiento de elección para disminuir las complicaciones en la fase de hospitalización y mejorar el pronóstico a medio y largo plazo.
Los pacientes con infarto de VD frecuentemente presentan trastornos en la conducción auriculoventricular y/o hipotensión arterial persistente; su tratamiento con marcapasos secuencial tiene un efecto beneficioso en la contracción auricular al incrementar el llenado ventricular y el volumen/latido99. En este tipo de pacientes es muy probable que el proceso isquémico se haya extendido al miocardio auricular derecho.
El tratamiento del choque cardiogénico por infarto ventricular derecho con dobutamina y vasodilatadores puede tener efectos limitados por la presencia de arritmias, vasodilatación sistémica e hipotensión arterial. En presencia de permeabilidad del foramen oval se puede provocar hipoxemia secundaria al cortocircuito de la AD a la izquierda; esta hipoxemia es resistente a la terapia convencional con oxígeno suplementario.
En cambio, la reducción de la poscarga del VD insuficiente con un vasodilatador pulmonar selectivo puede mejorar la función cardiaca sin producir vasodilatación sistémica e hipotensión arterial.
La inhalación de óxido nítrico produce relajación de las células del músculo liso; esta disminución en el tono vascular pulmonar se ha observado en pacientes con diversas formas de hipertensión arterial pulmonar (primaria o secundaria). De igual manera, en un modelo experimental de infarto de VD en cerdos se ha demostrado la reducción de la poscarga con la inhalación de óxido nítrico100.
En un estudio reciente efectuado en 13 humanos con infarto del miocardio ventricular derecho y choque cardiogénico se identificó que el tratamiento con óxido nítrico inhalado disminuye la presión media en la AD, la presión media en la arteria pulmonar y la resistencia vascular pulmonar; asimismo, incrementa el índice cardiaco y el índice de volumen/latido. En esta investigación se corroboró la ausencia de efectos del óxido nítrico sobre las presiones capilar pulmonar y arterial sistémica; otro efecto del óxido nítrico fue la reducción del cortocircuito arteriovenoso a través del foramen oval101. Los resultados mencionados demuestran el efecto beneficioso del óxido nítrico inhalado en el tratamiento del choque cardiogénico secundario a infarto de VD.
En presencia de disfunción ventricular derecha grave, secundaria a infarto de miocardio y que no responde a tratamiento médico, se debe considerar la colocación de un balón de contrapulsación aórtica o, aún mejor, un sistema de soporte mecánico ventricular derecho. Este dispositivo puede mejorar la función ventricular derecha deteriorada y puede servir como tratamiento intermedio (72-96 h) antes de efectuar la corrección quirúrgica de las obstrucciones coronarias101.
Con el propósito de mejorar la precarga y la función ventricular izquierda, así como de descomprimir el VD, en pacientes con choque cardiogénico refractario postinfarto del VD se ha propuesto efectuar una septostomía percutánea del tabique interauricular. La punción transeptal auricular (aguja de Brockenbrough) puede facilitarse con la guía de una ETE; el propósito de este procedimiento es crear una comunicación interauricular amplia con cortocircuito de derecha a izquierda. En estudios de casos aislados, con este procedimiento se ha registrado incrementos en la presión arterial sistólica y en el índice cardiaco, secundarios al aumento de llenado del VI; de igual manera, se ha observado con registros ecocardiográficos la recuperación funcional del VD y la ausencia de cortocircuito interauricular residual102.
Correspondencia: Dr. J. Vargas-Barrón.
Departamento de Ecocardiografía. Instituto Nacional de Cardiología Ignacio Chávez.
Juan Badiano, 1 Col. Sección XVI. 14080 Tlalpan. México DF. México.
Correo electrónico: eco_vargas@terra.com.mx