La disfunción miocárdica contribuye a la mortalidad precoz (24-72 horas) de los supervivientes de parada cardiaca (PC). Actualmente, la decisión de implantar un dispositivo de soporte circulatorio en este contexto se toma con información limitada acerca del potencial de recuperación neurológica (PRN) del paciente, lo que en muchas ocasiones termina en infratratamiento. Por tanto, requerimos de herramientas accesibles y fiables que añadan información sobre el PRN y ayuden a establecer planes individualizados de escalada terapéutica.
MétodosSe recogieron valores de índice biespectral (BIS) y tasa de supresión (TS) en supervivientes de una PC sometidos a control de la temperatura corporal. La función neurológica se evaluó con la escala Cerebral Performance Category (CPC).
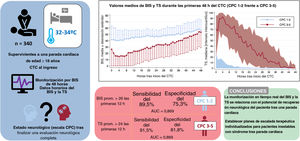
ResultadosSe incluyeron 340 pacientes. En la primera evaluación neurológica completa, 211 (62,1%) alcanzaron buen pronóstico (CPC 1-2). Los valores de BIS fueron significativamente mayores y los de TS menores, en pacientes con CPC 1-2. Un BIS promedio> 26 en las primeras 12 horas predijo buena evolución neurológica (sensibilidad 89,5%; especificidad 75,8%; AUC=0,869), mientras que una TS promedio> 24 en las primeras 12 horas predijo mala evolución o CPC 3-5 (sensibilidad 91,5%; especificidad 81,8%; AUC=0,906). Los valores horarios de BIS/TS mostraron buena capacidad predictiva (AUC> 0,85) desde la 2.a hora para TS y 4.a para BIS.
ConclusionesEl BIS/TS permiten estimar el PRN tras una PC. Este hallazgo puede contribuir a crear conciencia con respecto a evitar la limitación de escalada terapéutica en pacientes potencialmente recuperables.
Palabras clave
A pesar de los considerables esfuerzos para mejorar la respuesta de los supervivientes a una parada cardiorrespiratoria (PC), tales como aumentar la conciencación de la población, mejorar la calidad y el momento de las maniobras iniciales de reanimación e implementar un control de la temperatura corporal, la mortalidad de los pacientes ingresados tras una reanimación satisfactoria sigue siendo muy alta y se debe principalmente a una encefalopatía hipóxico-isquémica grave.
Otro factor importante que contribuye a una baja tasa de supervivencia de los pacientes que han sufrido una PC es la disfunción miocárdica posterior a la parada cardiaca1–5. Esta entidad clínica se ha definido como una disfunción generalizada y transitoria que empieza inmediatamente después de la PC, es máxima a las 7-8 h de recuperarse la circulación espontánea (RCE) y remite por completo en las 48-72 h siguientes. Cuando se establece, puede inducir un colapso circulatorio que requiere reconocimiento inmediato y a veces asistencia mecánica avanzada2,6,7. Por consiguiente, los médicos se enfrentan a decisiones que tienen que ver con la escalada terapéutica, que se debería sopesar con el potencial de recuperación neurológica (PRN) del paciente, que a su vez se basa en información más bien escasa. Así pues, según los factores tradicionales de predicción de la supervivencia tras una PC (ritmo inicial, pH o tiempo transcurrido hasta la RCE) y la exploración física, los pacientes se clasifican en una categoría de PRN buena o mala, y a muchos de ellos se les niega de manera inconsciente la posibilidad de un tratamiento avanzado. Es entonces cuando los instrumentos más accesibles y fiables adquieren importancia, ya que podrían añadir datos objetivos para los planes de escalada terapéutica individualizados.
La guía vigente recomienda un enfoque multimodal para el pronóstico neurológico que incluye exploración física diaria, biomarcadores (enolasa neuronal específica, S-100), técnicas de diagnóstico por la imagen (tomografía computarizada o resonancia magnética) y pruebas neurofisiológicas como el electroencefalograma (EEG) o los potenciales somatosensitivos evocados. Dicha estrategia implica un retraso de 72 h, además de otros inconvenientes, como escasa disponibilidad y necesidad de personal especializado2,8–10.
El índice biespectral (BIS) es un sistema clínico multicanal y de fácil uso que utiliza electrodos en las regiones frontal y temporal para registrar las señales del EEG subyacente y del electromiograma (EMG) del cuero cabelludo. A continuación, un algoritmo patentado y concebido clínicamente transforma las señales obtenidas en tiempo real en un índice entre 0 (EEG isoeléctrico) y 100 (conciencia plena). En la pantalla principal también aparece otro parámetro, la tasa de supresión (TS), que estima el porcentaje de tiempo de señal isoeléctrica o suprimida del EEG11,12. El BIS se utilizó por primera vez como método para monitorizar la profundidad anestésica13,14, pero su accesibilidad lo ha introducido progresivamente en el campo de los cuidados posteriores a la reanimación. En muchos estudios se ha establecido una relación entre la monitorización por BIS y los resultados neurológicos de los pacientes que han sufrido una PC. No obstante, los datos sobre los métodos, los valores límite de referencia y el momento adecuado siguen siendo pocos15–22.
Así pues, se intentó evaluar la utilidad de recurrir temprano al BIS y la TS para predecir el PRN de los pacientes en una población de supervivientes a una PC sometidos a control de la temperatura corporal. También se quiso identificar el margen de tiempo en que los valores predictivos del BIS y la TS son máximos.
MÉTODOSDiseño del estudioEste estudio retrospectivo observacional evaluó a todos los adultos (edad ≥ 18 años) comatosos supervivientes a una PC ingresados consecutivamente en la unidad de críticos y agudos cardiovasculares (UCyAC) de un centro especializado entre diciembre de 2011 y octubre de 2020. El protocolo del estudio se llevó a cabo según los principios de la Declaración de Helsinki y fue aprobado por el comité de ética sobre investigaciones clínicas local (Pl-4756).
Cuidados tras la reanimaciónSiguiendo el protocolo de cuidados tras la reanimación, tras el ingreso en la UCyAC se inició de manera urgente el control de la temperatura corporal, que se llevó a cabo con el dispositivo intravascular de control de la temperatura de ZOLL (IVTM, Estados Unidos), con un catéter endovascular seleccionado en función de las medidas del paciente. Las mediciones de la temperatura se obtuvieron de manera continua por medio de una sonda vesical. El enfriamiento se fijó a la velocidad máxima para alcanzar la temperatura deseada (32-34°C), que seleccionó el médico tratante o se asignó dentro de un ensayo clínico aleatorizado (NCT01155622 o NCT02035839), y se mantuvo durante por lo menos 24 h. A continuación, se volvió a calentar a una velocidad de 0,1-0,3°C/h para alcanzar los 36,5°C. Esta temperatura se mantuvo durante 72 h tras la RCE. Se intubó a todos los pacientes y se les proporcionó ventilación mecánica.
Cuando los pacientes llegaban al hospital, se los sometía a una evaluación inicial sistemática y tratamiento. Tras evaluar su estado neurológico inicial, se les inducía sedación, inicialmente mediante la administración intravenosa de midazolam (bolo de 5-10 mg seguido de infusión a 1,5 μg/kg/min) y remifentanilo (0,1 μg/kg/min). Para evitar que tiritaran y minimizar la interferencia entre el EMG y los valores del BIS, se indujo parálisis muscular mediante la administración intravenosa de cisatracurio (1 μg/kg/min). Una vez transferido el paciente a la UCyAC y tras colocar adecuadamente el monitor del BIS, se individualizaron los fármacos mencionados y se ajustaron de manera continua según la escala de agitación/sedación de Richmond (RASS) y un índice BIS entre 40 (estado de hipnosis profunda) y 60 (anestesia general).
Los objetivos del control general de cuidados intensivos se establecieron de acuerdo con las recomendaciones e incluyeron normoxemia, normocapnia, glucemia<180mg/dl evitando la hipoglucemia y una presión arterial media de 70 a 100mmHg. Siempre que se sospechaba que un síndrome coronario agudo era la causa de la PC, se recomendaba realizar una primera angiografía coronaria.
Monitorización por BIS y TSEl BIS se monitorizó colocando en la frente del paciente un sensor frontotemporal de 4 electrodos (monitor BIS VISTA Covidien Medtronic, Estados Unidos) según las instrucciones del fabricante, y el registro de datos comenzaba al iniciarse el control de la temperatura corporal. Los valores del BIS y la TS se anotaron en las historias clínicas de enfermería cada hora durante por lo menos 48 h. El personal de enfermería evaluó los valores del BIS, que tenían que cumplir los criterios de calidad prestablecidos de pocos artefactos en el EMG (ausentes o<30 dB) y el indicador de calidad de la señal>80. Se excluyó del análisis a los pacientes sin monitorización por BIS o sin datos que cumplieran estos criterios de calidad.
Evaluación neurológicaEl resultado neurológico se clasificó según la escala Cerebral Performance Category (CPC) de 1 (buen desempeño cerebral) a 5 (muerte cerebral). Las categorías de la CPC se dividieron en resultado bueno (CPC 1-2) o malo (CPC 3-5). Como objetivo primario de este estudio se eligió la puntuación de la CPC, registrada después de completar la primera evaluación neurológica exhaustiva (que incluyó exploración clínica, biomarcadores, técnicas de diagnóstico por la imagen y técnicas funcionales). Es más, esta puntuación de la CPC volvió a registrarse al final del periodo de seguimiento prestablecido de 3 meses.
También es necesario hacer hincapié en que la decisión de retirar el soporte vital se tomó de acuerdo con las recomendaciones de la guía vigente y siguiendo un enfoque multimodal. Ni la determinación del estado neurológico final del paciente ni las decisiones sobre la retirada del soporte vital se tomaron utilizando los valores del BIS, ya que su monitorización solo se empleó con la idea de ajustar la dosis de los sedantes.
Obtención de los datos y análisis estadísticoSe obtuvieron prospectivamente los datos personales de los pacientes y relativos a la comorbilidad inicial, las características de la PC (Utstein-Style), datos analíticos, de intervenciones específicas, de complicaciones y de la supervivencia al alta y el seguimiento ambulatorio.
Las variables continuas se expresan en media±desviación estándar y se compararon mediante la prueba de la t de Student; las variables con distribución no normal se describen como mediana [intervalo intercuartílico], y las diferencias se analizaron con el método de Kruskal-Wallis. Las variables categóricas se compararon con la prueba de la χ2 o la prueba exacta de Fisher. Los modelos predictivos se estimaron con regresión logística. La validación interna de todos los modelos se hizo con el procedimiento de muestreo. Se trazaron las curvas de las características operativas del receptor (ROC) y, para determinar la utilidad del BIS y la TS en la predicción de los resultados neurológicos, se determinó el área bajo la curva (AUC) con valores horarios y consecutivos promedio del BIS y la TS a las 6, 12 y 24 h. Se calcularon los valores discriminatorios óptimos de los valores del BIS para predecir un buen resultado (CPC 1-2) y los valores de la TS para predecir un mal resultado neurológico (CPC 3-5) con el valor máximo del índice de Youden —sensibilidad+1 – especificidad)—. Un valor de p<0,05 se consideró estadísticamente significativo. Todos los análisis estadísticos se hicieron con la versión 15 del software estadístico STATA (StataCorp. 2017, Estados Unidos).
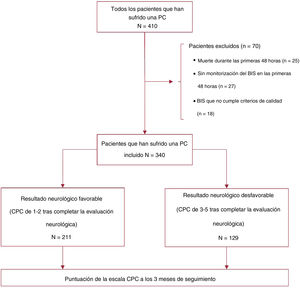
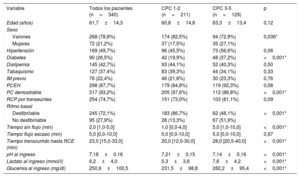
RESULTADOSDurante el periodo de estudio, ingresaron en la unidad 410 pacientes que habían sufrido una PC y se sometieron a control de la temperatura corporal. Se excluyó del análisis a 70 pacientes: 28 por falta de monitorización por BIS, 17 porque los valores del BIS no satisfacían los criterios de calidad prespecificados y 25 porque fallecieron en las primeras 48 h de ingreso en el hospital con un estado neurológico desconocido (figura 1). Los valores promedio del BIS y la causa de la muerte de estos 25 pacientes se muestran en las tablas 1 y 2 del material adicional. En el análisis se incluyó a 340 pacientes: 72 (21,2%) eran mujeres con una media de edad de 61,7±14,3 años.
Tras completar la primera evaluación neurológica exhaustiva (exploración clínica, biomarcadores, técnicas de diagnóstico por la imagen y técnicas funcionales), 211 pacientes (62,1%) presentaron una puntuación CPC de 1-2 y 129 (37,9%), de 3-5. En la tabla 1 se muestra la comparación entre grupos de las características basales y de la PC. Los factores asociados con buen resultado neurológico (CPC 1-2) incluyeron: ritmo inicial desfibrilable (el 86,7 frente al 48,1%; p<0,001), PC demostrable (el 97,6 frente al 86,8%; p<0,001), concentración sérica de lactato baja (5,3 frente a 7,6 mmol/l; p<0,001) y pH más alto (7,21 frente a 7,14; p<0,001) al ingreso. En la tabla 3 del material adicional, se muestran los cambios en la puntuación CPC durante el seguimiento de 3 meses.
Datos demográficos, variables basales y relacionadas con la parada cardiaca de todos los pacientes incluidos en el estudio y diferencias entre los grupos con CPC 1-2 y CPC 3-5
| Variable | Todos los pacientes (n=340) | CPC 1-2 (n=211) | CPC 3-5 (n=129) | p |
|---|---|---|---|---|
| Edad (años) | 61,7±14,3 | 60,8±14,8 | 63,3±13,4 | 0,12 |
| Sexo | ||||
| Varones | 268 (78,8%) | 174 (82,5%) | 94 (72,9%) | 0,036* |
| Mujeres | 72 (21,2%) | 37 (17,5%) | 35 (27,1%) | |
| Hipertensión | 169 (49,7%) | 96 (45,5%) | 73 (56,6%) | 0,06 |
| Diabetes | 90 (26,5%) | 42 (19,9%) | 48 (37,2%) | <0,001* |
| Dislipemia | 145 (42,7%) | 93 (44,1%) | 52 (40,3%) | 0,50 |
| Tabaquismo | 127 (37,4%) | 83 (39,3%) | 44 (34,1%) | 0,33 |
| IM previo | 76 (22,4%) | 46 (21,8%) | 30 (23,3%) | 0,76 |
| PCEH | 298 (87,7%) | 179 (84,8%) | 119 (92,3%) | 0,08 |
| PC demostrable | 317 (93,2%) | 205 (97,6%) | 112 (86,8%) | <0,001* |
| RCP por transeúntes | 254 (74,7%) | 151 (73,0%) | 103 (81,1%) | 0,09 |
| Ritmo basal | ||||
| Desfibrilable | 245 (72,1%) | 183 (86,7%) | 62 (48,1%) | <0,001* |
| No desfibrilable | 95 (27,9%) | 28 (13,3%) | 67 (51,9%) | |
| Tiempo sin flujo (min) | 2,0 [1,0-5,0] | 1,0 [0,0-4,0] | 5,0 [1,0-10,0] | <0,001* |
| Tiempo flujo escaso (min) | 5,0 [0,0-10,0] | 5,0 [0,0-10,0] | 5,0 [0,0-10,0] | 0,97 |
| Tiempo transcurrido hasta RCE (min) | 23,0 [15,0-33,0] | 20,0 [12,0-30,0] | 28,0 [20,5-40,0] | <0,001* |
| pH al ingreso | 7,18±0,16 | 7,21±0,15 | 7,14±0,16 | <0,001* |
| Lactato al ingreso (mmol/l) | 6,2±4,0 | 5,3±3,6 | 7,6±4.2 | <0,001* |
| Glucemia al ingreso (mg/dl) | 250,9±100,5 | 231,5±98,8 | 282,2±95,4 | <0,001* |
CPC: Cerebral Performance Category; IM: infarto de miocardio; PC: parada cardiaca; PCEH: parada cardiaca extrahospitalaria; RCE: recuperación de la circulación espontánea; RCP: reanimación cardiopulmonar.
Los valores expresan n (%), media±desviación estándar o mediana [intervalo intercuartílico].
Después de las primeras 48 h y dentro del periodo de seguimiento de 3 meses, fallecieron 135 pacientes (39,7%) y la principal causa de su muerte fue la retirada del soporte vital por una encefalopatía hipóxico-isquémica grave (80 pacientes, 59,3%). En la tabla 2 se describen otras causas de la mortalidad.
Principales causas de muerte de los supervivientes a una parada cardiaca pasadas las primeras 48 h del ingreso y dentro del periodo de seguimiento de 3 meses
| Retirada del soporte vital por mal pronóstico neurológico | 124 (59,3) |
| Cardiovasculares | 20 (14,8) |
| Retirada del soporte vital por otras situaciones | 14 (10,4) |
| Muerte cerebral | 12 (8,9) |
| Infección | 5 (3,7) |
| Respiratorias | 3 (2,2) |
| Hemorrágicas | 1 (0,7) |
Los valores expresan n (%).
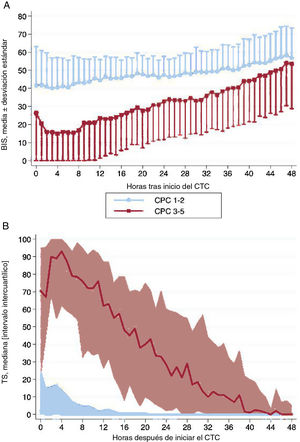
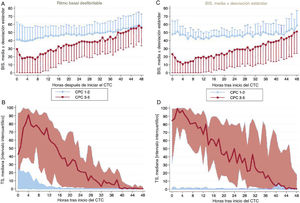
Los datos horarios del BIS y la TS de cada hora las primeras 48 h del control de la temperatura corporal se muestran en la figura 2 según el resultado neurológico de los pacientes. Los valores promedio del BIS y la TS durante las primeras 48 h del control de la temperatura corporal muestran diferencias entre los grupos de CPC 1-2 y CPC 3-5, incluso después de controlar por los posibles factores de confusión con un análisis multivariante (tabla 3). En los pacientes con un buen resultado neurológico, los valores promedio del BIS fueron sistemáticamente mayores, mientras que los valores medios de la TS fueron considerablemente inferiores. Las diferencias observadas en los valores del BIS y la TS fueron más pronunciadas durante las primeras 12-24 h de la monitorización. Cuando se analizó la muestra según el ritmo inicial de la PC, las diferencias se mantuvieron significativas y fueron mayores en los pacientes con ritmos iniciales no desfibrilables (figura 3).
Cambios en los valores medios del BIS (A) y la TS (B) durante las primeras 48 h del control de la temperatura corporal de supervivientes a una parada cardiorrespiratoria según el resultado neurológico (CPC 1-2 frente a CPC 3-5). A modo de ejemplo, en el gráfico A se han omitido el intervalo de desviaciones estándar negativos en el grupo de CPC 1-2 y el intervalo de desviaciones estándar positivos en el grupo de CPC 3-5. BIS: índice biespectral; CPC: Cerebral Performance Category; CTC: control de la temperatura corporal; TS: tasa de supresión.
Resultados de los valores promedio de BIS y TS durante las primeras 48 h del control de la temperatura corporal tras una parada cardiaca según la función neurológica
| Variable | CPC 1-2 | CPC 3-5 | OR (IC95%) | p | ORa (IC95%)* | p* |
|---|---|---|---|---|---|---|
| Prom. BIS | 47,9±7,1 | 31,5±14,5 | 1,17 (1,13-1,21) | <0,001 | 1,14 (1,09-1,19) | <0,001 |
| Prom. TS | 3,7±6,0 | 39,6±24,9 | 0,85 (0,81-0,89) | <0,001 | 0,85 (0,80-0,91) | <0,001 |
BIS: índice biespectral; CPC: escala Cerebral Performance Category; IC95%: intervalo de confianza del 95%; ORa: odds ratio ajustada; Prom.: promedio; TS: tasa de supresión.
La ORa y su valor de p se obtuvieron mediante el modelo de regresión logística multivariable que incluye todos los posibles factores de confusión (las variables que eran distintas en la comparación: sexo, diabetes mellitus, parada cardiaca demostrable, ritmo basal, tiempo de inactividad, tiempo de recuperación de la circulación espontánea, pH al ingreso, lactato y glucemia al ingreso).Los valores expresan n (%) o media±desviación estándar.
Diferencias relacionadas con el ritmo basal de la parada cardiaca en los cambios en los valores promedio del BIS y la TS durante las primeras 48 h del control de la temperatura corporal de supervivientes a una parada cardiorrespiratoria según el resultado neurológico (CPC 1-2 frente a CPC 3-5). En la parte izquierda de la figura se muestra a los pacientes con un ritmo basal desfibrilable (A y B) y en la parte de la derecha (C y D) a aquellos con un ritmo no desfibrilable. A modo de ejemplo, en los gráficos A y C se han omitido el intervalo de desviaciones estándar negativas en el grupo de CPC 1-2 y el intervalo de desviaciones estándar positivas en el grupo de CPC 3-5. BIS: índice biespectral; CPC: Cerebral Performance Category; CTC: control de la temperatura corporal; TS: tasa de supresión.
Además, 5 pacientes con un valor de BIS 0 al cabo de 1 h sobrevivieron con una CPC de 1-2 y solo 1 entre las 2 y las 6 h. Se registró un BIS promedio<10 durante las primeras 6 h de control de la temperatura corporal en 10 pacientes (13,5%) que se recuperaron con un resultado neurológico favorable, mientras que solo 3 (5,8%) lo hicieron con un BIS promedio<10 durante las primeras 12 h. Asimismo, solo se observó una TS promedio>90 durante las primeras 6 h en 2 pacientes (9,7%) que sobrevivieron sin ninguna alteración neurológica, y al final ningún paciente sufrió alteración con una CPC 1-2 cuando se obtuvo una TS promedio>90 durante las primeras 12 h.
En las tablas 4 y 5 del material adicional, se muestran el análisis ROC y la curva horaria AUC del BIS medio y los valores promedio de la TS para predecir un resultado neurológico. La AUC para la predicción del BIS de un buen resultado neurológico fue ≥ 0,85 a las 4 h y entre las 6 y las 8 h del control de la temperatura corporal. La mayor AUC (0,878) se observó a las 7 h de iniciarse el control de la temperatura corporal. Para predecir un mal resultado neurológico (CPC 3-5), la TS media entre las 2 y las 26 h de control de la temperatura corporal mostró una AUC ≥ 0,85, y a las 18 h fue el momento óptimo para una predicción neurológica desfavorable (AUC=0,920).
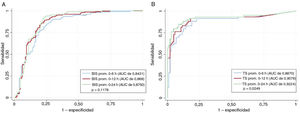
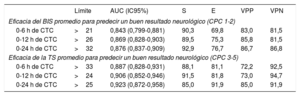
En la tabla 4 se muestran los resultados de predicción de los valores promedio del BIS durante las primeras 6, 12 y 24 h del control de la temperatura corporal. En las figuras 1-3 del material adicional, se trazan las curvas ROC y en la figura 4A del material adicional se comparan. Un valor límite del BIS>26 durante las primeras 12 h del control de la temperatura corporal predijo un buen resultado neurológico con una sensibilidad del 89,5% y una especificidad del 75,3%, lo que resulta en una proporción de falsos negativos del 10,5% (AUC=0,869; intervalo de confianza del 95% [IC95%], 0,828-0,903) (figura 5).
Eficacia predictiva del BIS y la TS promedio durante las primeras 6, 12 y 24 h del control de la temperatura corporal para el pronóstico neurológico
| Límite | AUC (IC95%) | S | E | VPP | VPN | |
|---|---|---|---|---|---|---|
| Eficacia del BIS promedio para predecir un buen resultado neurológico (CPC 1-2) | ||||||
| 0-6 h de CTC | >21 | 0,843 (0,799-0,881) | 90,3 | 69,8 | 83,0 | 81,5 |
| 0-12 h de CTC | >26 | 0,869 (0,828-0,903) | 89,5 | 75,3 | 85,8 | 81,5 |
| 0-24 h de CTC | >32 | 0,876 (0,837-0,909) | 92,9 | 76,7 | 86,7 | 86,8 |
| Eficacia de la TS promedio para predecir un buen resultado neurológico (CPC 3-5) | ||||||
| 0-6 h de CTC | >33 | 0,887 (0,828-0,931) | 88,1 | 81,1 | 72,2 | 92,5 |
| 0-12 h de CTC | >24 | 0,906 (0,852-0,946) | 91,5 | 81,8 | 73,0 | 94,7 |
| 0-24 h de CTC | >25 | 0,923 (0,872-0,958) | 85,0 | 91,9 | 85,0 | 91,9 |
AUC: área bajo la curva obtenida por análisis de la curva de características operativas del receptor (ROC); BIS: índice biespectral; CPC: Cerebral Performance Category; CTC: control de la temperatura corporal; E: especificidad; S: sensibilidad; TS: tasa de supresión; VDN: valor diagnóstico de un resultado negativo; VDP: valor diagnóstico de un resultado positivo.
En la tabla 4 se muestran los resultados de predicción de los valores promedio de la TS durante las primeras 6, 12 y 24 h del control de la temperatura corporal. En las figuras 4-6 del material adicional, se trazan las curvas ROC y en la figura 4B se comparan. Un valor límite de la TS>24 durante las primeras 12 h del control de la temperatura corporal podría predecir un mal resultado con una sensibilidad del 91,5% y una especificidad del 81,8% (AUC=0,906; IC95%, 0,852-0,946) (figura 5). Solo 9 pacientes con una TS promedio>24 sobrevivieron con un resultado neurológico favorable (CPC 1-2), lo que resultó en un valor diagnóstico de un resultado negativo del 94,7%. Los principales resultados estadísticos, los parámetros de calibración y la validación interna con técnicas de muestreo de todos los modelos de regresión logística se resumen en la tabla 6 del material adicional.
Comparación de todas las curvas ROC de todos los modelos predictivos con los valores promedio de BIS durante las primeras 6, 12 y 24 h del control de la temperatura corporal (A) y con los valores promedio de la TS durante las primeras 6, 12 y 24 h de este mismo control (B). AUC: área bajo la curva ROC; BIS: índice biespectral; CTC: control de la temperatura corporal; Prom.: promedio; TS: tasa de supresión.
Figura central. Los valores del BIS y la TS durante las primeras horas del control de la temperatura corporal pueden predecir con exactitud el potencial de recuperación neurológica de los pacientes supervivientes a una parada cardiaca. Se ilustra la eficacia predictiva de los valores promedio durante las primeras 12 h. AUC: área bajo la curva; BIS: índice biespectral; CPC: escala Cerebral Performance Category; CTC: control de la temperatura corporal; Prom.: promedio; TS: tasa de supresión.
Por último, en la figura 7 del material adicional, se muestra cómo al incluir los valores promedio del BIS y la TS durante las primeras 6, 12 y 24 h, además de otras variables clásicas muy utilizadas para la estratificación de pacientes en la práctica diaria (edad, PC demostrable, reanimación cardiopulmonar aplicada por transeúntes, ritmo inicial, tiempo de inactividad, tiempo transcurrido hasta la RCE, glucemia, pH y lactato sérico al ingreso), la eficacia predictiva de un resultado neurológico favorable aumentó (AUC, 0,947 frente a 0,829; AUC, 0,961 frente a 0,833, y AUC, 0,966 frente a 0,835 para los valores de BIS y TS a las 6, 12 y 24 horas respectivamente; p<0,001 para todas las comparaciones de curvas ROC).
DISCUSIÓNHasta la fecha, este es el mayor estudio observacional con pacientes que han sufrido una PC sometidos a control de la temperatura corporal en el que se confirma que el BIS y la TS, parámetros derivados del EEG, pueden identificar el PRN del paciente al principio del ingreso (figura 5).
Muchos de los pacientes que han sufrido una PC presentarán inestabilidad hemodinámica durante las primeras horas posteriores a su ingreso, principalmente por la disfunción miocárdica que tiene lugar tras la parada que puede ser incluso peor si es de origen cardiaco (p. ej., síndrome coronario agudo, miocardiopatía previa). Aunque esta entidad clínica es potencialmente recuperable y la mayoría de los pacientes responderán a los inotrópicos o vasopresores, habrá quienes evolucionen a un estado de choque refractario que requiera asistencia mecánica avanzada para evitar un desenlace fatal. Por lo tanto, los médicos tienen que afrontar la decisión de escalar el tratamiento de inmediato cuando la información sobre el estado neurológico del paciente es más bien escasa. Aún no se han validado aún instrumentos específicos que contribuyan a predecir el resultado neurológico en ese marco temporal y, lamentablemente, esta falta de conocimiento ha impedido que a muchos pacientes se les administraran tratamientos especializados.
Estas son algunos motivos por los que la monitorización no invasiva por BIS en el campo de los cuidados tras la reanimación ha ido generando mayor interés23. Tras un periodo de formación estructurada breve, el equipo técnico es capaz de interpretar los trazos simplificados del EEG y los valores que aparecen en el monitor11,12. Además, en los últimos años han aparecido indicios que corroboran la relación entre el BIS y los resultados neurológicos en los pacientes que han sufrido un PC sometidos a control de la temperatura corporal24–31. No obstante, cabe preguntarse por qué no se ha incluido este instrumento en los algoritmos de pronóstico neurológico multimodal32.
Una de las principales preocupaciones es la fiabilidad de la monitorización por BIS. En este estudio, un valor promedio de BIS>26 durante las primeras 12 h del control de la temperatura corporal predijo un buen resultado neurológico con una sensibilidad del 89,5% y una especificidad del 75,3%, mientras que un valor promedio de la TS>24 durante las primeras 12 h del control de la temperatura corporal predijo un mal resultado neurológico con una sensibilidad del 91,5% y una especificidad del 81,8%. En realidad, las primeras 6-24 h fueron el momento en que los valores del BIS y la TS alcanzaron las tasas de predicción máximas (AUC>0,80). Para poner en perspectiva la magnitud de estas observaciones, la ausencia del componente bilateral N20 de los potenciales somatosensitivos evocados con estimulación del nervio mediano, considerada una de las pruebas más fiables para el pronóstico neurológico en el contexto de los cuidados tras la reanimación, predice un mal resultado con una sensibilidad del 83% y una especificidad del 79% en las 8-24 h tras la RCE de pacientes con temperatura corporal>35°C27,33,34. Otro ejemplo se encuentra en los datos analíticos, ya que el cambio en los valores de la enolasa neuronal específica entre las 72 h posteriores a la RCE y el ingreso en el hospital pueden predecir un mal resultado neurológico con una AUC de 0,9035.
Otro posible argumento para no incluir la monitorización por BIS en los algoritmos de pronóstico neurológico multimodales es que puede conllevar un posible riesgo de retirada temprana del soporte vital (< 72 h tras la parada)36. Naturalmente, con estos resultados no se quiere fomentar la retirada temprana del soporte vital, ya que datos anteriores confirman la posibilidad de un despertar tardío en hasta el 20,9% de los pacientes que han sufrido una PC, en especial cuando se los ha tratado con temperaturas más bajas37. Además, en este estudio se observó que hasta el 13,5% de los pacientes con valores de BIS bajos durante las primeras horas del ingreso al final presentaban una puntuación CPC de 1-2. Sin duda, el enfoque multimodal recomendado es el camino que seguir para el pronóstico neurológico; no obstante, se cree que la monitorización por BIS podría reforzar los modelos de predicción general aplicados actualmente. Si se toman, por ejemplo, los resultados de una de las variables incluidas en los modelos de predicción general, el pH basal, los valores bajos (< 7,2) normalmente se han relacionado con mal pronóstico neurológico después de una PC, si bien datos recientes indican que incluso con valores de pH basal sumamente bajos (< 7,0) el 20% de los pacientes se recuperan con un buen resultado neurológico38. Este estudio muestra que, cuando se añaden los valores del BIS y la TS a las variables clásicas utilizadas para estratificar al ingreso (PC demostrable, ritmo basal, tiempo transcurrido hasta la RCE, pH y lactato sérico al ingreso), la eficacia predictiva del resultado neurológico aumenta considerablemente y podría evitarse el infratratamiento de los pacientes, sobre todo en las primeras 24-48 h del ingreso hospitalario39–43.
Además, puesto que los pacientes que han sufrido una PC podrían inestabilizarse de manera repentina, se presentan datos que corroboran que los valores horarios del BIS y la TS muestran una buena eficacia predictiva general si comienzan a las 2 h en el caso de la TS y a las 4 h en el caso del BIS, y se mantienen durante las primeras 24-48 h del control de la temperatura corporal. Es más, se proponen distintos valores medios umbral del BIS y la TS durante las primeras 6, 12 y 24 h del control de la temperatura corporal, todos los cuales muestran una alta capacidad predictiva (tabla 3 y figura 4). Esta observación refuerza la naturaleza dinámica de estos parámetros derivados del EEG y difiere de la mayoría de los estudios previos que han centrado la atención en hallar un valor discriminatorio óptimo del BIS y, con menor frecuencia, valores de la TS en un momento concreto (p. ej., en el minuto 267 o a las 4 h)24,26.
Por último, este estudio tiene varias limitaciones. Aunque cuenta con una población comparativamente grande a diferencia de publicaciones anteriores, se llevó a cabo en un único centro con cuidados exhaustivos validados tras la reanimación y su naturaleza es observacional. Otra limitación es que no se analizó la posible influencia de la dosis total de sedantes administrados a cada paciente en los valores del BIS y la TS. Sin embargo, se cree que los valores del BIS y la TS podrían haberse subestimado o sobrestimado, principalmente durante las primeras 2 o 3 h de ingreso, ya que tras completar la evaluación del estado neurológico inicial de los pacientes y antes de llevarlos a la UCyAC se sedó a todos según las dosis estándar prestablecidas en el protocolo local. Una vez colocado el monitor del BIS, se ajustaron individualmente las dosis de los sedantes para un valor de BIS de 40 a 60. Así pues, la variabilidad en las dosis totales de cada uno de los sedantes impidió obtener conclusiones sobre ellos. Que todos los pacientes recibieran relajantes musculares por vía intravenosa de manera continua puede percibirse como otra limitación, pero contribuyó a asegurar una lectura de la monitorización por BIS correcta y de calidad. Además, se excluyó del análisis a los pacientes que fallecieron en las primeras 48 h del ingreso hospitalario, ya que no pudo completarse a fondo la evaluación neurológica, lo que podría constituir un sesgo. Por último, la exactitud de los datos depende de la documentación preexistente, que puede ser incompleta o incorrecta en el momento de obtenerla.
CONCLUSIONESA la espera de otros estudios prospectivos, la monitorización por BIS y TS de los supervivientes a una PC sometidos a control de la temperatura corporal proporciona información exacta, real y a pie de cama para la predicción precoz del PRN de los pacientes. Este resultado podría ayudar a concienciar sobre la posibilidad de una buena evolución neurológica de pacientes que de otro modo se considerarían erróneamente no viables y establecer planes de escalada terapéutica personalizados.
FINANCIACIÓNNinguna.
CONTRIBUCIÓN DE LOS AUTORESE. Arbas-Redondo y S.O. Rosillo-Rodríguez contribuyeron por igual a este artículo (diseño del estudio, obtención de los datos, análisis estadístico, redacción y revisión del manuscrito). E. López-de-Sa contribuyó al diseño del estudio, el análisis estadístico y la revisión del artículo. E. Armada-Romero contribuyó al diseño del estudio y la revisión del artículo. C. Merino-Argos, I. Marco-Clement, L. Rodríguez-Sotelo, L.A. Martínez-Marín, L. Martín-Polo y A. Vélez-Salas contribuyeron a la obtención de los datos. J. Caro-Codón y D. García-Arribas contribuyeron a la obtención de los datos y el análisis estadístico. Todos los autores han leído y aprobado la versión final del artículo presentada a la Revista.
CONFLICTO DE INTERESESLos autores no declaran ninguno.
- •
En estudios observacionales previos con supervivientes a una PC comatosos, se observa correlación de los valores del BIS y la TS con los resultados neurológicos. No obstante, esos estudios son heterogéneos en cuanto a metodología y en su mayoría hacen referencia a la capacidad del BIS y la TS para predecir resultados neurológicos en momentos concretos, mientras que estos valores y la evolución clínica de los pacientes son dinámicos.
- •
Los valores del BIS y la TS durante las primeras 24 h del control de la temperatura corporal pueden predecir con exactitud el PRN de los pacientes. Las tasas de predicción son sistemáticamente altas varias horas después de iniciar el control de la temperatura corporal (algunas alcanzan el 100% de especificidad para un mal pronóstico), lo que permite que su interpretación carezca de limitaciones temporales durante las primeras 12-24 h. Esto es apropiado porque la disfunción miocárdica normalmente es máxima durante las primeras 8-24 h. Así pues, el BIS y la TS podrían convertirse en un medio no invasivo que facilite a los médicos su difícil proceso de toma de decisiones sobre la escalada terapéutica y evitar potencialmente el infratratamiento.