La parada cardiaca (PC) continúa representando un problema mayor de salud pública en nuestro medio, con una incidencia estimada en Europa de 118 casos/100.000 habitantes por año. La supervivencia al alta hospitalaria, que es muy variable según el país y se sitúa en torno al 8%, refleja el amplio margen de mejora que sigue existiendo en la atención a esta compleja afección1. La disfunción cardiaca tras la reanimación es la principal causa de muerte en las primeras 72 h y, en general, la segunda causa de mortalidad hospitalaria tras la PC. Esta disfunción cardiaca ocurre especialmente en las primeras 24 h de ingreso hospitalario, ya que se ha visto que el índice cardiaco alcanza su valor más bajo a las 8 h de la recuperación de la circulación espontánea, comienza a mejorar de nuevo a partir de las 24 h y a menudo alcanza la normalidad a las 72 h2. Se ha descrito que hasta un 10-15% de los pacientes recuperados de una PC extrahospitalaria sufrirán shock cardiogénico profundo y precisarán asistencia circulatoria3. Cuando se supera esta fase inicial de inestabilidad hemodinámica, la causa más frecuente de muerte es un déficit neurológico irreversible que suele conllevar la limitación del esfuerzo terapéutico (LET). Las secuelas neurológicas son la causa de muerte de 2 tercios de las PC extrahospitalarias3. Establecer la gravedad y la reversibilidad de este déficit neurológico es uno de los principales retos a los que se enfrentan los clínicos encargados del tratamiento de la PC.
Las guías de práctica clínica y los diferentes documentos de consenso concuerdan en abogar por una valoración multimodal que incluya exploración clínica, electroencefalograma, biomarcadores y técnicas de imagen3,4. Este enfoque conlleva la realización de pruebas complementarias más o menos complejas, la coordinación de diferentes profesionales y una demora inevitable, con el objetivo de establecer una aproximación pronóstica a partir de las 72 h tras la PC4–6. La recomendación de esta valoración multimodal se basa en que ninguna exploración por sí sola es constante en alcanzar el 100% de precisión. Con la combinación de toda la información se pretende definir de la manera más fiable posible el potencial de recuperación neurológica (PRN) y, en función de los hallazgos integrados, plantear la adecuación de las medidas de soporte vital. Las principales consideraciones, el nivel de precisión y el momento en que se debe interpretar estas exploraciones complementarias recomendadas se resumen en la tabla 1. Definir un mal pronóstico y un pobre PRN puede conllevar decisiones de LET, y por ello las pruebas complementarias deben aportar alta especificidad y precisión. La tasa de falsos positivos que se ha establecido como aceptable es de un 0,1%, según una encuesta realizada a profesionales expertos3. Cabe destacar, asimismo, la dificultad añadida que supone la discordancia temporal entre la inestabilidad hemodinámica que aparece en las primeras 24 h de ingreso tras la PC y la compleja definición de un pronóstico neurológico fiable. En este contexto, uno de los problemas al que se enfrentan los clínicos en el tratamiento de estos pacientes es la necesidad de tomar decisiones terapéuticas complejas en una fase precoz, con un pronóstico marcado por la disfunción miocárdica cuando el pronóstico neurológico y el PRN aún no están establecidos7,8. Ello puede suponer la realización de procedimientos esteriles en pacientes con mal pronóstico neurológico, con un gran consumo de recursos y un impacto negativo en las expectativas de las familias sobre la recuperación5. Por otro lado, la LET en esta fase podría limitar las posibilidades de recuperación en algunos casos.
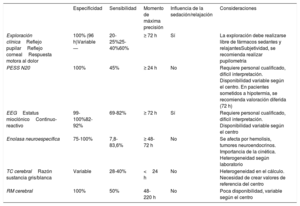
Variables clásicas en la valoración multimodal del pronóstico neurológico
| Especificidad | Sensibilidad | Momento de máxima precisión | Influencia de la sedación/relajación | Consideraciones | |
|---|---|---|---|---|---|
| Exploración clínicaReflejo pupilarReflejo cornealRespuesta motora al dolor | 100% (96 h)Variable— | 20-25%25-40%60% | ≥ 72 h | Sí | La exploración debe realizarse libre de fármacos sedantes y relajantesSubjetividad, se recomienda realizar pupilometría |
| PESS N20 | 100% | 45% | ≥ 24 h | No | Requiere personal cualificado, difícil interpretación. Disponibilidad variable según el centro. En pacientes sometidos a hipotermia, se recomienda valoración diferida (72 h) |
| EEGEstatus mioclónicoContinuo-reactivo | 99-100%82-92% | 69-82% | ≥ 72 h | Sí | Requiere personal cualificado, difícil interpretación. Disponibilidad variable según el centro |
| Enolasa neuroespecífica | 75-100% | 7,8-83,6% | ≥ 48-72 h | No | Se afecta por hemolisis, tumores neuroendocrinos. Importancia de la cinética. Heterogeneidad según laboratorio |
| TC cerebralRazón sustancia gris/blanca | Variable | 28-40% | <24 h | No | Heterogeneidad en el cálculo. Necesidad de crear valores de referencia del centro |
| RM cerebral | 100% | 50% | 48-220 h | No | Poca disponibilidad, variable según el centro |
EEG: electroencefalograma; PESS: potenciales evocados somatosensoriales; RM: resonancia magnética nuclear; TC: tomografía computarizada.
En un interesante trabajo publicado recientemente en Revista Española de Cardiología, Arbas-Redondo et al.9 proponen la utilización del índice biesprectal (BIS) y la tasa de supresión (TS) como una monitorización accesible en fase precoz y a pie de cama para obtener información del PRN y, con ello, guiar las decisiones clínicas para los pacientes que así lo requieran. En este trabajo se analiza una serie de 340 pacientes ingresados tras una PC con valores disponibles de BIS y TS y una media de edad de 61,7 años, de los que 72 (21,2%) eran mujeres. Tras una primera valoración neurológica global, 211 (62,1%) presentaron una buena evolución neurológica (escala Cerebral Performance Category [CPC] 1-2) y 129 (37,9%), un pronóstico desfavorable (CPC 3-5). Los principales factores asociados con una buena evolución neurológica fueron un ritmo inicial desfibrilable, parada presenciada, valores bajos de lactato sérico y pH elevado. Los valores horarios de BS y TS durante las primeras 48 h fueron significativamente distintos en función de la evolución neurológica. En pacientes con buena evolución, los valores medios del BIS fueron significativamente superiores, mientras que los valores medios de TS se mostraron significativamente inferiores. Además, las diferencias observadas en BIS y TS fueron más marcadas en las primeras 12-24 h de monitorización. El punto de corte del BIS> 26 durante las primeras 12 h predijo una buena evolución neurológica con una sensibilidad del 89,5% y una especificidad del 75,3% (área bajo la curva ROC [ABC], 0,869). De la misma manera, un punto de corte de TS> 24 en las primeras 12 h predijo una mala evolución con una sensibilidad del 91,5% y una especificidad del 81,8% (ABC, 0,906). En sus conclusiones, los autores destacan la capacidad predictiva de ambos parámetros para contribuir a optimizar la predicción del PRN.
El BIS se basa en los principios de la electroencefalografía, traduce las ondas en un valor numérico entre 0 y 100 y, además, recoge el porcentaje de tiempo en el que hay actividad suprimida (ondas de amplitud <0,5μV)10. Se diseñó para monitorizar la profundidad de la anestesia durante la cirugía, aunque su uso se ha ampliado a monitorizar la profundidad de la sedación en las unidades de cuidados intensivos. El BIS en este contexto presenta varias ventajas: es fácil de obtener e interpretar, no es invasivo, se puede determinar a pie de cama en la unidad de cuidados críticos y el registro puede ser continuo. La aplicación del BIS al pronóstico presenta también algunas dificultades. Existe gran heterogeneidad en los estudios tanto en relación con la población diana (PC extrahospitalaria u hospitalaria, aplicación de hipotermia, utilización de sedación y/o relajantes musculares) como en la propia valoración del BIS (momento de la medición, utilización de los valores máximo, mínimo o promedio, calidad de la medición), lo que hace muy difícil extraer conclusiones robustas. Los autores reconocen estas limitaciones9, y destacan el hecho de no haber analizado el impacto de las dosis de sedantes en los valores del BIS y TS. En este sentido, una reciente revisión sistemática de la literatura11 mostró un ABC de 0,92 para un valor de corte del BIS <32 para definir un mal pronóstico neurológico, y no describe diferencias en la capacidad diagnóstica del BIS en función de que se aplicaran hipotermia, sedación o bloqueo neuromuscular. El valor pronóstico del BIS y la TS independiente de la sedación se ha demostrado en otros trabajos12. Por otro lado, el complejo contexto clínico de la PC hace probable que haya factores de confusión no registrados en la mayoría de los trabajos. En su artículo, Arbas-Redondo et al.9 aportan un valioso análisis sobre la capacidad predictiva incremental de los valores de BIS y TS sobre conocidos predictores de PRN (edad, parada presenciada, reanimación por un testigo, ritmo inicial, tiempo sin flujo, tiempo hasta la recuperación de la circulación espontánea, glucemia, pH y lactato sérico al ingreso), con un incremento significativo en los valores del ABC al incluir las variables BIS y TS en los modelos predictivos.
A pesar de las limitaciones descritas, hay información relevante en la literatura sobre el uso del BIS en la definición del pronóstico neurológico. Burjek et al.13 describieron que el valor de BIS en la séptima hora tras el ingreso en UCI fue el que presentó mejor valor pronóstico. En la misma línea, modelos experimentales sobre el daño por isquemia-reperfusión cerebral mostraron que la disfunción mitocondrial y la producción de los radicales libres de oxígeno que llevan a la neurotoxicidad ocurren durante las primeras 6 h tras la PC2. Los pacientes con mal pronóstico neurológico tuvieron un valor promedio de BIS significativamente más bajo, y se observó que, por cada 10 puntos de caída del BIS, la odds ratio de mala recuperación neurológica aumentaba un 59%13. También se ha descrito la importancia pronóstica de la TS y, especialmente, los cambios que se producen en ella tras suspenderse la sedación. Una posible explicación para ello es que los cerebros más dañados son más sensibles a la sedación, por lo que muestran cambios mayores en la TS al iniciar o suspender la sedación12. Se ha descrito asimismo una buena capacidad del BIS para establecer la sospecha de muerte encefálica en pacientes recuperados de PC refractaria mediante oxigenador extracorpóreo de membrana tanto en hipotermia como tras el recalentamiento. Jouffroy et al.14 describieron un valor BIS <30 como el límite con mejores sensibilidad (96%) y especificidad (82%) para establecer la sospecha de muerte encefálica. Esto tiene implicaciones clínicas relevantes, ya que un diagnóstico precoz de muerte encefálica permite limitar costes y reducir el estrés familiar a la espera de un desenlace y puede facilitar que los pacientes sean donantes antes de que se produzca una inestabilidad que dañe irreversiblemente los órganos14. Otra utilidad de gran interés del BIS es la detección con altas especificidad y sensibilidad de un patrón de estatus epiléptico15. Esto tiene también gran relevancia clínica, ya que hasta en un tercio de las PC se presentan convulsiones a menudo infradiagnosticadas, y la mortalidad aumenta exponencialmente según su duración. Por otro lado, la realización de un electroencefalograma en las primeras horas tras la PC puede ser logísticamente complicado en muchos centros y variable según la disponibilidad, la hora o el día de ingreso.
En conjunto, cabe destacar que no existe en la literatura un valor de BIS de referencia para establecer un determinado pronóstico neurológico. En el trabajo de Arbas-Redondo et al.9, la valoración aplicada por los autores según el protocolo del centro y el valor de corte establecido fueron muy precisos para establecer un mal pronóstico (escala CPC 3-5), ya que a los 3 meses solo 1 paciente (0,3%) se recategorizó a un buen pronóstico (escala CPC 1-2). Otro aspecto importante sobre la aplicación del BIS en la práctica clínica es la interferencia de la electromiografía como la principal fuente de error en su interpretación. Por ello, tal y como recomiendan Arbas-Redondo et al.9, es necesario tener un protocolo de medición estructurado que valore la calidad del registro y contemple el uso de relajante muscular antes de la interpretación del BIS.
En definitiva, se puede considerar que el BIS es un valioso instrumento para la valoración del pronóstico neurológico, labor especialmente difícil en las primeras horas de ingreso cuando el paciente puede tener más inestabilidad hemodinámica. Su interpretación debe ir de la mano de indicadores de valor establecido y disponibles al ingreso, como el tiempo sin maniobras (no flow), el tiempo de reanimación cardiopulmonar (RCP) (low flow), el tiempo total de reanimación hasta la recuperación de la circulación espontánea, el pH y el lactato basales y la exploración neurológica a pie de cama. Además, es importante recalcar que esta información tampoco está exenta de limitaciones, pues a menudo son datos recogidos a partir de testigos que proporcionan un tiempo estimado u orientativo, pero no del todo fiable. Asimismo la exploración clínica suele ser dificultosa en pacientes sometidos a sedoanalgesia, y en ocasiones a miorrelajación, y más aún en pacientes en protocolo de hipotermia terapéutica. Estas limitaciones han motivado la elaboración en los últimos años de diferentes escalas cuyo cálculo puede suponer un medio adicional para la toma de decisiones clínicas. Estas escalas se resumen en la tabla 2. La escala Out-of-Hospital Cardiac Arrest (OHCA)7 recoge ritmo inicial, tiempo sin RCP, tiempo total de RCP, lactato y creatinina; la Cardiac Arrest Hospital Prognosis8 (CAHP) recoge tiempo sin RCP, ritmo inicial, tiempo en PC, lugar de la PC, edad, pH y administración de adrenalina; la Target Temperature Management (TTM)6 recoge ritmo inicial, tiempo sin RCP, tiempo total de RCP, edad, PC en domicilio, administración de adrenalina, reflejo corneal/pupilar bilateral, respuesta motora, pH y pCO2; por último, la escala MIRACLE25 recoge ritmo inicial, cambio de ritmo durante la PC, PC presenciada, edad, pupilas arreactivas, pH <7,20 y administración de adrenalina. A pesar de su potencial utilidad, estas escalas se han elaborado a partir de cohortes concretas, y esto puede ocasionar una extrapolabilidad limitada6. Por otro lado, se han utilizado también escalas de riesgo clásicas del paciente crítico (p. ej., APACHE II16), que aportan un peor rendimiento pronóstico al no incluir datos específicos de la PC recuperada8. Cabe reseñar asimismo la potencial contribución predictiva de algunos factores como la medición seriada de la enolasa para optimizar la predicción del PRN en pacientes con PC recuperada17.
Escalas para la valoración pronóstica tras parada cardiaca
| Escala | Variables incluidas | ABC | ||||||
|---|---|---|---|---|---|---|---|---|
| MIRACLE2 | PC presenciada | Ritmo no desfibrilable | Cambio de ritmo durante la PC | Pupilas arreactivas | Edad | pH <7,20 | Admnistración de adrenalina | 0,90 |
| OHCA | Tiempo sin RCP | Ritmo inicial | Tiempo de RCP | Lactato | Creatinina | — | — | 0,82 |
| CAHP | Tiempo sin RCP | Ritmo no desfibrilable | Tiempo a la ROSC | Lugar de la PC | Edad | pH | Admnistración de adrenalina | 0,93 |
| TTM | PC en domicilio | Ritmo no desfibrilable | pCO2 | Ausencia bilateral de reflejos corneales y pupilares | Edad | pH | Admnistración de adrenalina | 0,84 |
ABC: área bajo la curva, definida en la población del estudio original; CAHP: Cardiac Arrest Hospital Prognosis; OHCA: Out-of-Hospital Cardiac Arrest; PC: parada cardiaca; pCO2: presión parcial de CO2; RCP: reanimación cardiopulmonar; ROSC: recuperación de la circulación espontánea; TTM: Target Temperature Management.
En resumen, es fundamental establecer un pronóstico neurológico de la PC en la fase inicial de inestabilidad hemodinámica en el que basar potenciales decisiones relacionadas con la asistencia circulatoria. Como muestran los hallazgos de Arbas Redondo et al.9, el BIS puede resultar valioso para esta valoración precoz y ofrece ventajas derivadas de su escasa invasividad y su alta disponibilidad. Puede interpretarse asimismo en pacientes sometidos a hipotermia, sedación y relajación muscular, pero su valoración debe ser muy minuciosa, protocolizada y con personal experimentado para que sea fiable. En cualquier caso, y como reconocen los autores, nada de lo expuesto puede sustituir la valoración multimodal recomendada en las guías de práctica clínica. Cualquier hipotética LET por mal pronóstico neurológico debe basarse en las máximas precisión y especificidad que aporta la valoración combinada de diferentes aspectos de la compleja función neuronal.
FINANCIACIÓNNinguna.
CONFLICTO DE INTERESESNinguno.