Durante los últimos años, la impresión tridimensional (3D) ha dado el salto al campo de la cardiología gracias a su potencial para mejorar la comprensión de las cardiopatías congénitas, la planificación de la cirugía y la simulación del intervencionismo en cardiopatía estructural. En este artículo se introduce al lector en la tecnología de la impresión 3D con el objetivo de conocer qué es lo que se necesita para obtener un modelo 3D: cuáles son las imágenes radiológicas que se pueden utilizar, los requisitos mínimos de calidad que deben cumplir y qué tipos de impresión 3D hay disponibles. También se evalúa la utilidad de los modelos cardiovasculares 3D en el campo de la educación, la formación de médicos especialistas y la comunicación con los pacientes. Se revisan las publicaciones más relevantes sobre la aplicación para la planificación de la cirugía cardiaca y la simulación del intervencionismo percutáneo estructural. Finalmente se analizan las limitaciones actuales de la impresión 3D y las perspectivas futuras con el objetivo de fomentar el espíritu crítico ante esta nueva tecnología y sobre todo despertar el interés para desarrollar nuevas aplicaciones en este apasionante campo de la cardiología.
Palabras clave
El diagnóstico y el tratamiento de la cardiopatía estructural y congénita se han basado tradicionalmente en la revisión de imágenes como la ecocardiografía, la angiografía, la tomografía computarizada (TC) y la resonancia magnética (RM). Cardiólogos, hemodinamistas y cirujanos dependen de su habilidad, desarrollada tras años de experiencia para ensamblar en su cerebro, como si de un rompecabezas tridimensional (3D) se tratara, las múltiples imágenes bidimensionales obtenidas, y así comprender la complejidad de la cardiopatía a la que se enfrentan. Para mayor limitación, dichas imágenes habitualmente se proyectan y amplían en una pantalla plana, por lo que no representan el tamaño real de las estructuras. Ni siquiera cuando se muestra una proyección virtual en 3D, se puede tocar o tener una percepción exacta de la profundidad o la cercanía entre estructuras situadas en distintos planos del espacio.
En los últimos años, la impresión 3D, desarrollada inicialmente en la ingeniería y en la industria aeronáutica, ha dado el salto al campo de la medicina con la promesa de resolver las limitaciones anteriormente señaladas. Nuestro objetivo es introducir al lector en la tecnología de la impresión 3D y conocer los requisitos de imagen necesarios para obtener un modelo 3D. Se revisa la evidencia científica más relevante disponible sobre la utilidad de los modelos cardiovasculares 3D en el campo de la educación, la comunicación y la formación de los médicos especialistas y las aplicaciones de la impresión 3D en el campo de la cirugía cardiaca y del intervencionismo estructural.
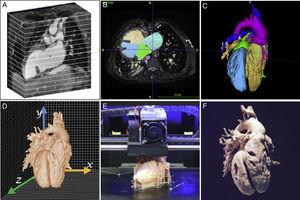
INTRODUCCIÓN A LA TECNOLOGÍALa obtención de un modelo 3D es un proceso complejo que requiere de un equipo multidisciplinario de radiólogos, cardiólogos, pediatras e ingenieros que trabajan conjuntamente en cada una de las siguientes etapas: adquisición de la imagen médica, segmentación, diseño asistido por ordenador y, finalmente, la impresión 3D (figura 1).
Los requisitos de la imagen médica son: ser 3D (isotrópica), de alta resolución espacial (finura de detalles) y con adecuado contraste (que permita distinguir estructuras adyacentes). Esto facilitará el tiempo de procesado y garantizará obtener una réplica exacta de la anatomía. Si la imagen es de baja resolución o contiene artefactos, podría parecer que estructuras vecinas como la aorta y la arteria pulmonar tienen solución de continuidad y dichas características se trasladarán al modelo 3D, con lo que se obtiene un falso diagnóstico de ventana aortopulmonar.
Cada técnica de imagen tiene sus ventajas y limitaciones. Tanto la TC1–8 como la RM9–15 son de elección para la impresión de grandes vasos, cavidades cardiacas y comunicaciones interventriculares. En ambas modalidades se debe perseguir una resolución de imagen isotrópica de 0,5-1,25mm3 en la TC y de 1,5-1,8mm3 en la RM. La ecocardiografía, por el contrario, es mejor para la impresión de válvulas, el aparato subvalvular y el tabique interauricular16–21. Al igual que en la práctica clínica, la evaluación multimodal también se puede emplear en la impresión 3D, fusionando imágenes para obtener modelos 3D con alto grado de detalle16 (figura 2A). Finalmente, en la elección de la modalidad de imagen idónea para la impresión 3D, resulta indispensable considerar la experiencia de cada centro.
A: modelo tridimensional (3D) híbrido creado a partir de imágenes de tomografía computarizada y ecocardiografía 3D para obtener el volumen de sangre y las válvulas tricúspide (verde) y mitral (rosa). Reproducido con permiso de Gosnell et al.16. B: modelo 3D que representa el miocardio del ventrículo izquierdo (ocre), la aurícula izquierda y la aorta (rojo). Esta figura se muestra a todo color solo en la versión electrónica del artículo.
El siguiente paso es la segmentación, proceso mediante el cual se seleccionan los elementos cardiovasculares de interés y se excluyen las estructuras no cardiacas que no sean relevantes, como huesos o pulmones. A grandes rasgos, en los modelos cardiacos, existen 2 estrategias: bien segmentar el volumen de sangre y dotarlo de pared (figura 2A), bien segmentar el miocardio (figura 2B). Los modelos 3D que representan la sangre facilitan una rápida comprensión de la enfermedad22, el tamaño de las estructuras, las arterias coronarias y los grandes vasos, mientras que los modelos 3D que representan el miocardio son ideales para la delineación de las comunicaciones interventriculares y la disección y permiten simular la estrategia quirúrgica13. Para la segmentación existen varios programas: algunos de ellos son versiones comerciales de pago muy completas (Materialise; Leuven, Bélgica) y algunos de ellos son gratuitos, lo que los convierte en una buena alternativa para pequeños centros que se estén iniciando en esta tecnología (ITK snap23). Para más información de los diferentes algoritmos de segmentación y metodologías, se recomienda consultar los trabajos de Suárez-Mejías et al.24 y Byrne et al.25.
Impresión tridimensionalEn términos generales, la impresión 3D se conoce como fabricación aditiva, dado que el objeto 3D se construye añadiendo nuevo material a la superficie existente a modo de capas. Los métodos de impresión más comunes son: el modelado por deposición fundida (fused deposition modelling), el sintetizado selectivo por láser (selective laser sintering) y la estereolitografía (stereolitography). Existen otros métodos de impresión 3D que también abarcan la impresión de tejidos vivos, con un grado de complejidad mucho mayor, que están fuera del propósito de esta revisión, pero que están extensamente descritos en otros artículos26,27.
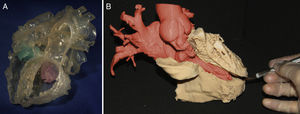
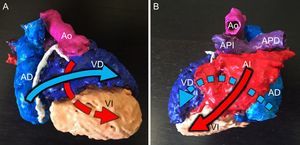
APLICACIONES DE LA IMPRESIÓN TRIDIMENSIONALEducaciónLa educación en la práctica médica depende de recursos limitados, no solo económicos sino también éticos, legales y culturales, que condicionan la disponibilidad de especímenes de cadáver. La tecnología moderna y la impresión 3D parecen ofrecer una solución en este aspecto y ya se han empleado en varios campos de la anatomía humana28. Esta aplicación cobra aún más relevancia si cabe en las cardiopatías congénitas, dado el gran espectro de malformaciones y la variabilidad incluso en un mismo tipo de cardiopatía. Conceptos tan complejos como las conexiones auriculoventriculares en criss-cross pueden demostrarse fácilmente sujetando un modelo 3D en la mano (figura 3). El estudiante puede ver, palpar y comprender los defectos anatómicos existentes. En un estudio realizado con alumnado, se utilizaron modelos 3D para explicar las características morfológicas de la tetralogía de Fallot. Los seminarios en los que se utilizaron modelos 3D fueron mejor valorados por los estudiantes que las clases en que no se utilizaron, lo que repercutió en una mayor satisfacción de los alumnos y esto, a su vez, se ha correlacionado con una mayor capacidad de memoria retentiva29.
Modelo tridimensional (3D) de un paciente con conexiones auriculoventriculares cruzadas en criss-cross. A: visión anterior. B: visión posterior. Posición contralateral de la aurícula derecha (AD) y el ventrículo derecho (VD), así como de la aurícula izquierda (AI) y el ventrículo izquierdo (VI), con el consiguiente cruce de los flujos de entrada auriculoventriculares (flechas). Ao: aorta; APD: arteria pulmonar derecha; API: arteria pulmonar izquierda.
La mejora en la educación se ve impulsada gracias a la interconectividad que ofrece internet mediante la creación de redes de colaboración online que permiten descargar el archivo de la enfermedad de interés y enviarlo directamente a imprimir a la impresora 3D. De esta forma, hospitales y centros académicos pueden tener acceso gratuito a colecciones que incluyen un gran espectro de cardiopatías30.
Pero la revolución de los modelos 3D en la enseñanza va más allá de la docencia teórica, ya que va a transformar en pocos años la formación médica, especialmente en el campo del intervencionismo percutáneo31. Alcanzar la capacitación adecuada requiere muchos recursos económicos, humanos, temporales, y además conlleva riesgo para el paciente. Este es el motivo de que varias sociedades internacionales —como la Cardiovascular and Interventional Radiological Society of Europe, la Society for Cardiovascular Angiography and Interventions, la Society of Interventional Radiology y la Radiological Society of North America— hayan comenzado a aunar esfuerzos para estandarizar que las guías de práctica médica exijan el uso de simuladores para la formación en el cateterismo cardiaco31,32. Los simuladores cardiacos que utilizan modelos 3D permiten reproducir diferentes escenarios en los que ensayar y repetir diversas técnicas y aprender de los errores sin riesgo para el paciente10. Esto puede aplicarse tanto a la capacitación previa a los primeros procedimientos en pacientes, la revalidación o la instrucción en nuevos procedimientos de mayor complejidad.
Finalmente, se puede usar los modelos 3D como herramienta durante la entrevista médica para explicar el tipo de intervención que se va a realizar, y se ha demostrado que ello mejora la satisfacción de los pacientes y la implicación con el personal médico11.
Planificación de la cirugía cardiacaCardiopatías congénitasLos modelos 3D han mostrado su utilidad para conocer de antemano el tipo de anatomía que se va a intervenir en un amplio espectro de cardiopatías congénitas, lo que aporta un grado de seguridad no igualado por las técnicas de imagen 3D convencionales, por ejemplo, para la planificación de reparaciones quirúrgicas complejas que ofrecen ventajas en la hemodinámica posquirúrgica, como la cirugía de Nikaidoh en casos de transposición de grandes arterias con comunicación interventricular y obstrucción al tracto de salida12.
También se han empleado para seleccionar a pacientes de los que se duda si son candidatos a corrección biventricular y a los que, en ausencia de modelo 3D, se habría paliado hacia la vía univentricular, tal y como demostraron Farooqi et al. en un caso de ventrículo derecho (VD) de doble salida y comunicación interventricular remota9.
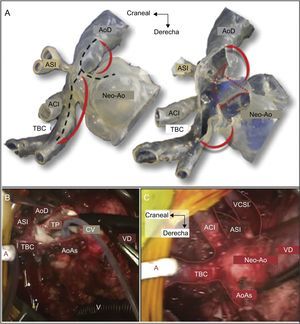
Otra aplicación con gran potencial es en la hipoplasia de cavidades izquierdas para la planificación de los diferentes estadios quirúrgicos, incluyendo las cirugías de Norwood8, Glenn2 y Fontan33. Kiraly et al. presentaron el caso de un niño de 5 años con hipoplasia de cavidades izquierdas y obstrucción en varios lugares de la aorta, en el que utilizaron un modelo 3D para planificar la cirugía de Glenn2 (figura 4). Finalmente, para los pacientes con fracaso de la circulación de Fontan, los modelos 3D también pueden ayudar a planificar la estrategia previa al trasplante34, dado que, debido a las distorsiones producidas por las intervenciones quirúrgicas previas, pueden ser necesarias variantes técnicas respecto a las de un paciente convencional.
A: simulación de la cirugía en el modelo tridimensional (3D) en la que se simula la visión intraoperatoria del cirujano; las líneas negras discontinuas representan la incisión deseada; el modelo 3D se abre y los segmentos estenóticos son resecados (líneas discontinuas rojas); los colgajos de tejido autólogo se preparan y se doblan para ampliar el arco aórtico (flechas rojas). B: visión del cirujano durante la intervención; disección desde la neoaorta a la unión con el arco transverso y ampliación extendida hacia el tronco braquiocefálico común y la aorta descendente; la membrana posterior estenótica se reseca (línea roja discontinua); la cardioplejia se inyecta en la raíz aórtica nativa utilizando un catéter de Foley de 6 Fr. C: visión intraoperatoria tras completar el parche autólogo de ampliación. ACI: arteria carótida izquierda; AoAs: aorta ascendente nativa; AoD: aorta descendente; ASI: arteria subclavia izquierda; CV: cánula venosa; Neo-Ao: neoaorta (tronco pulmonar nativo); TBC: tronco braquiocefálico; TP: tronco pulmonar; VCSI: vena cava superior izquierda; VD: ventrículo derecho. Adaptado con permiso de Kiraly et al.2. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
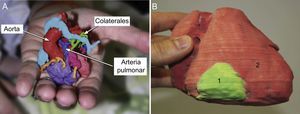
Pero, más allá de la evaluación de la anatomía intracardiaca como defectos auriculares13,21 o ventriculares20,33,35, los modelos 3D también se han utilizado para la valoración de la anatomía vascular, como en el caso de colaterales aortopulmonares de pacientes con atresia pulmonar y comunicación interventricular. Los modelos 3D permiten una planificación mucho más minuciosa de la localización y el curso tan intrincado de las colaterales, lo que es de extrema utilidad para la planificación previa a la intervención quirúrgica4,8 (figura 5A).
A: modelo tridimensional (3D) a tamaño real de un paciente de 1 día de vida con atresia de válvula pulmonar, ramas pulmonares confluentes conectadas con la arteria pulmonar (pulmonary artery) y múltiples colaterales aortopulmonares (colaterales). Reproducido con permiso de Ryan et al.4. B: modelo 3D de tumor cardiaco (1, verde) localizado en la pared libre del ventrículo derecho (2, rojo). Reproducido con permiso de Schmauss et al.35. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
La estrategia quirúrgica, en casos de tumores cardiacos y miocardiopatía hipertrófica, depende en gran medida del grado de extensión de las lesiones y condiciona optar entre resección total o parcial o trasplante cardiaco. La impresión 3D utilizando diferentes materiales y colores tiene una utilidad destacada en estos pacientes, ya que permite identificar la localización, la infiltración del tumor y las relaciones de vecindad con las válvulas, el aparato subvalvular y los músculos papilares. Esta aplicación ya se ha demostrado para la planificación de la resección total de un fibroma en el VD35 y de la miomectomía septal en un paciente con miocardiopatía hipertrófica5.
Enfermedad aórticaLa cirugía del arco aórtico sigue siendo un gran reto, dada la variabilidad de los casos de aneurismas, disección de aorta o cirugía previa. Los modelos 3D permiten la planificación y simulación de la intervención in vitro con una precisión minuciosa de los diámetros y la anatomía aórtica. Este es un requisito fundamental para la adecuada selección de las endoprótesis, tal y como publicaron Schmauss et al. sobre un paciente con aneurisma gigante de aorta, candidato a reparación mediante la técnica de trompa de elefante36. El mismo grupo también utilizó modelos 3D para la planificación de la cirugía de reemplazo valvular aórtico en un paciente con una cirugía de revascularización coronaria previa37. Otra aplicación de los modelos 3D sería ayudar a personalizar y testar los dispositivos de soporte aórtico externo (personalized external aortic root support)38. Estos dispositivos son una novedosa alternativa para estabilizar el crecimiento de la raíz aórtica en pacientes con síndrome de Marfan y así disminuir el riesgo de disección.
Simulación del intervencionismo percutáneo estructuralEs cada vez mayor el número de cardiopatías estructurales que tienen posibilidad de tratamiento mediante cateterismo intervencionista, lo que se traduce en un incremento de la complejidad de los procedimientos. En este sentido, los modelos 3D pueden ayudar tanto a la planificación de las intervenciones como a la formación de los hemodinamistas, tal y como se exponía recientemente en un artículo especial39. Solo 1 año después se han descrito nuevas aplicaciones que han superado con creces las expectativas inicialmente creadas.
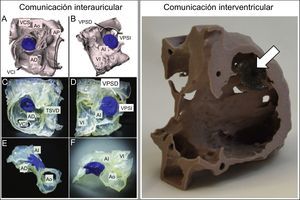
Cierre de defectos septalesEl riesgo de migración del dispositivo de cierre de comunicación interauricular se decide habitualmente en función del tamaño de la comunicación y, sobre todo, de la experiencia del hemodinamista para interpretar si los bordes son de suficientes extensión y consistencia para soportar el dispositivo40. En los casos límite en que es difícil predecir si el riesgo de embolización del dispositivo supera al riesgo de la cirugía, los modelos 3D pueden ser una herramienta útil en la toma de decisiones. En 2008 destacaron este potencial Kim et al., quienes desarrollaron los primeros prototipos de modelos 3D para ilustrar el amplio espectro de morfología y tamaños en defectos septales auriculares41. Años más tarde, Chaow et al. dieron el siguiente paso hacia la simulación in vitro con modelos 3D demostrando cómo podían ayudar a decidir cuál es el tamaño de dispositivo más adecuado en casos con deficiencia de borde posteroinferior. Es más, en los casos en que, una vez liberado el dispositivo y finalizado el procedimiento, quedan dudas sobre su adecuada colocación, los modelos 3D pueden ayudar a descartar compresiones residuales en estructuras vecinas42 (figura 6, izquierda).
Izquierda: comprobación del cierre percutáneo de comunicación interauricular tipo ostium secundum de 16 mm con dispositivo Amplatzer Septal Occluder de 17 mm (azul). A y B: segmentación de las imágenes a partir de tomografía computarizada. C-F: diferentes perspectivas para comprobar la posición adecuada y la ausencia de compresión de estructuras vasculares vecinas. Adaptado con permiso de Bartel et al.42. Derecha: simulación del cierre de comunicación interventricular posinfarto con un dispositvo Amplatzer Septal Occluder de 20 mm (flecha), visto desde el ventrículo derecho. Adaptado con permiso de Lazkani et al.43. AD: aurícula derecha; AI: aurícula izquierda; Ao: aorta; AP: arteria pulmonar; TSVD: tracto de salida del ventrículo derecho; VCI: vena cava inferior; VCS: vena cava superior; VI: ventrículo izquierdo; VPSD: vena pulmonar superior derecha; VPSI: vena pulmonar superior izquierda. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
El cierre percutáneo mediante el uso de modelos 3D también se ha aplicado en las comunicaciones interventriculares. Lazkani et al. predijeron el tipo de dispositivo y el tamaño adecuado basándose en la simulación in vitro con el modelo 3D y obtuvieron un resultado exitoso sin shunt residual en 1 paciente con comunicación interventricular posinfarto43 (figura 6, derecha).
Enfermedad mitralEl tratamiento percutáneo de la válvula mitral supone un reto intervencionista, por la variabilidad y la complejidad del complejo valvular mitral. Vaquerizo et al. publicaron anteriormente en Revista Española de Cardiología cómo los modelos 3D pueden brindar nuevas oportunidades para un mejor conocimiento de la anatomía y la interacción de la válvula mitral con los dispositivos de sustitución percutánea mitral44. Es más, los autores subrayan el potencial de los modelos 3D desde el punto de vista de la industria, ya que ofrecen la posibilidad de desarrollar y testar nuevos dispositivos en un amplio espectro de morfologías.
En otro artículo se extiende la aplicación de los modelos 3D a la planificación de la anuloplastia mitral percutánea45. La simulación con el modelo 3D sirvió para ensayar las complicadas maniobras de navegación de catéteres necesarias para avanzar desde la aorta hasta el ventrículo izquierdo y posicionar la punta del catéter entre ambos músculos papilares y en proximidad al anillo mitral. El tamaño del catéter deflector y la localización óptima respecto al anillo mitral utilizado en el paciente se eligieron de acuerdo con el modelo 3D, lo que permitió un resultado exitoso y con mayor seguridad, tal y como afirman sus autores.
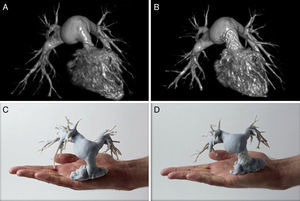
Reemplazo de válvula pulmonarLa mayoría de los pacientes operados de tetralogía de Fallot con parche transanular no son candidatos a reemplazo percutáneo de válvula pulmonar debido a la morfología tortuosa y dilatada del tracto de salida del VD. En un brillante artículo publicado por Phillips et al., explican cómo crearon modelos 3D a partir de imágenes de TC de 8 pacientes con dilatación del tracto de salida del VD46. Utilizaron los modelos 3D para simular de manera individualizada diferentes estrategias para crear una zona de anclaje estable para implante de válvula pulmonar híbrido entre cateterismo y cirugía. En los tractos de salida cuyo menor diámetro era > 26 mm, se redujo el diámetro del tracto de salida del VD implantando simultáneamente 1 o varios stents recubiertos. De este modo se creaba una zona de anclaje estable para el pre-stent sobre el que liberar la válvula pulmonar. Finalmente la luz del stent recubierto adyacente se selló mediante un dispositivo Amplatzer Vascular Plug II (St. Jude Medical). En opinión de los autores, los modelos 3D sirvieron para ayudar a todo el equipo multidisciplinario implicado a conceptualizar la intervención, probar diferentes estrategias y diseñar soluciones personalizadas para una población con anatomías tan diferentes. Esta aplicación también se ha trasladado a otras afecciones como la transposición de grandes arterias tras corrección quirúrgica de switch arterial, pacientes en los que se desarrolla estenosis supravalvular pulmonar47 (figura 7).
Reconstrucción virtual (A y B) y modelo tridimensional (C y D) de paciente de 15 años con transposición de grandes arterias y estenosis supravalvular pulmonar tras cirugía de switch arterial previa (A y C) y posterior (B y D) al implante de la válvula Melody (Medtronic). Reproducido con permiso de Poterucha et al.47.
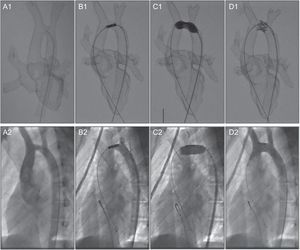
El tratamiento endovascular de la hipoplasia de arco aórtico asociada a la coartación de aorta es una alternativa a la cirugía, pero no está exenta de riesgos, ya que pueden ocluirse los troncos supraaórticos si el stent es demasiado largo o este puede migrar si se elige demasiado corto48. Nuestro grupo utilizó un modelo 3D basado en imágenes de RM de un paciente de 15 años con hipoplasia del arco para la simulación in vitro de dicho procedimiento10 (figura 8). Como este material es radioopaco, se puede visualizar la navegación de los catéteres convencionales con visión de escopia. Así se pudo ensayar ilimitadamente diferentes estrategias para determinar la longitud óptima del stent y el sitio más adecuado para su liberación. Posteriormente, en el procedimiento en el paciente, se pudo reproducir fielmente la misma técnica, catéteres y dispositivos, con lo que se minimizaron las improvisaciones y los riesgos para el paciente y se logró un procedimiento exitoso.
Colocación de un stent a un paciente de 15 años con hipoplasia del arco aórtico. Comparación entre la simulación in vitro en el modelo tridimensional (A1-D1) y en el paciente (A2-D2). Reproducido con permiso de Valverde et al.10.
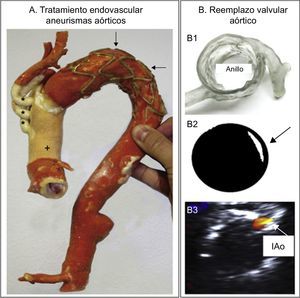
La aplicación de los modelos 3D también se ha extendido al tratamiento endovascular de los aneurismas aórticos. Sodian et al. utilizaron modelos 3D para fabricar dispositivos a medida para sellar fugas perianastomóticas en un paciente tras la sustitución quirúrgica de la aorta ascendente y el arco transverso49. Los autores concluyen que el modelo 3D sirvió no solo para planificar y simular la mejor estrategia para la oclusión del seudoaneurisma, sino que también sirvió a los ingenieros que fabricaron el dispositivo a medida para el paciente. En otro artículo el mismo grupo de investigadores aplican esta tecnología para la planificación del reemplazo percutáneo de válvula aórtica en un paciente con estenosis aórtica grave y aorta de porcelana36 (figura 9A).
A: modelo tridimensional (3D) de paciente tras procedimiento de trompa de elefante, en el que se demuestra la prótesis de reemplazo de aorta ascendente (+) y troncos supraaórticos (*). Las flechas señalan el stent. Reproducido con permiso de Schmauss et al.36. B1: modelo 3D de la raíz aórtica y arterias coronarias para evaluar la morfología. B2: predicción de la regurgitación aórtica paravalvular (flecha) tras colocación de la válvula Edwards-SAPIEN en el modelo 3D y pasar por ella un haz de luz. B3: comprobación de la regurgitación aórtica residual (IAo) en el paciente tras colocación de la válvula comprobada mediante ecocardiografía transesofágica. Adaptado con permiso de Ripley et al.50.
No obstante, uno de los estudios más minuciosos en la planificación del reemplazo percutáneo de válvula aórtica con modelos 3D fue el presentado por Ripley et al.50 (figura 9B). Evaluaron una serie de 16 pacientes sometidos a reemplazo percutáneo de válvula aórtica a los que imprimieron un modelo 3D retrospectivamente (9 con fuga paravalvular y 7 sin lesiones residuales). Evaluaron la forma y la localización de la fuga periprotésica en el modelo 3D y la compararon con la ecocardiografía posprocedimiento realizada a los pacientes. Los modelos 3D predijeron adecuadamente la existencia de dehiscencia en 6 de los 9 pacientes con fuga paravalvular (6 verdaderos positivos y 3 falsos negativos) y descartaron la presencia de fuga residual en 5 de los 7 pacientes (5 verdaderos negativos y 2 falsos positivos). Pese a que los autores reconocen que existen importantes limitaciones por resolver, como que los modelos representen exactamente las propiedades mecánicas de los tejidos, concluyen que esta tecnología está dando pasos de gigante para su implementación clínica en un futuro no muy lejano.
Obstrucciones vascularesLa obstrucción residual al drenaje venoso pulmonar en pacientes con transposición de grandes arterias corregida mediante técnica de Senning es una complicación de sobra conocida. El tratamiento percutáneo es una alternativa eficaz a la cirugía, pero requiere una planificación meticulosa para evitar complicaciones. Olivieri et al.7 se sirvieron de un modelo 3D para planificar el acceso vascular, evaluar la posición de diferentes stents en la estenosis del parche venoso y su relación con estructuras adyacentes7. Según los autores, la simulación in vitro previa permitió mejorar la eficiencia del procedimiento en el paciente y disminuir la dosis de radiación, el tiempo de procedimiento y las potenciales complicaciones.
LIMITACIONESRecientemente, Mathur et al.51 advertían que en la impresión 3D, como suele pasar ante toda tecnología emergente, no todo lo que brilla es oro y no hay que dejarse deslumbrar por el entusiasmo inicial. Así pues, se debe valorar la impresión 3D con una actitud crítica, escrutando minuciosamente sus limitaciones para así trabajar en cómo superarlas.
En un reciente metanálisis que incluye 158 estudios, las limitaciones más destacadas de la impresión 3D fueron la precisión, el tiempo de preparación y el coste económico28. En cuanto a la precisión, probablemente la segmentación sea uno de los determinantes que más influyen. La delimitación de los tejidos cardiacos actualmente requiere la intervención manual y subjetiva de un clínico con experiencia en imagen. Este proceso dependiente del operador se traduce en una inevitable variabilidad intraobservador y, sobre todo, interobservadores. Por ello se está trabajando en mejores programas que consigan una segmentación 100% automática, aunque Cai et al.52 recientemente han demostrado que aún queda mucho por hacer, dado que también hay variabilidad entre diferentes algoritmos utilizados. Sin embargo, más que comparar la reproducibilidad de los modelos 3D con la imagen radiológica, la validación definitiva se está centrando en comparar los modelos 3D con la anatomía real en muestras de autopsias53,54. En resumen, el análisis de las diferentes variables que pueden afectar a la precisión de la impresión 3D se antoja difícil y complicada. Sin embargo, es un requisito fundamental para superar la falta de control de calidad que impera actualmente y sin duda las agencias reguladoras de medicamentos no tardarán en establecer estándares de calidad previa a su estandarización en pacientes.
La otra gran limitación señalada en los modelos 3D es el tiempo total requerido para su obtención. Sin embargo, no se debe olvidar que el tiempo así considerado no deja de ser una valoración subjetiva. Por ejemplo, 10 min de tiempo ahorrado en el quirófano gracias a una planificación adecuada con un modelo 3D pueden tener el mismo valor económico que 1 h de trabajo de segmentación frente al ordenador55, y eso sin considerar otros beneficios menos tangibles como la seguridad del paciente. Para calcular el coste final de fabricación de un modelo 3D, hay que incluir todos los elementos que engranan la cadena de elaboración, como personal clínico, ingenieros, software, impresora y material. La filosofía de nuestro grupo es fabricar modelos 3D con la precisión justa para alcanzar un estándar de calidad diagnóstico, pero manteniendo el menor coste posible. Si no, es improbable que se pueda trasladar esta tecnología a todos los hospitales, y quedará relegada únicamente a los de mayor volumen o de práctica privada. Esto se consigue utilizando software libre y gratuito e impresoras de bajo coste que permiten obtener modelos con coste aproximado de 500 euros, en comparación con los 1.000 que se consiguen a través de empresas privadas o con impresoras más rápidas o de mayor calidad de acabados.
Finalmente hay que destacar que la mayoría de los estudios se limitan a una serie de casos, y que aún se está a la espera de estudios multicéntricos, aleatorizados y a gran escala que demuestren el impacto real de esta tecnología tanto en la cirugía como en el intervencionismo percutáneo.
PERSPECTIVAS FUTURASConforme la automatización de la segmentación se implemente y nuevas impresoras 3D más rápidas y económicas salgan al mercado, poco a poco serán más los hospitales y las universidades que dedicarán recursos propios para imprimir sus propios modelos, que se solicitarán como complemento de los estudios convencionales de imagen radiológica. En este sentido es fundamental la colaboración multidisciplinaria en su más amplio sentido, involucrando a radiólogos, cardiólogos, hemodinamistas y cirujanos y, sobre todo, incorporando a ingenieros en los equipos clínicos.
No hay duda de que estamos ante una tecnología inmensamente prometedora, con un impacto clínico enorme en el campo de la medicina en general y las cardiopatías congénitas y estructural en particular, que permitirá afrontar de manera más aventajada los nuevos retos diagnósticos y terapéuticos.
FINANCIACIÓNParte de esta investigación ha sido financiada por el Instituto de Salud Carlos III, del Ministerio de Ciencia e Innovación, Proyecto de Investigación en Salud, Fondo de Investigación Sanitaria número PI14/00180.
CONFLICTO DE INTERESESNinguno.
A Saúl Valverde, por su inestimable asistencia en la corrección de este manuscrito. A G. Gómez, M.N. Velasco, C. Suárez-Mejías, C. Escabias y J.A. Rivas, por el trabajo desarrollado en la línea de investigación de modelos 3D.