El impacto de un infarto de miocardio (IM) sobre la mortalidad, comparado con la gravedad de la hemorragia ocurrida tras el alta por síndrome coronario agudo, no está bien caracterizado. Definir esta relación puede ayudar a que se logre un balance riesgo-beneficio terapéutico favorable.
MétodosUtilizando modelos de Cox con fragilidad compartida, se evaluó la relación de la mortalidad con el IM y la gravedad de la hemorragia —clasificada según el Bleeding Academic Research Consortium (BARC)— en 4.229 pacientes con síndrome coronario agudo tratados con coronariografía entre enero de 2012 y diciembre de 2015.
ResultadosTanto el IM como la hemorragia se asociaron con la mortalidad (respectivamente HR = 5,8; IC95%, 3,7-9,8, y HR = 5,1; IC95%, 3,6-7,7). El IM tuvo mayor impacto en la mortalidad que las hemorragias BARC 2 y 3a: (RRR = 3,8 y RRR = 1,9; p < 0,05), pero equivalente al de las BARC 3b (RRR = 0,9; p = 0,88). El riesgo de muerte tras el IM fue menor que tras una hemorragia BARC 3c (RRR = 0,25; p < 0,001). La mortalidad tras un IM fue mayor entre los pacientes en tratamiento antiagregante plaquetario doble (TAPD) (HR = 2,9; IC95%, 1,8-4,5) que entre aquellos sin TAPD (HR = 1,5; IC95%, 0,7-3,4). Sin embargo, tras una hemorragia la mortalidad fue menor entre los pacientes en TAPD (HR = 1,6; IC95%, 1,1-2,6) que sin TAPD (HR = 3,2; IC95%, 1,7-5,8).
ConclusionesEl efecto en la mortalidad del IM o las hemorragias tras el alta por un síndrome coronario agudo depende de la gravedad de la hemorragia. Estar en TAPD en el momento del IM o la hemorragia es un modificador del ulterior riesgo de muerte.
Palabras clave
La amenaza de recurrencia tras el alta hospitalaria de un episodio isquémico entre pacientes con síndrome coronario agudo (SCA) es alta y supone un notable incremento del ulterior riesgo de muerte1–4. El tratamiento antiagregante plaquetario doble (TAPD) representa el pilar terapéutico en la prevención de las complicaciones isquémicas recurrentes para pacientes con SCA5–8. Sin embargo, la ventaja del TAPD se contrarresta con un mayor riesgo hemorrágico5–7, lo cual implica, a su vez, un riesgo observable de ulteriores complicaciones graves, como la de muerte9–12.
Algunos estudios han comparado el efecto pronóstico de las complicaciones isquémicas frente a las hemorrágicas tras el alta hospitalaria por SCA en el contexto de una intervención coronaria percutánea (ICP)9–11. No obstante, se dispone de muy pocos datos que comparen el riesgo de mortalidad asociado con el infarto de miocardio (IM) con el grado específico de gravedad de la hemorragia12. Además, todos estos estudios se realizaron con pacientes seleccionados que fueron incluidos antes de 20109–12, cuando todavía no estaba extendido el uso de los tratamientos más avanzados del SCA, hecho que limita la validez de sus hallazgos para pacientes con SCA contemporáneos no seleccionados.
De este modo, en este estudio se evaluaron los datos extraídos de dos cohortes contemporáneas de pacientes que recibieron una coronariografía intrahospitalaria durante el SCA índice para determinar el efecto relativo del IM y la gravedad de la hemorragia presentada tras el alta en la mortalidad.
MÉTODOSPoblación de pacientesEn este estudio se analizaron los datos obtenidos de un registro clínico retrospectivo combinado de 2 hospitales terciarios que incluía a todos los pacientes consecutivos ingresados en el servicio de cardiología con diagnóstico principal y establecido de SCA (n = 4.840) entre el 21 de enero de 2012 y el 31 de diciembre de 2015. El SCA se diagnosticó a partir de síntomas de reciente aparición que indicaran isquemia miocárdica, junto con uno cualquiera de los siguientes criterios: valores de biomarcadores cardiacos séricos por encima del límite superior de referencia, desviación del segmento ST en el electrocardiograma, prueba de esfuerzo hospitalaria que mostrara isquemia o antecedentes conocidos de coronariopatía. Se clasificó a los pacientes según presentaran IM con elevación del segmento ST o SCA sin elevación del ST (IM sin elevación del segmento ST o angina de pecho inestable). El diagnóstico de angina inestable exigía la presencia de síntomas que la indicaran junto con la evidencia objetiva de isquemia miocárdica en la prueba de esfuerzo, o la detección de la lesión causal en un 50% en la coronariografía, además de valores de biomarcadores cardiacos séricos inferiores al límite superior de referencia.
Conforme al propósito del estudio, se excluyó a los pacientes que fallecieron durante la hospitalización (n = 199). Además, puesto que en el presente estudio se proponía evaluar los efectos pronósticos del IM y la hemorragia por separado, se excluyó a los pacientes que presentaron ambas complicaciones durante el seguimiento (n = 23). También se excluyó a los pacientes no sometidos a coronariografía durante el ingreso índice (n = 187) y a los perdidos para el seguimiento (n = 202). Por lo tanto, la cohorte definitiva del presente estudio incluyó a 4.229 pacientes.
Objetivo del estudio, definiciones y seguimientoEl objetivo primario de interés para el análisis es la muerte por cualquier causa. Se pretende evaluar la asociación de la mortalidad por cualquier causa tanto con el IM como con la presencia y la gravedad de la hemorragia. El objetivo secundario es describir las tasas de mortalidad cardiovascular y no cardiovascular según el estado del IM y la hemorragia durante el seguimiento.
Este estudio solo incluye la primera complicación hemorrágica y el primer IM ocurridos durante el seguimiento. Personal que ignoraba los objetivos de interés para el análisis se encargó de la asignación del IM y las complicaciones hemorrágicas.
La comprobación del estado del IM y de la hemorragia durante el seguimiento se realizó entre septiembre y octubre de 2016. Se revisaron la historia médica electrónica y el archivo de las consultas médicas e historias clínicas del hospital. De cada paciente incluido en el estudio se disponía de información sobre las características de complicaciones hemorrágicas, lugar, gravedad clínica, pruebas de diagnóstico por la imagen, valores de hemoglobina y transfusiones sanguíneas.
El IM ocurrido durante el seguimiento se definió como de tipo 1 (IM espontáneo), de tipo 3 (muerte cardiaca por IM sin disponer de los valores de marcadores cardiacos séricos) o de tipo 4b (IM asociado con trombosis del stent), según la clasificación Third Universal Definition13.
Las complicaciones hemorrágicas se clasificaron según los criterios del Bleeding Academic Research Consortium (BARC)14. Debido al carácter retrospectivo del estudio y la dificultad que entrañaba la asignación de hemorragias de tipo BARC 1, este tipo no se incluyó en el estudio. Puesto que el resultado principal del análisis es la mortalidad, las complicaciones hemorrágicas correspondientes a la definición de hemorragia de clase BARC 5 (muerte cardiaca por hemorragia) no se analizan por separado, sino que se distribuyen entre las otras clases según la valoración inicial descrita anteriormente15,16. Por lo tanto, las hemorragias evaluadas en este estudio son las de los tipos BARC 2, 3a, 3b, y 3c.
La causa de muerte (cardiovascular frente a no cardiovascular) se clasifica según las definiciones de Hicks et al.17. Cuando no se disponía de información suficiente o no se lograba un consenso sobre la causa de la muerte, esta se incluyó dentro del grupo denominado «causa de muerte desconocida o inclasificable».
Análisis estadísticoLas características basales y clínicas se refieren al estado del IM y de la hemorragia ocurridos tras el alta hospitalaria. Los datos se presentan como mediana [intervalo intercuartílico] para las variables continuas y como número de casos (porcentaje) para las variables categóricas. Se utilizó la prueba de suma de rangos de Wilcoxon para comparar las diferencias de las variables continuas entre los pacientes que presentaron complicaciones hemorrágicas o IM y los que no. Las variables categóricas se compararon con la prueba de la χ2.
Debido a que el estado del IM y de la hemorragia varía con el tiempo, se investigó el efecto ajustado del IM y la hemorragia ocurridos tras el alta en la ulterior mortalidad por cualquier causa mediante modelos de Cox con fragilidad compartida, con el IM y la hemorragia como covariables dependientes del tiempo. Para el propósito anterior, se utiliza el comando introducido por el usuario «strmcure» (sin proporción de pacientes curados y con no estratificación), lo que permite probar el efecto directo e indirecto de la variable de exposición inicial en el objetivo final18. En el primer modelo «strmcure», se investigó el efecto general del IM y la hemorragia ocurridos tras el alta. En otro modelo, además del IM tras el alta, se introdujo la gravedad de las complicaciones hemorrágicas de tipo BARC como una covariable jerárquica dependiente del tiempo, en la que el estado de máximo riesgo es la hemorragia BARC 3c seguida de la 3b, la 3a y, por último, la de tipo 2.
Al objeto de conseguir datos sobre la influencia de encontrarse en TAPD en el momento del IM o de la hemorragia en el riesgo de mortalidad, se efectuó un análisis complementario mediante covariables categóricas dependientes del tiempo, tanto para el IM como para la hemorragia, con distintos valores según el paciente estuviera en TAPD o no en el momento de la complicación respectiva.
Se ajustaron todos los modelos de regresión mediante covariables que difiriesen significativamente entre los grupos según el estado del IM y de la hemorragia o que tuvieran una plausible relación con la mortalidad. Se transformaron las variables continuas que no cumpliesen la premisa de linealidad. Se incluyeron las siguiente covariables en los modelos de regresión: edad ≥ 65 años, sexo femenino, índice de masa corporal, tabaquismo actual, hipertensión, dislipemia, diabetes mellitus, cardiopatía isquémica previa, antecedentes de insuficiencia cardiaca congestiva o de fracción de eyección del ventrículo izquierdo < 40%, vasculopatía previa, antecedentes de hemorragia, neoplasia maligna, enfermedad pulmonar obstructiva crónica, tipo de SCA, valores séricos iniciales de creatinina y de hemoglobina, enfermedad coronaria multivaso, ICP o cirugía de revascularización aortocoronaria hospitalarias, tratamiento al alta y centro de estudio.
Se utiliza el método Bootstrap (500 iteraciones) para calcular y determinar la significación estadística, las hazard ratio (HR) y sus intervalos de confianza del 95% (IC95%).
Con el fin de determinar el número de muertes atribuibles al IM o a la hemorragia, se aplicó una HR ajustada para cada complicación al número real de fallecimientos según la fórmula siguiente: número de muertes entre pacientes con IM o hemorragia × [HR ajustada – 1] / HR ajustada.
El efecto diferencial en la mortalidad del IM frente a cada tipo de hemorragia BARC que se evalúa se generó desde los modelos de Cox ajustados correspondientes usando el comando lincom y expresando dicho efecto mediante el cociente de riesgo relativo (RRratio).
Por último, se investigó el patrón temporal del riesgo de muerte asociado con el IM y la hemorragia tras el alta como una función del tiempo transcurrido desde la primera complicación. Con dicho propósito se determinó la forma funcional de la relación entre el riesgo instantáneo de muerte ajustado y el tiempo transcurrido desde la hemorragia o el IM mediante la técnica de polinomiales fraccionados. Se trazó la curva resultante junto con el IC95% de la media.
Los valores se consideraron estadísticamente significativos con un valor de p < 0,05. Para todos los análisis estadísticos se utilizó el paquete estadístico Stata/MP versión 13.1.
El estudio se atuvo a las normas éticas establecidas en la Declaración de Helsinki y fue aprobado por el comité de ética local.
RESULTADOSComplicaciones durante el seguimientoDurante el seguimiento, con una mediana de 455 [377-783] días, 204 pacientes tuvieron un IM (tasa bruta: 3,1/100 personas/año; IC95%, 2,65-3,49). La mediana de tiempo transcurrido desde el alta hospitalaria hasta el primer episodio de IM fue de 192 [56-340] días. La mayoría de los IM ocurridos tras el alta fueron de tipo IM sin elevación del segmento ST (83,8%), mientras que 12 de los IM tuvieron desenlace de muerte, el 62,8% de los cuales tuvieron IM con elevación del segmento ST como causa.
Quinientos pacientes presentaron una complicación hemorrágica (tasa bruta: 7,7/100 personas/año; IC95%, 7,01-8,36), con una distribución de complicaciones hemorrágicas según los tipos BARC 2, 3a, 3b y 3c por 359 (8,5%), 61 (1,4%), 49 (1,2%) y 31 (0,7%) pacientes respectivamente.
La mediana de tiempo transcurrido desde el alta hospitalaria hasta las complicaciones hemorrágicas de tipo BARC 2, 3a, 3b y 3c fue 300 [117-405], 149 [41-410], 167 [82-321] y 314 [177-622] días respectivamente.
En su conjunto, el 91,2% de las hemorragias fueron espontáneas (es decir, no relacionadas con procedimientos). Alrededor de la mitad de los episodios hemorrágicos (53%) fueron de origen gastrointestinal y 9 de ellos, con desenlace de muerte; la hemorragia intracraneal supuso el 55,6% de las muertes.
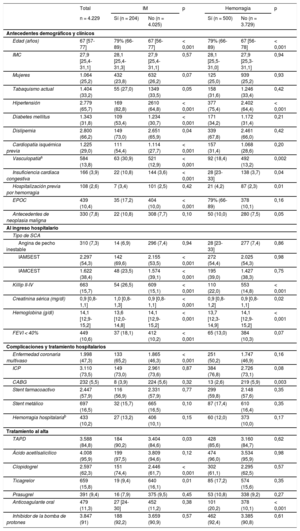
Las características basales y clínicas por estado de IM y hemorragia tras el alta se presentan en la tabla 1. En resumen, los pacientes que tuvieron un IM tras el alta eran más ancianos y en general tenían una carga de comorbilidad mayor (hipertensión, diabetes, dislipemia, vasculopatía previa, insuficiencia cardiaca y enfermedad pulmonar obstructiva crónica) que los pacientes que no presentaron un IM. También eran más propensos a una tener enrmedad coronaria multivaso, aunque presentaban una tasa de ICP hospitalaria similar a la de los pacientes sin IM tras el alta y mayor probabilidad de recibir clopidogrel al alta hospitalaria.
Características basales y clínicas por estado de IM y hemorragia tras el alta
| Total | IM | p | Hemorragia | p | |||
|---|---|---|---|---|---|---|---|
| n = 4.229 | Sí (n = 204) | No (n = 4.025) | Sí (n = 500) | No (n = 3.729) | |||
| Antecedentes demográficos y clínicos | |||||||
| Edad (años) | 67 [57-77] | 79% (66-89) | 67 [56-77] | < 0,001 | 79% (66-89) | 67 [56-78] | < 0,001 |
| IMC | 27,9 [25,4-31,1] | 28,1 [25,4-31,3] | 27,9 [25,4-31,1] | 0,57 | 28,1 [25,5-31,0] | 27,9 [25,3-31,1] | 0,94 |
| Mujeres | 1.064 (25,2) | 432 (23,8) | 632 (26,2) | 0,07 | 125 (25,0) | 939 (25,2) | 0,93 |
| Tabaquismo actual | 1.404 (33,2) | 55 (27,0) | 1349 (33,5) | 0,05 | 158 (31,6) | 1.246 (33,4) | 0,42 |
| Hipertensión | 2.779 (65,7) | 169 (82,8) | 2610 (64,8) | < 0,001 | 377 (75,4) | 2.402 (64,4) | < 0,001 |
| Diabetes mellitus | 1.343 (31,8) | 109 (53,4) | 1.234 (30,7) | < 0,001 | 171 (34,2) | 1.172 (31,4) | 0,21 |
| Dislipemia | 2.800 (66,2) | 149 (73,0) | 2.651 (65,9) | 0,04 | 339 (67,8) | 2.461 (66,0) | 0,42 |
| Cardiopatía isquémica previa | 1.225 (29,0) | 111 (54,4) | 1.114 (27,7) | < 0,001 | 157 (31,4) | 1.068 (28,6) | 0,20 |
| Vasculopatíaa | 584 (13,8) | 63 (30,9) | 521 (12,9) | < 0,001 | 92 (18,4) | 492 (13,2) | 0,002 |
| Insuficiencia cardiaca congestiva | 166 (3,9) | 22 (10,8) | 144 (3,6) | < 0,001 | 28 [23-33] | 138 (3,7) | 0,04 |
| Hospitalización previa por hemorragia | 108 (2,6) | 7 (3,4) | 101 (2,5) | 0,42 | 21 (4,2) | 87 (2,3) | 0,01 |
| EPOC | 439 (10,4) | 35 (17,2) | 404 (10,0) | < 0,001 | 79% (66-89) | 378 (10,1) | 0,16 |
| Antecedentes de neoplasia maligna | 330 (7,8) | 22 (10,8) | 308 (7,7) | 0,10 | 50 (10,0) | 280 (7,5) | 0,05 |
| Al ingreso hospitalario | |||||||
| Tipo de SCA | |||||||
| Angina de pecho inestable | 310 (7,3) | 14 (6,9) | 296 (7,4) | 0,94 | 28 [23-33] | 277 (7,4) | 0,86 |
| IAMSEST | 2.297 (54,3) | 142 (69,6) | 2.155 (53,5) | < 0,001 | 272 (54,4) | 2.025 (54,3) | 0,98 |
| IAMCEST | 1.622 (38,4) | 48 (23,5) | 1.574 (39,1) | < 0,001 | 195 (39,0) | 1.427 (38,3) | 0,75 |
| Killip II-IV | 663 (15,7) | 54 (26,5) | 609 (15,1) | < 0,001 | 110 (22,0) | 553 (14,8) | < 0,001 |
| Creatinina sérica (mg/dl) | 0,9 [0,8-1,1] | 1,0 [0,8-1,3] | 0,9 [0,8-1,1] | < 0,001 | 0,9 [0,8-1,2] | 0,9 [0,8-1,1] | 0,02 |
| Hemoglobina (g/dl) | 14,1 [12,9-15,2] | 13,6 [12,0-14,8] | 14,1 [12,9-15,2] | < 0,001 | 13,7 [12,3-14,9] | 14,1 [12,9-15,2] | < 0,001 |
| FEVI < 40% | 449 (10,6) | 37 (18,1) | 412 (10,2) | < 0,001 | 65 (13,0) | 384 (10,3) | 0,07 |
| Complicaciones y tratamiento hospitalarios | |||||||
| Enfermedad coronaria multivaso | 1.998 (47,3) | 133 (65,2) | 1.865 (46,3) | < 0,001 | 251 (50,2) | 1.747 (46,9) | 0,16 |
| ICP | 3.110 (73,5) | 149 (73,0) | 2.961 (73,6) | 0,87 | 384 (76,8) | 2.726 (73,1) | 0,08 |
| CABG | 232 (5,5) | 8 (3,9) | 224 (5,6) | 0,32 | 13 (2,6) | 219 (5,9) | 0,003 |
| Stent farmacoactivo | 2.447 (57,9) | 116 (56,9) | 2.331 (57,9) | 0,77 | 299 (59,8) | 2.148 (57,6) | 0,35 |
| Stent metálico | 697 (16,5) | 32 (15,7) | 665 (16,5) | 0,10 | 87 (17,4) | 610 (16,4) | 0,35 |
| Hemorragia hospitalariab | 433 (10,2) | 27 (13,2) | 406 (10,1) | 0,15 | 60 (12,0) | 373 (10,0) | 0,17 |
| Tratamiento al alta | |||||||
| TAPD | 3.588 (84,8) | 184 (90,2) | 3.404 (84,6) | 0,03 | 428 (85,6) | 3.160 (84,7) | 0,62 |
| Ácido acetilsalicílico | 4.008 (95,9) | 199 (97,5) | 3.809 (94,6) | 0,12 | 474 (96,0) | 3.534 (95,9) | 0,98 |
| Clopidogrel | 2.597 (62,3) | 151 (74,4) | 2.446 (61,7) | < 0,001 | 302 (61,1) | 2.295 (62,5) | 0,57 |
| Ticagrelor | 659 (15,8) | 19 (9,4) | 640 (16,1) | 0,01 | 85 (17,2) | 574 (15,6) | 0,35 |
| Prasugrel | 391 (9,4) | 16 (7,9) | 375 (9,5) | 0,45 | 53 (10,8) | 338 (9,2) | 0,27 |
| Anticoagulante oral | 479 (11,3) | 27 [24-30] | 452 (11,2) | 0,38 | 101 (20,2) | 378 (10,1) | < 0,001 |
| Inhibidor de la bomba de protones | 3.847 (91) | 188 (92,2) | 3.659 (90,9) | 0,57 | 462 (92,4) | 3.385 (90,8) | 0,61 |
BARC: Bleeding Academic Research Consortium; CABG: cirugía de revascularización aortocoronaria; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; IAMSEST: infarto agudo de miocardio sin elevación del segmento ST; ICP: intervención coronaria percutánea; IM: infarto de miocardio; IMC: índice de masa corporal; SCA: síndrome coronario agudo; TAPD: tratamiento antiagregante plaquetario doble.
Los valores expresan n (%) o mediana [intervalo intercuartílico].
Los pacientes que experimentaron una complicación hemorrágica tras el alta eran mayores, tenían mayor carga de comorbilidad (hipertensión, vasculopatía previa e insuficiencia cardiaca) y ya habían tenido hemorragia con mayor frecuencia que los pacientes que no presentaron hemorragias. Incluso tenían menor probabilidad de someterse a cirugía de revascularización aortocoronaria hospitalaria y mayor frecuencia de anticoagulantes orales al alta.
Durante el seguimiento se produjeron 335 muertes. El número de pacientes que fallecieron por IM o hemorragia se recogen en la tabla 2. Al estimarse como covariables dependientes del tiempo en el modelo de ajuste multivariable, tanto el IM (HR = 5,8; IC95%, 3,7-9,8) como las hemorragias en su conjunto (HR = 5,1; IC95%, 3,6-7,7) se asociaron significativamente con la mortalidad. La mortalidad atribuible al IM fue del 10,6%, mientras que la atribuible a las hemorragias fue del 16,8%.
Tasa de mortalidad bruta por infarto de miocardio y hemorragia tras el alta y su efecto (hazard ratio) en la posterior mortalidad por cualquier causa
| Complicación | Pacientes, n | Muertes, n | Tasa bruta de mortalidad (cada 100 personas/año) (IC95%) | HRa ajustada IC95% | p | Mortalidad atribuibleb, n (%) |
|---|---|---|---|---|---|---|
| Sin complicaciones | 3.525 | 222 | 3,5 (3,1-4,0) | — | — | — |
| IM | 204 | 43 | 20,7 (15,4-27,9) | 5,8 (3,7-9,8) | < 0,001 | 36 (10,6) |
| Hemorragia | 500 | 70 | 18,4 (14,5-23,2) | 5,1 (3,6-7,7) | < 0,001 | 56 (16,8) |
EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; HR: hazard ratio; IC95%: intervalo de confianza del 95%; ICP: intervención coronaria percutánea; IM: infarto de miocardio; SCA: síndrome coronario agudo.
Ajustado por edad ≥ 65 años, sexo femenino, índice de masa corporal, tabaquismo actual, hipertensión, dislipemia, diabetes mellitus, cardiopatía isquémica previa, antecedentes de insuficiencia cardiaca congestiva o FEVI < 40%, vasculopatía previa, antecedentes de hemorragia, neoplasia maligna, EPOC, tipo de SCA, valores séricos iniciales de creatinina y hemoglobina, enfermedad coronaria multivaso, ICP o cirugía de revascularización aortocoronaria hospitalarias, tratamiento al alta y centro de estudio.
El análisis pormenorizado de los modelos de Cox univariable y multivariable se muestra en la tabla 1 del material suplementario y la tabla 2 del material suplementario.
Al repetir este análisis e incluir únicamente a los pacientes que recibieron TAPD al alta hospitalaria (n = 3.588, con 189 IM, 428 complicaciones hemorrágicas y 270 muertes), los resultados no variaron sustancialmente: HR = 5,7 (IC95%, 3,6-9,3) para el IM y HR = 5,4 (IC95%, 3,6-8,1) para las hemorragias (tabla 3 del material suplementario).
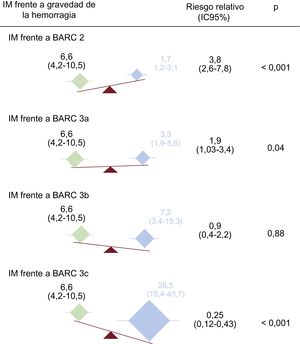
El efecto diferencial ajustado sobre la mortalidad del IM y de cada una de las 4 categorías BARC de gravedad se presenta en la figura 1. Se produjo un incremento escalonado de menor a mayor gravedad de la categoría de hemorragia BARC en el riesgo de mortalidad ajustado. El riesgo instantáneo relativo de muerte se cuatriplicó en el grupo de pacientes que tuvieron IM frente a una hemorragia BARC 2 (6,6 frente a 1,7; RRratio, 3,8; IC95%, 2,6-7,8; p < 0,001] y casi se duplicó el de pacientes que tuvieron un IM frente a una hemorragia BARC de tipo 3a (6,6 frente a 3,3; RRratio, 1,9; IC95%, 1,03-3,4; p = 0,04). Por el contrario, no se encontró una diferencia significativa al comparar el IM con la hemorragia BARC 3b (6,6 frente a 7,2; RRratio, 0,9; IC95%, 0,4-2,2; p = 0,88). Sin bargo, el riesgo de mortalidad asociado con el IM fue significativamente menor (4 veces menor) que el asociado con la hemorragia BARC 3c (HR = 26,5 frente a 6,6; RRratio, 0,25; IC95%, 0,12-0,43; p < 0,001).
Efecto diferencial en la posterior mortalidad del IM tras el alta frente a la gravedad de la hemorragia. El IM y la hemorragia se representan en verde y azul respectivamente. BARC: Bleeding Academic Research Consortium; IC95%: intervalo de confianza del 95%; IM: infarto de miocardio. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Cuando se repitió el análisis previo y se incluyó únicamente a los 3.588 pacientes que habían recibido TAPD al alta, se apreciaron resultados similares a los observados en el conjunto de la cohorte (figura 1 del material suplementario).
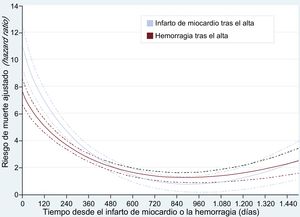
El riesgo de mortalidad ajustado tanto tras IM como tras hemorragia se elevó al máximo poco después de la aparición de estos episodios y, a pesar de que mostrara enseguida una desaceleración sustancial, se mantuvo significativo durante algunos meses (figura 2). Se observó un patrón similar en el grupo de pacientes dados de alta con TAPD (figura 2 del material suplementario).
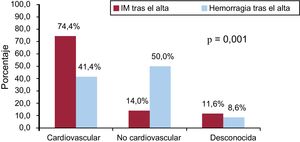
La tasa de muerte cardiovascular total fue del 45,4% (n = 152/335) y 47 pacientes (14%) fallecieron por causa de muerte desconocida o inclasificable. La tasa de muerte cardiovascular de los pacientes con IM fue del 74,4% (n = 32/43) frente al 41,4% (n = 29/70) de los pacientes con hemorragia tras el alta (p < 0,001) (figura 3). Se observaron tasas similares de causa de muerte desconocida o inclasificable tras IM (11,6%) y tras hemorragia (8,6%) durante el seguimiento (p = 0,6). La causa de muerte específica por IM y complicaciones hemorrágicas se muestra en la figura 3 del material suplementario.
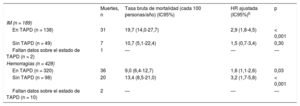
El efecto en la mortalidad de estar en TAPD en el momento del IM o la hemorragia tras el alta se presenta en la tabla 3 del material suplementario. En los 3.588 pacientes dados de alta con TAPD, se produjeron 189 IM, 428 complicaciones hemorrágicas y 270 muertes (tasa de mortalidad bruta, 3,2/100 personas/año; IC95%, 2,8-3,7).
Se dispuso de los datos sobre el TAPD en el momento del IM o la hemorragia de todos los pacientes excepto 12 (2 IM y 10 complicaciones hemorrágicas). El 73% de los pacientes que tuvieron un IM (n = 138/189) estaban en TAPD. De los pacientes que presentaron una complicación hemorrágica, el 74,8% (n = 320/428) se encontraba en TAPD.
El riesgo de mortalidad tras un IM casi se triplicó entre los pacientes en TAPD (HR = 2,9; IC95%, 1,8-4,5) respecto a los pacientes sin TAPD (HR = 1,5; IC95%, 0,7-3,4). Por el contrario, el riesgo de mortalidad asociado con hemorragia se dividió por 2 en los pacientes con TAPD (HR = 1,6; IC95%, 1,1-2,6) frente al grupo sin TAPD (HR = 3,2; IC95%, 1,7-5,8) (tabla 3).
Efecto del IM y la hemorragia tras el alta en la posterior mortalidad estratificado según el paciente esté en tratamiento antiagregante plaquetario doble en el momento de cada complicacióna
| Muertes, n | Tasa bruta de mortalidad (cada 100 personas/año) (IC95%) | HR ajustada (IC95%)b | p | |
|---|---|---|---|---|
| IM (n = 189) | ||||
| En TAPD (n = 138) | 31 | 19,7 (14,0-27,7) | 2,9 (1,8-4,5) | < 0,001 |
| Sin TAPD (n = 49) | 7 | 10,7 (5,1-22,4) | 1,5 (0,7-3,4) | 0,30 |
| Faltan datos sobre el estado de TAPD (n = 2) | 1 | — | — | — |
| Hemorragias (n = 428) | ||||
| En TAPD (n = 320) | 36 | 9,0 (6,4-12,7) | 1,6 (1,1-2,6) | 0,03 |
| Sin TAPD (n = 98) | 20 | 13,4 (8,5-21,0) | 3,2 (1,7-5,8) | < 0,001 |
| Faltan datos sobre el estado de TAPD (n = 10) | 2 | — | — | — |
EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; HR: hazard ratio; IC95%: intervalo de confianza del 95%; ICP: intervención coronaria percutánea; IM: infarto de miocardio; SCA: índrome coronario agudo; TAPD: tratamiento antiagregante plaquetario doble.
Edad ≥ 65 años, sexo femenino, índice de masa corporal, tabaquismo actual, hipertensión, dislipemia, diabetes mellitus, cardiopatía isquémica previa, antecedentes de insuficiencia cardiaca congestiva o FEVI < 40%, vasculopatía previa, antecedentes de hemorragia, neoplasia maligna, EPOC, tipo de SCA, valores basales de creatinina y hemoglobina, enfermedad coronaria multivaso, ICP o cirugía de revascularización aortocoronaria hospitalarias, tratamiento al alta y centro de estudio.
Se observaron algunos hallazgos dignos de mención en esta cohorte contemporánea. En primer lugar, se demostró que el riesgo de mortalidad tras un IM es significativamente mayor que después de una hemorragia BARC 2 o 3a e igual que después de una hemorragia BARC 3b. Por el contrario, el riesgo de mortalidad tras una hemorragia BARC 3c es significativamente mayor que tras un IM.
En segundo lugar, se confirma que la relación temporal entre el riesgo de muerte tras un IM o una hemorragia es equivalente y se caracteriza porque se eleva al máximo precozmente tras manifestarse la complicación para enseguida experimentar una desaceleración sustancial y mantenerse significativamente alto durante algunos meses. En tercer lugar, se observó que los pacientes que tuvieron un IM tras el alta fallecieron sobre todo por causas cardiovasculares, al contrario que los pacientes con complicaciones hemorrágicas tras el alta, que fallecieron principalmente por causas no cardiovasculares. En cuarto lugar, se demostró que estar en TAPD en el momento del IM o la hemorragia es un modificador del riesgo de mortalidad. Aunque el riesgo instantáneo de mortalidad asociado con el IM tras el alta es superior entre los pacientes en TAPD que en aquellos sin TAPD, el resultado fue el opuesto en el caso de la hemorragia tras el alta, que entrañó mayor riesgo de mortalidad para los pacientes sin TAPD que para aquellos en TAPD.
Este es el primer estudio de una cohorte de pacientes con SCA contemporánea y consecutiva que compara el efecto del IM y la gravedad de la hemorragia tras el alta en la mortalidad, y que evalúa la influencia en la mortalidad de encontrarse en TAPD en el momento en que tuvieron lugar estas complicaciones. Algunos estudios han analizado la asociación de la mortalidad con las complicaciones trombóticas o hemorrágicas tras el alta en el caso de un SCA; sin embargo, en muy pocas publicaciones se ha comparado vis a vis el efecto pronóstico de dichas complicaciones.
Un análisis retrospectivo realizado por Kazi et al.10, a partir de una base de datos administrativa, mostró riesgos de mortalidad comparables asociados con IM (HR = 1,9) y hemorragia (HR = 1,6) tras el alta en los pacientes sometidos a intervención coronaria percutánea entre 1996 y 2008. Sin embargo, en este estudio la definición de hemorragia se limitaba a hemorragia que exige hospitalización, las complicaciones no estaban actualizadas conforme a la gravedad de la hemorragia y no se disponía de datos sobre importantes predictores de la mortalidad, como la anatomía coronaria y la fracción de eyección del ventrículo izquierdo.
En un análisis a posteriori del registro PARIS, Baber et al.11 informaron sobre un riesgo de mortalidad similar asociado con IM o trombosis del stent (HR = 3,3) y con hemorragia (BARC 2 y 3) (HR = 3,5) a 2 años en 5.018 pacientes sometidos a ICP. No obstante, las complicaciones hemorrágicas tenidas en cuenta fueron únicamente BARC 2 y 3, dejando de lado la gravedad de la hemorragia BARC 3 (BARC 3a, 3b y 3c). Igualmente, este estudio solo incluía los episodios sin desenlace de muerte, hecho que puede haber influido en el efecto de las complicaciones isquémicas o hemorrágicas en la mortalidad. Además, el estudio PARIS se realizó antes de 2011, menos del 45% de los pacientes presentaban SCA y casi todos los participantes estaban tratados con clopidogrel (∼6%, con prasugrel).
Un tercer estudio se basó en la población del ensayo clínico TRACER. En ese interesante estudio, Valgimigli et al.12 demostraron que el riesgo de muerte tras un IM es superior al asociado con la hemorragia BARC 2 y 3a, equivalente a la hemorragia BARC 3b y solo es menor que es de la hemorragia BARC 3c. Sin embargo, el estudio previo incluía exclusivamente a pacientes con SCA sin elevación del ST, se seleccionó a todos los participantes antes de 2011, no se administró prasugrel o ticagrelor a ningún paciente y tampoco se abordó la influencia en la mortalidad del TAPD en el momento del IM o la hemorragia.
Por lo tanto, los hallazgos de estos 3 estudios no pueden generalizarse al conjunto de pacientes con SCA o aplicarse a la práctica actual.
En nuestra cohorte se confirman los hallazgos de Valgimigli et al.12 y se extrapola el conocimiento a todos los pacientes con SCA. También se investigó en la presente cohorte la influencia en la mortalidad del TAPD en el momento del IM o la hemorragia. Se observó un riesgo de mortalidad tras un IM de los pacientes con TAPD superior al de aquellos sin él. Al contrario, se observó un riesgo de mortalidad tras una complicación hemorrágica en los pacientes con TAPD menor que en aquellos sin TAPD. Estos resultados igualan a los publicados sobre la población de pacientes con ICP del estudio PARIS11. El exceso del riesgo de muerte de los pacientes que tuvieron un IM a pesar de encontrarse en TAPD puede deberse a la presencia de un entorno protrombótico acentuado o a la falta de adherencia terapéutica, o puede constituir un marcador de una población que se encuentra en un estado de mayor gravedad. Con independencia de estos posibles factores, la asociación entre la administración continua de TAPD y el incremento del riesgo de muerte tras un IM apuntan a que aún queda lugar para el tratamiento antitrombótico intensivo al menos en el caso de algunos de estos pacientes.
Es preciso mencionar que el reducido número de muertes ocurridas tras un IM entre los pacientes sin TAPD en este estudio hace que los resultados sean especulativos y deban confirmarse en cohortes más amplias.
Cabe destacar que la elevada mortalidad asociada con un episodio hemorrágico cuando el paciente no se encuentra en TAPD puede relacionarse no solo con la interrupción del TAPD, sino también con la suspensión de cualquier otra medicación de demostrada eficacia pronósotica en pacientes con SCA, y/o puede ser un marcador de pacientes expuestos a mayor riesgo (es decir, un factor de confusión inducido por la indicación del tratamiento) que no se ha recogido completamente en el análisis multivariable. El menor riesgo de mortalidad entre los pacientes que tuvieron hemorragia estando en TAPD frente a los que la presentaron sin TAPD puede indicar que este todavía puede funcionar tras presentarse la complicación hemorrágica y que se requiere un enfoque más preciso y personalizado en la toma de decisiones clínicas concernientes a la suspensión del TAPD tras una hemorragia.
Reviste interés en este estudio el hecho de que el riesgo de mortalidad tras IM y hemorragia se elevó al máximo pronto y descendió sustancialmente a partir de ese momento. Este hallazgo es de interés clínico, ya que puede facilitar la identificación de los periodos críticos tras la aparición de estas complicaciones. Hay que añadir que el efecto en la mortalidad que persiste algunos meses tras un IM o una hemorragia puede ayudar a dilucidar resultados contradictorios publicados por otros autores9,11,19. En un estudio en el que todos los pacientes presentaban SCA, el efecto de la hemorragia se limitó a los primeros 40 días tras la complicación9. En un segundo estudio, que incluyó a pacientes con IM con elevación del segmento ST, la recurrencia del IM mantuvo su efecto en la mortalidad durante más de 1 año, mientras que el efecto de la hemorragia grave remitió a los 30 días de la complicación19. Recientemente, Baber et al.11 demostraron que el efecto de la hemorragia en la mortalidad se prolongaba 2 años tras la complicación, a diferencia del efecto del IM, que desaparecía de manera significativa después del primer año. Por último, un estudio de Valle et al.20 indica que la hemorragia tras el alta todavía se asocia con muerte incluso después de una mediana de seguimiento de 665 [375-730] días. No obstante, es importante advertir que conciliar estos resultados inconcordantes es un reto, pues afectan a poblaciones diversas, tipos y definiciones de complicaciones distintos y diferentes métodos estadísticos.
Es importante que en este estudio también se publique la secuencia temporal del IM y la hemorragia tras el alta. La identificación de los periodos de mayor vulnerabilidad a IM y hemorragia tras el alta en el contexto de un SCA puede ayudar a centrar la atención del médico en estos periodos, lo cual optimizaría esfuerzos y recursos en su prevención.
En su conjunto, los resultados de este estudio aportan conocimiento para una mejor comprensión del riesgo que entrañan un IM o una hemorragia tras el alta en el contexto de un SCA y su efecto pronóstico diferencial en la mortalidad. Estos hallazgos demuestran la necesidad de actuar con cautela ante pacientes expuestos a riesgo de IM y hemorragia tras el alta. Se merecen seguimiento y evaluación estrechos, puesto que el IM y la hemorragia se presentan precozmente y conllevan un considerable riesgo de muerte. El TAPD reduce el riesgo de IM tras el alta en el contexto de un SCA, aunque esta ventaja quede neutralizada por la exposición a mayor riesgo hemorrágico. Este estudio muestra algunos aspectos relevantes que pueden facilitar el diseño de una estrategia terapéutica óptima del TAPD de modo que se logre un balance riesgo-beneficio terapéutico favorable.
LimitacionesEl presente análisis es un estudio retrospectivo con las limitaciones propias de este tipo de diseño. Otra limitación importante es que adolece de los datos de seguimiento de 202 pacientes que fueron excluidos del análisis principal. Aunque, en principio, esto pudiera suponer un sesgo de selección, se realizó una comparación entre los pacientes de los que faltaban datos de seguimiento y los que no, y el resultado no reveló diferencias significativas entre ambos grupos (tabla 4 del material suplementario). Igualmente, a pesar de que se intentara recopilar todos los episodios de IM y complicaciones hemorrágicas durante el seguimiento, no se puede descartar la posibilidad de que la tasa de IM se haya subestimado. Tampoco se recopilaron datos sobre las hemorragias BARC 1 y 4. Sin embargo, esto puede constituir una limitación menor, ya que en algunos estudios la hemorragia BARC 1 no se asoció con un incremento significativo del riesgo de muerte. Además, la hemorragia BARC 4 tras el alta es infrecuente, puesto que muy pocos pacientes se someten a cirugía de revascularización aortocoronaria durante el seguimiento.
Tampoco se recogieron datos sobre los IM de tipo 2 (infarto de miocardio secundario a un desequilibrio isquémico), tipo 4a (IM asociado con ICP) o tipo 5 (IM asociado con cirugía de revascularización aortocoronaria), de ahí que estos hallazgos no puedan extrapolarse a todos los tipos de IM. Hay que añadir que no se efectuó el análisis de subgrupo conforme al inhibidor del receptor plaquetario P2Y12 debido al tamaño muestral relativamente pequeño, por lo que los resultados no pueden extrapolarse a los distintos tipos de inhibidores del P2Y12.
Por último, no se pudo caracterizar el pronóstico de pacientes con IM o complicaciones hemorrágicas recurrentes porque solo se disponía del primer IM y la primera complicación hemorrágica durante el seguimiento. Así pues, los resultados del estudio no pueden extrapolarse a este grupo particular de pacientes, hecho que, teniendo en cuenta los estudios previos, puede significar cerca del 1% de la población de pacientes con SCA12.
CONCLUSIONESEl efecto diferencial del IM tras el alta comparado con la hemorragia tras el alta en la mortalidad depende fundamentalmente de la gravedad de la hemorragia. El IM tiene mayor efecto en la mortalidad que las hemorragias BARC 2 y 3a, mientras que el riesgo de mortalidad es similar en los casos del IM y la hemorragia BARC 3b. Muy al contrario que la hemorragia BARC 3c, que entraña un riesgo de mortalidad superior al del IM. Tanto el IM como las complicaciones hemorrágicas presentaban similares patrones temporales del riesgo instantáneo de mortalidad asociado. Que el paciente esté en TAPD en el momento del IM o la hemorragia es un modificador del ulterior riesgo de mortalidad. Estos hallazgos pueden contribuir a definir el riesgo y el perfil beneficioso de los medicamentos antitrombóticos.
CONFLICTO DE INTERESESE. Abu-Assi es Editor Asociado de Revista Española de Cardiología.
- –
El IM y la hemorragia ocurridos tras el alta aumentan el posterior riesgo de muerte.
- –
Se desconoce la magnitud del riesgo de mortalidad después de un IM frente al grado específico de gravedad de la hemorragia en pacientes con SCA consecutivos contemporáneos.
- –
Actualmente la influencia en la mortalidad de estar en TAPD en el momento del IM o la hemorragia tras el alta en el contexto de un SCA no está suficientemente caracterizado.
- –
El riesgo de mortalidad tras un IM es mayor que tras complicaciones hemorrágicas BARC 2 y 3a, pero es equivalente al de una BARC 3b.
- –
El riesgo de muerte tras una complicación hemorrágica BARC 3c es significativamente superior que después de un IM.
- –
Un IM ocurrido mientras el paciente está en TAPD entraña mayor riesgo de mortalidad que si el paciente está sin TAPD. Por el contrario, una complicación hemorrágica mientras el paciente está en TAPD frente a sin TAPD se asocia con menor riesgo de mortalidad.
- –
La causa de muerte después de un IM es primordialmente cardiovascular, al contrario que tras una complicación hemorrágica, que principalmente es no cardiovascular.