Con el número cada vez mayor de supervivientes al cáncer, a menudo con enfermedades cardiovasculares o factores de riesgo preexistentes o nuevos, ha surgido la necesidad de una nueva especialidad en el ámbito de la atención cardiovascular que pueda evaluar y tratar a estos pacientes, conjuntamente con nuestros colegas de hematología y oncología. De la misma manera, todos los proveedores de atención médica que participan en el cuidado de pacientes con cáncer y enfermedad cardiaca deben ser plenamente conscientes del impacto adverso de la enfermedad cardiovascular en la supervivencia de estos pacientes. La colaboración es necesaria para mitigar el efecto de la toxicidad cardiovascular asociada con estas terapias anticancerosas que salvan vidas. Los cardio-oncólogos tienen un papel fundamental en la unión entre las dos especialidades creando un plan integral para abordar las comorbilidades y proporcionando orientación para la elección del tratamiento óptimo. En esta revisión de 3 partes se describen: a) el impacto significativo de las terapias anticancerosas en la salud cardiovascular de los pacientes con cáncer y los supervivientes a este; b) la ventaja de un equipo multidisciplinario para abordar estas complicaciones cardiovasculares, y c) la prestación de atención clínica a los pacientes con cáncer y enfermedad cardiaca.
Palabras clave
El cáncer y las enfermedades cardiovasculares (ECV) pueden coexistir en un mismo paciente debido a la presencia de factores de riesgo comunes y por el envejecimiento1; además, cada vez hay más datos que indican una mayor prevalencia de las ECV en los pacientes a los que se diagnostica un cáncer2. Además, las terapias oncológicas pueden tener multitud de efectos en el sistema cardiovascular (CV), según cuál sea el tipo de tratamiento aplicado. Por otro lado, para un paciente con cáncer y una ECV preexistente al que se aplica un tratamiento oncológico, aumenta el riesgo de aparición de cardiotoxicidad3. Se ha descrito que las complicaciones CV tienen profundas repercusiones en la calidad de vida y la supervivencia de los pacientes con cáncer4,5, lo cual implica que su identificación y tratamiento temprano deben pasar a ser un elemento importante de la asistencia general prestada a los pacientes con cáncer6–8.
Esto ha llevado al surgimiento de una nueva disciplina denominada «cardio-oncología», que aborda las necesidades CV de los pacientes con cáncer y optimiza su asistencia con un enfoque multidisciplinario. Este nuevo campo tiene como objetivo controlar de manera óptima los efectos CV adversos del tratamiento del cáncer, así como facilitar la asistencia general de los pacientes con cáncer desde la evaluación inicial hasta la supervivencia6.
En esta revisión se recogen las repercusiones importantes que tienen los tratamientos oncológicos en la salud CV de los pacientes con cáncer y los pacientes que han sobrevivido a un cáncer, así como las ventajas de un servicio integral de cardio-oncología para abordar la toxicidad CV y prestar la asistencia clínica a los pacientes con cáncer y cardiopatías.
DEFINICIÓN DEL RIESGOEn las últimas 2 décadas se han producido mejoras importantes en la asistencia de los pacientes con cáncer. La combinación de un diagnóstico precoz del cáncer, el uso de los nuevos tratamientos dirigidos, la radioterapia y las técnicas quirúrgicas más radicales ha llevado a una disminución de la mortalidad asociada al cáncer9,10. Se estima que en Estados Unidos hay 14,5 millones de personas que han sobrevivido a largo plazo a un cáncer pediátrico o del adulto, y se prevé que esta cifra alcance los 19 millones en 20249,11,12. Sin embargo, los tratamientos eficaces del cáncer pueden conllevar complicaciones CV a corto y a largo plazo que pueden comprometer los beneficios clínicos obtenidos al influir en la calidad de vida y la supervivencia5,6,9,10 (figura 1)5. De hecho, el riesgo de muerte CV con algunos grupos de tumores puede superar el de la recaída del tumor en muchos tipos de cáncer13,14.
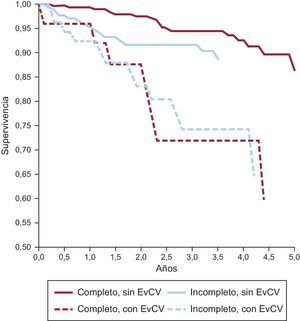
Eventos cardiovasculares (EvCV) en pacientes que reciben un tratamiento completo o incompleto con trastuzumab. Se observa que los pacientes con EvCV tienen una peor supervivencia, tanto si se completa el tratamiento con trastuzumab como si no. Reproducido de Wang et al.5 con permiso.
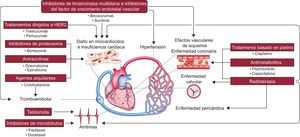
La totalidad del sistema CV puede verse afectada por los tratamientos oncológicos, si bien la cardiotoxicidad se define principalmente en función de los cambios en la fracción de eyección del ventrículo izquierdo (VI)10,15. El espectro de los efectos CV adversos de los tratamientos oncológicos incluye la disfunción del VI y la insuficiencia cardiaca (IC), los síndromes coronarios agudos, la hipertensión, las alteraciones del ritmo, los episodios tromboembólicos, las valvulopatías y la enfermedad pericárdica (figura 2)16.
Esquema general de los efectos adversos cardiovasculares de la quimioterapia y la radioterapia. HER2: receptor del factor de crecimiento epidérmico humano 2. Reproducido de Lenneman et al.16 con permiso.
La disfunción del VI y la IC son las manifestaciones más frecuentes. La incidencia de disfunción del VI e IC oscila entre el 5 y el 25% de los pacientes tratados con antraciclinas17,18; entre el 2 y el 33% con un tratamiento dirigido al factor de crecimiento endotelial vascular (VEGF)16,19, y entre los pacientes tratados con terapias dirigidas al receptor del factor de crecimiento epidérmico humano 2 (HER2), el de la IC es de alrededor de un 2,5% y el de la disfunción VI, del 11,2%20. La miocardiopatía inducida por antraciclinas con frecuencia es irreversible si no se identifica pronto, puesto que el inicio temprano de un tratamiento estándar para la IC es uno de los factores cruciales para su recuperación16,17,21. Puede conducir a una IC terminal progresiva con un pronóstico peor que el de las miocardiopatías isquémica o dilatada, y posiblemente peor incluso que el de la recaída del cáncer6,22,23.
La hipertensión sistémica (de nuevo inicio o agravamiento de la ya existente) se ha identificado como un efecto adverso frecuente asociado a los inhibidores del VEGF. La incidencia de hipertensión oscila entre el 19,1 y el 44,4%; la más baja es la observada en los pacientes tratados con sorafenib y la más alta, la que se da con regorafenib24. Se ha descrito que la hipertensión de grado alto (grado 3 o 4) secundaria al tratamiento con axitinib se asocia con una morbilidad significativa y podría conducir a la necesidad de reducir la dosis o interrumpir el tratamiento con este fármaco25.
Las arritmias, especialmente las bradiarritmias, son la toxicidad observada con mayor frecuencia a causa de los inhibidores de microtúbulos, como el docetaxel y el paclitaxel26. Se ha observado una bradicardia asintomática y autolimitada en hasta un 29% de los pacientes26. En comparación, las arritmias graves, como las taquiarritmias supraventricular y ventricular, son muy poco frecuentes (incidencias del 0,24 y el 0,26% respectivamente) y además suelen ser autolimitadas16,26–28. El riesgo de prolongación del QT varía con los distintos fármacos; el que tiene un efecto más importante es el trióxido de arsénico. Este fármaco prolonga el intervalo QT en un 26–93% de los pacientes, y no es infrecuente que se registren arritmias letales como la torsade de pointes29. De entre los demás tratamientos oncológicos, los inhibidores de la tirosincinasa, y concretamente el vandetanib, ocupan el segundo lugar en cuanto a la incidencia de prolongación del QT30–32.
El síndrome coronario agudo puede incluir la totalidad del espectro que va de la angina inestable al infarto agudo de miocardio e incluso la muerte súbita cardiaca. Se trata de un efecto adverso de algunos tratamientos oncológicos muy poco frecuente, pero que puede ser grave24. El síndrome coronario agudo prematuro es una de las consecuencias tardías más preocupantes de la quimioterapia basada en cisplatino, y se da en un 5,6–6,7% de los pacientes, con un riesgo relativo 3 veces superior al de los individuos de control de la misma edad16,33. En cambio, la isquemia cardiaca es una complicación a corto plazo que se asocia con el antimetabolito 5–fluorouracilo, así como los inhibidores de VEGF, con una incidencia que va del 1,5 al 2%34–36.
El riesgo de complicaciones CV que los tratamientos oncológicos implican se ve potenciado por otros factores propios del paciente y del tratamiento, como las enfermedades CV subyacentes, el tratamiento combinado y la radioterapia previa6. Por ejemplo, Armstrong et al.37 indicaron que los factores de riesgo CV, y en especial la hipertensión, aumentaban significativamente el riesgo de enfermedad coronaria (riesgo relativo [RR] = 6,1), IC (RR = 19,4), valvulopatía (RR = 13,6) y arritmia (RR = 6,0) de los pacientes supervivientes a un cáncer que habían recibido tratamiento de radioterapia torácica o quimioterapia con antraciclinas. Además, el riesgo de cada evento cardiaco aumentaba con el incremento en el número de factores de riesgo CV.
Considerados en conjunto, estos datos indican que las complicaciones CV son frecuentes y tienen trascendencia clínica. Esto justifica que los oncólogos/hematólogos y los cardiólogos estén pendientes de los posibles riesgos cardiacos del tratamiento oncológico, sobre todo en los pacientes en los que se han identificado factores de riesgo, así como de la necesidad de un diagnóstico temprano y un tratamiento inmediato de los factores de riesgo CV o de las complicaciones, para evitar o minimizar el riesgo de eventos cardiacos que pueden ser graves en los pacientes con cáncer o que han sobrevivido a él.
PROGRAMA MULTIDISCIPLINARIO DE CARDIO-ONCOLOGÍALa comunidad médica es cada vez más consciente de los posibles problemas CV en los pacientes con cáncer y los que han sobrevivido a él, tal como se ha resaltado recientemente en una encuesta nacional38 y una encuesta internacional39 sobre cardio-oncología. Sin embargo, la encuesta internacional señaló también la existencia de grandes diferencias en la práctica clínica entre los cardiólogos y los oncólogos por lo que respecta al diagnóstico, el tratamiento y el seguimiento de los pacientes oncológicos con riesgo de complicaciones CV, así como en el tratamiento clínico adecuado de los pacientes oncológicos que presentan una disfunción cardiaca relacionada con el tratamiento del cáncer (DCRTC). Por ejemplo, en un caso de DCRTC inducida por trastuzumab, los oncólogos mostraron una mayor probabilidad de «interrumpir el tratamiento con trastuzumab y reanudarlo si la fracción de eyección se normaliza», mientras que los cardiólogos mostraron una mayor tendencia a «interrumpir el tratamiento con trastuzumab definitivamente», con lo que se priva a estos pacientes de un tratamiento que puede salvarles la vida39. Además, en la práctica clínica habitual con pacientes que han sobrevivido a un cáncer, es bajo el cumplimiento de la vigilancia cardiaca y el tratamiento de la IC según lo recomendado por las guías. Lamentablemente, la disfunción cardiaca se suele diagnosticar tardíamente en el contexto de los signos y síntomas de la IC y se trata de manera inapropiada40. Por consiguiente, un abordaje multidisciplinario que combine el conocimiento experto de cardiología y oncología en un trabajo de colaboración es crucial para optimizar la evolución clínica de los pacientes8,41–44.
Efectos beneficiosos aportados por la asistencia multidisciplinaria en cardio–oncologíaLos equipos multidisciplinarios deberán mejorar la coordinación, la comunicación y la toma de decisiones acordadas por los miembros del equipo cardiaco y los pacientes, y ayudarán a mejorar su evolución45. El proceso de derivación del paciente por parte de los profesionales de la salud de primera línea puede verse facilitado a través de un punto de acceso común, como la historia clínica electrónica. Esto, junto con la facilidad de la derivación, deberá acelerar la evaluación del paciente, así como la vigilancia cardiaca, y mejorará su satisfacción con la asistencia46. Las reuniones de grupo con participantes expertos en múltiples campos de interés para la cardio-oncología permitirían reducir las lagunas existentes en el conocimiento y mejorar la homogeneidad de la asistencia prestada a los pacientes46,47. Esto resulta especialmente importante, puesto que actualmente se carece de guías para el tratamiento CV de los pacientes con cáncer, antecedentes de cáncer y tratamiento de las complicaciones CV del tratamiento del cáncer. Solo existe un documento de consenso de un grupo de expertos de la American Society of Echocardiography y la European Association of Cardiovascular Imaging15, y en 2016 la Canadian Cardiovascular Society acaba de publicar su guía para la evaluación y el tratamiento de las complicaciones CV del tratamiento del cáncer31. Además, la evidencia existente indica que la asistencia interdisciplinaria de los pacientes, incluida la consulta de cardiología en el tratamiento de los pacientes con DCRTC40 así como en otras poblaciones de IC48,49, mejora los resultados clínicos. La asistencia cardiológica se asoció a mayores tasas de tratamiento de la IC según lo recomendado en las guías40,48,49 y una mejor supervivencia40,48 en comparación con lo observado con la asistencia prestada por médicos de otras especialidades. También hay evidencia reciente de que la derivación a una consulta de cardio-oncología se asocia con altas tasas de pacientes que completan el tratamiento del cáncer, lo que podría mejorar su evolución clínica al aumentar la probabilidad de remisión del cáncer46,50.
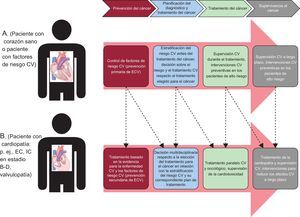
ObjetivosLa cardio-oncología es una subespecialidad médica orientada a prestar una asistencia CV integral a los pacientes con cáncer desde su diagnóstico hasta la supervivencia posterior. El centro de interés principal consiste en prestar apoyo a los pacientes con cáncer mediante la estratificación del riesgo CV, la supervisión CV durante y después del tratamiento del cáncer y el tratamiento de la enfermedad CV preexistente y de nuevo diagnóstico. El elemento clave en los pacientes con alto riesgo son las medidas preventivas, en función de cuáles sean los factores de riesgo asociados, con objeto de preservar la salud CV. Para los pacientes con una cardiopatía, el abordaje multidisciplinario de la elección del tratamiento oncológico sería la conducta más apropiada para minimizar la cardiotoxicidad31,38,46 (figura 3)38. Las estrategias de prevención y tratamiento de la cardiotoxicidad serán importantes para que se pueda aplicar un tratamiento óptimo del cáncer al tiempo que se protege la salud CV, y para mejorar, por lo tanto, los resultados cardiológicos y oncológicos1,8,38,46.
Ejemplo del espectro continuo de la asistencia cardiovascular en la cronología del diagnóstico del cáncer, su tratamiento y la supervivencia al cáncer. El paciente A representa a un paciente sin enfermedad cardiovascular existente y el paciente B, a uno con un trastorno cardiovascular preexistente. CV: cardiovascular; EC: enfermedad coronaria; ECV: enfermedad cardiovascular; IC: insuficiencia cardiaca. Reproducido de Barac et al.38 con permiso.
Otros objetivos que debe explicar la cardio-oncología son el diseño de estrategias innovadoras para diagnosticar y prevenir la cardiotoxicidad y la elaboración de guías basadas en la evidencia, es decir, estandarizar el diagnóstico, el tratamiento y el seguimiento de la cardiotoxicidad50,51. De hecho, están en curso trabajos de investigación para elaborar instrumentos prácticos de estratificación del riesgo cardiaco, que permitan seleccionar mejor a los pacientes que pueden obtener un efecto beneficioso de una supervisión cardiaca más intensiva durante el tratamiento del cáncer y el seguimiento, identificar la mejor estrategia en la elección y tratamiento iniciales de la cardiotoxicidad para evitar secuelas a largo plazo52–54 e identificar las consecuencias cardiacas a largo plazo de estos tratamientos en los supervivientes al cáncer y mejorar la vigilancia cardiaca en esa población50.
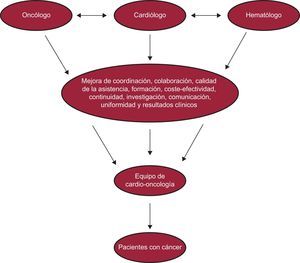
Para alcanzar este objetivo, es necesario que haya una colaboración organizada y una continua comunicación entre las diferentes partes implicadas en la asistencia de los pacientes con cáncer, con objeto de poner en común los conocimientos expertos y las responsabilidades8,55,56 (figura 4)57.
Equipo multidisciplinario de cardio-oncología. Reproducido de Barros-Gomes et al.57 con permiso.
Una clínica multidisciplinaria de oncología cardiaca requiere la participación de muchos tipos de profesionales de la salud, como cardiólogos, hematólogos-oncólogos, oncólogos radioterapeutas, cirujanos oncológicos y personal de apoyo clínico, como auxiliares administrativos, enfermeras y auxiliares médicos (enfermeras especialistas/asociados médicos). Según cuál sea la situación clínica, podría ser necesaria también la participación de dietistas, farmacéuticos, terapeutas psicosociales, fisiólogos del ejercicio, especialistas en cuidados paliativos y profesionales de la atención primaria8,46,58.
Todos los participantes deben tener una plataforma de comunicación común, que puede ser proporcionada por la historia clínica electrónica. Mientras que el hematólogo/oncólogo será quien aporte conocimientos sobre el tratamiento más actualizado, lo ideal es que el cardiólogo tenga un conocimiento experto adicional por lo que respecta a la IC o a las técnicas de imagen CV, para tomar decisiones basadas en los antecedentes, la exploración física y las imágenes de alta calidad, para asegurar que se aporte el mejor tratamiento. Se espera de él que proporcione recomendaciones respecto a estrategias de tratamiento para asegurar una máxima seguridad cardiaca8,58,59. El personal de apoyo clínico es esencial, como en cualquier otra consulta médica, para programar todas las citas necesarias, que incluyen (aunque sin limitarse a ellas) las de quimioterapia, exploraciones radiológicas, visitas psicosociales, de dietética, cardio-oncología, oncología, cirugía, etc.; la educación sanitaria y la implicación de los pacientes, y con los pacientes más estables, las enfermeras especializadas o médicos colaboradores podrían realizar el seguimiento y liberar algo de tiempo del cardio-oncólogo que incluiría en su actividad clínica a pacientes más complejos58.
De ser posible, cada uno de los miembros del equipo debe tener contacto con el paciente en la visita inicial para identificar sus necesidades de asistencia y examinar las estrategias de tratamiento. Se debe tener en cuenta los trastornos físicos, mentales y sociales al formular la estrategia de tratamiento. Este enfoque de equipo permitirá abordar cualquier nuevo motivo de preocupación dirigiendo al paciente al miembro adecuado del equipo para su tratamiento. Este abordaje integral no solo aportará beneficio al paciente, sino que también mejorará la eficiencia del servicio de cardio-oncología46.
Situación actualCon la creciente necesidad de los pacientes, están surgiendo numerosos programas clínicos de cardio-oncología, sobre todo en los centros académicos, que se han añadido a los pocos programas pioneros en cardio-oncología, como los de MD Anderson Cancer Center, Memorial Sloan Kettering Cancer Center, Vanderbilt-Ingram Cancer Center, University of Pennsylvania Abramson Cancer Center, Mayo Clinic y Dana-Farber Cancer Institute. En Estados Unidos, un equipo multidisciplinario presta el 27% de los servicios de cardio-oncología, según indica una reciente encuesta cardiaca de ámbito nacional; el principal motivo de la remisión a este servicio es la consulta preoperatoria (35%). En el 16% de los casos, la consulta cardiaca la proporciona un solo cardiólogo con un conocimiento experto en cardio-oncología38. En una encuesta nacional de profesionales de la salud que participaban en el tratamiento de pacientes con cáncer expuestos a una terapia cardiotóxica, se observó que se disponía de una consulta especializada en cardio-oncología en el 54% de los centros académicos y en el 29% de los hospitales generales39. En nuestro centro, la práctica de la cardio-oncología se inició de forma establecida en 2013 a través de consultas por medios electrónicos («e–consultas»). Estos tipos de consultas surgieron como un mecanismo para prestar una asistencia clínica eficiente y rápida a través de la historia clínica electrónica, sin necesidad de interacción personal57. Con el aumento de la complejidad de la población oncológica, se añadieron a ello consultas personales que pasaron a ser el principal modo de asistencia. En 2014 se puso en marcha una clínica de cardio-oncología especializada que ha tenido un crecimiento significativo en los últimos 3 años.
De igual modo, es importante incorporar normas de calidad como las propuestas por la Sociedad Española de Cardiología para las clínicas de IC, que podrían aplicarse a estas unidades que se están convirtiendo cada vez más en una parte integrante de la práctica clínica actual. De este modo, los pacientes obtienen un efecto beneficioso de un abordaje del diagnóstico y el tratamiento similar entre los distintos centros de cardio-oncología, lo cual facilita el proceso de acreditación y la investigación interinstitucional que deberá aplicarse en un futuro próximo60.
Sin duda alguna, la cardio-oncología es un campo de la medicina en rápida evolución. Esto se refleja, entre otros, en el aumento de la concienciación de la comunidad médica en cuanto a la importancia de la asistencia CV para los pacientes con cáncer, el crecimiento exponencial de las publicaciones sobre cardio-oncología, el reconocimiento de la especialidad por el American College of Cardiology en 2015, la aparición de revistas y revisiones de cardio-oncología y el número creciente de congresos internacionales dedicados a esta especialidad8,38.
ASISTENCIA CLÍNICA CARDIOVASCULAR DE LOS PACIENTES ONCOLÓGICOS Y LOS QUE HAN SOBREVIVIDO A UN CÁNCEREs necesario un enfoque multidisciplinario que incorpore el conocimiento experto de cardiología y de oncología para la evaluación CV de los pacientes antes, durante y después del tratamiento del cáncer.
Identificación de la población en alto riesgoAntes del inicio del tratamiento oncológico, los pacientes deben ser estratificados respecto a su riesgo basal de cardiotoxicidad, lo cual permitirá al cardiólogo facilitar mejor a los oncólogos la individualización del tratamiento y la definición del tipo de seguimiento cardiaco que deberá aplicarse15. En los pacientes de riesgo bajo, el seguimiento cardiaco puede no ser necesario, con lo que los recursos de asistencia sanitaria podrán dedicarse a los pacientes con mayor riesgo, para los que es preciso considerar la conveniencia de una estrategia de vigilancia más agresiva31. En general, se considera que los pacientes con enfermedad CV establecida o factores de riesgo de sufrirla, edad avanzada y exposición a un tratamiento oncológico combinado tienen alto riesgo de sufrir cardiotoxicidad31. Se han utilizado varios modelos de riesgo para predecir la cardiotoxicidad del tratamiento del cáncer31. Nosotros propusimos una puntuación del riesgo de cardiotoxicidad que incluye factores de riesgo relacionados con la medicación y relacionados con el paciente6. Elementos como la edad (< 15 o > 65 años), el sexo femenino, los antecedentes de miocardiopatía y la IC, la enfermedad coronaria, la hipertensión, la diabetes, el uso previo o simultáneo de antraciclinas y la radioterapia torácica previa o simultánea son criterios que se han utilizado para identificar a los pacientes en riesgo. Además de los antecedentes y la exploración física completos, se recomienda el empleo de pruebas diagnósticas como el electrocardiograma, la ecocardiografía con strain y la determinación de la troponina durante la evaluación cardiaca basal y en el seguimiento15. De ser posible, esta evaluación deberá realizarse a todos los pacientes a los que se aplican tratamientos potencialmente cardiotóxicos, o al menos los considerados en alto riesgo de cardiotoxicidad15,61–63.
Detección y prevención de la cardiotoxicidadEl seguimiento de los pacientes se realiza generalmente de manera secuencial para identificar posibles signos de disfunción del VI (es decir, DCRTC definida como una disminución de la fracción de eyección del VI > 10% con un valor absoluto < 53%) o una disfunción del VI subclínica (strain longitudinal anormal). Aunque no se emplean habitualmente en la práctica clínica, los biomarcadores cardiacos (es decir, troponina, péptido natriurético cerebral) son un instrumento diagnóstico fiable para la identificación temprana y el seguimiento de la cardiotoxicidad31,64. Los electrocardiogramas iniciales y periódicos son útiles para los tratamientos oncológicos que se asocian con aumento del riesgo de arritmia. Se recomienda vigilar la presión arterial de los pacientes tratados con inhibidores de VEGF31.
Actualmente existen 2 artículos de posicionamiento con recomendaciones respecto a la frecuencia y las pruebas que utilizar para el diagnóstico por imagen cardiaca de los pacientes durante y después del tratamiento del cáncer; sus protocolos de vigilancia se basan en métodos derivados de ensayos clínicos y opiniones de expertos15,61. La técnica de imagen (ecocardiografía, ventriculografía radioisotópica y resonancia magnética cardiaca) para monitorizar la función del VI dependerá de la disponibilidad y el conocimiento experto locales, así como de la situación clínica; se da preferencia a la ecocardiografía con técnicas de imagen tridimensionales, dado que es transportable y de fácil acceso15,61. En el caso de las antraciclinas, el consenso de expertos internacionales recomienda una evaluación ecocardiográfica basal, con un seguimiento al finalizar el tratamiento y al cabo de 6 meses. Si la dosis empleada es > 240 mg/m2, se recomienda una evaluación en cada ciclo adicional de tratamiento15. La European Society of Medical Oncology recomienda realizar ecocardiografías en la situación basal, al finalizar el tratamiento, cada 3 meses durante los primeros 12 meses, y luego 1 vez al año61. Por lo que respecta a los inhibidores del VEGF, el consenso de expertos internacional recomienda evaluación basal con ecocardiografía y seguimiento al cabo de 1 mes y luego cada 3 meses durante el tratamiento15. Sin embargo, en el caso de los tratamientos dirigidos a HER2, parece haber consenso en evaluar la función del VI en la situación basal y luego cada 3 meses durante el tratamiento15,31,65.
La vigilancia a largo plazo de los pacientes que han sobrevivido a un cáncer depende principalmente de la presencia de factores de riesgo modificadores y de usar una estrategia para la detección precoz de la disfunción del VI subclínica durante el tratamiento, según lo indicado por el consenso de expertos internacional15. Si no hay un riesgo CV concomitante ni antecedentes de radioterapia, cuando el strain longitudinal general es estable durante la quimioterapia y es normal 6 meses después de completado el tratamiento con antraciclinas, o cuando las troponinas se han mantenido negativas durante todo el tratamiento, no es necesario un mayor seguimiento con técnicas de imagen para detectar la DCRTC. Para los pacientes que no han sido objeto de seguimiento con técnicas de imagen para determinar el strain o la concentración de troponina, se propone una evaluación clínica CV al año, para detectar posibles signos y síntomas iniciales de ECV. Para los pacientes que han recibido radioterapia concomitante, es necesario un seguimiento según el consenso de expertos publicado por la American Society of Echocardiography y la European Association of Cardiovascular Imaging66. La National Comprehensive Cancer Network recomienda ecocardiografía en el plazo de 1 año tras finalizar el tratamiento oncológico. En el caso de los pacientes de edad avanzada que han sobrevivido a un cáncer, se recomienda una mayor vigilancia, especialmente en los casos de exposición a dosis altas de antraciclinas61. El seguimiento con técnicas de imagen a largo plazo de niños, adolescentes y adultos jóvenes que han sobrevivido a un cáncer depende de la edad en el momento de aplicar el tratamiento y la dosis acumulada de antraciclina, así como de la radioterapia concomitante67.
La utilidad de la vigilancia en general no está clara68,69. Una de las razones es el hecho de que no haya evidencia de que las estrategias de detección temprana de la disfunción del VI mejoran los resultados CV y generales de estos pacientes31. Así pues, existe una urgente necesidad de estudios de colaboración que permitan orientar el tratamiento de los pacientes. El empleo de registros prospectivos amplios permitiría elaborar modelos de riesgo para predecir los eventos CV en los pacientes que han sobrevivido a un cáncer, así como evaluar el efecto de las estrategias de vigilancia en la prevención de la cardiotoxicidad31.
CONCLUSIONESEn esta nueva era en el tratamiento del cáncer, los profesionales de la salud son más conscientes de todo el espectro de toxicidades CV que pueden darse durante o después del tratamiento y pueden comprometer la supervivencia total del paciente. Se están desarrollando programas multidisciplinarios de cardio-oncología para mejorar la asistencia de los pacientes y sus resultados. La colaboración es el elemento central en este campo interdisciplinario. La cardio-oncología es un campo de la medicina en rápida evolución y se están realizando nuevos trabajos para esclarecer cuáles son las intervenciones preventivas más eficaces para el paciente cardio-oncológico.
CONFLICTO DE INTERESESNinguno.