Los dispositivos de asistencia ventricular izquierda (DAVI) han cambiado el pronóstico de la insuficiencia cardiaca terminal y sirven como puente hasta el trasplante cardiaco (TxC) para los pacientes que están en lista de espera. La colocación de la cánula a través de la pared toracoabdominal puede causar complicaciones abdominales.
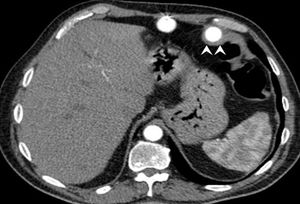
Se presenta el caso de un varón de 58 años, fumador, con hipertensión, diabetes mellitus tipo 2 y cardiopatía isquémica desde 1997. Se decidió el implante de un DAVI pulsátil paracorpóreo (DAVI-PP), Berlin Heart Excor (BH), por cardiopatía isquémica en insuficiencia cardiaca terminal, INTERMACS (Interagency Registry for Mechanically Assisted Circulatory Support) 3 como puente al TxC, y el BH univentricular se colocó satisfactoriamente sin complicaciones. El tratamiento antitrombótico consistió en enoxaparina, dipiridamol y ácido acetilsalicílico según protocolo. El paciente sufrió episodios repetidos de hemorragia gastrointestinal, sin hallazgos en las endoscopias seriadas ni en la tomografía compuratizada abdominal, en la que se observó contacto directo de tejido cicatricial rodeando la cánula de entrada del BH a nivel de la flexura esplénica del colon (figura 1). El tratamiento antitrombótico se redujo durante la hemorragia, y dentro de la bomba externa apareció un trombo de alto riesgo embólico, por lo que se reemplazó el ventrículo artificial sin más complicaciones.
Tras 104 días de asistencia, se intervino al paciente para trasplante. La retirada del dispositivo se llevó a cabo tras el implante de injerto durante la misma intervención quirúrgica para reducir el tiempo de isquemia y evitar complicaciones hemorrágicas al eliminar la cánula tras la reversión de la heparina. Hubo dificultades para extraer la cánula ventricular, ya que estaba muy adherida, pero no se observaron complicaciones quirúrgicas relevantes.
Durante el periodo posoperatorio, el paciente sufrió disfunción ventricular derecha transitoria, que se trató con fármacos inotrópicos y vasopresores. El tratamiento con inmunosupresores consistió en 20 mg de basiliximab, 500 mg de metilprednisolona y 1.000 mg de micofenolato mofetilo para la inducción y metilprednisolona (0,8mg/kg/día), micofenolato mofetilo (1.000 mg 2 veces al día) y tacrolimus (el inicio se retrasó hasta 14 días debido a insuficiencia renal) para el mantenimiento. También se administró tratamiento profiláctico con cefazolina, cotrimoxazol y ganciclovir.
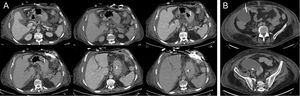
Al sexto día, el paciente tuvo fiebre y leucocitosis. Los hemocultivos fueron positivos al octavo día y se evidenció bacteriemia por Bacteroides intestinalis y B. thetaiotaomicron. Se sospechó un origen abdominal. El tratamiento consistió en meropenem y anidulafungina. Al cabo de 11 días, comenzó a drenar una secreción fecaloidea a través de la herida de la cánula de entrada. La tomografía computarizada confirmó la existencia de ascitis y una fístula enterocutánea que se originaba en la flexura esplénica sin neumoperitoneo, de modo que no estaba conectada con la cavidad peritoneal (figura 2A) y también reveló una colección supradiafragmática en estrecho contacto con una colección de gas retroesternal, pero sin ninguna relación visible con la fístula, así como otra colección subhepática. La administración de contraste yodado a través de la fístula mostró que no había conexión entre las 2 colecciones y la fístula. Para drenar la colección, obtener muestras y establecer un diagnóstico diferencial, el paciente se sometió a una revisión quirúrgica del mediastino. No se observó conexión con la cavidad abdominal, pero sí crecimiento de Enterococcus faecium en la muestra procedente de la colección torácica y en la secreción de la fístula. Se añadió vancomicina al tratamiento. La fístula enterocutánea se trató clínicamente porque no había indicios de drenaje del contenido intestinal a la cavidad peritoneal y el cirujano general consideraba inaceptable el riesgo quirúrgico (porque el paciente se estaba recuperando de un fracaso primario del injerto, insuficiencia renal aguda y una probable infección mediastínica).
A: imagen de la fístula enterocutánea desde la flexura esplénica del colon, en la que se observa que no hay ninguna conexión con la cavidad peritoneal o con la acumulación supradiafragmática tras la infusión de contraste yodado a través de la herida del drenaje. B: parecentesis guiada mediante tomografía computarizada de la acumulación subhepática.
Dados la progresión de la ascitis, la bacteriemia recurrente por Bacteroides y el empeoramiento clínico, se llevó a cabo una paracentesis guiada por tomografía computarizada (figura 2B) y se obtuvieron 500 ml de un líquido purulento procedente del absceso subhepático, cuyos cultivos mostraron crecimiento de E. faecium, B. thetoiotaomicron y Butyricimonas virosa, y en consecuencia se administró tigeciclina. Posteriormente, fue necesario reintubar al paciente debido a una neumonía relacionada con ventilación mecánica y trabajo respiratorio. Esta evolucionó rápidamente a una sepsis grave y a continuación a shock séptico resistente al tratamiento con antibióticos y fármacos vasopresores. El paciente también sufrió insuficiencia renal aguda y coagulopatía por consumo y falleció al cabo de 81 días de haberse sometido al TxC.
Los dispositivos paracorpóreos requieren cánulas que atraviesen la pared abdominal y algunos dispositivos intracorpóreos están en contacto directo con la cavidad peritoneal o próximos a esta1,2. En este contexto, hay posibilidad de complicaciones abdominales graves. Otros factores, como la anticoagulación, la exposición sanguínea a superficies extravasculares y la congestión venosa atribuible a disfunción del ventrículo derecho y otras comorbilidades, también pueden contribuir a complicaciones de los órganos viscerales1. La literatura sobre complicaciones abdominales tras DAVI paracorpóreo es escasa. En una serie contemporánea de pacientes procedentes de un mismo centro y en asistencia mediante un dispositivo BH, no se observaron complicaciones abdominales3. Solo se ha publicado 1 caso de fístula enterocutánea hasta el yeyuno, el colon transverso y el estómago durante la asistencia con el dispositivo BH4. De las asistencias intracorpóreas, recientemente se ha comunicado el caso de una fístula colónica causada por el remanente de una cánula del dispositivo HeartMate IP en una localización muy parecida5, pero se concoce mejor las complicaciones abdominales que tienen lugar con los DAVI pulsátiles intracorpóreos de primera generación. Hasta donde sabemos, esta es la primera descripción de una fístula enterocutánea tras la retirada del DAVI-PP. Conviene alertar a los cirujanos de que resecar la cánula en el momento del TxC puede ser complicado debido a la fibrosis intensa del tejido cicatricial. Aunque no pudo constatarse una conexión entre la fístula, el mediastino y el resto de las colecciones abdominales y no puede descartarse la diseminación hemática, el hallazgo de Bacteroides intestinalis y E. faecium en las muestras subhepáticas, peritoneales y mediastínicas llevó a la sospecha de que la fístula era el primer foco común de infección poco después del TxC, y esto podría explicar la presencia de gas en la colección retroesternal. Las complicaciones abdominales pueden ser insidiosas tras el TxC y por lo tanto se debe sospecharlas y tratarlas precozmente, teniendo en cuenta que la laparotomía suele tolerarse bien tras el TxC6 y que debe determinarse concienzudamente el equilibrio entre riesgos y beneficios para evitar futuras complicaciones sépticas.