El cierre percutáneo de dehiscencias paravalvulares es una alternativa a la cirugía en pacientes de alto riesgo, pero la falta de dispositivos específicos ha limitado su uso. Recientemente se han desarrollado dispositivos más adecuados, como el Amplatzer Vascular Plug III, pero actualmente hay poca información de su eficacia y su seguridad. El objetivo es estudiar el resultado a medio plazo del cierre de dehiscencias paravalvulares con este dispositivo.
MétodosSe analizó la evolución clínica y ecocardiográfica tanto hospitalaria como a medio plazo (13±9 meses) de una serie de 20 pacientes consecutivos (edad, 68 años; EuroSCORE logístico, 29) con dehiscencias paravalvulares e intento de cierre percutáneo.
ResultadosSe intentó el cierre de 23 dehiscencias (17 mitrales y 6 aórticas) durante 22 procedimientos en 20 pacientes. Se logró el éxito del implante en el 87% de las dehiscencias y el éxito del procedimiento con una reducción de ≥ 1 grado de la insuficiencia en el 83%. La supervivencia al año fue del 64,7% y la supervivencia libre de muerte/cirugía, del 58,8%. El grado de insuficiencia valvular residual no se relacionó con la mortalidad, pero sí con el grado funcional. Entre los supervivientes se observó una mejora significativa en la clase funcional.
ConclusionesEl cierre percutáneo de dehiscencias con el Amplatzer Vascular Plug III es seguro y eficaz a medio plazo, aunque la mortalidad de los pacientes de alto riesgo es alta independientemente del grado de insuficiencia residual, lo que indica que se realiza en un estadio avanzado de la cardiopatía.
Palabras clave
La aparición de dehiscencias paravalvulares (DPV) es una complicación frecuente tras el implante de una prótesis valvular, consecuencia de un fallo de la sutura quirúrgica favorecido por la presencia de calcio, infección, friabilidad del tejido o la forma no circular del anillo1,2. La mayoría de las DPV son de pequeño tamaño y se detectan casualmente en un estudio ecocardiográfico posquirúrgico. Solo un 1-5% de las DPV producen síntomas, bien de insuficiencia cardiaca congestiva en caso de DPV grandes, bien de anemia hemolítica en caso de DPV más pequeñas, anfractuosas y múltiples2.
El tratamiento médico puede mejorar los síntomas, pero no corrige la anomalía estructural, por lo que la reintervención quirúrgica para el cierre del defecto y/o la sustitución protésica ha sido el tratamiento de elección clásico1. Pero las intervenciones repetidas se asocian a mayor morbimortalidad que las iniciales, así como a una alta tasa de DPV residuales o recurrentes, dado que los factores predisponentes aún subyacen3.
Recientemente el cierre percutáneo se postuló como una alternativa a la cirugía para pacientes de alto riesgo, sobre todo con el desarrollo de dispositivos con un diseño más adecuado para el cierre de DPV, como el Amplatzer Vascular Plug (AVP) III (AGA, St. Jude Medical; Minneapolis, Minnesota, Estados Unidos). No obstante, la experiencia publicada sobre este dispositivo se limita al resultado inmediato de casos aislados y series pequeñas, y no hay estudios que hayan evaluado el resultado a largo plazo. El objetivo de este estudio es analizar la evolución clínica y ecocardiográfica inmediata y a medio plazo de una serie de pacientes consecutivos tratados con el dispositivo AVP III como primera opción.
MÉTODOSPoblación del estudioDesde septiembre de 2010 a septiembre de 2012, se programó para cierre percutáneo a 22 pacientes en un solo centro. Todos estaban sintomáticos y fueron presentados en sesiones específicas con participación de cardiólogos clínicos, ecocardiografistas, intervencionistas y cirujanos. Se rechazó a 2 pacientes para el cierre percutáneo, uno por tener un seudoaneurisma aórtico infeccioso con desinserción de la prótesis y el otro por desinserción de un anillo mitral (sin prótesis) que afectaba a más de un tercio de su circunferencia. Todos los pacientes firmaron el formulario de consentimiento en el que se les explicaba los riesgos y beneficios del uso off-label del dispositivo AVP III.
Se definió anemia hemolítica por hemoglobina ≥ 10g/dl y hemolisis con necesidad de transfusión sanguínea. Se definió insuficiencia cardiaca por disnea en clase funcional de la New York Heart Association (NYHA) >II. Se definió éxito técnico como implante del dispositivo a nivel de la DPV sin interferencia con el normal funcionamiento de la prótesis o necesidad de cirugía urgente. Se consideró éxito del procedimiento cuando, además del éxito técnico, se consiguió una reducción de ≥ 1 grado de la insuficiencia paravalvular.
Técnica de cierre percutáneoSe practicó en todos los casos guiado mediante ecocardiografía transesofágica tridimensional y con el paciente intubado. Se administró heparina intravenosa tras la punción transeptal y cefazolina como profilaxis. En todas las DPV aórticas, se realizó una aortografía para localizar la DPV y se usó la vía retrógrada para el implante. Se utilizó una guía hidrófila de 0,035″ para pasar desde la aorta hasta el ventrículo izquierdo con la ayuda de un catéter de diagnóstico coronario de 5 Fr con una curvatura adecuada según la localización de la DPV. Una vez alojada la guía en el ventrículo izquierdo, se pasó el catéter diagnóstico de 5 Fr y se intercambió la guía hidrófila por una guía de 0,035″ de alto soporte. Finalmente, por esta guía se pasó la vaina de liberación del dispositivo de un calibre adecuado al tamaño del dispositivo, se retiró la guía y, a través de la vaina de liberación, se implantó el dispositivo a nivel de la DPV.
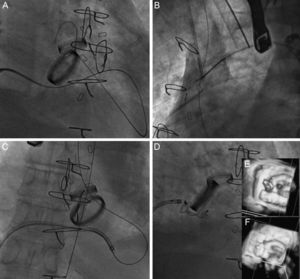
En las DPV mitrales la vía habitual fue la anterógrada; se realizó una punción transeptal para alojar una vaina de Mullins en la aurícula izquierda. A través de la vaina, se introdujo un catéter coronario de 5 Fr con una guía hidrófila de 0,035″ para intentar pasar la guía desde la aurícula al ventrículo izquierdo y la aorta. A este nivel, con un lazo se externalizó la guía por una arteria femoral y se realizó un asa arteriovenosa. Finalmente, a través de la guía se avanzó la vaina de liberación del dispositivo desde el lado venoso para el implante del dispositivo. En 3 casos se usó el catéter dirigible Agilis (St. Jude Medical) para dirigir la guía en la aurícula izquierda hacia la DPV. En 2 casos la vía fue retrógrada, pasando la DPV desde el ventrículo izquierdo a la aurícula izquierda; con un lazo a nivel de una vena pulmonar, se atrapó la guía para su externalización y realización del asa arteriovenosa. De los pacientes con DPV mitrales, 8 eran además portadores de prótesis mecánica aórtica. Se realizó en todos ellos el asa arteriovenosa usando una guía hidrófila (Terumo; Tokio, Japón), por la falta de soporte para avanzar la vaina de liberación. La guía en las prótesis aórticas bilentes se pasó por uno de los orificios laterales, y en las prótesis monolentes, por el orificio mayor. En un paciente con DPV mitral y DPV aórtica, se pasó la guía por el defecto aórtico y se evitó pasar por el interior de la prótesis mecánica. La figura 1 muestra un ejemplo.
Cierre de una dehiscencia paravalvular posterior sobre prótesis mitral mecánica en presencia de prótesis aórtica mecánica bilente. A: se pasa la guía hidrófila por vía anterógrada a través de la dehiscencia paravalvular mitral y por dentro de la prótesis aórtica. B: se atrapa la guía en aorta ascendente con un lazo y se externaliza por una arteria femoral para crear un circuito arteriovenoso. C: esto permite tener el empuje suficiente para pasar la vaina de liberación. D: se implanta un dispositivo Amplatzer Vascular Plug III 14/5. E: imagen basal por ecocardiografía transesofágica tridimensional. F: resultado tras el implante.
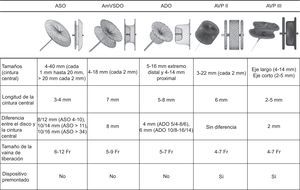
La primera opción fue el implante de un dispositivo AVP III, aunque en algún caso finalmente se usó un Amplatzer Duct Occluder o un Amplatzer Ventricular Septal Occluder por la morfología, tamaño de la DPV o interferencia del AVP III con algún disco de la prótesis. La figura 2 muestra las características de los distintos tipos de dispositivos. Para la elección del tamaño del dispositivo, se tuvo en cuenta los diámetros mayor y menor del defecto mediante la reconstrucción tridimensional por ecocardiografía transesofágica con y sin color. Se usó un dispositivo con un tamaño igual o 1–2mm mayor que los diámetros de referencia del defecto por ecocardiografía. En caso de DPV grandes, se usaron dos AVP III simultáneos, un Amplatzer Duct Occluder II o Amplatzer Ventricular Septal Occluder.
Características de los diferentes dispositivos utilizados clásicamente para el cierre de dehiscencia paravalvular, todos de St. Jude Medical (St. Paul, Minnesota, Estados Unidos). ADO: Amplatzer Duct Occluder; AmVSDO: Amplatzer Ventricular Septal Defect Occluder; ASO: Amplatzer Septal Occluder; AVP: Amplatzer Vascular Plug.
Se recogieron los datos del procedimiento y las complicaciones hospitalarias, como muerte o cirugía urgente relacionada con el procedimiento, muerte cardiovascular y por todas las causas, eventos neurológicos, complicaciones vasculares que requirieron cirugía o transfusión sanguínea, taponamiento cardiaco o infarto de miocardio.
Seguimiento clínico y ecocardiográficoSe siguió a los pacientes en una consulta específica, tras 1, 6 y 12 meses y posteriormente en visitas anuales. Durante este seguimiento se realizó ≥ 1 estudio ecocardiográfico transtorácico y además un estudio transesofágico en caso de prótesis mitrales. Desde el punto de vista clínico, se recogió información sobre la clase funcional, la necesidad de transfusiones, la muerte cardiovascular y total y los eventos neurológicos y cardiacos. Por ecocardiografía se recogió información de función ventricular, presión pulmonar y grado (de 0-4) de regurgitación residual semicuantitativa (leve, moderada y grave) y cuantitativa.
Análisis estadísticoLas variables cualitativas se presentan como número absoluto y porcentaje. Las variables cuantitativas, en forma de media±desviación estándar. La supervivencia libre de eventos se analizó construyendo curvas Kaplan-Meier. Se usó el test no paramétrico de Mann-Whitney para la comparación del EuroSCORE de los primeros y los últimos 10 pacientes. El test de Wilcoxon para la comparación de la presión pulmonar, la fracción de eyección y la clase funcional preoperatoria y postoperatoria según el grado de insuficiencia valvular residual (que se clasificó como binaria: 0–2 y 3–4). Para estudiar la relación del grado de insuficiencia residual con mortalidad y clase funcional, se utilizó la prueba de la χ2. Se usó el paquete estadístico SPSS versión 21.0 (SPSS Inc.; Chicago, Illinois, Estados Unidos).
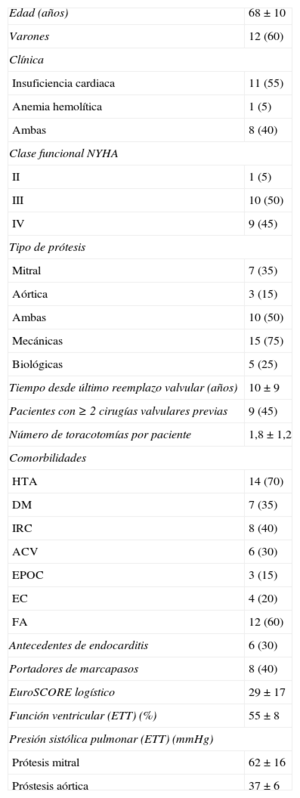
RESULTADOSSe realizó el cierre percutáneo de 23 DPV (17 mitrales y 6 aórticas) en 20 pacientes durante 22 procedimientos. Las características clínicas basales se detallan en la tabla 1. En 1 paciente se realizó el cierre percutáneo de una DPV mitral y otra aórtica en el mismo procedimiento; 2 pacientes requirieron dos procedimientos separados para el cierre completo de la DPV. Es reseñable que se trataba de una población con alta comorbilidad y un riesgo quirúrgico muy elevado (EuroSCORE logístico medio, 29±17). Si se divide aleatoriamente la muestra y se analiza el EuroSCORE de los primeros 10 pacientes frente a los últimos 10, se observa que el EuroSCORE logístico medio de los primeros 10 pacientes fue 39±20 y el de los últimos, 19±11 (p=0,01), lo que indica que se inició el programa de cierre percutáneo de DPV con casos de muy alto riesgo quirúrgico.
Características demográficas y clínicas basales de los 20 pacientes
| Edad (años) | 68±10 |
| Varones | 12 (60) |
| Clínica | |
| Insuficiencia cardiaca | 11 (55) |
| Anemia hemolítica | 1 (5) |
| Ambas | 8 (40) |
| Clase funcional NYHA | |
| II | 1 (5) |
| III | 10 (50) |
| IV | 9 (45) |
| Tipo de prótesis | |
| Mitral | 7 (35) |
| Aórtica | 3 (15) |
| Ambas | 10 (50) |
| Mecánicas | 15 (75) |
| Biológicas | 5 (25) |
| Tiempo desde último reemplazo valvular (años) | 10±9 |
| Pacientes con ≥ 2 cirugías valvulares previas | 9 (45) |
| Número de toracotomías por paciente | 1,8±1,2 |
| Comorbilidades | |
| HTA | 14 (70) |
| DM | 7 (35) |
| IRC | 8 (40) |
| ACV | 6 (30) |
| EPOC | 3 (15) |
| EC | 4 (20) |
| FA | 12 (60) |
| Antecedentes de endocarditis | 6 (30) |
| Portadores de marcapasos | 8 (40) |
| EuroSCORE logístico | 29±17 |
| Función ventricular (ETT) (%) | 55±8 |
| Presión sistólica pulmonar (ETT) (mmHg) | |
| Prótesis mitral | 62±16 |
| Próstesis aórtica | 37±6 |
ACV: accidente cerebrovascular; DM: diabetes mellitus; EC: enfermedad coronaria; EPOC: enfermedad pulmonar obstructiva crónica; ETT: ecocardiografía transtorácica; FA: fibrilación auricular; HTA: hipertensión arterial; IRC: insuficiencia renal crónica; NYHA: New York Heart Association.
Los valores expresan n (%) o media±desviación estándar.
De las 23 DPV que se intentó cerrar percutáneamente en 20 pacientes, se logró el éxito del implante en el 87% (el 85% de los pacientes) y el éxito del procedimiento en el 83% (el 80% de los pacientes). No se logró el cierre de 3 DPV mitrales en 3 pacientes con doble prótesis mitral y aórtica mecánica. En 1 paciente, no se logró pasar la guía a través del defecto en una DPV mitral tortuosa y de localización septal, ni por acceso anterógrado ni por retrógrado, y pese a usar un catéter deflectable y dirigible como el Agilis. En otro paciente se pasó la guía y no se consiguió pasar la vaina de liberación aun habiendo realizado un asa arteriovenosa. En el tercer paciente se logró el implante de un dispositivo AVP III tras la realización de un asa arteriovenosa, pero el dispositivo interfería constantemente con el disco mitral, aunque se intentara reposicionarlo en múltiples ocasiones. Se envió a cirugía a los 3 pacientes.
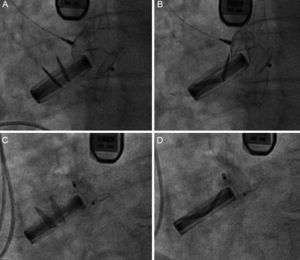
Finalmente, se implantaron 21 dispositivos Amplatzer en las 20 DPV (17 pacientes) cerradas con éxito. En 1 paciente se implantaron simultáneamente dos dispositivos, por el gran tamaño de la DPV. De los dispositivos implantados, 18 (86%) fueron AVP III, por tener la morfología más adecuada al defecto. Además, se implantaron dos dispositivos Amplatzer Duct Occluder y un Amplatzer Ventricular Septal Occluder. En 1 paciente con una DPV aórtica tratada con el implante de un AVP III, se observó interferencia del dispostivo con un disco de la prótesis áortica, y se cambió por un Amplatzer Duct Occluder para evitar la interferencia (figura 3). Se logró el éxito del procedimiento en el 83% de las DPV: el 100% de las DPV aórticas y el 77% de las mitrales.
Implante de dispositivo Amplatzer Vascular Plug III 12/5 en posición aórtica. A: en sístole no hay interferencia del dispositivo con la prótesis. B: en diástole el dispositivo interfiere con la prótesis. C: implante de dispositivo Amplatzer Duct Occluder 12/10 sin interferencia en sístole. D: tampoco en diástole.
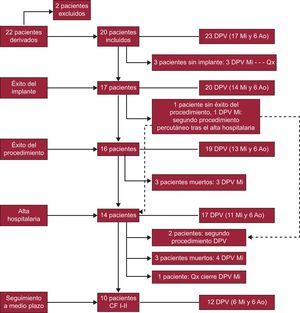
Como complicaciones hospitalarias, hubo 3 muertes; solo una de ellas tuvo relación con el procedimiento, una paciente que tras el cierre con éxito de una DPV mitral, presentó hemorragia femoral con anemización que precisó reparación quirúrgica por pequeña rotura de la arteria femoral y, a las 48h, presentó un cuadro fatal de isquemia intestinal. En los otros 2 pacientes el cierre percutáneo se realizó en situación de insuficiencia cardiaca terminal, y a pesar del éxito del procedimiento, el desenlace fue fatal. Un paciente ya estaba intubado por edema agudo de pulmón y fue imposible la extubación tras el procedimiento; falleció por fallo multiorgánico pese a que a los 20 días quedaba una insuficiencia mitral ligera. El otro paciente también quedó con insuficiencia mitral leve-moderada tras el cierre, pero falleció por infección respiratoria y shock séptico a los 15 días. Además, en otro paciente se formaron seudoaneurismas en ambas arterias femorales pese a usarse un dispositivo de cierre percutáneo, y se lo intervino sin complicaciones. No hubo ningún caso de embolización de dispositivos o interferencia con el normal funcionamiento de la prótesis que requiriese cirugía urgente. La tabla 2 recoge los datos del procedimiento y las complicaciones. La figura 4 muestra un diagrama de flujo de la evolución de todos los pacientes.
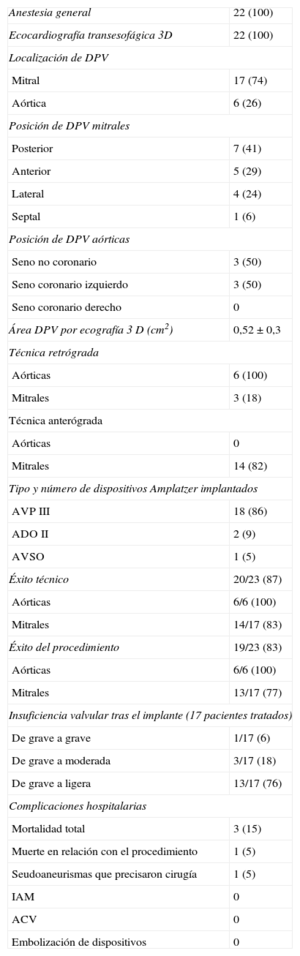
Resultados y complicaciones inmediatas de los 22 procedimientos para el cierre de 23 dehiscencias paravalvulares
| Anestesia general | 22 (100) |
| Ecocardiografía transesofágica 3D | 22 (100) |
| Localización de DPV | |
| Mitral | 17 (74) |
| Aórtica | 6 (26) |
| Posición de DPV mitrales | |
| Posterior | 7 (41) |
| Anterior | 5 (29) |
| Lateral | 4 (24) |
| Septal | 1 (6) |
| Posición de DPV aórticas | |
| Seno no coronario | 3 (50) |
| Seno coronario izquierdo | 3 (50) |
| Seno coronario derecho | 0 |
| Área DPV por ecografía 3D (cm2) | 0,52±0,3 |
| Técnica retrógrada | |
| Aórticas | 6 (100) |
| Mitrales | 3 (18) |
| Técnica anterógrada | |
| Aórticas | 0 |
| Mitrales | 14 (82) |
| Tipo y número de dispositivos Amplatzer implantados | |
| AVP III | 18 (86) |
| ADO II | 2 (9) |
| AVSO | 1 (5) |
| Éxito técnico | 20/23 (87) |
| Aórticas | 6/6 (100) |
| Mitrales | 14/17 (83) |
| Éxito del procedimiento | 19/23 (83) |
| Aórticas | 6/6 (100) |
| Mitrales | 13/17 (77) |
| Insuficiencia valvular tras el implante (17 pacientes tratados) | |
| De grave a grave | 1/17 (6) |
| De grave a moderada | 3/17 (18) |
| De grave a ligera | 13/17 (76) |
| Complicaciones hospitalarias | |
| Mortalidad total | 3 (15) |
| Muerte en relación con el procedimiento | 1 (5) |
| Seudoaneurismas que precisaron cirugía | 1 (5) |
| IAM | 0 |
| ACV | 0 |
| Embolización de dispositivos | 0 |
3D: tridimensional; ACV: accidente cerebrovascular; ADO: Amplatzer Duct Occluder; AVP: Amplazter Vascular Plug; AVSO: Amplatzer Ventricular Septal Occluder; DPV: dehiscencia paravalvular; IAM: infarto agudo de miocardio.
Los valores expresan n/N (%) o media ± desviación estándar.
Diagrama que muestra el flujo de pacientes según el éxito del implante, el éxito del procedimiento, el alta hospitalaria y el seguimiento a largo plazo. La flecha discontinua señala a un paciente con éxito del implante pero que quedó con insuficiencia mitral grave, al que se cerró con éxito el defecto en un segundo procedimiento tras el alta hospitalaria. Ao: aórtica; CF: clase funcional; DPV: dehiscencia paravalvular; Mi: mitral; Qx: cirugía de cierre de dehiscencia paravalvular.
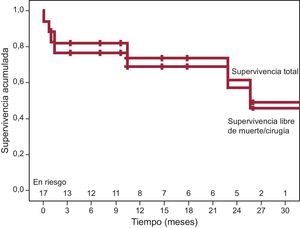
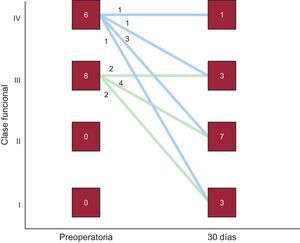
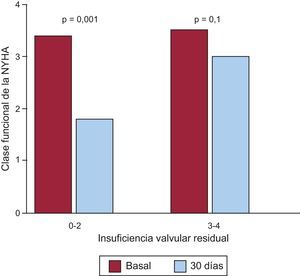
Tras un seguimiento medio de 13±9 (mediana, 12) meses, fallecieron 3 de los 14 pacientes dados de alta hospitalaria, por insuficiencia cardiaca terminal 2 de ellos, en los que quedaba una insuficiencia mitral residual moderada y que estaban en NYHA III. La tercera paciente, tras un segundo procedimiento, quedó con insuficiencia leve y en NYHA I, pero finalmente falleció por cáncer de mama. Además, 1 paciente requirió cirugía al rechazar un segundo procedimiento percutáneo, dado que estaba en NYHA III y requiriendo transfusiones periódicas y con insuficiencia mitral grave residual. Por lo tanto, la supervivencia acumulada a largo plazo fue del 64,7% y la supervivencia libre del evento combinado muerte/cirugía, del 58,8%. La figura 5 muestra las curvas de Kaplan-Meier. El grado de insuficiencia valvular residual no se relacionó significativamente con la mortalidad. De los 14 pacientes dados de alta hospitalaria, el 72% presentaba mejora de la clase funcional a los 30 días del procedimiento, excepto los 4 pacientes mencionados (figura 6). Se constató una relación significativa entre el grado de insuficiencia valvular residual y la clase funcional de la NYHA a los 30 días. En los pacientes con insuficiencia residual ≤ 2, hubo una mejora significativa de la clase funcional, pero no en los pacientes con insuficiencia residual >2 (figura 7). A largo plazo, los 10 pacientes supervivientes y sin cirugía se encontraban en NYHA I–II, lo que evidencia una mejora significativa de la clase funcional (p=0,001). De los parámetros ecocardiográficos, hubo una mejoría significativa de la insuficiencia valvular residual por ecocardiografía, que era ligera en 9 pacientes y moderada en 1 con una DPV aórtica pero en NYHA II (p=0,001). La presión sistólica pulmonar estimada pasó de 56±16 a 48±10mmHg (p=0,04) tras el cierre percutáneo, y no se observaron cambios significativos en la fracción de eyección del ventrículo izquierdo.
Los principales hallazgos del estudio son que el cierre percutáneo de las DPV con el dispositivo AVP III es un procedimiento factible, con altos porcentajes de éxito técnico y del procedimiento. En segundo lugar, la mortalidad a largo plazo es alta en una cohorte de pacientes de alto riesgo, sin relación con la insuficiencia valvular residual, lo que indica que el cierre percutáneo se realiza en un estadio avanzado de la enfermedad. Finalmente, en los pacientes supervivientes hay clara mejora de la clase funcional a largo plazo, que está en relación con el grado de insuficiencia valvular residual.
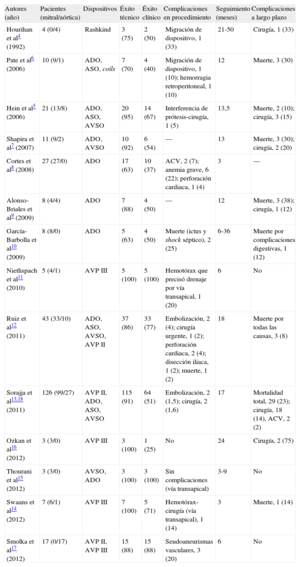
El cierre percutáneo de las DPV se desarrolló hace ya más de 20 años como una alternativa a la cirugía en casos de alto riesgo4. Inicialmente se realizó en centros muy seleccionados, pero en los últimos años la técnica se ha ido perfeccionando y extendiendo, en coincidencia con el desarrollo de dispositivos de cierre vascular y de defectos intracardiacos, aunque ninguno específicamente diseñado para las DPV. Casos clínicos aislados y series cortas de casos mostraron que es una técnica compleja pero factible, con una tasa de éxito del procedimiento alta. La tabla 3 muestra todas las series publicadas con ≥ 3 pacientes de cierre percutáneo de DPV tanto por acceso transfemoral como transapical4–18. La tasa de éxito técnico de todas las series varía del 63 al 100%. En las dos series más largas12,13,18, que son relativamente recientes, las tasas de éxito técnico fueron del 86 y el 89%. Esto indica que, aunque el cierre de las DPV es un procedimiento complejo, sobre todo en posición mitral, la experiencia que se ha ido alcanzando en estos últimos años hace que el implante de dispositivos en las DPV sea factible y exitoso en un alto porcentaje de casos. El uso off-label de dispositivos como el AVP III, con un diseño más apropiado para el cierre de las DPV, hipotéticamente podría aumentar el éxito del procedimiento. La experiencia con este nuevo dispositivo se reduce a publicaciones sobre casos clínicos aislados y series11,14,16,17 de pacientes muy cortas. En tres series se usó sistemáticamente la vía transapical para el cierre de DPV mitrales11,14,16 y otra serie también incluyó a pacientes tratados con AVP II17. Nuestra serie es una de las más amplias de pacientes tratados con AVP III por vía transfemoral y con seguimiento de ≥ 1 año. Las tasas de éxito técnico y del procedimiento fueron del 87 y el 83%, equiparables a las de series también recientes que usaron otros dispositivos12,13,18. El AVP III tiene la limitación del tamaño, que imposibilita tratar DPV >14mm con un solo dispositivo, y en ocasiones uno de los discos que sobresalen sobre la cintura puede bloquear la prótesis, como el caso de la figura 3. Pero es incuestionable que el AVP III representa un paso de calidad respecto a los dispositivos utilizados previamente, dado que su morfología ovalada se adapta mejor a la anatomía de las DPV, viene premontado, tiene mejor perfil de cruce y se puede introducir por vainas de menor calibre, lo que permite cruzar las DPV con mayor facilidad. A pesar de todo, el cierre de ciertas DPV mitrales, las DPV de gran tamaño, las pequeñas con trayectos serpiginosos, las que son múltiples, las de localización lateral o septal, el agrandamiento de las DPV pequeñas al forzar el paso de la vaina y la aparición de nuevas DPV contralaterales tras el procedimiento de cierre son factores que explican que no haya una sustancial variación en la tasa de éxito técnico y del procedimiento pese a tener mejores dispositivos.
Estudios con series de cierre percutáneo de dehiscencias paravalvulares (n≥3 pacientes)
| Autores (año) | Pacientes (mitral/aórtica) | Dispositivos | Éxito técnico | Éxito clínico | Complicaciones en procedimiento | Seguimiento (meses) | Complicaciones a largo plazo |
| Hourihan et al4 (1992) | 4 (0/4) | Rashkind | 3 (75) | 2 (50) | Migración de dispositivo, 1 (33) | 21-50 | Cirugía, 1 (33) |
| Pate et al6 (2006) | 10 (9/1) | ADO, ASO, coils | 7 (70) | 4 (40) | Migración de dispositivo, 1 (10); hemorragia retroperitoneal, 1 (10) | 12 | Muerte, 3 (30) |
| Hein et al5 (2006) | 21 (13/8) | ADO, ASO, AVSO | 20 (95) | 14 (67) | Interferencia de prótesis-cirugía, 1 (5) | 13,5 | Muerte, 2 (10); cirugía, 3 (15) |
| Shapira et al7 (2007) | 11 (9/2) | ADO, AVSO | 10 (92) | 6 (54) | — | 13 | Muerte, 3 (30); cirugía, 2 (20) |
| Cortes et al8 (2008) | 27 (27/0) | ADO | 17 (63) | 10 (37) | ACV, 2 (7); anemia grave, 6 (22); perforación cardiaca, 1 (4) | 3 | — |
| Alonso-Briales et al9 (2009) | 8 (4/4) | ADO | 7 (88) | 4 (50) | — | 12 | Muerte, 3 (38); cirugía, 1 (12) |
| García-Barbolla et al10 (2009) | 8 (8/0) | ADO | 5 (63) | 4 (50) | Muerte (ictus y shock séptico), 2 (25) | 6-36 | Muerte por complicaciones digestivas, 1 (12) |
| Nietlispach et al11 (2010) | 5 (4/1) | AVP III | 5 (100) | 5 (100) | Hemotórax que precisó drenaje por vía transapical, 1 (20) | 6 | No |
| Ruiz et al12 (2011) | 43 (33/10) | ADO, ASO, AVSO, AVP II | 37 (86) | 33 (77) | Embolización, 2 (4); cirugía urgente, 1 (2); perforación cardiaca, 2 (4); disección iliaca, 1 (2); muerte, 1 (2) | 18 | Muerte por todas las causas, 3 (8) |
| Sorajja et al13,18 (2011) | 126 (99/27) | AVP II, ADO, ASO, AVSO | 115 (91) | 64 (51) | Embolización, 2 (1,5); cirugía, 2 (1,6) | 17 | Mortalidad total, 29 (23); cirugía, 18 (14), ACV, 2 (2) |
| Ozkan et al16 (2012) | 3 (3/0) | AVP III | 3 (100) | 1 (25) | No | 24 | Cirugía, 2 (75) |
| Thourani et al15 (2012) | 3 (3/0) | AVSO, ADO | 3 (100) | 3 (100) | Sin complicaciones (vía transapical) | 3-9 | No |
| Swaans et al14 (2012) | 7 (6/1) | AVP III | 7 (100) | 5 (71) | Hemotórax-cirugía (vía transapical), 1 (14) | 3 | Muerte, 1 (14) |
| Smolka et al17 (2012) | 17 (0/17) | AVP II, AVP III | 15 (88) | 15 (88) | Seudoaneurismas vasculares, 3 (20) | 6 | No |
ACV: accidente cerebrovascular; ADO: Amplatzer Duct Occluder; ASO: Amplatzer Septal Occluder; AVP: Amplatzer Vascular Plug; AVSO: Amplatzer Ventricular Septal Occluder.
Salvo otra indicación, las cifras expresan n (%).
Otro factor es el cierre de DPV mitrales en presencia de prótesis aórtica mecánica que, aunque es factible, no está exento de dificultades19. En nuestra serie no hubo ninguna complicación mayor derivada del asa arteriovenosa, pero sí momentos de deterioro hemodinámico que requirieron la movilización (movimientos de tensión y liberación) de la guía hidrófila para recuperar el movimiento del disco bloqueado, lo que hace importante la vigilancia mediante ecocardiografía, escopia y presiones invasivas. La vía transapical, que no se usó en nuestra serie, podría evitar estos problemas técnicos y aumentar la tasa de éxito técnico20,21.
En la literatura médica, el porcentaje de complicaciones es muy variable; las comunicadas con más frecuencia son las complicaciones vasculares, la cirugía urgente por embolización de dispositivos o interferencia con la prótesis, el ictus perioperatorio y las hemorragias (tabla 3). La muerte relacionada con el procedimiento es poco frecuente en las distintas series y también en la nuestra, lo que lleva a concluir que, pese a ser un procedimiento complejo, es seguro.
La mortalidad por todas las causas en estudios previos con ≥ 1 año de seguimiento varió entre el 8 y el 38%4,7,9,10,12,13. En el estudio de Sorajja et al13, que incluye la serie más larga y con un seguimiento medio de 17 meses, la mortalidad fue del 23% y la muerte por insuficiencia cardiaca terminal fue la más frecuente. Nuestra serie está compuesta de pacientes de muy alto riesgo y con alta comorbilidad, tal como indica el EuroSCORE logístico de 29. La mortalidad fue del 30% en un seguimiento medio aproximado de 1 año, y la insuficiencia cardiaca terminal causó el 66% de las muertes. No hubo relación entre el grado de insuficiencia valvular residual y la mortalidad, lo que apunta a que la indicación de cierre percutáneo para pacientes rechazados de cirugía se hizo cuando el paciente estaba en una situación clínica muy deteriorada y avanzada que llevó a un desenlace fatal a medio plazo, independiente de la reducción del grado de insuficiencia valvular. Por lo tanto, creemos que la indicación de cierre de DPV se debe realizar en un estadio más precoz en la evolución de la valvulopatía, y no esperar a que la situación clínica sea terminal. Así, desde el punto de vista clínico, no estaría indicado para pacientes críticos, con endocarditis aguda o en general para los pacientes con una expectativa de vida <1 año.
El éxito clínico en las series publicadas fue muy variable, del 40 al 100%. En la serie más grande, el éxito clínico de los pacientes supervivientes fue del 72%13, idéntico al de esta serie. Hubo una relación significativa entre el grado de regurgitación valvular residual y la clase funcional, lo que indica que el cierre percutáneo de las DPV, cuando se realiza con éxito, puede ser una alternativa completamente válida a la cirugía de reemplazo valvular, con mejoría clínica evidente a largo plazo.
Limitaciones del estudioLa principal limitación es que se trata de un estudio en un solo centro con un pequeño número de pacientes. Además, se intervino a todos los pacientes analizados por acceso femoral, dado que el acceso transpical se empezó a utilizar en el hospital en fecha posterior. Este aspecto puede tener importancia en la tasa de éxito del procedimiento, que puede aumentar con la introducción de la vía transapical. Tiene la robustez de que no existen estudios con seguimiento a medio-largo plazo con el nuevo dispositivo AVP III, que en esta serie se usó en el 86% de los casos.
CONCLUSIONESEl cierre percutáneo de DPV con el dispositivo AVP III aporta una significativa mejoría clínica a largo plazo en un alto porcentaje de pacientes. Sin embargo, la mortalidad es alta en una población de pacientes de alto riesgo, independientemente del éxito del procedimiento, lo que muestra que la indicación de cierre se realiza en un estadio muy avanzado de la enfermedad cardiovascular.
CONFLICTO DE INTERESESNinguno.