Palabras clave
INTRODUCCIÓN
Uno de los principales retos del intervencionismo coronario es la tasa de reestenosis y la consiguiente necesidad de revascularización en el seguimiento. Cuando se compara la revascularización percutánea multivaso con la cirugía, la necesidad de nuevas revascularizaciones causa la mayor parte de la diferencia en la tasa de eventos en el seguimiento entre ambas estrategias1. Los ensayos realizados hasta el momento con stents recubiertos de fármacos (paclitaxel y rapamicina) muestran una notable reducción de la reestenosis y de la consiguiente necesidad de una nueva revascularización en la lesión previamente tratada2-7. No obstante, en estos grandes estudios no se incluyó a los casos que precisamente presentan mayor riesgo de reestenosis con stents convencionales (SC), como las oclusiones totales, las reestenosis intra-stent, las lesiones muy largas (> 30 mm) o las localizadas en vasos de ≤ 2,5 mm. En relación con estos tipos de lesiones, se han publicado series reducidas retrospectivas en las que se ha empleado uno u otro modelo de stent recubierto y en las que se han obtenido unos resultados muy esperanzadores8-16.
Tampoco hay estudios en los que se comparen la eficacia y la seguridad de ambos stents. Si hubiera diferencias entre ambos tipos de stent en algún aspecto, éstas se podrían detectar con más facilidad en los contextos lesionales más complejos. Por ello, hemos desarrollado el presente estudio, en el que comparamos la evolución clínica de 2 grupos de pacientes con un perfil lesional similar y complejo tratados con stent liberador de paclitaxel (SLT) o de rapamicina (SLR). Incluimos como control a un tercer grupo comparable pero tratado con SC (extraído de la experiencia inmediatamente previa a la introducción de stents recubiertos).
PACIENTES Y MÉTODO
Se incluyó a los pacientes remitidos a nuestra unidad con la indicación clínica de coronariografía que fueran candidatos para revascularización percutánea y cuyas lesiones (todas o alguna) cumplieran al menos 1 de los siguientes criterios:
1. Reestenosis intra-stent.
2. Obstrucción total de cualquier antigüedad.
3. Lesión difusa (> 20 mm).
4. Lesión en un vaso pequeño (≤ 2,5 mm).
Períodos de tratamiento:
1. De octubre de 2001 a mayo de 2002 los pacientes fueron tratados con SC.
2. De junio a diciembre de 2002 se trató con SLR, Cypher®, al 72% de las lesiones que cumplían algún criterio de los expuestos con anterioridad. Las restantes lesiones se trataron con SC, bien por disponibilidad de medidas o por tratarse de lesiones con un perfil más favorable (lesiones focales en vasos de 2,5 mm o lesiones difusas de 20-25 mm en vasos ≥ 3 mm). Todas las oclusiones totales y las reestenosis intra-stent fueron tratadas con SLR.
3. De abril a diciembre de 2003 se trató con SLT, Taxus®, al 70% de las lesiones que cumplían algún criterio. Las restantes fueron tratadas con SC (de manera muy puntual) o con SLR debido a la disponibilidad de medidas o al uso más frecuente de SLR por parte de 1 de los miembros del equipo (por razones puramente logísticas).
En cada período se incluyó a los primeros 100 casos consecutivos tratados con el correspondiente tipo de stent. Los resultados aislados de la serie de pacientes tratados con SLR ya han sido previamente publicados en esta Revista16.
Se excluyeron los casos de angioplastia primaria y los que se encontraban en situación de shock cardiogénico. En cuanto a las oclusiones, sólo se incluyeron aquellas en las que se logró implantar el stent. El modo de implantación del stent, directo o no, se dejó a criterio del operador, aunque la implantación directa no se intentó en ninguno de los casos con obstrucción completa, necesidad de un stent largo (> 23-24 mm) y vasos con una calcificación evidente o una marcada angulación o tortuosidad. La evaluación angiográfica fue cuantitativa digital posprocedimiento.
El procedimiento se realizó por vía femoral y en todos los casos se emplearon dispositivos de cierre vascular. La utilización de inhibidores de la glucoproteína IIb/IIIa se dejó a criterio del cirujano. El éxito angiográfico se definió como la obtención de una estenosis residual < 25% con un flujo TIMI III. La determinación seriada de enzimas no se realizó de manera sistemática sino sólo en los casos con sospecha clínica o electrocardiográfica de necrosis posterior a la angioplastia coronaria transluminal percutánea (ACTP) (complicación en el procedimiento, isquemia y/o síntomas post-ACTP). Todos los pacientes recibieron una carga oral de clopidogrel de 300 mg inmediatamente después del procedimiento, y con posterioridad se les administró una combinación de 100 mg de aspirina y 75 mg de clopidogrel durante 3 meses en caso de stent Cypher y de 6 meses en caso de stent Taxus.
El seguimiento clínico se ha efectuado mediante una consulta clínica a los 6-12 meses del procedimiento y, además, a través de una llamada telefónica en la que se conversó directamente con el paciente. Para poder comparar la evolución de las 3 series consecutivas, cerramos el seguimiento de cada grupo en el momento en el que el último paciente tuviera 6 meses de evolución. De este modo, los seguimientos tienen una extensión similar en los 3 grupos (media, 8-9 meses; rango, 6-12 meses). Los pacientes fueron controlados por sus respectivos cardiólogos clínicos, quienes indicaron pruebas de isquemia o coronariografía cuando lo consideraron oportuno
Los eventos se clasificaron en:
1. Muerte (cardíaca o no cardíaca).
2. Infarto de miocardio con onda Q definido por la aparición de nuevas ondas Q en el electrocardiograma (ECG), precedidas o no de cuadro clínico sintomático, o infarto sin onda Q definido como síndrome coronario agudo asociado a elevación enzimática (más del doble del límite superior de la normalidad para la isoenzima MB de la creatincinasa [CK-MB]) sin la aparición ulterior de ondas Q en el ECG.
3. Trombosis de stent definida como la observación angiográfica de una oclusión-suboclusión del stent por material de aspecto trombótico precedida de un cuadro clínico agudo que puede cursar con elevación del segmento ST.
4. Revascularización, que se podrá realizar en la lesión tratada (por reestenosis intrasegmento) o en una nueva lesión.
Análisis estadístico
Las variables continuas se presentan como media ± desviación estándar (DE). Las variables categóricas se expresan como porcentajes. Las variables continuas se compararon con la prueba de la t de Student cuando seguían una distribución normal y con el test de Wilcoxon cuando no la seguían (la valoración del tipo de distribución se realizó con el test de Kolmogorov-Smirnov). Las variables categóricas se compararon con las pruebas de la χ² o con test exacto de Fisher, según estuviera indicado. Todas las variables se compararon entre los 2 grupos de stent recubierto y entre éstos y el grupo control. Se obtuvieron las curvas de Kaplan-Meier de supervivencia libre de eventos para cada grupo y se compararon mediante el test de rangos logarítmicos. Se consideraron estadísticamente significativos los valores de p < 0,05. Se empleó el paquete estadístico SPSS 11.0.
RESULTADOS
De cada período de tratamiento se incluyeron los primeros 100 casos consecutivos tratados con el modelo de stent correspondiente. De octubre de 2001 a mayo de 2002 se trató con SC a 100 pacientes con 170 lesiones, de las cuales 117 (69%) cumplían los criterios expuestos con anterioridad. De junio a diciembre de 2002 se trató con stents Cypher a 100 pacientes del grupo SLR con 154 lesiones, de las cuales 109 (71%) cumplían criterios. De abril a diciembre de 2003 se trató con stent Taxus a 100 pacientes del grupo SLT con 164 lesiones, de las cuales 118 (72%) cumplían criterios. Es preciso indicar que se logró implantar el stent recubierto en todos los casos en los que se intentó.
Las características clínicas de los 3 grupos de pacientes están recogidas en la tabla 1. Sólo encontramos diferencias significativas en la tasa de revascularización quirúrgica previa, más alta en el grupo SLR que en el grupo SC, y en el tratamiento previo con estatinas, que experimenta un lógico crecimiento progresivo con cada período y, por tanto, resulta significativamente más alta en el grupo SLT, cronológicamente más reciente, que en el SC. No obstante, el tratamiento con estatinas durante el seguimiento fue muy similar en los 3 grupos.
Las características angiográficas de las lesiones de cada grupo se describen en la tabla 2. En todos los grupos había una proporción similar de lesiones que cumplían criterios (el 69% en SC, el 71% en SLR y el 72% en SLT). En cuanto a la distribución morfológica de las lesiones, es comparable, aunque se aprecia una tendencia hacia un menor número de reestenosis intra-stent tratadas en el grupo SLT. Las características del procedimiento resultan igualmente muy comparables y cabe destacar la tendencia hacia mayores longitudes totales de stent por paciente en los grupos de stent recubierto en relación con el grupo SC, que resulta significativa cuando se compara el grupo SLT con el SC (tabla 3). El éxito angiográfico fue totalmente comparable en los 3 grupos.
Complicaciones en el procedimiento y la hospitalización
En el grupo SLR se produjeron 2 infartos sin onda Q (2%), 1 de ellos debido a una disección retrógrada oclusiva tras el implante de un stent en la coronaria derecha media que se resolvió con un stent adicional, y 1 por la oclusión irresoluble de una pequeña rama diagonal (< 2 mm diámetro) tras el implante del stent en la descendente anterior. Se produjo un accidente cerebral isquémico transitorio (1%) en 1 paciente varón hipertenso de 66 años (tabla 4).
En el grupo SLT se produjo un infarto sin onda Q por ausencia de reflujo tras el implante del stent. Se produjeron 2 trombosis de stent que se presentaron como infarto con elevación del segmento ST, 1 a las 3 h de un procedimiento en el que se implantó un stent de 2,5/8 mm intra-stent por reestenosis en la descendente anterior distal, y 1 a las 24 h en un stent de 2,75/32 mm implantado en la descendente anterior media. En ningún caso se había empleado abciximab en el procedimiento. En estos casos, el lecho distal era escaso o presentaba enfermedad difusa. Se realizó reintervención percutánea con abciximab (aspiración de trombo y dilatación con balón), con buen resultado.
En el grupo SC se produjeron 2 infartos sin onda Q relacionados con la oclusión no resuelta de 2 pequeñas ramas diagonales (≤ 2 mm) al tratar las lesiones bifurcadas.
Seguimiento clínico
Se obtuvo un seguimiento completo en el 100% de los pacientes de los grupos SLR y SLT y en el 99% de los del grupo SC.
En el grupo SLR, durante un seguimiento de 8,5 ± 2 meses (rango, 6-12 meses) no se registró ningún fallecimiento y hubo 2 (2%) trombosis tardías, una de las cuales ocasionó un infarto con onda Q (tabla 4). En 1 caso la trombosis ocurrió a los 3,5 meses en 1 paciente con un stent de 2,75/33 mm implantado sobre una reestenosis intra-stent oclusiva y difusa en la descendente anterior proximal, con un lecho distal difusamente enfermo y una amplia colateralidad «boca-boca» desde la coronaria derecha que generaba una competencia de flujo incluso tras implantar el stent. En este caso, la trombosis cursó como una angina inestable sin elevación enzimática debido al flujo colateral descrito. El segundo caso aconteció 7 meses después del implante de un stent de 3/33 mm sobre una lesión de novo en la descendente anterior proximal, con una lesión bifurcacional del 50% a la salida. En relación con el caso de reestenosis clínica que precisó re-ACTP, se trataba de 1 paciente diabética tipo 1 con enfermedad coronaria difusa, multivaso y severa en la que se implantaron inicialmente 92 mm de stent en los 3 vasos. La coronariografía realizada 5 meses después por la recurrencia de los síntomas mostró 2 lesiones reestenóticas intra-stent no marginales, severas y focales (< 5 mm) en la descendente anterior y la circunfleja. Durante el seguimiento se efectuaron 3 (3%) procedimientos de revascularización sobre la lesión tratada, 2 de los cuales correspondieron a las trombosis tardías (tabla 4). En un caso adicional se efectuó angioplastia de 1 lesión nueva. Al final del seguimiento, sólo 2 pacientes (2%) presentaban síntomas compatibles con angina estable de clase II que no fueron remitidos para un nuevo estudio por el buen control médico de sus síntomas.
En el grupo SLT, con un seguimiento de 9 ± 2,5 meses (rango, 6-14 meses), se produjo 1 muerte no cardíaca (accidente con precipitación), no hubo nuevas trombosis de stent y 2 pacientes presentaron infarto sin onda Q (2%). Un paciente presentó reestenosis clínica que precisó revascularización percutánea (1%) y en 2 pacientes (los que habían presentado infartos sin onda Q) se realizó la revascularización de las lesiones nuevas. En uno de estos últimos casos se apreció una reestenosis de SLT en el límite de la significación angiográfica (50%). La lesión fue evaluada con una guía de presión y se obtuvo un FFR de 0,85, por lo que se procedió a tratar otras lesiones severas en otro vaso relacionadas con el cuadro clínico. Al final del seguimiento, 3 pacientes (3%) presentaron angina estable de clase II controlada con tratamiento médico y otros 3 han presentado durante todo el período 1-2 episodios de dolor torácico breves y autolimitados. El único caso de revascularización de la lesión tratada correspondió a 1 paciente en el que se implantó un stent de 3/24 mm en la descendente anterior proximal sin cubrir el ostium, que no estaba afectado. A los 11 meses, se le realizó un nuevo cateterismo por angina inestable y se observó una lesión muy severa en el ostium de la descendente anterior (dentro de los 5 mm proximales al límite del stent).
En el grupo SC, con un seguimiento de 8 ± 2 meses (rango, 6-12 meses), no se registraron muer tes y se produjo 1 trombosis subaguda (1%), pero ninguna tardía. Se produjeron 2 infartos (2%) uno con onda Q y otro sin onda Q. En 15 casos (15%) se efectuó revascularización de la lesión tratada por reestenosis clínica. En 3 casos (3%) se realizó revascularización de lesiones nuevas, en un caso con cirugía. Al final del seguimiento, 6 pacientes (6%) presentaban angina estable en clase II.
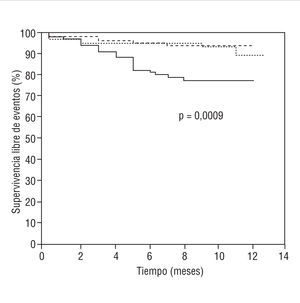
Las curvas de supervivencia libre de eventos (muerte de cualquier causa, infarto y toda revascularización) se muestran en la figura 1. Los grupos SLR y SLT mostraron una evolución comparable y significativamente mejor que el grupo SC. En la tabla 5 se refleja la tasa de reintervención por reestenosis según el tipo lesional. Dado que había diferencia entre los grupos en la tasa de tratamiento con estatinas previa al procedimiento, menos frecuente en el grupo SC, se analizó la influencia del tratamiento basal en la incidencia de revascularización sobre la lesión tratada en este grupo, sin que se observaran diferencias significativas (16% sin estatinas y 14% con estatinas).
Fig. 1. Curvas Kaplan-Meier de supervivencia libre de eventos (muerte total, infarto o revascularización) para los 3 grupos: SC (línea continua), SLT (línea de puntos) y SLR (línea quebrada). Con p = 0,002 para la comparación de SLR con SC y con p = 0,004 para la comparación de SLT con SC.
DISCUSIÓN
Los grandes estudios realizados hasta hoy con SLR y SLP sólo han evaluado lesiones de riesgo reestenótico ligero o moderado excluyendo lesiones > 30 mm, obstrucciones totales, lesiones ostiales, lesiones que precisen stents < 2,5 mm o reestenosis intra-stent. En este tipo de lesiones la eficacia de los stents recubiertos no es del todo bien conocida aunque se han publicado algunas series que sugieren buenos resultados8-16.
Es precisamente en estos tipos de lesiones donde más interesante resulta la aplicación de los stents recubiertos puesto que la reestenosis clínica con los stents metálicos no recubiertos en estas lesiones es alta (10-30%)17-28. Por otra parte, no existen todavía estudios que comparen la eficacia y seguridad de ambos modelos de stent recubierto. De existir diferencias en su comportamiento que tuvieran relevancia clínica, éstas serían más fácilmente evidenciables en el contexto de lesiones de alto riesgo.
Por todo ello hemos realizado este trabajo en el que comparamos 3 tipos de tratamiento para un mismo perfil de lesiones (lesiones difusas, en vaso pequeño, obstrucciones completas y reestenosis intrastent). Los grupos son consecutivos en el tiempo ya que la introducción de los SLR y SLT no ha sido simultánea. Las características clínicas son muy similares y las características angiográficas son igualmente parecidas, destacando únicamente una menor presencia de reestenosis intra-stent en el grupo SLT debido a la introducción en el período previo de los SLR que han reducido notablemente la incidencia de este problema. La menor presencia de reestenosis en el grupo SC en relación al SLR se justificaría por una mayor tendencia a remitir estos casos a cirugía cuando no existían stents recubiertos o a tratamientos con sólo balón, entonces más frecuentes. Se trata, pues, de grupos de alto riesgo con elevada tasa de revascularización multilesional y multivaso así como de procedimientos previos.
Trombosis de stents
En cuanto a la seguridad, la tasa de trombosis de stent fue similar aunque con distinta distribución temporal. La incidencia de trombosis con los stents recubiertos (2%) está dentro de los rangos de aceptabilidad asumiendo que no es una serie general sino una serie seleccionada de casos con lesiones complejas. En un caso de trombosis aguda de SLT y en otro de tardía con SLR se observó un aspecto común, como fue la existencia de un lecho distal enfermo con flujo no del todo óptimo, además ambos casos fueron procedimientos de stent recubierto intra-stent. En el caso agudo no se empleó abciximab y en el tardío la trombosis aconteció 3 días después de suspender clopidogrel 3 meses tras el procedimiento. Este último caso sugiere la recomendación de una terapia combinada aspirina-clopidogrel por períodos superiores a 3 o incluso a 6 meses en casos de más riesgo (stents muy largos o múltiples, reestenosis intra-stent...).
Necesidad de nueva revascularización
Sin duda la tasa de nueva revascularización sobre la lesión tratada en seguimiento en ambos grupos de stents recubiertos, así como la escasa prevalencia de síntomas de angina estable en los pacientes sin eventos, constituyen resultados espectaculares en un grupo de pacientes con las características lesionales descritas. Es más, serían buenos resultados incluso para una población con lesiones no seleccionadas. Los resultados en estos grupos contrastan con lo observado en el grupo SC, donde la necesidad de nueva reintervención fue significativamente mayor.
Podría discutirse que los resultados son demasiado buenos reflejando tasas de revascularización inferiores incluso a las reportadas en los estudios aleatorizados o en la experiencia de otros centros2-14. En primer lugar podría considerarse que las lesiones seleccionadas para tratamiento con stents recubiertos pudieran haber sido menos complejas pero la realidad es totalmente la contraria, existió ciertamente un sesgo selectivo que afectó negativamente al grupo de los stents recubiertos, ya que éstos se destinaron a las lesiones de más riesgo reestenótico y sólo se desviaron a SC algunas de las lesiones que sólo cumplían 1 criterio de riesgo (difusa o vaso pequeño pero no ambas) y en ningún caso oclusión o reestenosis intra-stent. Por todo ello el perfil lesional podría haber sido en todo caso más adverso en los grupos de stent recubierto.
En segundo lugar, podría suponerse una sesgada tendencia a recateterizar menos los grupos SLR y SLT pero la tasa de reintervención en el grupo SC es igualmente menor que la reportada en series de stents convencionales17-28. La evaluación directa e independiente del estado clínico de los pacientes al final del seguimiento confirma que ésta se ajustó plenamente a la realidad ya que solamente 2 pacientes en el grupo SLR y 3 en el grupo SLT presentaban angina estable clase II al final del seguimiento. Las razones reales para una menor reintervención en los 3 grupos en relación a ensayos y series de otros centros son las siguientes:
- En los estudios aleatorizados se ha demostrado que la realización de seguimiento angiográfico modifica al alza la tasa de revascularización respecto a un seguimiento sólo clínico29. En este sentido, los seguimiento angiográficos no reflejan el impacto clínico, pues se puede detectar reestenosis o bien silentes clínicamente o que ocasionan angina estable de fácil control médico, y estos hallazgos pueden condicionar revascularizaciones que nunca se hubieran efectuado en la práctica. Estas observaciones son también aplicables a los ensayos con stents recubiertos donde se ha observado la coincidencia temporal de muchos eventos de revascularización con el momento de la angiografía de control30.
- En cuanto a las experiencias de otros centros, la cardiología clínica de nuestro entorno no es tan propensa a la intervención como la de otros países (especialmente EE.UU. y Europa occidental)31. Algo que sabemos en primer lugar por el significativo menor número de coronariografías por millón de habitantes y segundo por la notable menor presencia de angina estable o angor poscirugía entre las indicaciones de coronariografía en nuestro medio. Esto explicaría una menor tendencia en nuestro entorno a la recateterización de aquellos pacientes que sólo muestran angina estable clase I o II y que son controlados con medicación31.
Tratamiento antiagregante
En relación con el tratamiento antiagregante, el período de tiempo varía según los estudios y el stent empleado; es de 6 meses en los estudios con SLT5-7 y de 2-3 meses en los estudios con SLR2-4. En nuestra serie se trataron por 3 meses los casos con SLR y por 6 los de SLT, tal y como se recomienda. Es probable que un período de hasta 6 meses o más pudiera ser recomendable para ambos (esto empíricamente) en casos con reestenosis intra-stent, amplia longitud de stent, múltiples stents, etc. Los dos casos descritos de trombosis tardía en el grupo SLR pudieran apoyar esta actitud que es la nuestra en el momento actual.
Limitaciones
Se trata de un estudio observacional que describe los resultados obtenidos en unas series seleccionadas, consecutivas, pero no aleatorizadas de pacientes. Igualmente no se ha realizado seguimiento angiográfico. Todo esto resta valor informativo al estudio, pero hay que reseñar que el estudio se enmarca dentro de la práctica asistencial y como tal lo que nos interesaba era conocer y comparar el impacto que sobre la misma va a tener la utilización de estos stents y que concernía a su seguridad (incidencia de trombosis) y a la reducción de la necesidad de nuevas reintervenciones, así como al estado clínico de los pacientes al final de un seguimiento clínico razonable. La evaluación directa e independiente del estado clínico de los pacientes al final del seguimiento confirma que la necesidad de nueva revascularización se ajustó a la realidad, ya que solamente 2 pacientes en el grupo SLR y 3 en el grupo SLT presentaban angina estable clase II al final del seguimiento.
Una última limitación fue la no determinación seriada de enzimas tras el procedimiento en todos los casos (sólo se realizó en los complicados), lo que impide conocer la incidencia de necrosis posprocedimiento en los casos no complicados. En relación con este aspecto, nuestro grupo ha evaluado recientemente la incidencia de elevación de la troponina I en series consecutivas de pacientes tratados con SC (200 pacientes) y SLR (100 pacientes) en procedimientos no complicados no encontrando diferencias significativas (el 15 frente al 19%, respectivamente), aun con un perfil lesional más adverso en el grupo tratado con SLR32.
CONCLUSIONES
La utilización de SLR y SLP en lesiones con alto riesgo de reestenosis (difusas, vaso ≤ 2,5 mm, obstrucciones totales y reestenosis intra-stent) parece ser comparablemente segura y muy eficaz en relación con los stents convencionales. Teniendo en consideración las limitaciones indicadas para este estudio, son necesarias series más amplias y con comparación aleatorizada para asentar con mayor certeza estos hallazgos.
No obstante, habida cuenta de la relativa dificultad para elaborar modelos predictivos de reestenosis33, será difícil evitar que la única contraindicación para la generalización de su empleo sea la siempre discutida y variable cuestión económica, al menos en los tiempos presentes34.
Correspondencia: Dr. J.M. de la Torre Hernández.
Unidad de Hemodinámica y Cardiología Intervencionista.
Hospital Universitario Marqués de Valdecilla.
Avda. Valdecilla, s/n. 39008 Santander. Cantabria. España.
Correo electrónico: hemodinamica@humv.es