Full English text available from: www.revespcardiol.org/en
La fuga paravalvular (FPV) es una complicación, infrecuente pero grave, del implante quirúrgico de prótesis valvulares, que más recientemente se ha identificado con el implante valvular percutáneo. Dicha complicación ha suscitado renovado interés tras observarse relación entre el grado de regurgitación paravalvular y la mortalidad1. El cierre percutáneo de las FPV resulta muy prometedor, con unos porcentajes de éxito actuales de hasta el 86%, sobre todo en pacientes con riesgo elevado en una reparación o sustitución quirúrgica2,3. Los avances en el campo de la cardiopatía estructural han aportado la adaptación de muchos progresos técnicos y de intervención, en un intento de mejorar en mayor medida el éxito de las técnicas percutáneas, al tiempo que se reduce el riesgo de complicaciones. Las recientes publicaciones de Cruz-González et al4 y Sánchez-Recalde et al5 en Revista Española de Cardiología ilustran el continuo deseo de innovación entre los cardiólogos intervencionistas. Es su aplicación de nuevas técnicas y tecnologías lo que está permitiendo su expansión. Por lo que respecta al cierre percutáneo de las FPV, la pregunta que todavía se plantea es hacia dónde vamos ahora. Creemos que un enfoque triple —centrado en mejores dispositivos para adaptarse a las formas peculiares específicas de las FPV, vías de acceso más favorables y una mejora de la guía de imagen— ampliará los límites de este alentador tratamiento.
Las FPV son el resultado de un cierre no hermético entre el anillo de sutura y el anillo valvular en las prótesis quirúrgicas o entre el marco del stent y el anillo aórtico/valvas calcificadas en las prótesis aórticas percutáneas. En el primer caso, esto es consecuencia de una presión anormal o de fuerzas de tracción existentes tras la operación, generalmente en relación con calcificación del anillo, infección, técnica de sutura y tamaño y forma de la prótesis. En el segundo caso, la FPV suele ser consecuencia de una aposición incompleta de la prótesis con el anillo aórtico nativo a causa de calcificación, excentricidad del anillo, tamaño de la válvula demasiado pequeño o mala colocación, independientemente del tipo de prótesis: autoexpansible o expansible con balón6. La mayor parte de nuestra experiencia en el cierre percutáneo y las exploraciones de imagen gira en torno a las FPV en el contexto de las prótesis quirúrgicas. A pesar de las posibles etiologías, la forma y el trayecto difieren en cada FPV. Es muy poco frecuente observar una FPV redonda, y en su mayoría tienen un aspecto ovalado o en media luna. Además, los trayectos rara vez son paralelos y a menudo transcurren perpendiculares, con un curso sinuoso. Las características físicas del tejido circundante son igualmente difíciles de determinar y su respuesta a los dispositivos de cierre es casi imposible de predecir. Los avances realizados en la ecocardiografía transesofágica tridimensional (3D) y en la angiografía de tomografía computarizada 3D/4D han mejorado enormemente nuestra evaluación y planificación previas al cierre percutáneo.
Las estrategias utilizadas inicialmente para el cierre percutáneo consistieron en dispositivos en paraguas y en espirales. Posteriormente se sustituyeron por dispositivos diseñados para el cierre de otros defectos cardiovasculares (fuera de las indicaciones aprobadas), como la familia de dispositivos Amplatzer (St. Jude Medical; St. Paul, Minnesota, Estados Unidos): oclusores de tabique auricular y ventricular muscular y oclusor de conducto. Estos dispositivos son redondos o cónicos, están rellenos de fibra de poliéster y tienen uno o dos discos de retención. Su diseño de malla de nitinol tiene un entrelazado menos denso, con una estructura más rígida que la de los tapones más modernos, lo que hace que sean menos aptos para adaptar su forma. Actualmente, el tapón vascular Amplatzer (AVP) II es el dispositivo más comúnmente utilizado en Estados Unidos para el cierre de las FPV de prótesis valvulares quirúrgicas. Está formado por una malla de nitinol en capas más densas, con tres segmentos: un lóbulo central y dos discos, uno a cada lado7. El AVP II tiene forma redonda; sin embargo, la malla fina permite cierta adaptación de su forma.
Cruz-González et al4 y Sánchez-Recalde et al5 han presentado su experiencia con un tapón vascular específico, el AVP III, con tasas de éxito de hasta el 94%. Este dispositivo está hecho de la misma malla de nitinol que el AVP II, pero tiene una forma oblonga, con dos rebordes extendidos7. El diámetro del eje largo oscila entre 4 y 14 mm y el del eje corto, entre 2 y 5 mm. Puede aplicarse a través de vainas de calibre 4–7 Fr o catéteres guía de 6–9 Fr. Es un dispositivo de nicho que puede usarse en cualquier anatomía apta para su estructura concreta. Sin embargo, los informes clínicos publicados se limitan al tratamiento de las FPV8,9. El uso del dispositivo está restringido; tiene la autorización de la Comisión Europea para la embolización de vasos sanguíneos de la circulación periférica, pero no ha recibido la autorización de la Food and Drug Administration en Estados Unidos.
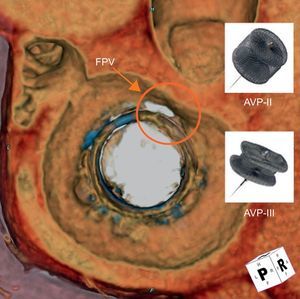
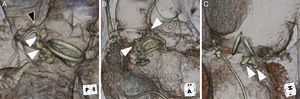
La elección del tamaño del AVP III es similar a la de los tamaños más comúnmente utilizados del AVP II, que habitualmente son de 8–12 mm. Se propone que las FPV en media luna u oblongas, que son la mayoría, pueden ser más apropiadas para un cierre con el dispositivo AVP III (figura 1). Con el AVP II, el lóbulo medio se moldea para adaptarlo a la forma de la FPV. En muchas FPV grandes, esto puede requerir el despliegue de múltiples dispositivos, en secuencia o simultáneamente; el llenado denso de la FPV con múltiples dispositivos puede asegurar un cierre hermético adecuado. Además, se ha apuntado el concepto de múltiples dispositivos de menor tamaño en vez de uno o dos más grandes para obtener un cierre más hermético en la FPV y menos interferencia con otras estructuras cardiacas10. Cuando el tamaño de los AVP II es excesivo, el lóbulo central está comprimido habitualmente por la FPV/prótesis quirúrgica, con lo que se alarga el dispositivo y aumenta la probabilidad de que sobresalga. Que el dispositivo sobresalga puede conducir a una obstrucción mecánica del ostium coronario (en la posición aórtica) o del flujo valvular, o puede causar una disfunción de la prótesis, sobre todo en las de tipo mecánico (figura 2). El uso de múltiples AVP III permitiría un llenado del canal de fuga de FPV aún más denso, sin esos posibles riesgos.
Reconstrucción tridimensional de la angiografía por tomografía computarizada del corazón que muestra una válvula mitral bioprotésica (proyección sagital desde el lado auricular) con una fuga paravalvular en forma de media luna (círculo) de las 11.00 a las 12.00 del reloj. El tapón vascular Amplatzer III (oblongo) puede ser más apropiado para el cierre, ya que su forma se puede adaptar a la de la FPV mejor que el tapón vascular Amplatzer II (redondo). AVP: tapón vascular Amplatzer; FPV: fuga paravalvular.
Con el exceso de tamaño del tapón vascular Amplatzer II, la fuga paravalvular y la prótesis quirúrgica pueden comprimir el lóbulo central. El alargamiento del tapón vascular Amplatzer II (puntas de flecha blancas) puede causar una obstrucción mecánica y riesgo de complicaciones. A: oclusión coronaria de la arteria coronaria principal izquierda (punta de flecha negra). B: obstrucción supraaórtica al flujo de salida. C: interferencia de las valvas de una válvula mecánica.
Gran parte de la técnica del cierre percutáneo de la FPV depende de la posición de la válvula en cuestión, la localización de la fuga, la presencia de válvulas mecánicas que dificulten la entrada y las dificultades de acceso vascular del paciente. Además, las características de la FPV pueden comportar dificultades, como en caso de calcificación, trayecto sinuoso o diferencias en el tamaño del orificio a cada lado de la prótesis. Los ángulos de abordaje pueden añadir otra complicación. En las FPV mitrales, puede ser importante para alcanzar y superar las fugas septales y de localización posterior la angulación de los catéteres y las vainas de aplicación (figura 3). Pueden ser necesarios para un cierre satisfactorio otros abordajes alternativos, como los combinados que requieren un raíl arteriovenoso. En la serie de Cruz-González et al4, en un porcentaje elevado de pacientes (casi un 60%) se cerró la FPV mitral empleando un abordaje transaórtico retrógrado. En los casos de FPV mitral con una prótesis aórtica de dos discos, fue necesario superar la abertura central de la prótesis con una guía deslizante hidrófila y un catéter, y crear luego un raíl arteriovenoso para aportar el soporte necesario para introducir la vaina de aplicación. Este es un enfoque novedoso, descrito anteriormente por el mismo grupo, que ha resultado con éxito11. No obstante, este abordaje tiene riesgos inherentes, entre los que se encuentra el deterioro hemodinámico durante la intervención y el potencial de dañar los discos mecánicos o las bisagras.
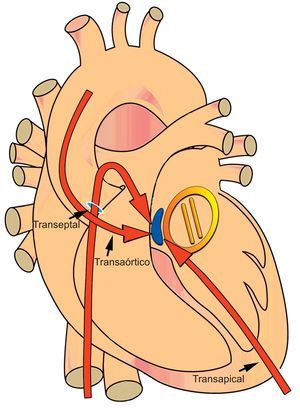
Representación esquemática de una fuga paravalvular (azul) alrededor de una válvula mitral mecánica (amarillo) en una localización septal (de la 1.00 a las 3.00 del reloj). Las fugas de localización septal y posterior (de la 1.00 a las 6.00) requieren grandes angulaciones de los catéteres y las vainas de aplicación con los abordajes transeptal anterógrado y transaórtico retrógrado. Un abordaje transapical percutáneo proporciona un acceso directo tanto a la válvula aórtica como a la mitral y reduce las angulaciones pronunciadas del catéter y la necesidad de atravesar las válvulas mecánicas. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Otros métodos de acceso alternativos, como el transapical, aportan un abordaje adicional cuando los métodos de acceso tradicionales (aórtico: transaórtico retrógrado, transeptal anterógrado; mitral: transeptal anterógrado, transaórtico retrógrado) no son eficaces o resultan difíciles por razones técnicas. A la vista de la experiencia de nuestro centro, plantearíamos que el abordaje primario para las FPV mitrales, sobre todo las situadas en localizaciones septales y posteriores (posiciones de la 1.00 a las 6.00 del reloj) es el transapical. El método transapical percutáneo (TAp) proporciona un abordaje directo tanto de la válvula aórtica como del aparato valvular mitral, y se ha demostrado que reduce de manera significativa los tiempos de intervención y de fluoroscopia2. Las técnicas percutáneas para el acceso y la salida pueden obviar la necesidad de una exposición quirúrgica directa, mientras que la entrada en el ventrículo izquierdo puede reducir las grandes angulaciones del catéter y la necesidad de atravesar válvulas mecánicas (figura 3).
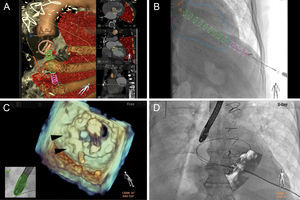
Sin embargo, son las técnicas de imagen multimodales las que hacen posible un cierre eficaz y seguro de la FPV TAp. La capacidad de integrar las técnicas de angiografía de tomografía computarizada previa a la intervención y ecocardiografía transesofágica durante la intervención, lo que se denomina también técnica de imagen de fusión, ofrece actualmente una alternativa a las intervenciones convencionales con guía ecográfica. El uso de angiografía con técnica de imagen de fusión de tomografía computarizada-fluoroscopia para la TAp permite determinar la vía y el lugar de entrada, de manera que queden alineados con la FPV y lejos del parénquima pulmonar, las arterias coronarias y los músculos papilares (figura 4A)2. A pesar del movimiento cardiaco, la TAp puede estar a menos de 5 mm del lugar de punción previsto, al tiempo que se mantiene una distancia de seguridad (1–2 cm) respecto a la arteria descendente anterior izquierda12. En cambio, la técnica de imagen de fusión de ecofluoroscopia se basa en el uso de los datos de ecocardiografía transesofágica que se fusionan con la fluoroscopia13. A diferencia de la fusión de angiografía de tomografía computarizada-fluoroscopia, la fusión de ecocardiografía transesofágica-fluoroscopia utiliza datos en tiempo real de ambas modalidades de exploración, con lo que se reducen muchas de las limitaciones del movimiento cardiaco, la colocación del paciente y las variaciones fisiológicas existentes entre los distintos momentos de realización de las exploraciones previas a la intervención. Para el cierre de la FPV, una mejor visualización con ecocardiografía transesofágica 3D y la confirmación con Doppler color facilitan la localización de la fuga (figura 4B). Los puntos de referencia pueden colocarse en el centro o en los márgenes o se puede dibujar la forma de toda la fuga. Una vez registrada y superpuesta a la fluoroscopia, se puede utilizar una imagen con arco de radioscopia para guiar el paso a través de la FPV. Esta técnica puede resultar especialmente útil con las prótesis valvulares que tienen marcadores fluoroscópicos mínimos.
Técnicas de imagen de fusión de angiografía por tomografía computarizada-fluoroscopia (HeartNavigator, Philips HealthCare; Best, Países Bajos) y ecocardiografía transesofágica-fluoroscopia (EchoNavigator, Philips HealthCare; Andover, Massachusetts, Estados Unidos) utilizadas como guía para la intervención. A: la planificación previa a la intervención con la fusión de tomografía computarizada-fluoroscopia comporta una segmentación de la válvula mitral mecánica y la válvula aórtica bioprotésica, la aorta y las costillas (todo ello en marrón) y los pulmones (rojo); los puntos de referencia se colocan en la piel (punto rojo) y en el vértice del ventrículo izquierdo (punto verde) para el acceso transapical, el tabique interauricular para el acceso transeptal (punto azul) y la fuga paravalvular (punto rojo/texto). B: el registro y la superposición de la tomografía computarizada-fluoroscopia sobre la fluoroscopia muestra un cilindro (rosa/verde) que dirige el acceso de la aguja hacia el ventrículo izquierdo (delimitado en azul). C: la fusión de ecocardiografía transesofágica-fluoroscopia muestra una imagen frontal tridimensional de una válvula mitral mecánica en posición abierta con dos tapones vasculares Amplatzer II (puntas de flecha negras) situada dentro de la fuga paravalvular y una guía de seguridad aún en posición. D: la superposición de la ecocardiografía transesofágica sobre la fluoroscopia en vivo muestra la vaina transapical a través de la fuga paravalvular alrededor de la válvula mitral, con una guía de seguridad aún en posición. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
En general, el tratamiento de las FPV está evolucionando; los abordajes endovasculares han aumentado sustancialmente desde el primer cierre realizado por Hourihan et al14 en 1992. La elección del dispositivo de cierre, aunque esté fuera de las indicaciones aprobadas, ha cambiado nuestro conocimiento de las características de la FPV y ha aumentado el potencial de complicaciones. Además, el aprovechamiento de las técnicas de acceso alternativas, como la transapical percutánea, y el uso de técnicas de imagen de multimodalidad, específicamente las imágenes de fusión, aportan actualmente la posibilidad de continuar avanzando en esta intervención percutánea. Dado que la complejidad tanto de los pacientes como de las intervenciones continúa aumentando, una reconsideración de las intervenciones percutáneas, como el cierre de FPV, ha aumentado el uso de esta intervención en otro tiempo desalentadora y la ha hecho más fácilmente disponible incluso para los pacientes de máximo riesgo.
CONFLICTO DE INTERESESChad Kliger recibe honorarios por conferencias de St. Jude Medical. Carlos E. Ruiz es consultor de St. Jude Medical, Valtech, Sorin, MediValve; asesor de St. Jude Medical; recibe subvenciones para investigación de Philips Healthcare y posee acciones de Vascular Therapies, MitrAssist, Entourage y BioInspire.