No se ha estudiado en comparación con normopeso el perfil de los biomarcadores relacionados con obesidad, síndrome metabólico y diabetes mellitus. Se pretende caracterizar el perfil de biomarcadores en el continuo de riesgo metabólico definido por la transición de normopeso a obesidad, síndrome metabólico y diabetes mellitus.
MétodosAnálisis transversal de datos agrupados procedentes de siete estudios poblacionales españoles. Se determinaron 20 biomarcadores del metabolismo de los hidratos de carbono y los lípidos, inflamatorios, de coagulación, oxidación, hemodinámicos y de lesión miocárdica. Se realizaron modelos de regresión multinomial ajustados para los fenotipos sano, obesidad, síndrome metabólico y diabetes mellitus.
ResultadosSe incluyó a 2.851 participantes, con media de edad de 57,4 ± 8,8 años; 1.269 (44,5%) eran varones; 464 sujetos tenían obesidad; 443, síndrome metabólico; 473, diabetes mellitus, y 1.471, normopeso (sujetos sanos). Los biomarcadores que mostraron asociación positiva significativa con al menos uno de los fenotipos clínicos de interés fueron la proteína C reactiva de alta sensibilidad, la apolipoproteína B100, la leptina y la insulina. La apolipoproteina A1 y la adiponectina mostraron asociación negativa.
ConclusionesEl grupo de normopeso, y algo menos la obesidad, se diferencian del síndrome metabólico y la diabetes mellitus en su perfil metabólico, inflamatorio y lipídico, lo que indica la relevancia de estos mecanismos en el continuo del riesgo metabólico. Estas diferencias son menores entre el síndrome metabólico y la diabetes mellitus.
Palabras clave
A pesar de la menor morbimortalidad cardiovascular del sur de Europa1, las enfermedades cardiovasculares son la primera causa de morbimortalidad en España2.
La obesidad3, el síndrome metabólico (SM)4 y la diabetes mellitus (DM)5 son epidémicas en España y los países industrializados y se asocian a morbilidad y mortalidad6. Actualmente se acepta la importancia del tejido graso en la homeostasis metabólica7 y que su acumulación determina inflamación crónica con elevación de numerosas adipocitocinas, como la interleucina 6, proteína 1 quimiotáctica para monocitos, el factor de necrosis tumoral alfa y la leptina, y con disminución de la adiponectina. Todas estas alteraciones conllevan resistencia a la insulina y la leptina8 e inducen la aparición de dislipemia, hipertensión arterial y alteración del metabolismo de los hidratos de carbono, cuya agrupación constituye el SM9, y finalmente la aparición de DM10. No se ha estudiado de manera sistemática el perfil de biomarcadores inflamatorios, metabólicos y de otros tipos en sujetos con obesidad, SM y DM y su comparación con sujetos sanos.
El estudio DARIOS Inflamatorio tiene como objetivo principal caracterizar un perfil amplio de biomarcadores (metabólicos, inflamatorios, hemodinámicos, hemostáticos y de daño miocárdico) en el continuo del riesgo metabólico definido por la transición de normopeso, a obesidad, SM y DM en población mediterránea.
MÉTODOSDiseño y población de estudioEstudio transversal a partir de un análisis agrupado de 21.038 individuos reclutados en siete estudios poblacionales realizados a partir del año 2000 en España: CDC (Canarias)11, DRECA-2 (Andalucía)12, HERMEX (Extremadura)13, RECCyL (Castilla y León)14, REGICOR (Cataluña)15, RIVANA (Comunidad Foral de Navarra)16 y TALAVERA (Castilla-La Mancha)17. La metodología de todos los estudios fue similar y se ha descrito previamente5.
Para este estudio se definieron cuatro fenotipos y se seleccionó aleatoriamente a 464 participantes con obesidad (sin SM ni DM), 443 con SM, 473 con DM y 1.471 sanos (no obesos). Todos los participantes fueron informados de los objetivos y firmaron su consentimiento. El estudio DARIOS fue aprobado por el Comité Ético de Investigación Clínica del Parc de Salut Mar (n.o de autorización: 2009/3640).
Determinaciones y definición de los fenotipos de interésLos cuestionarios de los estudios componentes se basaron en encuestas estandarizadas de la Organización Mundial de la Salud18.
Se midió el perímetro de la cintura y se talló y pesó a todos los participantes en básculas y tallímetros calibrados. Se calculó el índice de masa corporal (IMC) y definió obesidad como IMC ≥ 3019. Se definió obesidad abdominal como perímetro de la cintura > 102 cm los varones y > 88cm las mujeres, según el Adult Treatment Panel III20.
El SM se definió por la presencia de tres de los cinco criterios siguientes21: glucemia en ayunas ≥ 100mg/dl o tratamiento antidiabético; presión arterial sistólica ≥ 130mmHg o diastólica ≥ 85mmHg; colesterol unido a lipoproteínas de alta densidad <40mg/dl los varones y < 50mg/dl las mujeres; triglicéridos ≥ 150mg/dl y/o un perímetro abdominal ≥ 102 cm los varones y > 88 cm las mujeres. No se incluyó a los pacientes con diagnóstico de DM previo.
La DM se definió por el diagnóstico previo y la utilización de antidiabéticos orales o insulina o por glucemias en ayunas ≥ 126mg/dl.
Determinación de biomarcadores: métodos de laboratorioLas muestras de sangre se tomaron tras al menos 10 h de ayuno, y las alícuotas se almacenaron a –80°C (en todos los casos se garantizó la cadena del frío). Se determinaron todos los biomarcadores en el IMIM (Instituto Hospital del Mar de Investigaciones Médicas) de Barcelona. Se estudiaron analitos relacionados con el metabolismo de los hidratos de carbono (glucosa e insulina), perfil lipídico (colesterol total, colesterol unido a lipoproteínas de alta densidad y colesterol unido a lipoproteínas de baja densidad, triglicéridos y apolipoproteínas A1 y B100), estado metabólico (adiponectina y leptina), inflamatorio (proteína C reactiva de alta sensibilidad [PCRas], interleucina 6, interleucina 10, factor de necrosis tumoral alfa, interferón gamma, proteína 1 quimiotáctica para monocitos, hemostático (inhibidor del activador del plasminógeno 1), de oxidación (anticuerpos contra lipoproteínas de baja densidad oxidadas), hemodinámicos (péptido natriurético tipo B) y de lesión miocárdica (troponina I).
La glucosa, el colesterol total y los triglicéridos se analizaron por métodos enzimáticos y el colesterol unido a lipoproteínas de alta densidad, por metodología directa de detergente selectivo acelerador (HORIBA-ABX Diagnostics, Francia), en un analizador PENTRA-400 (HORIBA-ABX Diagnostics). El colesterol unido a lipoproteínas de baja densidad se calculó mediante la fórmula de Friedewald (si trigliceridemia < 300mg/dl). La PCRas y las apolipoproteínas A1 y B100 se determinaron por inmunoturbidimetría (HORIBA-ABX Diagnostics) en un analizador PENTRA-400 (HORIBA-ABX Diagnostics). El péptido natriurético tipo B y troponina I se analizaron mediante enzimoinmunoanálisis de micropartículas (Abbott, Estados Unidos) en un analizador AXSYM (Abbott). interleucina 6, interleucina 10, factor de necrosis tumoral alfa, interferón gamma, proteína 1 quimiotáctica para monocitos,, adiponectina, leptina, insulina e inhibidor del activador del plasminógeno 1 se analizaron por duplicado mediante tecnología Luminex xMAP® en un sistema Bio-Plex (Bio-Rad, Hercules, California, Estados Unidos). Los anticuerpos contra lipoproteínas de baja densidad oxidadas se analizaron mediante ELISA por duplicado (Biomedica, Austria). El cálculo del índice Homeostasis Model Assessment (HOMA) se realizó como (insulina × 0,024 × glucosa) / 22,5. El coeficiente de variación de los análisis (Enzyme-Linked ImmunoSorbent Assay) por inmunoturbidimetría (apolipoproteínas A1 y B100 y la PCRas) osciló entre el 1,62 y el 2,00%, por enzimoinmunoanálisis de micropartículas, (MEIA), del 10,89 al 15,00% por enzimoinmunoanálisis y del 6,70 al 15,51% por metodología Luminex.
Cálculo del tamaño muestralPara el cálculo del tamaño muestral se asumió que el porcentaje de sanos con valores por debajo del límite de detección en los biomarcadores no sería < 15% ni > 80%. Con 1.400 participantes con normopeso y 450 en cada uno de los otros tres grupos de riesgo metabólico (obesidad, SM y DM), se tiene una potencia estadística del 80% para detectar como estadísticamente significativa una odds ratio ≥ 1,5 entre dos de los grupos de riesgo metabólico definidos.
Análisis estadísticoLos biomarcadores analizados cuya distribución se alejó del supuesto de normalidad se transformaron mediante el logaritmo natural. En aquellos que presentaron valores por encima o por debajo del límite de detección: a) si la proporción de participantes era > 5%, se categorizaron agrupándolos con el siguiente criterio: los valores más allá de los límites de detección formaron un grupo y los demás valores se agruparon en terciles o cuartiles según el número de efectivos en la categoría por debajo (o por encima) de los valores de detección; b) si la proporción de individuos en este grupo era < 5%, se les asignó un valor de biomarcador estándar calculado como fracción de los valores de detección: 0,99 × valor del límite de detección inferior, si estaban por debajo, o 1,01 × valor del límite de detección superior, si estaban por encima de este límite.
Para las comparaciones bivariables de los cuatro grupos, se utilizó la prueba de la χ2 para tendencias con las variables categóricas y la correlación de Pearson con las variables continuas.
Se ajustaron modelos de regresión logística multinomial para los cuatro grupos de riesgo metabólico, utilizando la categoría «sano» como referencia. Las variables explicativas de interés fueron los biomarcadores de perfil metabólico-inflamatorio. Los modelos se ajustaron además por edad y sexo. Solo se retuvieron los biomarcadores con al menos una categoría asociada con al menos un grupo de riesgo metabólico. El límite de significación se estableció en p = 0,01 para tener en cuenta las comparaciones múltiples. Los resultados se presentan como odds ratio y su intervalo de confianza del 95%.
Se utilizó la técnica backward (pasos hacia atrás), introduciendo todos los biomarcadores analizados en el modelo, y se fue eliminando aquellos cuya exclusión no modificaba significativamente el cambio en la verosimilitud del modelo, es decir, cuando p > 0,01, como se ha mencionado. Para asegurarnos de no eliminar ningún biomarcador importante, se añadieron al modelo final (forward method, o por pasos hacia adelante) los eliminados en el proceso anterior, reteniendo en el modelo final aquellos cuya inclusión alcanzara significación estadística en la verosimilitud.
La discriminación de los modelos se valoró con el área bajo la curva ROC (receiver operating characteristic).
Se estudiaron las interacciones de primer grado entre cada biomarcador y el sexo en relación con los cuatro grupos estudiados. Para evitar un problema relacionado con comparaciones múltiples, se corrigió este valor de p mediante el test de Bonferroni y se fijó un valor de 0,0033 como umbral para considerar significación estadística.
Los análisis se realizaron con el software R versión 3.0.1 (R Foundation for Statistical Computing; Viena, Austria).
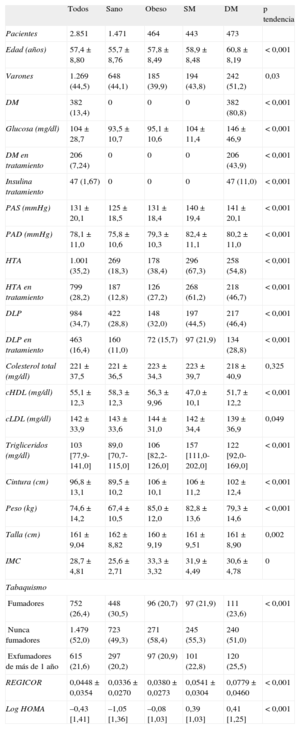
RESULTADOSSe incluyó a 2.851 participantes, con una media de edad de 57,4 ± 8,8 años, de los que eran varones 1.269 (44,5%). En la tabla 1 se presentan las características basales de los cuatro grupos de fenotipos, definidos por: a) normopeso (sin evidencia de SM ni DM); b) obesidad (sin evidencia de SM ni DM); c) SM, y d) DM. Se observó una tendencia progresiva y significativa a presentar más factores de riesgo cardiovascular, salvo la disminución del tabaquismo, con un aumento del riesgo coronario según la función de Framingham calibrada REGICOR al pasar del grupo de sanos a SM y DM. En la tabla S1 del material suplementario se describen las características generales del estudio DARIOS Inflamatorio y por estudio componente.
Características sociodemográficas y clínicas de los participantes del estudio DARIOS Inflamatorio, divididos en cuatro grupos según las diferentes entidades metabólicas de interés
| Todos | Sano | Obeso | SM | DM | p tendencia | |
| Pacientes | 2.851 | 1.471 | 464 | 443 | 473 | |
| Edad (años) | 57,4 ± 8,80 | 55,7 ± 8,76 | 57,8 ± 8,49 | 58,9 ± 8,48 | 60,8 ± 8,19 | < 0,001 |
| Varones | 1.269 (44,5) | 648 (44,1) | 185 (39,9) | 194 (43,8) | 242 (51,2) | 0,03 |
| DM | 382 (13,4) | 0 | 0 | 0 | 382 (80,8) | < 0,001 |
| Glucosa (mg/dl) | 104 ± 28,7 | 93,5 ± 10,7 | 95,1 ± 10,6 | 104 ± 11,4 | 146 ± 46,9 | < 0,001 |
| DM en tratamiento | 206 (7,24) | 0 | 0 | 0 | 206 (43,9) | < 0,001 |
| Insulina tratamiento | 47 (1,67) | 0 | 0 | 0 | 47 (11,0) | < 0,001 |
| PAS (mmHg) | 131 ± 20,1 | 125 ± 18,5 | 131 ± 18,4 | 140 ± 19,4 | 141 ± 20,1 | < 0,001 |
| PAD (mmHg) | 78,1 ± 11,0 | 75,8 ± 10,6 | 79,3 ± 10,3 | 82,4 ± 11,1 | 80,2 ± 11,0 | < 0,001 |
| HTA | 1.001 (35,2) | 269 (18,3) | 178 (38,4) | 296 (67,3) | 258 (54,8) | < 0,001 |
| HTA en tratamiento | 799 (28,2) | 187 (12,8) | 126 (27,2) | 268 (61,2) | 218 (46,7) | < 0,001 |
| DLP | 984 (34,7) | 422 (28,8) | 148 (32,0) | 197 (44,5) | 217 (46,4) | < 0,001 |
| DLP en tratamiento | 463 (16,4) | 160 (11,0) | 72 (15,7) | 97 (21,9) | 134 (28,8) | < 0,001 |
| Colesterol total (mg/dl) | 221 ± 37,5 | 221 ± 36,5 | 223 ± 34,3 | 223 ± 39,7 | 218 ± 40,9 | 0,325 |
| cHDL (mg/dl) | 55,1 ± 12,3 | 58,3 ± 12,3 | 56,3 ± 9,96 | 47,0 ± 10,1 | 51,7 ± 12,2 | < 0,001 |
| cLDL (mg/dl) | 142 ± 33,9 | 143 ± 33,6 | 144 ± 31,0 | 142 ± 34,4 | 139 ± 36,9 | 0,049 |
| Trigliceridos (mg/dl) | 103 [77,9-141,0] | 89,0 [70,7-115,0] | 106 [82,2-126,0] | 157 [111,0-202,0] | 122 [92,0-169,0] | < 0,001 |
| Cintura (cm) | 96,8 ± 13,1 | 89,5 ± 10,2 | 106 ± 10,1 | 106 ± 11,2 | 102 ± 12,4 | < 0,001 |
| Peso (kg) | 74,6 ± 14,2 | 67,4 ± 10,5 | 85,0 ± 12,0 | 82,8 ± 13,6 | 79,3 ± 14,6 | < 0,001 |
| Talla (cm) | 161 ± 9,04 | 162 ± 8,82 | 160 ± 9,19 | 161 ± 9,51 | 161 ± 8,90 | 0,002 |
| IMC | 28,7 ± 4,81 | 25,6 ± 2,71 | 33,3 ± 3,32 | 31,9 ± 4,49 | 30,6 ± 4,78 | 0 |
| Tabaquismo | ||||||
| Fumadores | 752 (26,4) | 448 (30,5) | 96 (20,7) | 97 (21,9) | 111 (23,6) | < 0,001 |
| Nunca fumadores | 1.479 (52,0) | 723 (49,3) | 271 (58,4) | 245 (55,3) | 240 (51,0) | |
| Exfumadores de más de 1 año | 615 (21,6) | 297 (20,2) | 97 (20,9) | 101 (22,8) | 120 (25,5) | |
| REGICOR | 0,0448 ± 0,0354 | 0,0336 ± 0,0270 | 0,0380 ± 0,0273 | 0,0541 ± 0,0304 | 0,0779 ± 0,0460 | < 0,001 |
| Log HOMA | –0,43 [1,41] | –1,05 [1,36] | –0,08 [1,03] | 0,39 [1,03] | 0,41 [1,25] | < 0,001 |
cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; DLP: dislipemia; DM: diabetes mellitus; HTA: hipertensión arterial; IMC: índice de masa corporal; Log HOMA: logaritmo Homeostasis Model Assesment; PAD: presión arterial diastólica; PAS: presión arterial sistólica; REGICOR: función de riesgo que expresa la probabilidad de sufrir un evento coronario a 10 años; SM: síndrome metabólico.
Las cifras expresan n (%), media ± desviación estandar o mediana [intervalo intercuartílico].
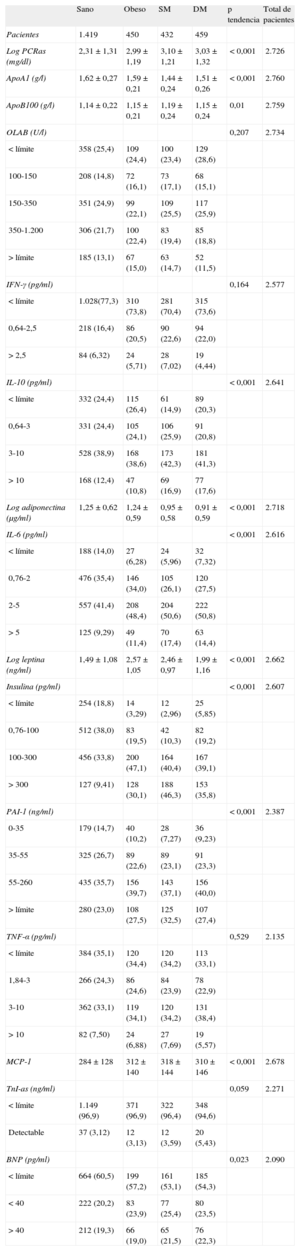
En la tabla 2 se presentan los valores de los diferentes biomarcadores analizados en los diferentes grupos. Los títulos de anticuerpos contra lipoproteínas de baja densidad oxidadas, interferón gamma, factor de necrosis tumoral alfa, troponina I y péptido natriurético tipo B no se asociaron significativamente con aquellos. Los demás biomarcadores aumentaron significativamente, salvo en el caso de la adiponectina y la apolipoproteína A1, que disminuyeron al pasar del grupo de sanos a SM y DM. La leptina se asoció positiva y significativamente con los tres fenotipos.
Descripción de la distribución de los diferentes biomarcadores analizados en los participantes del estudio DARIOS Inflamatorio, divididos en cuatro grupos según las diferentes entidades metabólicas de interés
| Sano | Obeso | SM | DM | p tendencia | Total de pacientes | |
| Pacientes | 1.419 | 450 | 432 | 459 | ||
| Log PCRas (mg/dl) | 2,31 ± 1,31 | 2,99 ± 1,19 | 3,10 ± 1,21 | 3,03 ± 1,32 | < 0,001 | 2.726 |
| ApoA1 (g/l) | 1,62 ± 0,27 | 1,59 ± 0,21 | 1,44 ± 0,24 | 1,51 ± 0,26 | < 0,001 | 2.760 |
| ApoB100 (g/l) | 1,14 ± 0,22 | 1,15 ± 0,21 | 1,19 ± 0,24 | 1,15 ± 0,24 | 0,01 | 2.759 |
| OLAB (U/l) | 0,207 | 2.734 | ||||
| < límite | 358 (25,4) | 109 (24,4) | 100 (23,4) | 129 (28,6) | ||
| 100-150 | 208 (14,8) | 72 (16,1) | 73 (17,1) | 68 (15,1) | ||
| 150-350 | 351 (24,9) | 99 (22,1) | 109 (25,5) | 117 (25,9) | ||
| 350-1.200 | 306 (21,7) | 100 (22,4) | 83 (19,4) | 85 (18,8) | ||
| > límite | 185 (13,1) | 67 (15,0) | 63 (14,7) | 52 (11,5) | ||
| IFN-γ (pg/ml) | 0,164 | 2.577 | ||||
| < límite | 1.028(77,3) | 310 (73,8) | 281 (70,4) | 315 (73,6) | ||
| 0,64-2,5 | 218 (16,4) | 86 (20,5) | 90 (22,6) | 94 (22,0) | ||
| > 2,5 | 84 (6,32) | 24 (5,71) | 28 (7,02) | 19 (4,44) | ||
| IL-10 (pg/ml) | < 0,001 | 2.641 | ||||
| < límite | 332 (24,4) | 115 (26,4) | 61 (14,9) | 89 (20,3) | ||
| 0,64-3 | 331 (24,4) | 105 (24,1) | 106 (25,9) | 91 (20,8) | ||
| 3-10 | 528 (38,9) | 168 (38,6) | 173 (42,3) | 181 (41,3) | ||
| > 10 | 168 (12,4) | 47 (10,8) | 69 (16,9) | 77 (17,6) | ||
| Log adiponectina (μg/ml) | 1,25 ± 0,62 | 1,24 ± 0,59 | 0,95 ± 0,58 | 0,91 ± 0,59 | < 0,001 | 2.718 |
| IL-6 (pg/ml) | < 0,001 | 2.616 | ||||
| < límite | 188 (14,0) | 27 (6,28) | 24 (5,96) | 32 (7,32) | ||
| 0,76-2 | 476 (35,4) | 146 (34,0) | 105 (26,1) | 120 (27,5) | ||
| 2-5 | 557 (41,4) | 208 (48,4) | 204 (50,6) | 222 (50,8) | ||
| > 5 | 125 (9,29) | 49 (11,4) | 70 (17,4) | 63 (14,4) | ||
| Log leptina (ng/ml) | 1,49 ± 1,08 | 2,57 ± 1,05 | 2,46 ± 0,97 | 1,99 ± 1,16 | < 0,001 | 2.662 |
| Insulina (pg/ml) | < 0,001 | 2.607 | ||||
| < límite | 254 (18,8) | 14 (3,29) | 12 (2,96) | 25 (5,85) | ||
| 0,76-100 | 512 (38,0) | 83 (19,5) | 42 (10,3) | 82 (19,2) | ||
| 100-300 | 456 (33,8) | 200 (47,1) | 164 (40,4) | 167 (39,1) | ||
| > 300 | 127 (9,41) | 128 (30,1) | 188 (46,3) | 153 (35,8) | ||
| PAI-1 (ng/ml) | < 0,001 | 2.387 | ||||
| 0-35 | 179 (14,7) | 40 (10,2) | 28 (7,27) | 36 (9,23) | ||
| 35-55 | 325 (26,7) | 89 (22,6) | 89 (23,1) | 91 (23,3) | ||
| 55-260 | 435 (35,7) | 156 (39,7) | 143 (37,1) | 156 (40,0) | ||
| > límite | 280 (23,0) | 108 (27,5) | 125 (32,5) | 107 (27,4) | ||
| TNF-α (pg/ml) | 0,529 | 2.135 | ||||
| < límite | 384 (35,1) | 120 (34,4) | 120 (34,2) | 113 (33,1) | ||
| 1,84-3 | 266 (24,3) | 86 (24,6) | 84 (23,9) | 78 (22,9) | ||
| 3-10 | 362 (33,1) | 119 (34,1) | 120 (34,2) | 131 (38,4) | ||
| > 10 | 82 (7,50) | 24 (6,88) | 27 (7,69) | 19 (5,57) | ||
| MCP-1 | 284 ± 128 | 312 ± 140 | 318 ± 144 | 310 ± 146 | < 0,001 | 2.678 |
| TnI-as (ng/ml) | 0,059 | 2.271 | ||||
| < límite | 1.149 (96,9) | 371 (96,9) | 322 (96,4) | 348 (94,6) | ||
| Detectable | 37 (3,12) | 12 (3,13) | 12 (3,59) | 20 (5,43) | ||
| BNP (pg/ml) | 0,023 | 2.090 | ||||
| < límite | 664 (60,5) | 199 (57,2) | 161 (53,1) | 185 (54,3) | ||
| < 40 | 222 (20,2) | 83 (23,9) | 77 (25,4) | 80 (23,5) | ||
| > 40 | 212 (19,3) | 66 (19,0) | 65 (21,5) | 76 (22,3) |
ApoA1: apolipoproteína A1; ApoB100: apolipoproteína B100; BNP: péptido natriurético tipo B; IFN-γ: interferón gamma; IL: interleucina; MCP-1: proteína 1 quimiotáctica para monocitos; OLAB: anticuerpos contra lipoproteínas de baja densidad oxidadas; PAI-1: inhibidor del activador del plasminógeno-1 PCRas: proteína C reactiva de alta sensibilidad; TnI-as: troponina I de alta sensibilidad; TNF-α: factor de necrosis tumoral alfa.
Las cifras expresan n (%), media ± desviación estandar o mediana [intervalo intercuartílico].
En las tablas S2 y S3 del material suplementario se presentan los mismos resultados cuando se definió obesidad según el perímetro de la cintura. En general, los resultados fueron similares a los observados cuando el criterio de obesidad se basó en el IMC.
La correlación entre los diferentes biomarcadores analizados fue en general débil, con un coeficiente de correlación máximo de 0,453 (p > 0,001) entre insulina y leptina (tabla S4 del material suplementario).
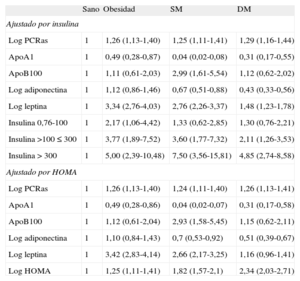
En la tabla 3 se presentan los resultados del análisis de regresión logística multinomial tomando como referencia el grupo de individuos sanos con normopeso. El individuo con normopeso se diferencia claramente de los tres fenotipos estudiados. La obesidad se caracteriza por una asociación positiva significativa con PCRas, leptina e insulina y una asociación negativa significativa con la apolipoproteína A1. El SM suma a ese mismo patrón la asociación positiva con la apolipoproteína B100 que la caracteriza —único fenotipo— y muestra una asociación negativa significativa con la adiponectina; mientras que la DM mantiene un perfil similar al del SM, aunque la fuerza de asociación con esos mismos marcadores es algo menor en todos ellos salvo la PCRas.
Odds ratio (intervalo de confianza del 95%) mediante regresión logística multinomial de cada biomarcador de pertenecer a una diferente entidad metabólicamente de interés definiendo obesidad a partir del índice de masa corporal ajustado por edad, sexo y demás biomarcadores
| Sano | Obesidad | SM | DM | |
| Ajustado por insulina | ||||
| Log PCRas | 1 | 1,26 (1,13-1,40) | 1,25 (1,11-1,41) | 1,29 (1,16-1,44) |
| ApoA1 | 1 | 0,49 (0,28-0,87) | 0,04 (0,02-0,08) | 0,31 (0,17-0,55) |
| ApoB100 | 1 | 1,11 (0,61-2,03) | 2,99 (1,61-5,54) | 1,12 (0,62-2,02) |
| Log adiponectina | 1 | 1,12 (0,86-1,46) | 0,67 (0,51-0,88) | 0,43 (0,33-0,56) |
| Log leptina | 1 | 3,34 (2,76-4,03) | 2,76 (2,26-3,37) | 1,48 (1,23-1,78) |
| Insulina 0,76-100 | 1 | 2,17 (1,06-4,42) | 1,33 (0,62-2,85) | 1,30 (0,76-2,21) |
| Insulina >100 ≤ 300 | 1 | 3,77 (1,89-7,52) | 3,60 (1,77-7,32) | 2,11 (1,26-3,53) |
| Insulina > 300 | 1 | 5,00 (2,39-10,48) | 7,50 (3,56-15,81) | 4,85 (2,74-8,58) |
| Ajustado por HOMA | ||||
| Log PCRas | 1 | 1,26 (1,13-1,40) | 1,24 (1,11-1,40) | 1,26 (1,13-1,41) |
| ApoA1 | 1 | 0,49 (0,28-0,86) | 0,04 (0,02-0,07) | 0,31 (0,17-0,58) |
| ApoB100 | 1 | 1,12 (0,61-2,04) | 2,93 (1,58-5,45) | 1,15 (0,62-2,11) |
| Log adiponectina | 1 | 1,10 (0,84-1,43) | 0,7 (0,53-0,92) | 0,51 (0,39-0,67) |
| Log leptina | 1 | 3,42 (2,83-4,14) | 2,66 (2,17-3,25) | 1,16 (0,96-1,41) |
| Log HOMA | 1 | 1,25 (1,11-1,41) | 1,82 (1,57-2,1) | 2,34 (2,03-2,71) |
ApoA1: apolipoproteína A1; ApoB100: apolipoproteína B100; DM: diabetes mellitus; HOMA: Homeostasis Model Assesment; PCRas: proteína C reactiva de alta sensibilidad; SM: síndrome metabólico.
Al ajustar el modelo por el HOMA en lugar de insulina, los resultados fueron similares salvo la asociación positiva de la leptina con la DM, que pierde su significación (tabla 3). El patrón de las asociaciones observadas fue también similar cuando la obesidad se definió según el perímetro de la cintura, salvo la leptina, que mantiene la asociación positiva significativa con la DM (tabla S5 del material suplementario). El estudio de las interacciones mostró una interacción significativa entre PCRas y sexo, de modo que las mujeres tienen mayor probabilidad de obesidad, SM o DM que los varones a igual incremento de la PCRas.
Al ser un estudio multicéntrico, también se ajustaron los modelos por el efecto de anidación (clustering) mediante modelos que incluían la variable «centro» como variable de efectos aleatorios y no se observaron diferencias estadísticamente significativas en las asociaciones descritas.
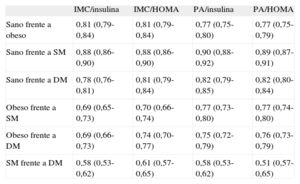
Finalmente, en la tabla 4 se muestra la capacidad de discriminación entre los grupos metabólicos de riesgo con los biomarcadores analizados mediante el cálculo del área bajo la curva de la función de las la tabla 3 y las tablas S5A y S5B del material suplementario. En general, los biomarcadores presentaron una aceptable discriminación entre los subgrupos y su referencia, excepto entre los grupos de SM y DM. También se analizó la calibración de los modelos (concordancia entre probabilidades estimadas por los modelos y las realmente observadas) mediante la prueba de Hosmer-Lemeshow, y en todos los modelos (excepto el que incluía índice HOMA y perímetro de y cintura para estimar la probabilidad de DM) se observó una correcta calibración.
| IMC/insulina | IMC/HOMA | PA/insulina | PA/HOMA | |
| Sano frente a obeso | 0,81 (0,79-0,84) | 0,81 (0,79-0,84) | 0,77 (0,75-0,80) | 0,77 (0,75-0,79) |
| Sano frente a SM | 0,88 (0,86-0,90) | 0,88 (0,86-0,90) | 0,90 (0,88-0,92) | 0,89 (0,87-0,91) |
| Sano frente a DM | 0,78 (0,76-0,81) | 0,81 (0,79-0,84) | 0,82 (0,79-0,85) | 0,82 (0,80-0,84) |
| Obeso frente a SM | 0,69 (0,65-0,73) | 0,70 (0,66-0,74) | 0,77 (0,73-0,80) | 0,77 (0,74-0,80) |
| Obeso frente a DM | 0,69 (0,66-0,73) | 0,74 (0,70-0,77) | 0,75 (0,72-0,79) | 0,76 (0,73-0,79) |
| SM frente a DM | 0,58 (0,53-0,62) | 0,61 (0,57-0,65) | 0,58 (0,53-0,62) | 0,51 (0,57-0,65) |
DM: diabetes mellitus; HOMA: Homeostasis Model Assesment; IMC: índice de masa corporal; PA: perímetro abdominal; SM: síndrome metabólico.
En este estudio, tras analizar un panel de 20 biomarcadores séricos del metabolismo de los hidratos de carbono, perfil lipídico, metabólico, inflamatorio, de coagulación, oxidación, hemodinámico y de lesión miocárdica, hemos identificado un grupo reducido de marcadores (PCRas, apolipoproteína A1, apolipoproteína B100, adiponectina, leptina y resistencia a insulina) que se asocian de manera independiente con diferentes fenotipos de riesgo metabólico como son la obesidad, el SM y la DM. Todos los biomarcadores analizados forman parte de alguno de los mecanismos presentes en las alteraciones metabólicas, inflamatorias y de coagulación que se activan (low grade inflammation) en los diferentes fenotipos estudiados.
Este hallazgo, aunque el diseño transversal del estudio no permita establecer causalidad, refuerza la idea del papel central que tienen la resistencia a la insulina, la inflamación y la alteración del perfil lipídico en el continuo de riesgo metabólico que va desde el individuo sano hasta el paciente con obesidad y DM.
En condiciones de sobrealimentación, se produce un remodelado (adipose tissue remodeling)22 que se caracteriza por hipertrofia de adipocitos, infiltrado de macrófagos y angiogénesis23,24. Este remodelado favorece la inflamación crónica25,26, lo cual puede contribuir al desarrollo y la progresión de la arteriosclerosis y cierto grado de resistencia a la acción de la insulina7,27. Esta asociación quizá no sea causal, como ocurre en el caso de la asociación entre PCR y enfermedad coronaria28, pero sí señala la relevancia de la inflamación en esta transición entre normopeso y DM. La hiperinsulinemia y la resistencia a la insulina (determinada por el índice HOMA) son comunes a los tres fenotipos.
Esta mayor resistencia a la insulina está relacionada con la hipoadiponectinemia e hiperleptinemia29,30. En nuestro estudio también observamos que la insulina y la leptina son los biomarcadores con mayor correlación entre sí, aunque fuera moderada. También es interesante que ambos se asociaran de manera independiente con los fenotipos metabólicos definidos, lo que indica que representan mecanismos independientes o complementarios.
La asociación positiva significativa de la PCRas con los fenotipos estudiados es clara, como también su fuerte interacción con la obesidad; se ha descrito la relación inversa de la PCR con la adiponectina31. La causalidad de este reactante de fase aguda en la enfermedad aterosclerótica permanece en discusión32. Chen et al33 registraron la presencia en sangre de varias proteínas en suero que interactuaban con la leptina, e informaban de que una de las más importantes era la PCR, por lo que propusieron que esta proteína podría generar resistencia a la leptina; sin embargo, no se ha podido replicar estos resultados y han sido refutados34.
La adiponectina se asocia inversamente con el SM y la DM. La adiponectina es una proteína que aumenta la sensibilidad a la insulina y previene la acumulación de ácidos grasos en el músculo esquelético y las vísceras35 aumentando su oxidación. También se han descrito sus efectos antiinflamatorios probablemente inhibiendo la expresión de moléculas de adhesión y sus posibles efectos antiateroscleróticos36. Además, diversos estudios han señalado que títulos bajos de adiponectina se asocian con el desarrollo de SM, DM y enfermedad cardiovascular37–41.
La hipoadiponectinemia que se observa en la mayoría de estos fenotipos refuerza también el estado inflamatorio y la resistencia a la insulina del paciente con SM o DM7.
Nuestro estudio muestra que esta asociación negativa todavía no es manifiesta cuando el individuo es obeso exclusivamente, lo que permite especular que las concentraciones normales de esta proteína podrían ser útiles en el futuro para identificar el fenotipo recientemente descrito como obeso sano42. También se observa que los grupos con mayor riesgo cardiovascular estimado con la función REGICOR presentaron títulos de adiponectina más bajos.
La leptina es una proteína producida por el tejido adiposo, con la particularidad de que la grasa de la mujer produce unas 3 veces más leptina que la del varón, y que tiene como función43 evitar el depósito de ácidos grasos en tejido no adiposo, restringir la ingesta alimentaria, estimular el crecimiento, la fertilidad y la inflamación. En nuestro estudio la leptina se asoció positiva y significativamente con los tres fenotipos, aunque esta asociación perdió significación en los pacientes diabéticos cuando la obesidad se consideró por el IMC y el modelo se ajustó por el índice HOMA. Esta última situación no se mantuvo en el contexto de la obesidad considerada por el aumento de perímetro abdominal.
La apolipoproteína A1 también se asoció inversamente con todas las entidades clínicas definidas, especialmente con el SM, probablemente como consecuencia de la definición de este síndrome, que incluye el colesterol unido a lipoproteínas de alta densidad bajo como criterio. Además la disminución de la apolipoproteína A1 también se asocia con obesidad y DM, lo cual podría atribuirse a una mayor resistencia a la insulina. En esta línea, algunos autores han propuesto el empleo del cociente triglicéridos/colesterol unido a lipoproteínas de alta densidad44,45.
En nuestro estudio, la apolipoproteína B100 se asocia únicamente con la presencia de SM, y aunque no es per se un criterio de SM, frecuentemente se asocia a sus alteraciones lipídicas. Esta asociación indica que cifras de colesterol unido a lipoproteínas de baja densidad elevadas asocian con SM, aun cuando se ha señalado que los pacientes con SM podrían tener cifras no muy elevadas, pero dichas partículas son pequeñas y densas, y en consecuencia más aterogénicas46. No encontramos asociación entre los diferentes fenotipos y los biomarcadores de oxidación lipídica, hemostásicos, hemodinámicos y de lesión miocárdica analizados. Aunque el inhibidor del activador del plasminógeno 1 se asoció con los fenotipos metabólicos en el análisis bivariable, la asociación perdió la significación estadística en el multivariable. Esta falta de asociación podría estar relacionada con el hecho de que la concentración de inhibidor del activador del plasminógeno 1 no se pudo determinar con precisión en el 23% de los participantes, por tener concentraciones por debajo del límite de detección del procedimiento de laboratorio empleado.
Finalmente, se debate acerca de cuál es el mejor criterio para definir la obesidad3–47: el IMC o el perímetro de la cintura. En nuestro estudio no encontramos diferencias al emplear como criterios de obesidad el IMC o el perímetro de la cintura en la asociación de los biomarcadores analizados, salvo la leptina, que perdió significación al ajustar el modelo por el índice HOMA en el contexto de la obesidad considerada por el IMC.
LimitacionesEste estudio tiene las limitaciones propias de los estudios transversales, que determinan asociaciones y no causalidad. Por otra parte, en algunos biomarcadores de los analizados, parte de los sujetos presentaron valores por debajo (o por encima) del límite de detección de la técnica utilizada. Las muestras se obtuvieron en los distintos centros participantes entre los años 2000 y 2009, con lo que existe un factor de variabilidad atribuida a los procedimientos preanalíticos aplicados en cada estudio y cada periodo de realización. De todas formas, se evaluaron las condiciones y los procedimientos de obtención y manejo de la muestra en los distintos centros, a fin de asegurar una adecuada comparación. Todas las determinaciones se realizaron de manera centralizada en un laboratorio para minimizar la variabilidad analítica.
Por último el punto, de corte utilizado en el IMC impide ser más preciso en el posible efecto del sobrepeso, que no se considera en nuestro estudio.
No obstante, el carácter poblacional y el gran tamaño de la muestra ofrecen una importante visión del perfil de biomarcadores y su relación con la epidemia que hoy son la obesidad y sus consecuencias.
CONCLUSIONESEl normopeso y algo menos la obesidad se diferencian del SM y la DM en su perfil metabólico, inflamatorio y lipídico analizado por biomarcadores, lo que indica la relevancia de estos mecanismos en el continuo del riesgo metabólico. Estas diferencias son menores entre el SM y la DM.
FINANCIACIÓNEste estudio se ha financiado enteramente mediante una ayuda no condicionada de AstraZeneca.
La obtención de los datos originales de los estudios componentes fue financiada por: FEDER (Fondo Europeo de Desarrollo Regional)-Ministerio de Ciencia e Innovación, Instituto de Salud Carlos III (red HERACLES RD06/0009; fondos para investigación. Acuerdo del Consejo Interterritorial de 8 de abril de 2003; EMER07/046 RCESP C3/09); Fondo de Investigación Sanitaria (FIS-FEDER) (PI01/0711, PI02/1158, PI02/1179, PI02/1717, PI03/20471, PI05/2364, PI05/2751, PI07/040, PI07/0934, PI07/1213, G03-045, FIS-ETES 2007, CP06/00100, CM08/00141); Ministerio de Sanidad y Consumo, Plan Nacional I+D+i 2004-2007 (IP071218); Agència d’Avaluació de Tecnologia i Recerca Mèdica (034/33/02); Agència de Gestió d’Ajuts Universitaris i de Recerca (2005SGR00577); Departament de Salut de la Generalitat de Catalunya; Fundación Canaria de Investigación y Salud (45/98); Departamento de Salud del Gobierno de Navarra; Junta de Castilla y León; Beca Intensificación de la investigación (INT 07/289); Subdirección General de Promoción de la salud y Prevención. Consejería de Sanidad de la Comunidad de Madrid; Govern Balear; Servicio Andaluz de Salud; Programa de Iniciativa Comunitaria INTERREG IIIA (SP5.E51); Consejería de Salud de la Junta de Andalucía, Ayuda a Proyectos de Investigación (290/04 y 036/06); Sociedad Andaluza de Medicina Familiar y Comunitaria (SAMFYC 2008); Sociedad Española de Medicina de Familia y Comunitaria (semFYC 2009); Consejería de Sanidad y Consumo de la Región de Murcia; Consejería de Salud y Bienestar Social, Junta de Comunidades de Castilla-La Mancha.
CIBEROBEN y CIBERESP son una iniciativa del Instituto de Salud Carlos III.
CONFLICTO DE INTERESESNinguno.
A Juan Carlos Palma, Manuel Leal, María J. Zaro y Yolanda Morcillo, por su apoyo en la gestión del proyecto.
Se puede consultar material suplementario a este artículo en su versión electrónica disponible en doi:10.1016/j.recesp.2013.10.021.