Conocer cuál es el grado de control de los pacientes anticoagulados en seguimiento por atención primaria en Galicia y si la determinación por número de controles es comparable al Rosendaal para estimar el tiempo en rango terapéutico.
MétodosEstudio transversal que incluyó a pacientes > 65 años, diagnosticados de fibrilación auricular no valvular, anticoagulados durante al menos 1 año. Se consideró buen control cuando el tiempo en rango terapéutico era > 65% calculado por Rosendaal o 60% estimado por el número de controles.
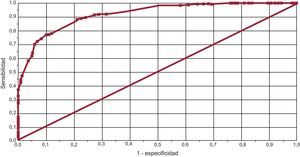
ResultadosSe incluyó a 511 pacientes (el 53,0% mujeres; media de edad, 77,8±0,6 años). El 41,5% de los pacientes tenían en rango terapéutico menos del 60% de los controles realizados y el 42,7% mostró un tiempo en rango terapéutico calculado por la fórmula de Rosendaal < 65%. En el grupo de pacientes con mal control, se observó mayor número de fármacos (6,8±0,4 frente a 5,7±0,3; p<0,0001), mayor prevalencia de enfermedad renal (el 24,3 frente al 17,0%; p=0,05) y mayor puntuación en la escala HAS-BLED (3,8±0,1 frente a 2,5±0,1; p<0,0001). El punto de corte del 60% para el número de controles mostró sensibilidad y especificidad del 79,4 y el 86,7%, respectivamente, con un área bajo la curva de 0,92 (intervalo de confianza del 95%, 0,87-0,97).
ConclusionesMás del 40% de los pacientes anticoagulados no alcanzan el mínimo tiempo en rango terapéutico para beneficiarse de este tratamiento. Las variables que influyen en el peor control son la enfermedad renal y el alto riesgo de hemorragia cerebral. Ambos métodos de estimación son comparables.
Palabras clave
Entre las enfermedades crónicas, la fibrilación auricular (FA) es uno de los problemas de salud más importantes en el mundo por sus elevadas prevalencia (el 8,5% en > 65 años)1, morbilidad y mortalidad2 y porque es una causa importante de ingresos hospitalarios3 y la principal indicación de anticoagulación en atención primaria4. Además, no se debe olvidar que la tendencia de la población es a envejecer más, por lo que la importancia de la FA irá en aumento5, más aún si se confirman los resultados de algunos estudios que indican que alrededor del 20% de los pacientes > 60 años presentan FA y no están diagnosticados6.
El riesgo de enfermedad cerebrovascular asociado a FA, principal causa de la mortalidad y la morbilidad que conlleva7, es variable en función de la coexistencia de otros factores de riesgo. En la práctica clínica se puede estimar este riesgo empleando escalas como CHADS2 (insuficiencia cardiaca congestiva, hipertensión, edad, diabetes, ictus [doble])8 o CHA2DS2-VASc (insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75 [doble], diabetes, ictus [doble], enfermedad vascular y categoría de sexo [mujeres])9, de tal forma que puntuaciones ≥ 2 en un paciente con FA hacen necesaria la anticoagulación10. Se ha demostrado que la anticoagulación con fármacos antagonistas de la vitamina K (AVK) reduce la incidencia de eventos tromboembólicos en un 64% y la mortalidad en un 26%11. Sin embargo, la anticoagulación con AVK tiene importantes limitaciones; la más importante es la variabilidad de la respuesta clínica, ya que la razón internacional normalizada (INR) debe mantenerse entre 2 y 3 para asegurar el efecto anticoagulante de estos fármacos12, y múltiples factores ambientales (dieta, fármacos, etc.) y genéticos influyen en el efecto terapéutico y con frecuencia hacen que la INR se encuentre fuera del rango establecido13, lo que expone a los pacientes a eventos trombóticos y hemorrágicos14.
La comercialización en los últimos años de nuevos fármacos anticoagulantes —con menos interacciones farmacológicas y ambientales, rango terapéutico más amplio, demostradas eficacia y seguridad al menos similares a las de los AVK y que son coste-eficaces en los pacientes con insuficiente control de INR15— ha hecho que las autoridades sanitarias los recomienden para este grupo de pacientes16.
Se desconoce cuál es el grado de control de los pacientes anticoagulados entre la población adscrita al Sistema Nacional de Salud en el territorio gallego, motivo por el cual se planteó el presente estudio para conocer el grado de control de los pacientes cuya INR se sigue en los centros de salud de la comunidad autónoma de Galicia. Como objetivos secundarios, se planteó analizar las variables que pueden influir en ese grado de control y conocer si la determinación por número de controles es comparable al Rosendaal para estimar el tiempo en rango terapéutico (TRT).
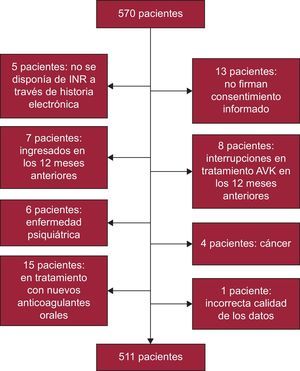
MÉTODOSPacientesSe diseñó un estudio transversal a partir de una muestra estratificada por comarcas, sexo y grupos de edad, según los datos aportados por el Instituto Galego de Estatística17. El tamaño muestral calculado fue de 327 pacientes, atendiendo a una población de 632.379 habitantes mayores de 65 años, una prevalencia de FA no valvular del 8,5%, nivel de confianza del 95%, precisión del 3% y un 15% de posibles pérdidas. Para garantizar la representatividad de las localidades con pocos habitantes (que en Galicia representan más del 50% de la población mayor de 65), se hizo una asignación previa de pacientes a estas localidades y a continuación se obtuvo la proporción de pacientes en las muestras en poblaciones mayores; se obtuvo un tamaño muestral de 570 pacientes. Tras la pérdida de 59 (figura 1), se obtuvo la muestra final de 511 pacientes. Esta muestra se reparte de la siguiente manera: el 59,3% en poblaciones rurales (< 5.000 habitantes), el 21,9% en poblaciones semiurbanas (5.000-20.000 habitantes) y el 18,8% en poblaciones urbanas (> 20.000 habitantes).
Se seleccionó a pacientes > 65 años diagnosticados de FA no valvular y con tratamiento anticoagulante con AVK desde al menos 12 meses antes de la inclusión en el estudio. Se excluyó a los pacientes que en esos 12 meses hubieran tenido cualquier tipo de interrupción del tratamiento anticoagulante o hubieran tenido algún ingreso hospitalario (excluidas las estancias en urgencias); también se excluyó a los que presentaran alguna enfermedad psiquiátrica grave (esquizofrenia o trastorno bipolar) o cáncer. El protocolo del estudio fue aprobado por el Comité Ético de Investigación Clínica de Galicia.
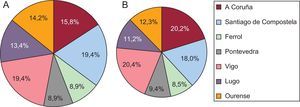
La selección de los investigadores colaboradores se hizo en función de su concello/ayuntamiento de trabajo, atendiendo al reparto territorial de la muestra prediseñada. Solo tres investigadores rechazaron la invitación a participar, por lo que se los sustituyó por otros tres compañeros del mismo ayuntamiento. La selección de la submuestra por el investigador colaborador se hizo consecutivamente a partir de los pacientes que acudieron a consulta de forma ordinaria por cualquier motivo diferente del control y la dosificación de AVK, siempre que cumplieran los criterios de inclusión y ninguno de exclusión, hasta completar la submuestra preasignada, entre el 1 y el 31 de octubre de 2013. En la figura 2 se puede observar la distribución de los pacientes de la muestra por áreas sanitarias y los investigadores que participaron en el estudio.
Registro de variablesSe registraron datos demográficos (edad, sexo, ayuntamiento y comarca), antecedentes personales (hipertensión arterial, diabetes mellitus, dislipemia, alcoholismo, tabaquismo, cardiopatía isquémica, insuficiencia cardiaca, enfermedad cerebrovascular, insuficiencia renal, arteriopatía periférica y embolia sistémica; además, de cada evento se registra la fecha), datos clínicos actuales (peso, talla y perímetro de cintura, los controles de INR del último año y sus fechas, cifras de presión arterial sistólica y diastólica, glucemia, glucohemoglobina, creatinina, urea y tasa de filtrado glomerular, transaminasa glutámico oxalacética, transaminasa glutámico pirúvica, gamma-glutamiltransferasa, fosfatasa alcalina, bilirrubina, colesterol total, colesterol unido a lipoproteínas de baja densidad, colesterol unido a lipoproteínas de alta densidad, triglicéridos, consumo de antiinflamatorios no esteroideos o antiagregantes plaquetarios y número de tratamientos farmacológicos habituales) y tipo de anticoagulante AVK empleado (acenocumarol o warfarina). Disponer de estas variables permitió el cálculo de las escalas CHADS2, CHA2DS2-VASc y HAS-BLED (hipertensión, función renal/hepática anormal, ictus, antecedentes de hemorragia o predisposición a ella, labilidad de la razón internacional normalizada, edad > 65 años y toma concomitante de fármacos o alcohol), cuyos puntos de corte son ≥ 2 las dos primeras y ≥ 3 la última.
Se clasificó como obesos a los pacientes con índice de masa corporal (IMC) ≥ 30 y en obesidad abdominal cuando el perímetro abdominal era > 102 cm (varones) o > 88 cm (mujeres)18. Se definió al paciente como hipertenso, diabético o dislipémico cuando estaba diagnosticado como tal en la historia clínica electrónica, cumplía criterios diagnósticos o estaba tomando medicación antihipertensiva18–20. Se definió como fumador a quien en el mes previo a la inclusión en el protocolo consumía tabaco (cigarros, puros y pipa; al menos una unidad en el mes). Se consideró ex fumador al paciente que no había fumado en el último año21. Se detectó el consumo elevado de alcohol por medio de la entrevista clínica; se lo sospechó cuando la ingesta por día era > 4 unidades (40g) para los varones y > 3 (30 g) para las mujeres22. Se registró el antecedente de enfermedad cardiovascular (cardiopatía isquémica, insuficiencia cardiaca, enfermedad cerebrovascular o arteriopatía periférica) cuando tenían registrado en la historia clínica electrónica el antecedente de ingreso o asistencia en urgencias por alguno de los procesos19. Finalmente, se definió la enfermedad renal oculta por tasa de filtrado glomerular estimada por Modification of Diet in Renal Disease (MDRD)<60ml/min/1,73 m2 y creatinina sérica normal (< 1,2mg/dl las mujeres o > 1,3mg/dl los varones); se definió enfermedad renal crónica como tasa de filtrado glomerular estimada por MDRD<60ml/min/1,73 m2 y creatinina sérica elevada (> 1,2mg/dl las mujeres o > 1,3mg/dl los varones)19,23.
Análisis de datosPara el procesamiento y el análisis de los datos, se utilizó el paquete estadístico G-STAT 2.0 para Windows. Para el cálculo del tamaño muestral, se empleó el programa EPIDAT 3.1 para Windows.
Se calculó el TRT tanto por método de Rosendaal24 como por el porcentaje de controles fuera de rango, ambos métodos reconocidos como válidos en las recomendaciones del Ministerio de Sanidad para estimar el grado de control de los pacientes anticoagulados con AVK16, aunque para los análisis bivariable y multivariable se empleó el grado de control calculado por Rosendaal. Este método utiliza una interpolación lineal para asignar el valor de INR a cada día entre dos valores observados de INR. No se interpolan los periodos de más de 56 días. Tras la interpolación, se calcula el porcentaje de tiempo con INR 2-324.
En el análisis estadístico de las variables, se utilizan distintos parámetros descriptivos: media±desviación estándar, mediana [intervalo intercuartílico] y cálculo de proporciones. En el análisis bivariable, se emplearon las pruebas de la χ2, de la t de Student y análisis de la varianza o sus homólogos tests no paramétricos para datos de distribución no normal (U de Mann-Whitney o Kruskall-Wallis). La normalidad de las variables numéricas se analizó mediante las pruebas de Kolmogorov-Smirnov y de la homocedasticidad.
Para determinar las variables asociadas con mal control, se empleó el método de regresión logística. Las variables candidatas son las que mostraron significación estadística en el análisis bivariable o que en otros estudios publicados presentaron asociación con el grado de control del INR: sexo, edad, IMC, hipertensión arterial, diabetes mellitus tipo 2, insuficiencia renal (estimada por MDRD), número de fármacos, CHADS2, CHA2DS2-VASc, HAS-BLED, y personal encargado de validar la INR.
Además, se calculó una curva ROC (receiver operating characteristic) para identificar el mejor punto de corte en la determinación del número de controles frente al Rosendaal en la estimación del mal control. Se consideró válida la curva con un área bajo la curva > 0,90.
Todos los resultados se presentan con la media y el intervalo de confianza del 95% (IC95%) y se exponen con un decimal, aunque durante el cálculo no se redondea en ningún caso. Se consideró estadísticamente significativo un valor de p<0,05.
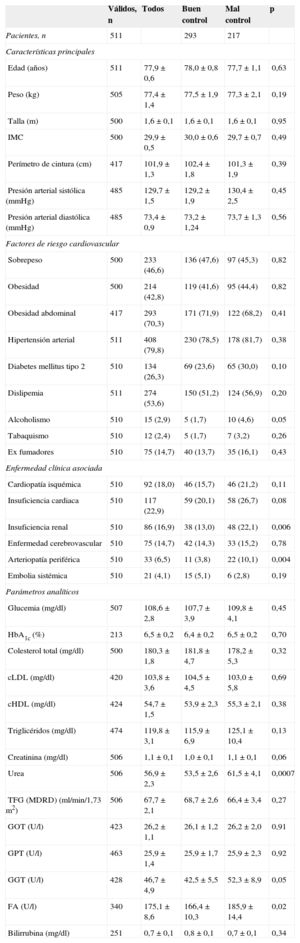
RESULTADOSDescripción de la muestraLos 134 investigadores aportaron datos de 511 pacientes, de los que 271 (53,0%) eran mujeres (media de edad, 77,8±0,6 años). En la tabla 1 se expresan las características clinicoepidemiológicas de los pacientes de la muestra. Los factores de riesgo más prevalentes fueron hipertensión arterial (79,8%), con una prevalencia de mal control del 25,4%; obesidad abdominal (70,3%); dislipemia (53,6%), con una prevalencia de mal control del 20,7%, y diabetes mellitus (26,3%), con una prevalencia de mal control del 11,0%. Los antecedentes cardiovasculares más frecuentes fueron insuficiencia cardiaca (22,9%), cardiopatía isquémica (18,0%) e insuficiencia renal (16,9%). Respecto a esta, la determinación analítica de la tasa de filtrado glomerular estimada por MDRD mostró prevalencias de insuficiencia renal del 20,6% y de enfermedad renal subclínica del 19,2%. Entre las diferentes áreas sanitarias no se observaron diferencias estadísticamente significativas en las variables clínicas y epidemiológicas mostradas en la tabla 1.
Características clínicas de los pacientes incluidos en la muestra y en función del grado de control de la razón internacional normalizada
| Válidos, n | Todos | Buen control | Mal control | p | |
|---|---|---|---|---|---|
| Pacientes, n | 511 | 293 | 217 | ||
| Características principales | |||||
| Edad (años) | 511 | 77,9±0,6 | 78,0±0,8 | 77,7±1,1 | 0,63 |
| Peso (kg) | 505 | 77,4±1,4 | 77,5±1,9 | 77,3±2,1 | 0,19 |
| Talla (m) | 500 | 1,6±0,1 | 1,6±0,1 | 1,6±0,1 | 0,95 |
| IMC | 500 | 29,9±0,5 | 30,0±0,6 | 29,7±0,7 | 0,49 |
| Perímetro de cintura (cm) | 417 | 101,9±1,3 | 102,4±1,8 | 101,3±1,9 | 0,39 |
| Presión arterial sistólica (mmHg) | 485 | 129,7±1,5 | 129,2±1,9 | 130,4±2,5 | 0,45 |
| Presión arterial diastólica (mmHg) | 485 | 73,4±0,9 | 73,2±1,24 | 73,7±1,3 | 0,56 |
| Factores de riesgo cardiovascular | |||||
| Sobrepeso | 500 | 233 (46,6) | 136 (47,6) | 97 (45,3) | 0,82 |
| Obesidad | 500 | 214 (42,8) | 119 (41,6) | 95 (44,4) | 0,82 |
| Obesidad abdominal | 417 | 293 (70,3) | 171 (71,9) | 122 (68,2) | 0,41 |
| Hipertensión arterial | 511 | 408 (79,8) | 230 (78,5) | 178 (81,7) | 0,38 |
| Diabetes mellitus tipo 2 | 510 | 134 (26,3) | 69 (23,6) | 65 (30,0) | 0,10 |
| Dislipemia | 511 | 274 (53,6) | 150 (51,2) | 124 (56,9) | 0,20 |
| Alcoholismo | 510 | 15 (2,9) | 5 (1,7) | 10 (4,6) | 0,05 |
| Tabaquismo | 510 | 12 (2,4) | 5 (1,7) | 7 (3,2) | 0,26 |
| Ex fumadores | 510 | 75 (14,7) | 40 (13,7) | 35 (16,1) | 0,43 |
| Enfermedad clínica asociada | |||||
| Cardiopatía isquémica | 510 | 92 (18,0) | 46 (15,7) | 46 (21,2) | 0,11 |
| Insuficiencia cardiaca | 510 | 117 (22,9) | 59 (20,1) | 58 (26,7) | 0,08 |
| Insuficiencia renal | 510 | 86 (16,9) | 38 (13,0) | 48 (22,1) | 0,006 |
| Enfermedad cerebrovascular | 510 | 75 (14,7) | 42 (14,3) | 33 (15,2) | 0,78 |
| Arteriopatía periférica | 510 | 33 (6,5) | 11 (3,8) | 22 (10,1) | 0,004 |
| Embolia sistémica | 510 | 21 (4,1) | 15 (5,1) | 6 (2,8) | 0,19 |
| Parámetros analíticos | |||||
| Glucemia (mg/dl) | 507 | 108,6±2,8 | 107,7±3,9 | 109,8±4,1 | 0,45 |
| HbA1c (%) | 213 | 6,5±0,2 | 6,4±0,2 | 6,5±0,2 | 0,70 |
| Colesterol total (mg/dl) | 500 | 180,3±1,8 | 181,8±4,7 | 178,2±5,3 | 0,32 |
| cLDL (mg/dl) | 420 | 103,8±3,6 | 104,5±4,5 | 103,0±5,8 | 0,69 |
| cHDL (mg/dl) | 424 | 54,7±1,5 | 53,9±2,3 | 55,3±2,1 | 0,38 |
| Triglicéridos (mg/dl) | 474 | 119,8±3,1 | 115,9±6,9 | 125,1±10,4 | 0,13 |
| Creatinina (mg/dl) | 506 | 1,1±0,1 | 1,0±0,1 | 1,1±0,1 | 0,06 |
| Urea | 506 | 56,9±2,3 | 53,5±2,6 | 61,5±4,1 | 0,0007 |
| TFG (MDRD) (ml/min/1,73 m2) | 506 | 67,7±2,1 | 68,7±2,6 | 66,4±3,4 | 0,27 |
| GOT (U/l) | 423 | 26,2±1,1 | 26,1±1,2 | 26,2±2,0 | 0,91 |
| GPT (U/l) | 463 | 25,9±1,4 | 25,9±1,7 | 25,9±2,3 | 0,92 |
| GGT (U/l) | 428 | 46,7±4,9 | 42,5±5,5 | 52,3±8,9 | 0,05 |
| FA (U/l) | 340 | 175,1±8,6 | 166,4±10,3 | 185,9±14,4 | 0,02 |
| Bilirrubina (mg/dl) | 251 | 0,7±0,1 | 0,8±0,1 | 0,7±0,1 | 0,34 |
cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; FA: fosfatasa alcalina; GOT: transaminasa glutámico oxalacética; GPT: transaminasa glutámico pirúvica; GGT: gamma-glutamiltransferasa; HbA1c: glucohemoglobina; IMC: índice de masa corporal; MDRD: Modification of Diet in Renal Disease; TFG: tasa de filtrado glomerular.
Salvo otra indicación, los valores expresan n (%), media±desviación estándar.
El tiempo medio de registro de los valores de INR fue 10,6±0,4 meses, con una media de 13,7±0,2 determinaciones por paciente. El AVK más prescrito fue el acenocumarol (98,2%) frente a la warfarina (1,8%). El 89,6% de los investigadores tenían en sus cupos a otros pacientes anticoagulados con nuevos anticoagulantes orales. Los profesionales que con más frecuencia se encargan de validar la pauta de AVK son el hematólogo (el 46,4% de los casos) y los profesionales de atención primaria (el 35,4% de los casos). En el 18,2% de los casos, la validación es compartida por ambos niveles asistenciales.
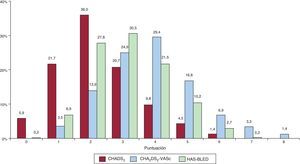
Atendiendo a las escalas de riesgo trombótico y hemorrágico (figura 3), el valor medio de CHADS2 fue 2,3±0,1; el de CHA2DS2-VASc, 3,8±0,1, y el de HAS-BLED, 3,1±0,1. Se clasificó en alto riesgo por la escala CHADS2 al 72,4% de los pacientes; por CHA2DS2-VASc, al 96,5% y por HAS-BLED, al 65,2%.
Distribución de los pacientes (porcentaje) por la puntuación en cada escala de riesgo. CHADS2: insuficiencia cardiaca congestiva, hipertensión, edad, diabetes, ictus (doble); CHA2DS2-VASc: insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75 (doble), diabetes, ictus (doble), enfermedad vascular y categoría de sexo (mujeres); HAS-BLED: hipertensión, función renal/hepática anormal, ictus, antecedentes de hemorragia o predisposición a ella, labilidad de la razón internacional normalizada, edad > 65 años y toma concomitante de fármacos o alcohol.
El 41,5% de los pacientes tenía en rango terapéutico menos del 60% de los controles realizados y el 42,7% mostró un TRT<65%, calculado por la fórmula de Rosendaal. En la tabla 1 se muestran las características clinicoepidemiológicas en función del grado de control, sin que se observen diferencias estadísticamente significativas en la mayoría de ellas, salvo la mayor prevalencia de insuficiencia renal y arteriopatía periférica; además, se observó mayor número de fármacos (6,8±0,4 frente a 5,7±0,3; p<0,0001) en el grupo de pacientes con mal control. En el caso de la enfermedad renal estimada por MDRD, se observó que el grado de control era inferior en pacientes con enfermedad renal crónica que en los pacientes con función renal normal (el 48,1 frente al 60,9%; p=0,05).
El análisis de las escalas de riesgo trombótico no mostró diferencias estadísticamente significativas entre ambos grupos, tanto con CHADS2 (2,2±0,1 frente a 2,3±0,1) como con CHA2DS2-VASc (3,8±0,1 frente a 3,9±0,1). Por el contrario, los pacientes con mal control de INR tenían mayor puntuación en la escala de riesgo hemorrágico HAS-BLED (3,8±0,1 frente a 2,5±0,1; p<0,0001).
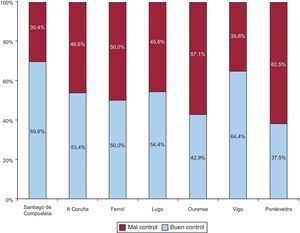
Finalmente, se encontraron diferencias estadísticamente significativas (p=0,0008) entre los pacientes mal controlados según el área sanitaria a la que pertenecieran (figura 4). El análisis de las diferentes variables entre áreas sanitarias que pudieran asociarse a peor control en cada área mostró mayor prevalencia de enfermedad renal en el área de A Coruña (62,1%; p<0,0001), mayor número de fármacos en el área de Lugo (7,3±0,8; p=0,0036) y menor uso de nuevos anticoagulantes orales en el área de Pontevedra (83,3%; p=0,0015). No se observaron diferencias en la puntuación de las escalas de riesgo trombótico y hemorrágico entre áreas sanitarias.
Métodos de determinación del grado de controlSe evaluó el grado de coincidencia entre ambos métodos de medición. En 254 (49,7%) pacientes, coincidieron en el buen control; en 173 (33,8%), en el mal control, y en 84 (16,4%) hubo discrepancias entre los métodos de medición. Usando el método de Rosendaal como patrón de referencia y el 65% como punto de corte, la sensibilidad y la especificidad comparables del método alternativo (contar el número de controles) son del 79,4 y el 86,7% respectivamente, con un área bajo la curva de 0,92 (IC95%, 0,87-0,97) para el punto de corte del 60% (figura 5).
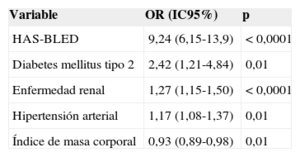
Variables asociadas al mal control de la razón internacional normalizadaEn el análisis multivariable (tabla 2), se observó que, respecto a los que no presentan estas enfermedades, la probabilidad de mal control de los pacientes con valores altos de HAS-BLED se eleva el riesgo 9,24 veces; para los diabéticos, 2,42 veces; para los pacientes con enfermedad renal, 1,27 veces, y para los hipertensos, 1,17 veces.
Variables asociadas a tiempo en rango terapéutico insuficiente
| Variable | OR (IC95%) | p |
|---|---|---|
| HAS-BLED | 9,24 (6,15-13,9) | < 0,0001 |
| Diabetes mellitus tipo 2 | 2,42 (1,21-4,84) | 0,01 |
| Enfermedad renal | 1,27 (1,15-1,50) | < 0,0001 |
| Hipertensión arterial | 1,17 (1,08-1,37) | 0,01 |
| Índice de masa corporal | 0,93 (0,89-0,98) | 0,01 |
HAS-BLED: hipertensión, función renal/hepática anormal, ictus, antecedentes de hemorragia o predisposición a ella, labilidad de la razón internacional normalizada, edad > 65 años y toma concomitante de fármacos o alcohol); IC95%: intervalo de confianza del 95%; OR: odds ratio.
Los resultados del estudio ANFAGAL (ANticoagulación en pacientes con Fibrilación Auricular en el ámbito de atención primaria de GALicia), realizado en una amplia muestra de pacientes anticoagulados representativa de la población gallega atendida en atención primaria, muestra que el 42,7% de los pacientes que reciben AVK no se encuentran en rango terapéutico el tiempo suficiente para beneficiarse del tratamiento anticoagulante.
El estudio incluye una muestra de pacientes representativa por sus características demográficas y clínicas de los pacientes gallegos anticoagulados por FA, que en su totalidad acuden a los centros de salud de atención primaria para control y seguimiento de su tratamiento con AVK. Si se comparan las características clínicas de los pacientes incluidos en ANFAGAL, son similares a las de otros estudios realizados con pacientes con FA en España25.
El TRT calculado mediante la fórmula de Rosendaal refleja la calidad de la anticoagulación de los pacientes en tratamiento con AVK26, que es correcto si > 65%27. Por ello durante el estudio se ha empleado este método para evaluar el grado de control en los pacientes de la muestra e identificar las variables que pueden influir en ese grado de control. El grado de control obtenido coincide con lo publicado por estudios de mayor tamaño con muestras de práctica clínica, que oscilan entre el 45%28 y el 75,8%29. Si se compara con estudios españoles, como FIATE25, se obtiene un grado de control inferior, aunque planteó un objetivo diferente (estudiar la adecuación del tratamiento de pacientes con FA), por lo que evaluó el grado de control en función de las últimas tres determinaciones de INR, sin olvidar que la prevalencia y el CHADS2 —variables relacionadas con el TRT— de su muestra eran inferiores a los obtenidos en este estudio.
Registros como VARIA30 o ATRIA31 han estudiado las variables que influyen en el grado de control de la INR. El estudio VARIA mostró que algunas enfermedades graves que acortan la expectativa de vida, como el cáncer o la demencia, o los ingresos hospitalarios influyen en el peor grado de control30. A los pacientes con algunas de estas variables se los excluyó del estudio, ya que tienen una influencia en el grado de control ajena al papel de atención primaria. Sin embargo, otras variables identificadas en esa cohorte de más de 120.000 pacientes, como el consumo excesivo de alcohol o el número de fármacos, coinciden con los resultados del presente estudio.
Respecto al estudio ATRIA, se analizó en profundidad la influencia de otras variables cardiovasculares en el pronóstico de los pacientes con FA y su influencia en el grado de control. De este modo, se encontró que las variables que definen las escalas CHADS28 y CHA2DS2-VASc9 influyen en el mal control y, del mismo modo que en este estudio, la insuficiencia renal tiene un papel relevante, sin obviar su importancia en el pronóstico cardiovascular de los pacientes con FA.
No se ha encontrado ningún estudio que analice la influencia de una escala de riesgo hemorrágico en el grado de control de la INR. En este caso, se empleó la escala HAS-BLED32 para esta estimación, y se observó que los pacientes con mayor riesgo de hemorragia también tienen peor control. Esta condición tiene una traducción casi inmediata en la práctica clínica, ya que es el grupo de pacientes que más se podría beneficiar del empleo de los nuevos anticoagulantes orales, porque los tres comercializados han mostrado un riesgo inferior que con los AVK en hemorragia intracraneal33.
En cuanto a las variables asociadas al mal control de la INR, el análisis multivariable confirmó la influencia de las puntuaciones altas en la escala HAS-BLED, la enfermedad renal y otros dos factores de riesgo cardiovascular como la diabetes mellitus y la hipertensión arterial.
Finalmente, desde un punto de vista práctico, en este entorno, parece interesante conocer la concordancia entre los dos métodos para estimar el TRT. Por un lado está la fórmula de Rosendaal, que identifica el tiempo que el paciente se encuentra en rango terapéutico y es el método más ortodoxo y el preferido, como ya se ha comentado. Por otro lado, la identificación del número de controles fuera de rango, mucho más práctico en la práctica clínica e igualmente aceptado por las autoridades sanitarias para estimar el TRT16. El análisis realizado mostró que ambos métodos coinciden en el 83,5% de los pacientes de la muestra, pero especialmente interesantes son los resultados de la curva ROC, que mostró que el punto de corte del 60% del número de controles es equivalente al 65% de Rosendaal.
LimitacionesLas limitaciones de este trabajo son las propias de cualquier estudio observacional, ya que algunas variables de exploración física y del análisis de sangre y orina se obtuvieron de la historia clínica, además de que no se valoró el grado de incumplimiento terapéutico como causa de mal control. Pero lo que se pretendía con el estudio ANFAGAL era conocer el grado de control de la INR en la práctica clínica habitual, por lo que se considera que la muestra empleada (por tamaño, representatividad y selección) y la metodología de análisis llevada a cabo proporcionan fortaleza suficiente al estudio y que los resultados pueden considerarse razonablemente representativos de los pacientes anticoagulados en seguimiento por la atención primaria gallega.
CONCLUSIONESEn el estudio ANFAGAL se observó que más del 40% de los pacientes anticoagulados no alcanzan el nivel mínimo de calidad en la anticoagulación. Además, los pacientes con enfermedad renal y alto riesgo de hemorragia cerebral presentan peor grado de control. Finalmente, el método de evaluación del TRT por recuento de controles en rango parece igualmente eficaz que el método de Rosendaal, más tedioso y la mayoría de las veces subordinado a disponer de soporte informático.
CONFLICTO DE INTERESESS. Cinza-Sanjurjo ha recibido honorarios como asesor de Almirall y Pfizer. También ha recibido honorarios por ponencias de Almirall, Bayer, Boehringer Ingelheim y Pfizer.
Agradecemos la colaboración prestada en el desarrollo del estudio ANFAGAL a todos los investigadores colaboradores, por proporcionar los datos necesarios, así como a Bayer S.A. y Almirall S.A., por facilitarnos la infraestructura necesaria. A los facultativos del Complejo Hospitalario Universitario de Santiago de Compostela, por el apoyo y los consejos que nos han ofrecido y sirvieron para mejorar el proyecto ANFAGAL: Miguel Blanco González, Jefe de Unidad de Ictus; José Castillo Sánchez, Jefe del Servicio de Neurología; Alfonso Varela Román y Pilar Mazón Ramos, facultativos especialistas adjuntos del Servicio de Cardiología, y José Ramón González-Juanatey, Jefe de Servicio de Cardiología.
Se puede consultar material suplementario a este artículo (listado de colaboradores y becas recibidas) en su versión electrónica disponible en doi:10.1016/j.recesp.2014.04.020.
En el material suplementario se relacionan los miembros del grupo de investigadores del estudio ANFAGAL.