Analizar la prevalencia en España de mal control de la anticoagulación con antagonistas de la vitamina K en pacientes con fibrilación auricular no valvular y sus factores asociados.
MétodosSe ha estudiado a 1.056 pacientes consecutivos vistos en 120 consultas de cardiología en España entre noviembre de 2013 y marzo de 2014. Se analizó la razón internacional normalizada de los 6 meses previos a la inclusión, calculando la prevalencia de mal control de la anticoagulación, definida como un tiempo en rango terapéutico < 65% según el método de Rosendaal.
ResultadosLa media de edad fue de 73,6 ± 9,8 años; las mujeres fueron el 42%. La prevalencia de mal control de la anticoagulación fue del 47,3%. El tiempo medio en rango terapéutico fue de 63,8 ± 25,9%. Se asociaron independientemente con mal control de la anticoagulación: la insuficiencia renal (odds ratio=1,53; intervalo de confianza del 95%, 1,08-2,18; p=0,018), la toma habitual de antiinflamatorios no esteroideos (odds ratio=1,79; intervalo de confianza del 95%, 1,20-2,79; p=0,004), el tratamiento con antiagregantes (odds ratio=2,16; intervalo de confianza del 95%, 1,49-3,12; p < 0,0001) y no recibir antagonistas del receptor de la angiotensina II (odds ratio=1,39; intervalo de confianza del 95%, 1,08-1,79; p=0,011).
ConclusionesLa prevalencia de mal control de la anticoagulación con antagonistas de la vitamina K es alta en España. Los factores asociados al mal control son la insuficiencia renal, la ingesta habitual de antiinflamatorios no esteroideos, el uso de antiagregantes y no recibir antagonistas del receptor de la angiotensina II.
Palabras clave
La fibrilación auricular no valvular (FANV) es una afección de prevalencia e incidencia crecientes en los países de nuestro entorno, sobre todo por el mejor tratamiento de las diversas enfermedades cardiovasculares, que prolonga la vida de los pacientes, y al envejecimiento de la población. Un reciente estudio epidemiológico de base poblacional realizado en España (estudio OFRECE) ha revelado una prevalencia de fibrilación auricular del 4,4% en el grupo de edad > 40 años, con un incremento exponencial con la edad1. La trascendencia de este problema es muy alta, debido a su influencia negativa en la supervivencia, alta incidencia de eventos embólicos o hemorrágicos (sobre todo accidentes cerebrovasculares), repercusiones económicas de su tratamiento y sus complicaciones y deterioro de la calidad de vida de los pacientes2. Las actuales guías de práctica clínica para el manejo de la fibrilación auricular recomiendan que los pacientes con algún factor de riesgo embolígeno reciban terapia anticoagulante preventiva2,3. A pesar de la introducción de los nuevos anticoagulantes orales (ACO) antagonistas directos de la trombina y del factor Xa4–6 para la anticoagulación de los pacientes con FANV, la utilización de los clásicos antagonistas de la vitamina K (AVK), como los dicumarínicos y la warfarina sódica, sigue siendo predominante en España. Este tratamiento reduce el riesgo de accidentes tromboembólicos, pero su efectividad depende del adecuado control de los niveles de anticoagulación (razón internacional normalizada [INR] entre 2 y 3). Diversos estudios demuestran que un alto porcentaje de los pacientes con FANV anticoagulados con AVK pueden tener INR fuera de rango terapéutico en una importante proporción del tiempo7,8, lo que los pondría en riesgo de sufrir eventos tromboembólicos y/o hemorrágicos. El objetivo de nuestro estudio es analizar la prevalencia de mal control de la anticoagulación con AVK en pacientes con FANV en nuestro país, así como los posibles factores asociados a dicho mal control.
MÉTODOSLa Agencia de Investigación de la Sociedad Española de Cardiología diseñó el estudio CALIFA (acrónimo de Calidad de la Anticoagulación y comorbilidades asociadas en pacientes con Fibrilación Auricular no valvular en consultas de cardiología) para dar respuesta a ese objetivo. Se trata de un estudio nacional, multicéntrico, observacional, con corte transversal y análisis retrospectivo, de casos consecutivos de pacientes con FANV que estuvieran recibiendo anticoagulación oral con AVK, seguidos en consultas de cardiología. Incluyeron a los pacientes de 120 cardiólogos en consultas ambulatorias de cardiología repartidas por toda España. Cada cardiólogo investigador incluyó a los primeros 10 pacientes que cumplieran los criterios de inclusión y no tuvieran ninguno de los de exclusión a partir de la fecha de inicio del estudio (1 de noviembre de 2013). Se podía incluir a mujeres o varones con edad ≥ 18 años, FANV (definida por la existencia de dicha arritmia en ausencia de una prótesis valvular, estenosis mitral reumática de cualquier grado o insuficiencia mitral significativa de grado moderado o grave), que estuvieran tomando de manera estable AVK durante al menos los 6 meses previos a la inclusión y firmaran el consentimiento informado. No se incluyó a pacientes cuyo periodo de ajuste de dosis del anticoagulante se iniciara en esos 6 meses ni tampoco a los pacientes a los que se hubiera modificado la dosis o suspendido temporalmente el AVK en dicho periodo debido a intervenciones o procedimientos diagnósticos o terapéuticos con riesgo de hemorragia. Se podía incluir a pacientes con cualquier tipo de FANV (permanente, persistente, paroxística, primer episodio, etc.). El estudio fue aprobado por el Comité Ético de Investigación del Hospital Universitario de San Juan de Alicante. El estudio se llevó a cabo, como toda la investigación en personas, de acuerdo con los requisitos éticos expresados en la declaración de Helsinki y sus enmiendas posteriores. Se cumplió la Ley Orgánica de Protección de Datos española.
El periodo de inclusión total del estudio fue de 5 meses (noviembre de 2013 a marzo de 2014). Se realizó una única visita para cada paciente, en la que se recogieron las variables de interés para el objetivo del estudio de los 6 meses previos. Además, en dicha visita, el investigador recogió los valores de INR de todas las determinaciones realizadas en los 6 meses previos, con el fin de calcular el tiempo en rango terapéutico (TRT) según el método de Rosendaal et al9. En resumen, este método se basa en la presunción de que, para pasar de un valor de INR a otro en dos determinaciones separadas por un número dado de días, se estima que el INR tuvo que «atravesar» la diferencia entre los dos valores en esos días, suponiendo que el cambio del INR durante ese tiempo fuera aproximadamente lineal, es decir, que cada día aumentó o disminuyó lo mismo. Por ejemplo, si en un periodo de 14 días el INR pasa de 1,9 a 3,1, esa diferencia de 1,2 puntos se estima que se produce de forma lineal día a día (cada día aumenta el INR 1,2/14=0,085). Hay aplicaciones que calculan automáticamente el número de días, como se ha utilizado en nuestro estudio. La variable principal del estudio fue el TRT del INR, determinado mediante el método de Rosendaal. Se consideró con mal control de la anticoagulación a los pacientes cuyo TRT fuera < 65% del tiempo durante los 6 meses previos a la inclusión en el estudio.
Para conseguir que la muestra fuera lo más representativa posible, se incluyó a investigadores repartidos por la mayoría de las zonas geográficas españolas (anexo 1 del material suplementario). Se recogieron de todos los pacientes las variables que se detallan en la tabla 1. En todos los casos, el registro de las variables se realizó mediante entrevista personal al paciente el mismo día de la vista de inclusión y mediante consulta de su historia clínica. Recogió la información el propio cardiólogo investigador. En el anexo 2 del material suplementario disponible en la web se detallan las definiciones de las distintas variables. El tamaño muestral se calculó para el objetivo de identificar los factores asociados con mala calidad de la anticoagulación. Asumiendo que un 50% de los pacientes pudieran tener mal control de la anticoagulación (TRT < 65%) y que 1 de cada 4 pacientes presentaran las variables analizadas (p. ej., diabetes mellitus, insuficiencia renal, etc.), aceptando un error alfa de 0,05 y un error beta de 0,20 para la estimación del riesgo relativo de no tener en rango el INR que se introduciría en caso de presentar esa variable (p. ej., tener diabetes mellitus frente a no tenerla), serían necesarios 296 pacientes en el grupo con la variable (p. ej., diabéticos) y 888 en el grupo sin dicha variable (no diabéticos) para detectar un riesgo relativo mínimo de 1,20 si la tasa de enfermos en el grupo expuesto (pacientes que no están en rango) fuera del 50%. Asumiendo una tasa de pérdidas no superior al 10%, se estimó que se necesitaría incluir a un total de 1.184 pacientes. Finalmente, la muestra analizada fue de 1.056 casos que cumplían la condición mínima requerida para poder calcular el TRT por el método de Rosendaal de tener al menos 4 determinaciones de INR en los 6 meses previos a la inclusión, con lo que el porcentaje de pérdidas estuvo dentro de lo previsto.
Variables recogidas y analizadas en el estudio CALIFA
| Datos demográficos |
| Edad |
| Sexo |
| Situación laboral |
| Situación social |
| Nivel de estudios |
| Comorbilidades y factores de riesgo cardiovascular |
| Hipertensión arterial |
| Hiperlipemia |
| Diabetes mellitus |
| Tabaquismo |
| Enfermedad pulmonar obstructiva crónica |
| Insuficiencia renal |
| Disfunción hepática |
| Historia de cáncer |
| Arteriopatía aórtica o de miembros inferiores |
| Accidente cerebrovascular previo |
| Embolia no cerebral previa |
| Toma habitual de antiinflamatorios no esteroideos |
| Disfunción tiroidea |
| Abuso de alcohol o drogas |
| Demencia |
| Antecedentes cardiológicos distintos de la FA |
| Fármacos prohemorrágicos (antiinflamatorios no esteorideos, antiagregantes) |
| Insuficiencia renal significativa (tasa de filtrado glomerular < 60 ml/min) |
| Insuficiencia renal grave (diálisis, trasplante renal, tasa de filtrado glomerular < 30 ml/min o creatinina sérica ≥ 2,2 mg/dl) |
| Cardiopatía previa y tipo de cardiopatía |
| Taquiarritmias previas |
| Bradiarritmias previas |
| Ablación previa |
| Marcapasos |
| Resincronizador/desfibrilador automático implantable |
| Índice Charlson resumido |
| Antecedentes hemorrágicos |
| Datos relacionados con la fibrilación auricular |
| Tiempo desde el diagnóstico inicial |
| Tipo de fibrilación auricular |
| Cardioversión eléctrica previa |
| Ablación previa |
| Estrategia de control (ritmo o frecuencia) |
| Cierre de orejuela previo |
| Clase funcional de la EHRA |
| CHADS2 |
| CHA2DS2-VASc |
| HAS-BLED |
| Exploración y pruebas diagnósticas |
| Presión arterial sistólica |
| Presión arterial diastólica |
| Frecuencia cardiaca |
| Peso |
| Talla |
| Índice de masa corporal |
| Perímetro de cintura |
| Ritmo en el ECG |
| Trastorno de conducción en el ECG |
| Fracción de eyección ventricular izquierda (la más reciente en los 6 meses previos) |
| Analítica sanguínea (la más reciente en los 6 meses previos) |
| Hemoglobina |
| Glucemia basal |
| Triglicéridos |
| Creatinina sérica |
| Colesterol total |
| Tasa de filtrado glomerular |
| cHDL |
| HbA1c |
| Tratamiento farmacológico en los 6 meses previos |
| Fármaco antivitamina K |
| Antagonistas del receptor de mineralocorticoides |
| Inhibidores de la enzima de conversión de la angiotensina |
| Antagonistas del receptor de la angiotensina II |
| Diuréticos |
| Estatinas |
| Antiagregantes |
| Bloqueadores beta |
| Digoxina |
| Antagonistas del calcio |
| Antiarrítmicos |
| Valores de INR habituales en los 6 meses previos |
| Actitud respecto a la anticoagulación |
cHDL: colesterol unido a lipoproteínas de alta densidad; ECG: electrocardiograma; EHRA: European Heart Rhythm Association; FA: fibrilación auricular; HbA1c: glucohemoglobina; INR: International Normalized Ratio.
La prevalencia de mal control de la anticoagulación se expresa como el porcentaje de casos con TRT < 65% por el método de Rosendaal sobre el total de pacientes analizados. Se interrogó a los investigadores sobre si realizarían algún cambio en el tratamiento anticoagulante una vez conocido el TRT concreto de cada paciente, con 4 posibles actitudes: seguir igual, cambiar a uno de los nuevos ACO, optimizar el AVK o suspender el ACO (respuestas «cerradas», una sola posible por paciente entre las cuatro). Se realizó un análisis comparativo bivariable de todas las variables relacionadas con antecedentes, comorbilidades y tratamiento farmacológico, recogidas entre los subgrupos de pacientes con TRT mayor o menor del 65%, mediante los tests de la χ2 y de Mann-Whitney. Se consideró estadísticamente significativo un valor de p < 0,05. Los factores que resultaron estadísticamente significativos y los que mostraron p ≤ 0,15 se incluyeron en un modelo de regresión logística multivariable, y se estimaron las odds ratio (OR) y sus intervalos de confianza del 95% (IC95%).
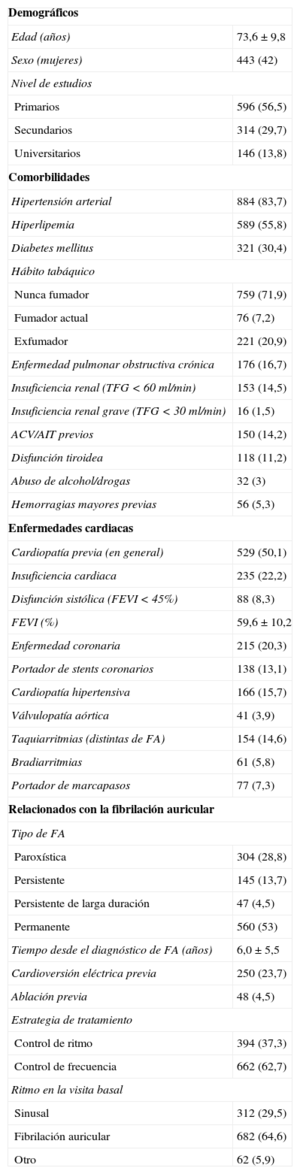
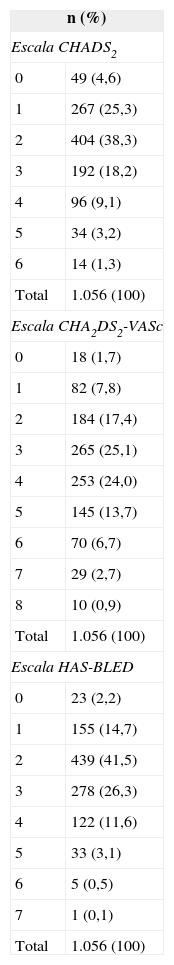
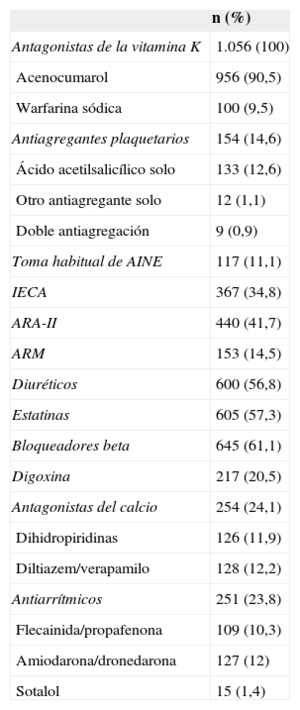
RESULTADOSCaracterísticas generales de la muestraLa media de edad era 73,6 ± 9,8 años; eran mujeres el 42% de los casos. En la tabla 2 se describen los antecedentes más importantes de los pacientes. El valor medio de la escala CHADS2 fue 2,2 ± 1,2 (intervalo, 0-6) y el de CHA2DS2-VASc, 3,5 ± 1,6 (0-8). El valor medio de la escala HAS-BLED fue 2,4 ± 1,1 (0-7). En la tabla 3 se expresa la distribución de los casos según los valores de dichas escalas. Todos los pacientes estaban recibiendo AVK durante al menos los 6 meses previos a la inclusión (acenocumarol el 90,5% y warfarina sódica el 9,5%). En la tabla 4 se detalla el tratamiento farmacológico que habían estado tomando los pacientes en los 6 meses previos a la visita de inclusión.
Antecedentes y características generales (n=1.056)
| Demográficos | |
| Edad (años) | 73,6 ± 9,8 |
| Sexo (mujeres) | 443 (42) |
| Nivel de estudios | |
| Primarios | 596 (56,5) |
| Secundarios | 314 (29,7) |
| Universitarios | 146 (13,8) |
| Comorbilidades | |
| Hipertensión arterial | 884 (83,7) |
| Hiperlipemia | 589 (55,8) |
| Diabetes mellitus | 321 (30,4) |
| Hábito tabáquico | |
| Nunca fumador | 759 (71,9) |
| Fumador actual | 76 (7,2) |
| Exfumador | 221 (20,9) |
| Enfermedad pulmonar obstructiva crónica | 176 (16,7) |
| Insuficiencia renal (TFG < 60 ml/min) | 153 (14,5) |
| Insuficiencia renal grave (TFG < 30 ml/min) | 16 (1,5) |
| ACV/AIT previos | 150 (14,2) |
| Disfunción tiroidea | 118 (11,2) |
| Abuso de alcohol/drogas | 32 (3) |
| Hemorragias mayores previas | 56 (5,3) |
| Enfermedades cardiacas | |
| Cardiopatía previa (en general) | 529 (50,1) |
| Insuficiencia cardiaca | 235 (22,2) |
| Disfunción sistólica (FEVI < 45%) | 88 (8,3) |
| FEVI (%) | 59,6 ± 10,2 |
| Enfermedad coronaria | 215 (20,3) |
| Portador de stents coronarios | 138 (13,1) |
| Cardiopatía hipertensiva | 166 (15,7) |
| Válvulopatía aórtica | 41 (3,9) |
| Taquiarritmias (distintas de FA) | 154 (14,6) |
| Bradiarritmias | 61 (5,8) |
| Portador de marcapasos | 77 (7,3) |
| Relacionados con la fibrilación auricular | |
| Tipo de FA | |
| Paroxística | 304 (28,8) |
| Persistente | 145 (13,7) |
| Persistente de larga duración | 47 (4,5) |
| Permanente | 560 (53) |
| Tiempo desde el diagnóstico de FA (años) | 6,0 ± 5,5 |
| Cardioversión eléctrica previa | 250 (23,7) |
| Ablación previa | 48 (4,5) |
| Estrategia de tratamiento | |
| Control de ritmo | 394 (37,3) |
| Control de frecuencia | 662 (62,7) |
| Ritmo en la visita basal | |
| Sinusal | 312 (29,5) |
| Fibrilación auricular | 682 (64,6) |
| Otro | 62 (5,9) |
ACV: accidente cerebrovascular; AIT: accidente isquémico transitorio
FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo
TFG: tasa de filtrado glomerular.
Las variables cuantitativas se expresan como media ± desviación estandar y las cualitativas, como n (%).
Distribución de los casos según el valor de las escalas de riesgo tromboembólico y hemorrágico
| n (%) | |
|---|---|
| Escala CHADS2 | |
| 0 | 49 (4,6) |
| 1 | 267 (25,3) |
| 2 | 404 (38,3) |
| 3 | 192 (18,2) |
| 4 | 96 (9,1) |
| 5 | 34 (3,2) |
| 6 | 14 (1,3) |
| Total | 1.056 (100) |
| Escala CHA2DS2-VASc | |
| 0 | 18 (1,7) |
| 1 | 82 (7,8) |
| 2 | 184 (17,4) |
| 3 | 265 (25,1) |
| 4 | 253 (24,0) |
| 5 | 145 (13,7) |
| 6 | 70 (6,7) |
| 7 | 29 (2,7) |
| 8 | 10 (0,9) |
| Total | 1.056 (100) |
| Escala HAS-BLED | |
| 0 | 23 (2,2) |
| 1 | 155 (14,7) |
| 2 | 439 (41,5) |
| 3 | 278 (26,3) |
| 4 | 122 (11,6) |
| 5 | 33 (3,1) |
| 6 | 5 (0,5) |
| 7 | 1 (0,1) |
| Total | 1.056 (100) |
Tratamiento farmacológico en los 6 meses previos (n=1.056)
| n (%) | |
|---|---|
| Antagonistas de la vitamina K | 1.056 (100) |
| Acenocumarol | 956 (90,5) |
| Warfarina sódica | 100 (9,5) |
| Antiagregantes plaquetarios | 154 (14,6) |
| Ácido acetilsalicílico solo | 133 (12,6) |
| Otro antiagregante solo | 12 (1,1) |
| Doble antiagregación | 9 (0,9) |
| Toma habitual de AINE | 117 (11,1) |
| IECA | 367 (34,8) |
| ARA-II | 440 (41,7) |
| ARM | 153 (14,5) |
| Diuréticos | 600 (56,8) |
| Estatinas | 605 (57,3) |
| Bloqueadores beta | 645 (61,1) |
| Digoxina | 217 (20,5) |
| Antagonistas del calcio | 254 (24,1) |
| Dihidropiridinas | 126 (11,9) |
| Diltiazem/verapamilo | 128 (12,2) |
| Antiarrítmicos | 251 (23,8) |
| Flecainida/propafenona | 109 (10,3) |
| Amiodarona/dronedarona | 127 (12) |
| Sotalol | 15 (1,4) |
AINE: antiinflamatorios no esteroideos; ARA-II: antagonistas del receptor de la angiotensina II; ARM: antagonistas del receptor de mineralocorticoides
IECA: inhibidores de la enzima de conversión de la angiotensina.
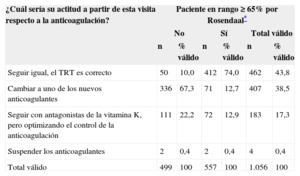
Se realizaron 6.758 determinaciones de INR en los 1.056 pacientes en los 6 meses analizados (6,40 por paciente y 1,07 por paciente y mes). Solo el 59,1% ± 24,8% de las determinaciones estaban en rango terapéutico (INR, 2–3), sin diferencias por áreas geográficas. La distribución de pacientes según la proporción de determinaciones en rango fue: < 30% en rango, 13,6% de los pacientes: un 30-50% en rango, el 30%; un 50-70% en rango, el 21,7%, y > 70% en rango, el 34,7%. Por el método de Rosendaal, el TRT medio de la muestra en ese periodo fue del 63,8 ± 25,9% del tiempo. La prevalencia de mal control de la anticoagulación, definido como un TRT < 65% del tiempo según el método de Rosendaal, fue del 47,3% (IC 95%, 44,3-50,3%; n=499). El 29,6% de los pacientes tenían un TRT < 50% del tiempo. La actitud de los investigadores respecto al tratamiento anticoagulante, según el TRT fuera superior o inferior al 65%, se muestra en la tabla 5. El 67,3% cambiaría a un nuevo anticoagulante en los casos de TRT < 65%, frente a solo el 12,7% con TRT ≥ 65% (p < 0,001).
Actitud de los investigadores respecto al tratamiento anticoagulante según tiempo en rango terapéutico
| ¿Cuál sería su actitud a partir de esta visita respecto a la anticoagulación? | Paciente en rango ≥ 65% por Rosendaal* | |||||
|---|---|---|---|---|---|---|
| No | Sí | Total válido | ||||
| n | % válido | n | % válido | n | % válido | |
| Seguir igual, el TRT es correcto | 50 | 10,0 | 412 | 74,0 | 462 | 43,8 |
| Cambiar a uno de los nuevos anticoagulantes | 336 | 67,3 | 71 | 12,7 | 407 | 38,5 |
| Seguir con antagonistas de la vitamina K, pero optimizando el control de la anticoagulación | 111 | 22,2 | 72 | 12,9 | 183 | 17,3 |
| Suspender los anticoagulantes | 2 | 0,4 | 2 | 0,4 | 4 | 0,4 |
| Total válido | 499 | 100 | 557 | 100 | 1.056 | 100 |
TRT: tiempo en rango terapéutico.
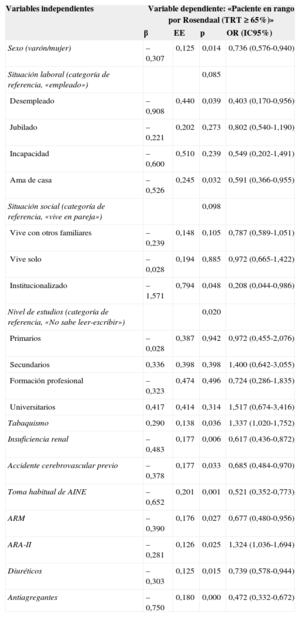
Los resultados de la comparación bivariable de las distintas variables analizadas entre los 499 pacientes con TRT < 65% y los 557 con TRT ≥ 65% se muestra en la tabla 6. Los pacientes con TRT < 65% por el método de Rosendaal fueron en mayor proporción mujeres (el 45,9 frente al 38,4%, p=0,014), desempleados (el 3,4 frente al 1,8%; p=0,039), amas de casa (el 17,4 frente al 13,5%; p=0,032), institucionalizados (el 1,6 frente al 0,4%; p=0,048), con insuficiencia renal (tasa de filtrado glomerular < 60ml/min) (el 17,6 frente al 11,7%; p=0,006), con antecedentes de accidente cerebrovascular previo (el 16,6 frente al 12%; p=0,033), y con toma habitual de antiinflamatorios no esteroideos (el 14,4 frente al 8,1%; p=0,001). Asimismo, tenían antecedentes de tabaquismo (actual o antiguo) en menor proporción que los pacientes con TRT ≥ 65% (el 25,1 frente al 30,9%; p=0,036). En relación con el tratamiento farmacológico, la toma de diuréticos, antialdosterónicos y antiagregantes fue más frecuente en pacientes con TRT < 65%, mientras que la de antagonistas del receptor de la angiotensina II lo fue en los pacientes con TRT ≥ 65% (tabla 6). No hubo diferencias significativas para el resto de las variables analizadas.
Variables significativas en la comparación bivariable entre los 499 pacientes con TRT < 65% y los 557 con TRT ≥ 65%
| Variables independientes | Variable dependiente: «Paciente en rango por Rosendaal (TRT ≥ 65%)» | |||
|---|---|---|---|---|
| β | EE | p | OR (IC95%) | |
| Sexo (varón/mujer) | –0,307 | 0,125 | 0,014 | 0,736 (0,576-0,940) |
| Situación laboral (categoría de referencia, «empleado») | 0,085 | |||
| Desempleado | –0,908 | 0,440 | 0,039 | 0,403 (0,170-0,956) |
| Jubilado | –0,221 | 0,202 | 0,273 | 0,802 (0,540-1,190) |
| Incapacidad | –0,600 | 0,510 | 0,239 | 0,549 (0,202-1,491) |
| Ama de casa | –0,526 | 0,245 | 0,032 | 0,591 (0,366-0,955) |
| Situación social (categoría de referencia, «vive en pareja») | 0,098 | |||
| Vive con otros familiares | –0,239 | 0,148 | 0,105 | 0,787 (0,589-1,051) |
| Vive solo | –0,028 | 0,194 | 0,885 | 0,972 (0,665-1,422) |
| Institucionalizado | –1,571 | 0,794 | 0,048 | 0,208 (0,044-0,986) |
| Nivel de estudios (categoría de referencia, «No sabe leer-escribir») | 0,020 | |||
| Primarios | –0,028 | 0,387 | 0,942 | 0,972 (0,455-2,076) |
| Secundarios | 0,336 | 0,398 | 0,398 | 1,400 (0,642-3,055) |
| Formación profesional | –0,323 | 0,474 | 0,496 | 0,724 (0,286-1,835) |
| Universitarios | 0,417 | 0,414 | 0,314 | 1,517 (0,674-3,416) |
| Tabaquismo | 0,290 | 0,138 | 0,036 | 1,337 (1,020-1,752) |
| Insuficiencia renal | –0,483 | 0,177 | 0,006 | 0,617 (0,436-0,872) |
| Accidente cerebrovascular previo | –0,378 | 0,177 | 0,033 | 0,685 (0,484-0,970) |
| Toma habitual de AINE | –0,652 | 0,201 | 0,001 | 0,521 (0,352-0,773) |
| ARM | –0,390 | 0,176 | 0,027 | 0,677 (0,480-0,956) |
| ARA-II | –0,281 | 0,126 | 0,025 | 1,324 (1,036-1,694) |
| Diuréticos | –0,303 | 0,125 | 0,015 | 0,739 (0,578-0,944) |
| Antiagregantes | –0,750 | 0,180 | 0,000 | 0,472 (0,332-0,672) |
ARA-II: antagonistas del receptor de la angiotensina II; AINE: antiinflamatorios no esteroideos; ARM: antagonistas del receptor de mineralocorticoides; EE: error estándar; IC95%: intervalo de confianza del 95%; OR: odds ratio; TRT: tiempo en rango terapéutico.
En el estudio multivariable (tabla 7), cuatro variables se asociaron de forma independiente con un TRT < 65%: la insuficiencia renal moderada o grave (OR=1,53; IC95%, 1,08-2,18; p=0,018), la toma habitual de antiinflamatorios no esteroideos (OR=1,79; IC95%, 1,20-2,79; p=0,004), el tratamiento con antiagregantes (OR=2,16; IC95%, 1,49-3,12; p < 0,0001) y no recibir antagonistas del receptor de la angiotensina II (OR=1,39; IC95%, 1,08-1,79; p=0,011).
Variables significativas asociadas a mal control de la anticoagulación con AVK (TRT < 65%) en el análisis multivariable
| p | OR (IC95%) | |
|---|---|---|
| Sin tratamiento con ARA-II | 0,011 | 1,390 (1,083-1,794) |
| Insuficiencia renal | 0,018 | 1,530 (1,080-2,180) |
| Tratamiento con antiagregantes | < 0,0001 | 2,163 (1,498-3,121) |
| Toma habitual de AINE (al menos 1 vez a la semana) | 0,004 | 1,790 (1,200-2,790) |
AINE: antiinflamatorios no esteroideos; ARA-II: antagonistas del receptor de la angiotensina II; AVK: antagonistas de la vitamina K; IC95%: intervalo de confianza del 95%; OR: odds ratio; TRT: tiempo en rango terapéutico.
Los resultados del estudio CALIFA, que incluye una muestra amplia y representativa de pacientes con FANV anticoagulados con AVK en la actualidad en España indican que el control y la calidad de la anticoagulación con estos fármacos en nuestro país son pobres, y casi la mitad de ellos, en concreto el 47,3%, están fuera del rango terapéutico de INR durante más del 65% del tiempo (TRT < 65%), calculado por el método de Rosendaal et al9, que actualmente es el más aceptado para dicha valoración. Más aún, casi la tercera parte de los pacientes estaban fuera de rango más de la mitad del tiempo en tratamiento con AVK (TRT < 50%). Esto supone que en la mitad de los pacientes con FANV y alto riesgo embólico, teóricamente protegidos de los riesgos de sufrir fenómenos tromboembólicos al estar recibiendo tratamiento anticoagulante, persiste una probabilidad elevada de padecer dichas graves complicaciones. El mal control del grado de anticoagulación es uno de los más potentes predictores independientes de complicaciones tromboembólicas y hemorrágicas10–12.
La prevalencia de mal control de la anticoagulación con AVK en estudios previos también es alta, en torno al 30-40%, y no parece haber disminuido en los últimos 20 años7,8,13–15. Aunque esta prevalencia de mal control es mayor en los registros clínicos que incluyen a pacientes de la práctica habitual7, incluso en los ensayos clínicos más recientes, como el RE-LY8 y el ROCKET AF10, entre el 30 y el 40% de los pacientes con FANV que reciben AVK están fuera de rango, con INR < 2 o > 3, más del 60-65% del tiempo. En nuestro estudio, los resultados observados son similares o incluso algo peores, con casi el 50% de los pacientes con TRT < 65%. Hay que resaltar, además, que en el estudio CALIFA solo se ha incluido a pacientes con un régimen de anticoagulación con AVK «estable», es decir, se excluyeron los casos en que se hubiera iniciado la anticoagulación en el periodo de 6 meses evaluado y también a los que en ese periodo se hubiera suspendido temporalmente o se hubiera modificado la dosis del AVK debido a procedimientos con riesgo de hemorragia. Si hubiéramos incluido a pacientes de este tipo, habituales en la práctica diaria, la prevalencia de mal control probablemente habría sido aún mayor. Por otra parte, aceptar que un paciente que recibe AVK está correctamente anticoagulado si su TRT es > 65% significa asumir que sus INR pueden estar fuera de rango en hasta un 35% del tiempo de anticoagulación, lo que resulta cuando menos arriesgado. Sin embargo, este valor de corte del 65% para indicar si un paciente con AVK está bien o mal anticoagulado es el admitido por las autoridades sanitarias españolas para establecer la indicación de uso de los nuevos ACO en pacientes con FANV16, y por ello lo hemos elegido para nuestro análisis.
El segundo objetivo de nuestro estudio ha sido identificar posibles factores predictores de la calidad de la ACO con AVK, lo que puede tener gran importancia a la hora de seleccionar la estrategia de tratamiento ACO para un paciente con indicación para ello. Estudios previos han encontrado diversas variables y comorbilidades asociadas a peor control de la ACO con AVK17–21, aunque con mucha variabilidad dependiendo de los trabajos. La edad más joven y el sexo femenino han sido señalados como predictores independientes de mal control de la ACO en algunos estudios17, pero no en otros18, al igual que el nivel educativo y el dominio del idioma18,19. Algunos factores dietéticos (alimentos ricos en vitamina K, consumo de alcohol), el índice de masa corporal, la raza no caucásica, la presencia de comorbilidades (diabetes mellitus, ictus previo, insuficiencia cardiaca) y algunos tratamientos farmacológicos concomitantes (antiinflamatorios no esteroideos, amiodarona) también han sido señalados como predictores de mala calidad de la anticoagulación con AVK17–21. El uso de algunos fármacos, como bloqueadores beta y verapamilo, por el contrario, se han asociado a mejor control de la ACO con AVK17. Respecto al hábito tabáquico, mientras que algún estudio encuentra que haber fumado en los 2 años previos es un predictor muy potente de mal control de la ACO17, otros señalan que no haber fumado nunca se asocia a mayor riesgo de INR > 318. La asociación con la raza puede deberse al nivel educativo19 o diferencias genéticas en los genes relacionados con el metabolismo de la vitamina K y del citocromo P45021. En nuestro estudio, cuatro variables se mostraron predictoras independientes de mal control de la anticoagulación con AVK: una comorbilidad (la insuficiencia renal con tasa de filtrado glomerular < 60ml/min) y tres factores farmacológicos. El uso habitual de antiinflamatorios no esteroideos y antiagregantes se asoció con mal nivel de anticoagulación, mientras que recibir antagonistas del receptor de la angiotensina II se asoció a buen control. Posiblemente, la relación entre control de la ACO con AVK y estos fármacos, al igual que la descrita en otros estudios con bloqueadores beta, verapamilo y amiodarona17, se deba a interacciones farmacocinéticas en los mecanismos de degradación.
La variabilidad y la discordancia de los resultados acerca de los posibles factores predictores de buen o mal control de la ACO con AVK hacen difícil identificar a priori el subgrupo de pacientes que van a estar mal anticoagulados con AVK. Por ello, algunos autores han tratado de simplificar este problema introduciendo escalas que integren dichos factores individuales, como la SAMe-TT2R2 (sexo femenino, edad < 60 años, al menos dos comorbilidades, estrategia de control de ritmo, tabaquismo y raza), propuesta por Apostolakis et al, basada en la cohorte del estudio AFFIRM17. Aunque algún otro estudio reciente parece confirmar la validez de esta escala22,23, parece necesaria una mayor experiencia antes de adoptarla como guía de elección del tratamiento con AVK u otros ACO.
Los resultados de nuestro estudio indican que una elevada proporción de los pacientes con FANV que actualmente reciben AVK en nuestro país están mal anticoagulados y que esta situación no ha mejorado en los últimos 20 años. Ello implica que los pacientes, a pesar de que teóricamente están «protegidos», siguen teniendo un riesgo elevado de ictus, nuevas embolias y complicaciones hemorrágicas, por lo que es necesario emplear estrategias que mejoren esta situación. Se han propuesto diversas alternativas, como el uso de AVK con mayor estabilidad anticoagulante, como warfarina sódica o fenprocumón24, un dicumarínico de vida media más larga que la del acenocumarol, no disponible en España. En nuestro estudio, casi un 10% de los pacientes recibían warfarina, pero los resultados fueron similares a los del acenocumarol. Paradójicamente, la adición de un suplemento diario de vitamina K puede aumentar la estabilidad de la anticoagulación con AVK25, aunque hay poca experiencia con esta pauta. Otras alternativas son las estrategias de autocontrol del paciente o de control intensivo por clínicas especializadas26, pero esto solo puede aplicarse a pacientes muy concretos. Se han propuesto pautas de ajuste de las dosis de AVK que incluyan en sus algoritmos de decisión información genética sobre los genes implicados en el metabolismo de los AVK (VKORC1 y CYP2C9)27,28. Se ha demostrado que polimorfismos en estos genes pueden explicar hasta un tercio de las variaciones en las necesidades de dosis de AVK. Sin embargo, esto es complejo y, además, los resultados de dos estudios controlados muy recientes han mostrado resultados opuestos (favorable para la warfarina27, pero no para el acenocumarol28). Por último, la alternativa más eficaz, segura y factible4–6 posiblemente sea cambiar, al menos a los pacientes mal anticoagulados, a estos nuevos ACO, lo cual, por otra parte, es la opción preferida mayoritariamente por los investigadores de nuestro estudio.
LimitacionesLas principales limitaciones de nuestro estudio son las inherentes a su diseño observacional y no aleatorizado y los posibles sesgos derivados de la selección de los pacientes, pues la selección no fue aleatoria, por lo que no puede excluirse una tendencia a incluir a pacientes mal controlados. Sin embargo, estos posibles sesgos de inclusión se ven reducidos por el importante tamaño muestral, el corto periodo de inclusión de pacientes y la distribución de los investigadores por toda España. Este estudio ofrece los resultados actuales de una población de la «vida real» en nuestro país.
CONCLUSIONESNuestros resultados indican que una elevada proporción, casi el 50%, de los pacientes con FANV que actualmente reciben de manera estable AVK en España tienen mal control de la anticoagulación. Los factores asociados de forma independiente a este mal control son la presencia de insuficiencia renal y la ingesta habitual de antiinflamatorios no esteroideos y antiagregantes. La toma de antagonistas del receptor de la angiotensina II se asocia a buen control de la anticoagulación. Estos resultados indican que el riesgo de fenómenos tromboembólicos y hemorrágicos sigue siendo alto en una elevada proporción de pacientes con FANV teóricamente «protegidos» contra ellos, y que son precisas estrategias para mejorar esta situación. Estas estrategias deben incluir una mejor identificación de los factores asociados a mala anticoagulación con AVK, una mejor organización del control y la monitorización de los AVK y una mayor utilización de los nuevos ACO en los casos indicados.
FINANCIACIÓNEste estudio se ha realizado gracias a una beca no condicionada de Bayer Hispania S.L.
CONFLICTO DE INTERESESNinguno.