Recientemente, un nuevo algoritmo electrocardiográfico ha mostrado resultados esperanzadores para el diagnóstico del infarto agudo de miocardio (IAM) en presencia de bloqueo completo de rama izquierda del haz de His (BRIHH). Se decidió evaluar estos nuevos algoritmos en una cohorte de pacientes remitidos para intervención coronaria percutánea primaria (ICPp).
MétodosEstudio observacional de cohorte retrospectiva que incluyó a todos los pacientes con sospecha de IAM y BRIHH en el ecocardiograma inicial remitidos para ICPp a 4 hospitales terciarios de Barcelona, España.
ResultadosSe incluyó a 145 pacientes; 54 (37%) tenían un cuadro clínico equivalente a un IAM con elevación del segmento ST (IAMCEST). Entre los pacientes con IAMCEST, 25 (46%) estaban en Killip III o IV y la mortalidad hospitalaria fue del 15%. Los algoritmos I y II de Smith presentaron mejores resultados que los algoritmos de Sgarbossa y tuvieron buena especificidad (el 90 y el 97% respectivamente); sin embargo, su sensibilidad fue del 67 y el 54% respectivamente. En una estrategia terapéutica guiada por los algoritmos de Smith, 18 (33%) o 25 (46%) pacientes con IAMCEST no habrían recibido ICPp. Por otra parte, la gravedad y el pronóstico de los pacientes con IAMCEST era similar independientemente de la positividad de los algoritmos de Smith. Los marcadores de daño miocárdico fueron positivos en un 54% de los pacientes sin IAMCEST, lo que limita su utilidad para el diagnóstico inicial.
ConclusionesEl diagnóstico de IAMCEST en presencia de BRIHH sigue siendo un desafío. Los algoritmos de Smith pueden ser útiles, pero están limitados por una sensibilidad subóptima. Se tiene que promover la búsqueda de nuevos criterios electrocardiográficos para evitar tratamientos agresivos no necesarios a la mayoría de los pacientes y, al mismo tiempo, proporcionar reperfusión emergente a un subgrupo con alto riesgo.
Palabras clave
La presencia de un bloqueo completo de rama izquierda del haz de His (BRIHH) se asocia a anomalías de la repolarización que dificultan el diagnóstico del infarto agudo de miocardio (IAM). Se han propuesto varios criterios para el diagnóstico del IAM en presencia de un BRIHH, pero ninguno ha alcanzado un rendimiento diagnóstico óptimo1–5.
En el contexto de estas incertidumbres diagnósticas, la presencia de un BRIHH de nueva aparición o supuesta nueva aparición junto con síntomas isquémicos se ha considerado tradicionalmente un equivalente electrocardiográfico del infarto agudo de miocardio con elevación del segmento ST (IAMCEST) que debe motivar una reperfusión de emergencia6,7.
Sin embargo, varios estudios coinciden en describir una baja incidencia de IAM en los pacientes con BRIHH remitidos para intervención coronaria percutánea primaria (ICPp)8–10. Teniendo en cuenta estas evidencias, la guía más reciente de la American Heart Association11 afirma que, en los pacientes con síntomas isquémicos, el BRIHH por sí solo no es diagnóstico de IAMCEST.
La mejora del diagnóstico electrocardiográfico del IAMCEST en pacientes con BRIHH es crucial para adoptar una estrategia de tratamiento apropiada en cada caso. Recientemente, Smith et al.12 han propuesto 2 modificaciones de las reglas de Sgarbossa que, según sus resultados, aumentan de manera significativa su sensibilidad.
El principal objetivo del presente estudio es evaluar el rendimiento diagnóstico de estos nuevos algoritmos en una cohorte de pacientes con BRIHH remitidos para ICPp.
MÉTODOSDiseño del estudio y selección de los pacientesEstudio de cohorte observacional retrospectivo. En octubre de 2009 se inició en Cataluña (España) la red Codi IAM13 con el objetivo de proporcionar una reperfusión temprana, principalmente mediante ICPp, a todo paciente con sospecha de IAMCEST que acudiera en las primeras 12 h siguientes al inicio de los síntomas. Según el protocolo de la red, la presencia de un BRIHH de nueva aparición o de presunta nueva aparición junto con síntomas isquémicos se considera un equivalente de IAMCEST y es indicación de ICPp.
Este estudio es un proyecto de colaboración llevado a cabo en 4 hospitales terciarios de Barcelona que son centros de referencia para la ICPp. En cada hospital, los datos clínicos de los pacientes remitidos para ICPp se registran prospectivamente en una base de datos dedicada.
Se identificó retrospectivamente a todos los pacientes remitidos para ICPp a causa de un BRIHH. Se los incluyó en el estudio si el electrocardiograma (ECG) que motivaba la consulta para la ICPp (registrado cuando el paciente tenía síntomas) estaba disponible para el análisis y se confirmaba la presencia de BRIHH completo. Si se disponía de más de 1 ECG previo a la ICP, se analizaban todos.
El estudio recibió la aprobación del comité de ética local y todos los pacientes dieron su consentimiento informado por escrito.
Análisis electrocardiográficoDos cardiólogos (A. Di Marco y M. Rodríguez) que no conocían los datos clínicos de los pacientes analizaron de manera independiente todos los ECG. En caso de discrepancia, se solicitaba la evaluación de un tercer cardiólogo (I. Anguera). El BRIHH se definió por una duración del QRS > 120 ms, QS o rS en V1 y ausencia de onda Q en V6. Se calculó la desviación del segmento ST en el punto J. En consonancia con los métodos utilizados en el estudio de Smith et al.12, todas las mediciones se aproximaron al valor de 0,5 mm (0,05 mV) más próximo y se relacionaron con el segmento PR. La desviación del segmento ST se consideró concordante o discordante respecto al eje principal del QRS.
Se evaluaron los 3 criterios de Sgarbossa, los 2 algoritmos de Sgarbossa y los 3 algoritmos de Smith, que se describen detalladamente en la tabla 1. Para limitar la influencia de la variación basal y de la variabilidad interlatido del ST y el QRS, cada algoritmo se consideró positivo cuando estaba presente en más del 50% de los latidos en una derivación disponibles.
Descripción de los criterios y algoritmos electrocardiográficos evaluados
| Criterios | Descripción |
| Puntuación de Sgarbossa = 5 | Elevación del segmento ST concordante ≥ 1 mm |
| Puntuación de Sgarbossa = 3 | Depresión del segmento ST ≥ 1mm en las derivaciones V1-V3 |
| Puntuación de Sgarbossa = 2 | Elevación del segmento ST discordante ≥ 5 mm |
| Algoritmos | Descripción |
| Puntuación de Sgarbossa ≥ 3 | Elevación del segmento ST concordante ≥ 1mm o depresión concordante del segmento ST ≥ 1mm en las derivaciones V1-V3 |
| Puntuación de Sgarbossa ≥ 2 | Puntuación de Sgarbossa ≥ 3 o elevación discordante del segmento ST ≥ 5 mm |
| Regla de Smith I (regla III en el artículo original) | Puntuación de Sgarbossa ≥ 3 o elevación discordante del segmento ST con un cociente ST/S ≤ –0,25 |
| Regla de Smith II (regla IV en el artículo original) | Puntuación de Sgarbossa ≥ 3 o desviación discordante del segmento ST con un cociente ST/S o ST/R ≤ –0,3 |
| Regla de Smith III (regla V en el artículo original) | Desviación discordante del segmento ST con un cociente ST/S o ST/R ≤ –0,3 |
Un equivalente de IAMCEST se definió como la presencia de una oclusión coronaria aguda (Thrombolysis In Myocardial Infarction [TIMI] 0) o una lesión aguda con un flujo TIMI ≥ 1 junto con aumento significativo de los biomarcadores cardiacos. La estenosis coronaria se consideró aguda cuando se podía identificar signos de trombo o ulceración en la angiografía. Dado que los 4 hospitales utilizaron métodos diferentes para analizar los biomarcadores cardiacos, los valores se estandarizaron empleando el cociente del valor máximo del biomarcador con el límite superior de la normalidad en cada test utilizado. Se consideró que había un aumento significativo de los biomarcadores cuando los cocientes de troponinas I o T cardiacas eran ≥ 10 o cuando el cociente de la isoenzima MB de la creatincinasa era ≥ 5.
Análisis estadísticoTodos los análisis estadísticos se realizaron con el programa informático STATA RELEASE 12 (StataCorp LP; College Station, Texas, Estados Unidos). Las variables continuas se presentan en forma de media ± desviación estándar o mediana [intervalo intercuartílico]; las variables discretas se presentan en forma de número y porcentaje. Se calculó la sensibilidad, la especificidad, el valor predictivo positivo, el valor predictivo negativo y la eficiencia para el equivalente de IAMCEST. La eficiencia es un parámetro que expresa el porcentaje de clasificaciones correctas que proporciona una prueba diagnóstica. Se obtuvieron los intervalos de confianza del 95% con el método de Wald o, cuando era apropiado, con el método de Wilson. Las diferencias de sensibilidad y especificidad entre los algoritmos se evaluaron con la prueba de McNemar14. Las comparaciones entre los grupos se realizaron con la prueba de la χ2 o la prueba exacta de Fisher para las variables discretas y con la prueba de la U de Mann-Whitney para las variables continuas que no tenían una distribución normal. Las diferencias se consideraron estadísticamente significativas en presencia de p < 0,05.
RESULTADOSCaracterísticas basales y datos del ingreso hospitalarioEntre octubre de 2009 y diciembre de 2014, se remitió a 10.122 pacientes para ICPp. En 251 pacientes (2,5%), el protocolo para la ICPp se activó a causa de un BRIHH. De ellos, se excluyó del presente estudio a 106 por falta de una copia del ECG inicial (75 pacientes) o por la ausencia de un BRIHH completo en el ECG inicial (31 pacientes). En consecuencia, 145 pacientes formaron la población del estudio.
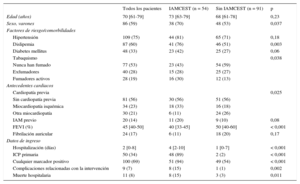
Las características basales se resumen en la tabla 2. De los 145 pacientes, 54 (37%) tenían IAMCEST. De los pacientes con IAMCEST (tabla 3), 41 (76%) presentaron una oclusión aguda completa o una reducción del flujo TIMI en la arteria coronaria culpable. En 4 pacientes (7%), la lesión culpable se identificó en el tronco común. Un alto porcentaje de pacientes con IAMCEST se encontraban en clase Killip III o IV (47%). Los valores máximos de biomarcadores estaban claramente elevados en los pacientes con IAMCEST: la mediana del cociente de troponina I fue 240 [84-769]; la mediana del cociente de troponina T, 180 [73-1.590], y la mediana del cociente de la isoenzima MB de la creatincinasa, 26 [7-70].
Características basales de la población del estudio
| Todos los pacientes | IAMCEST (n = 54) | Sin IAMCEST (n = 91) | p | |
|---|---|---|---|---|
| Edad (años) | 70 [61-79] | 73 [63-79] | 68 [61-78] | 0,23 |
| Sexo, varones | 86 (59) | 38 (70) | 48 (53) | 0,037 |
| Factores de riesgo/comorbilidades | ||||
| Hipertensión | 109 (75) | 44 (81) | 65 (71) | 0,18 |
| Dislipemia | 87 (60) | 41 (76) | 46 (51) | 0,003 |
| Diabetes mellitus | 48 (33) | 23 (42) | 25 (27) | 0,06 |
| Tabaquismo | 0,038 | |||
| Nunca han fumado | 77 (53) | 23 (43) | 54 (59) | |
| Exfumadores | 40 (28) | 15 (28) | 25 (27) | |
| Fumadores activos | 28 (19) | 16 (30) | 12 (13) | |
| Antecedentes cardiacos | ||||
| Cardiopatía previa | 0,025 | |||
| Sin cardiopatía previa | 81 (56) | 30 (56) | 51 (56) | |
| Miocardiopatía isquémica | 34 (23) | 18 (33) | 16 (18) | |
| Otra miocardiopatía | 30 (21) | 6 (11) | 24 (26) | |
| IAM previo | 20 (14) | 11 (20) | 9 (10) | 0,08 |
| FEVI (%) | 45 [40-50] | 40 [33-45] | 50 [40-60] | < 0,001 |
| Fibrilación auricular | 24 (17) | 6 (11) | 18 (20) | 0,17 |
| Datos de ingreso | ||||
| Hospitalización (días) | 2 [0-8] | 4 [2-10] | 1 [0-7] | < 0,001 |
| ICP primaria | 50 (34) | 48 (89) | 2 (2) | < 0,001 |
| Cualquier marcador positivo | 100 (69) | 51 (94) | 49 (54) | < 0,001 |
| Complicaciones relacionadas con la intervención | 9 (7) | 8 (15) | 1 (1) | 0,002 |
| Muerte hospitalaria | 11 (8) | 8 (15) | 3 (3) | 0,011 |
FEVI: fracción de eyección del ventrículo izquierdo; IAM: infarto agudo de miocardio; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; ICP: intervención coronaria percutánea.
Se utilizó, en los casos apropiados, la prueba de la χ2 o la prueba exacta de Fisher para calcular las diferencias entre proporciones; se utilizó la prueba de la U de Mann-Whitney para calcular las diferencias entre las medianas.
Los datos expresan n (%) o mediana [intervalo intercuartílico].
Características angiográficas y clínicas de los pacientes con infarto agudo de miocardio con elevación del segmento ST
| IAMCEST (n = 54) | |
|---|---|
| Oclusión aguda | 28 (52) |
| Lesión aguda con flujo TIMI 1-2 | 13 (24) |
| Lesión aguda con flujo TIMI 3 | 13 (24) |
| Número de arterias coronarias con estenosis | |
| 0 | 0 |
| 1 | 20 (37) |
| 2 | 13 (24) |
| 3 | 21 (39) |
| Arteria culpable | |
| Principal izquierda | 4 (7) |
| DAI | 22 (41) |
| CXI | 13 (24) |
| ACD | 7 (13) |
| Diagonal | 5 (9) |
| Arteria intermedia | 3 (5) |
| Clase Killip al ingreso | |
| I | 26 (48) |
| II | 3 (5) |
| III | 15 (28) |
| IV | 10 (19) |
| Cociente de TnT | 240 [84-769] |
| Cociente de TnI | 180 [73-1.590] |
| Cociente de CK-MB | 26 [7-70] |
ACD: arteria coronaria derecha; CK-MB: isoenzima MB de la creatincinasa; CXI: arteria circunfleja izquierda; DAI: arteria descendente anterior izquierda; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; TIMI: Thrombolysis In Myocardial Infarction; TnI: troponina I; TnT: troponina T.
Los datos expresan n (%) o mediana [intervalo intercuartílico].
Se realizó ICPp a 48 (89%) pacientes con IAMCEST. De los 6 pacientes restantes, 2 de edad avanzada y comorbilidades graves que tenían una lesión culpable con un flujo TIMI 3 fueron tratados de manera conservadora, y la lesión culpable no se consideró apta para revascularización percutánea en 4 pacientes (1 oclusión en el segmento distal de la descendente anterior, 1 lesión con un flujo TIMI 3 en la parte distal de la descendente anterior y 2 lesiones con flujo TIMI 1/2 en una rama diagonal). Se produjeron complicaciones relacionadas con la intervención en 9 pacientes (7%): 1 hemorragia mortal, 1 disección coronaria, 2 fallos de la ICP y 5 episodios de insuficiencia renal aguda (1 en un paciente sin IAMCEST).
Los pacientes con IAMCEST tuvieron una mortalidad hospitalaria significativamente superior (el 15 frente al 4%; p = 0,011). Excepto por 1 paciente que falleció por una hemorragia después de la ICPp, todas las demás muertes del grupo de IAMCEST fueron cardiacas, principalmente por shock cardiogénico. En cambio, 2 de las 3 muertes de pacientes sin IAMCEST se debieron a una encefalopatía posanóxica; la tercera muerte se debió a shock cardiogénico en un paciente que había ingresado tras un parada cardiaca reanimada.
Tres pacientes del grupo sin IAMCEST sufrieron un síndrome coronario agudo (SCA) (lesión aguda y biomarcadores positivos), pero no cumplían los criterios de un equivalente de IAMCEST. Se trató a los 3 pacientes con revascularización (2 con ICPp y 1 con cirugía cardiaca urgente).
De los pacientes sin IAMCEST, 49 (54%) tuvieron al menos 1 determinación de biomarcadores cardiacos por encima del límite superior; sus diagnósticos de alta se indican en la tabla 4. De estos pacientes, 17 (35%) presentaron valores de biomarcadores bajos sin una curva característica y sin signos de enfermedad cardiaca o extracardiaca, por lo que fueron dados de alta con diagnóstico de dolor torácico inespecífico.
Diagnósticos de pacientes sin infarto agudo de miocardio con elevación del segmento ST y con biomarcadores cardiacos positivos
| Total (n = 49) | |
|---|---|
| Dolor torácico inespecífico | 17 (35) |
| Insuficiencia cardiaca aguda | 11 (22) |
| Muerte súbita reanimada | 11 (22) |
| SCA con biomarcadores bajos | 3 (6) |
| Miocarditis | 2 (4) |
| Hipertensión no controlada | 2 (4) |
| Bloqueo AV | 2 (4) |
| Angina de Prinzmetal | 1 (2) |
AV: auriculoventricular; SCA: síndrome coronario agudo.
Los datos expresan n (%).
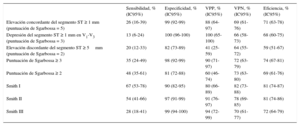
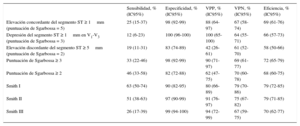
Hubo una coincidencia completa entre los 2 cardiólogos que analizaron los ECG respecto a los criterios de Sgarbossa y hubo 1 caso de discrepancia (0,7%) con las reglas de Smith I y II. El rendimiento diagnóstico de cada criterio y cada algoritmo se presenta en la tabla 5. De entre todos los criterios de Sgarbossa considerados solos y los 2 algoritmos de Sgarbossa, la regla de una puntuación de Sgarbossa ≥ 3 fue la que mostró mayor eficiencia (74%). Una puntuación de Sgarbossa ≥ 3 tuvo sensibilidad del 35% y especificidad del 98% para el diagnóstico de un equivalente de IAMCEST. De los pacientes con una lesión culpable situada en el tronco común, solo 1 (25%) de 4 presentó una puntuación de Sgarbossa ≥ 3. En comparación con la puntuación ≥ 3, una puntuación de Sgarbossa ≥ 2 mostró una sensibilidad significativamente superior (del 48%; p = 0,02), pero con menor especificidad (del 81%; p < 0,001).
Rendimiento diagnóstico de los criterios de Sgarbossa y los algoritmos de Sgarbossa y de Smith para el equivalente de infarto agudo de miocardio con elevación del segmento ST
| Sensibilidad, % (IC95%) | Especificidad, % (IC95%) | VPP, % (IC95%) | VPN, % (IC95%) | Eficiencia, % (IC95%) | |
|---|---|---|---|---|---|
| Elevación concordante del segmento ST ≥ 1 mm (puntuación de Sgarbossa = 5) | 26 (16-39) | 99 (92-99) | 88 (64-97) | 69 (61-76) | 71 (63-78) |
| Depresión del segmento ST ≥ 1 mm en V1-V3 (puntuación de Sgarbossa = 3) | 13 (6-24) | 100 (96-100) | 100 (65-100) | 66 (58-73) | 68 (60-75) |
| Elevación discordante del segmento ST ≥ 5mm (puntuación de Sgarbossa = 2) | 20 (12-33) | 82 (73-89) | 41 (25-59) | 64 (55-72) | 59 (51-67) |
| Puntuación de Sgarbossa ≥ 3 | 35 (24-49) | 98 (92-99) | 90 (71-97) | 72 (63-79) | 74 (67-81) |
| Puntuación de Sgarbossa ≥ 2 | 48 (35-61) | 81 (72-88) | 60 (46-74) | 73 (63-80) | 69 (61-76) |
| Smith I | 67 (53-78) | 90 (82-95) | 80 (66-89) | 82 (73-88) | 81 (74-87) |
| Smith II | 54 (41-66) | 97 (91-99) | 91 (76-97) | 78 (69-85) | 81 (74-86) |
| Smith III | 28 (18-41) | 99 (94-100) | 94 (72-99) | 70 (61-77) | 72 (64-79) |
IC95%: intervalo de confianza del 95%; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
La regla I de Smith fue la que mostró mayor sensibilidad (67%), significativamente superior a la de la puntuación de Sgarbossa ≥ 3 (p < 0,001) y ≥ 2 (p = 0,01), pero aún así fue subóptima; su especificidad fue del 90%, significativamente inferior a la de una puntuación de Sgarbossa ≥ 3 (p = 0,02) y sin diferencia estadísticamente significativa respecto a una puntuación de Sgarbossa ≥ 2.
La regla de Smith II, aunque mostró buena especificidad (97%), tuvo menor sensibilidad (54%), comparable a la de una puntuación de Sgarbossa ≥ 2 (p = 0,6). La regla de Smith III tuvo la limitación de presentar el valor más bajo de sensibilidad (27%).
La eficiencia general de las reglas varió entre el 69% para una puntuación de Sgarbossa ≥ 2 y el 81% para la regla de Smith I.
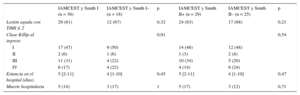
Si se hubieran utilizado las reglas de Smith I o II para guiar la conducta terapéutica, no se habría tratado con ICPp a 18 (33%) o 25 (46%) pacientes con IAMCEST respectivamente.
Además, los pacientes con IAMCEST y reglas de Smith negativas presentaron a menudo un IAM muy grave, con una forma de presentación clínica y una tasa de mortalidad similares a las de los pacientes con un IAMCEST y reglas de Smith positivas (tabla 6). De los 4 pacientes con la lesión culpable en la arteria principal izquierda, 2 (50%) tenían una regla de Smith I negativa y 3 (75%), una regla de Smith II negativa.
Características de los pacientes con infarto agudo de miocardio con elevación del segmento ST, según la positividad de las reglas de Smith
| IAMCEST y Smith I (n = 36) | IAMCEST y Smith I– (n = 18) | p | IAMCEST y Smith II+ (n = 29) | IAMCEST y Smith II– (n = 25) | p | |
|---|---|---|---|---|---|---|
| Lesión aguda con TIMI ≤ 2 | 29 (81) | 12 (67) | 0,32 | 24 (83) | 17 (68) | 0,21 |
| Clase Killip al ingreso | 0,91 | 0,54 | ||||
| I | 17 (47) | 9 (50) | 14 (48) | 12 (48) | ||
| II | 2 (6) | 1 (6) | 1 (3) | 2 (8) | ||
| III | 11 (31) | 4 (22) | 10 (34) | 5 (20) | ||
| IV | 6 (17) | 4 (22) | 4 (14) | 6 (24) | ||
| Estancia en el hospital (días) | 5 [2-11] | 4 [1-10] | 0,45 | 5 [2-11] | 4 [1-10] | 0,47 |
| Muerte hospitalaria | 5 (14) | 3 (17) | 1 | 5 (17) | 3 (12) | 0,71 |
IAMCEST: infarto agudo de miocardio con elevación del segmento ST; TIMI: Thrombolysis In Myocardial Infarction.
Se utilizó, en los casos apropiados, la prueba de la χ2 o la prueba exacta de Fisher para calcular las diferencias entre proporciones; se utilizó la prueba de la U de Mann-Whitney para calcular las diferencias entre las medianas.
Los datos expresan n (%) o mediana [intervalo intercuartílico].
Ninguno de los 3 pacientes con IAM y valor máximo de biomarcadores cardiacos bajo presentó una regla de Smith I o II positiva; en consecuencia, la inclusión de esos pacientes en el análisis reduciría la sensibilidad de las reglas de Smith I y II a un 63 y un 51% respectivamente. En la tabla 7 se presentan los resultados de todos los criterios y algoritmos al aplicarlos al grupo total de pacientes con SCA, incluidos los que no cumplían los criterios de IAMCEST.
Rendimiento diagnóstico de los criterios de Sgarbossa y los algoritmos de Sgarbossa y Smith para todos los pacientes con síndrome coronario agudo
| Sensibilidad, % (IC95%) | Especificidad, % (IC95%) | VPP, % (IC95%) | VPN, % (IC95%) | Eficiencia, % (IC95%) | |
|---|---|---|---|---|---|
| Elevación concordante del segmento ST ≥ 1mm (puntuación de Sgarbossa = 5) | 25 (15-37) | 98 (92-99) | 88 (64-97) | 67 (58-74) | 69 (61-76) |
| Depresión del segmento ST ≥ 1mm en V1-V3 (puntuación de Sgarbossa = 3) | 12 (6-23) | 100 (96-100) | 100 (65-100) | 64 (55-71) | 66 (57-73) |
| Elevación discordante del segmento ST ≥ 5mm (puntuación de Sgarbossa = 2) | 19 (11-31) | 83 (74-89) | 42 (26-61) | 61 (52-70) | 58 (50-66) |
| Puntuación de Sgarbossa ≥ 3 | 33 (22-46) | 98 (92-99) | 90 (71-97) | 69 (61-77) | 72 (65-79) |
| Puntuación de Sgarbossa ≥ 2 | 46 (33-58) | 82 (72-88) | 62 (47-75) | 70 (60-78) | 68 (60-75) |
| Smith I | 63 (50-74) | 90 (82-95) | 80 (66-89) | 79 (70-86) | 79 (72-85) |
| Smith II | 51 (38-63) | 97 (90-99) | 91 (76-97) | 75 (67-82) | 79 (71-85) |
| Smith III | 26 (17-39) | 99 (94-100) | 94 (72-99) | 67 (59-75) | 70 (62-77) |
IC95%: intervalo de confianza del 95%; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
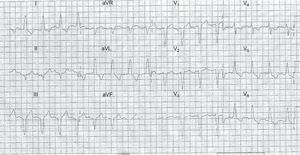
En la figura se muestra un ejemplo de 1 paciente con IAMCEST con reglas de Smith negativas.
DISCUSIÓNHasta donde sabemos, este es el primer estudio en el que se ha intentado evaluar los algoritmos de ECG propuestos por Smith et al.12 en una cohorte de pacientes con BRIHH remitidos para ICPp.
El principal resultado del presente estudio es que, aunque la regla de Smith I mejora significativamente la eficacia diagnóstica de las reglas de Sgarbossa, continúa teniendo una sensibilidad subóptima; actualmente no se puede recomendar como instrumento estándar para el diagnóstico del IAMCEST y establecer la indicación de ICPp.
Diagnóstico de infarto de miocardio en presencia de bloqueo de rama izquierda del haz de His: un rompecabezas interminableLa desviación del segmento ST en los pacientes con BRIHH tiene algunas características típicas: la desviación suele ser opuesta al eje principal del QRS (es decir, discordante) y tiende a ser proporcional al voltaje del QRS. La isquemia aguda se asocia a un aumento de la desviación discordante.
Estas anomalías de la repolarización dificultan el diagnóstico del IAM y, aunque se han propuesto varios criterios electrocardiográficos1–3, ninguno ha mostrado una fiabilidad suficiente para que se pueda recomendar su uso en la práctica clínica. Aunque los criterios de Sgarbossa son un importante avance, tienen la limitación de su baja sensibilidad4,15–21: en un metanálisis se observó una sensibilidad general del 20% para una puntuación de Sgarbossa ≥ 35.
Una de las limitaciones tanto del trabajo original de Sgarbossa como de los estudios de validación posteriores es que utilizaron solo las concentraciones de biomarcadores cardiacos y no la angiografía coronaria para establecer el diagnóstico de IAM.
El estudio de Smith et al.12 fue el primero en evaluar los algoritmos de Sgarbossa en el contexto de la ICPp. Esos autores observaron una sensibilidad del 52% para una puntuación de Sgarbossa ≥ 3 en el diagnóstico de un cuadro clínico equivalente al IAMCEST. En consonancia con lo indicado por estudios previos, el presente estudio ha observado que una puntuación de Sgarbossa ≥ 3 mostraba una especificidad excelente (96%) pero una sensibilidad baja (33%).
Una limitación de las reglas de Sgarbossa podría ser que no tienen en cuenta la proporcionalidad existente entre la desviación concordante del segmento ST y la amplitud del QRS. Los nuevos criterios propuestos por Smith se basan en la proporcionalidad de ST/QRS y, en el artículo original, alcanzaron un rendimiento diagnóstico excelente12.
Lamentablemente, nuestros resultados no confirman las expectativas generadas por el artículo original. Las reglas de Smith aumentaron ciertamente la eficacia diagnóstica de los criterios de Sgarbossa y, de hecho, la regla de Smith I fue la que tuvo la máxima eficiencia (81%) de entre los algoritmos analizados. Los algoritmos de Smith mostraron también una buena especificidad. Sin embargo, continuaron teniendo una sensibilidad subóptima, muy por debajo de la del estudio original (el 67 frente al 91% de la regla de Smith I).
En un reciente estudio de validación de la regla de Smith I22, se observó una sensibilidad del 80%, inferior al valor hallado en la muestra de derivación pero superior a la del presente estudio. Sin embargo, hay algunas diferencias importantes entre el estudio mencionado y el nuestro. El de Meyers et al.22 es un estudio de casos y controles en el que se incluyó también a pacientes sin sospecha de IAM a los que no se había practicado una angiografía coronaria de urgencia inmediata; en cambio, el actual corresponde a un estudio de cohorte de pacientes remitidos para cateterismo urgente, lo cual probablemente sea el contexto ideal para evaluar los criterios diagnósticos para un equivalente de IAMCEST. Además, en el estudio de Meyers et al.22, se incluyó a 2 pacientes en el grupo de IAMCEST a pesar de que no se les había practicado una angiografía coronaria; en el presente estudio se ha puesto de manifiesto que un diagnóstico basado solo en los biomarcadores cardiacos puede llevar a confusión. Por último, ese estudio no fue del todo una validación externa, puesto que los autores incluyeron a pacientes del Minneapolis Heart Institute, como en la comunicación original.
Según nuestros resultados, los algoritmos de Smith pueden ser un instrumento útil pero no son la solución definitiva para el complejo problema del diagnóstico del IAM mediante ECG en pacientes con BRIHH. Además, al utilizar el cociente entre la elevación del segmento ST y la amplitud del QRS con valores de corte de −0,25 y −0,30, estos criterios pueden resultar demasiado complejos para el cálculo, en especial en un contexto de urgencia ante la sospecha de un IAM.
Por último, entre los pacientes con un equivalente de IAMCEST, la positividad de las reglas de Smith no identificó a los de mayor riesgo; de hecho, la gravedad del IAM fue similar en los pacientes con algoritmos de Smith positivos y negativos. Es de destacar que las reglas de Smith no se propusieron inicialmente para identificar a los pacientes con alto riesgo.
Sin embargo, la estrategia de añadir una regla basada en el concepto de la proporcionalidad entre la desviación del segmento ST y la amplitud del QRS mejora el diagnóstico del IAM en presencia de BRIHH y deberá explorarse con mayor detalle.
Revascularización de urgencia inmediata en pacientes con bloqueo de rama izquierda del haz de His y sospecha de infarto agudo de miocardioBasándose en el metanálisis que indicó que la fibrinolisis se asocia a un aumento de la supervivencia de los pacientes con BRIHH o bloqueo de rama derecha del haz de His y sospecha de IAM23, las guías han recomendado tradicionalmente una reperfusión emergente para los pacientes con dolor torácico y BRIHH de nueva aparición o de presunta nueva aparición6,7.
Es de destacar que no se dispone de datos acerca del efecto de la ICPp en pacientes con BRIHH, puesto que se los ha excluido sistemáticamente de los ensayos clínicos sobre ICPp.
Cada vez hay más evidencia de que el BRIHH es una causa importante de activación en falso del laboratorio de cateterismo para una ICPp. De los pacientes con dolor torácico y BRIHH remitidos para una ICPp, solo un 22-26% obtienen realmente un beneficio con la revascularización urgente8–10. A la vista de estos resultados, la guía de 2013 de la American Heart Association11 estableció que el BRIHH no debe considerarse por sí solo diagnóstico de IAM.
En consonancia con lo indicado por estudios previos, en la presente serie, se sometió innecesariamente a angiografía coronaria emergente a casi dos tercios de los pacientes.
La falta de un diagnóstico electrocardiográfico fiable del IAM en presencia de BRIHH es un problema clínico acuciante, puesto que cualquier estrategia que se adopte tiene limitaciones importantes. Tratar la totalidad de estos casos como IAMCEST implica que una mayoría de pacientes sin SCA se verán expuestos innecesariamente a un protocolo costoso y a los riesgos de la fibrinolisis o de una anticoagulación y un tratamiento antiagregante plaquetario agresivo, junto con la angiografía coronaria.
Por otro lado, considerar que el BRIHH no es diagnóstico puede retardar la reperfusión de pacientes que de verdad están sufriendo un IAM. Esto podría resultar especialmente nocivo, puesto que los IAM asociados con un BRIHH de nueva aparición suelen ser graves24,25. Los datos de nuestra población con IAMCEST y BRIHH de nueva aparición cierta o presunta confirman que se trata de un subgrupo con muy alto riesgo.
En ausencia de unos criterios electrocardiográficos fiables, el juicio clínico, los biomarcadores cardiacos y la ecocardiografía pueden resultar de utilidad. Sin embargo, la forma de presentación clínica puede ser atípica y no siempre se dispone de la ecocardiografía in situ en los hospitales secundarios o las ambulancias, que a menudo asumen la responsabilidad de decidir si un paciente necesita una reperfusión urgente.
Los biomarcadores cardiacos tienen también inconvenientes importantes. En primer lugar, transcurre un tiempo entre el inicio de los síntomas y la liberación de los biomarcadores. En segundo lugar, la elevación de los biomarcadores cardiacos puede ser secundaria a otras causas distintas del SCA; además, a pesar de que la elevación se produzca en el contexto de un SCA, no siempre implica que sea necesaria la reperfusión de urgencia inmediatamente. En el presente estudio, de los pacientes sin IAMCEST, el 54% tenía valores anormales de al menos un biomarcador cardiaco.
En resumen, el diagnóstico rápido de un IAM en presencia de BRIHH sigue planteando un verdadero reto. En este contexto, deberá alentarse la búsqueda de nuevos algoritmos basados en el ECG para evitar la aplicación innecesaria de protocolos costosos y tratamientos agresivos a la inmensa mayoría de los pacientes. Al mismo tiempo, los nuevos algoritmos del ECG deberán permitir la reperfusión emergente de un subgrupo de pacientes con alto riesgo.
LimitacionesLa principal limitación del presente estudio es su carácter observacional. Dado que el diagnóstico de IAMCEST se basa en criterios electrocardiográficos7 que no son aplicables a los pacientes con BRIHH, fue preciso definir un equivalente clínico del IAMCEST para los fines del estudio; la definición de un equivalente de IAMCEST tiene limitaciones inherentes. Al igual que Smith et al.12, se intentó superar algunas de estas limitaciones usando parámetros angiográficos y bioquímicos. La elección de estos parámetros se basó tanto en el estudio de Smith et al. como en los datos de estudios amplios que han presentado datos angiográficos y bioquímicos de pacientes con y sin IAMCEST26–30. La oclusión aguda completa de una arteria coronaria debe considerarse un equivalente de IAMCEST. Sin embargo, en especial después de un tratamiento previo con heparina no fraccionada, entre un cuarto y un tercio de los pacientes con IAMCEST tienen una arteria culpable permeable en el momento de realizar la ICPp26,31. En los casos de arteria culpable permeable, los biomarcadores que se asocian claramente al tamaño del infarto26 pueden ser útiles para detectar el SCA con una lesión miocárdica relevante que probablemente se beneficie con la ICPp. En general, el IAMCEST se asocia a una liberación de biomarcadores mayor que la que se da sin IAMCEST, pero existe un considerable solapamiento27. Se observó que usando un cociente entre el valor máximo y el límite superior de la normalidad de cada biomarcador, un 25% de los pacientes con IAMCEST tienen un cociente de troponina I cardiaca < 4527 y un 11% se encuentra en una categoría de troponina cardiaca baja definida por un límite inferior del cociente de troponina cardiaca de 1028. El cociente de la isoenzima MB de la creatincinasa suele ser inferior al cociente de troponina I cardiaca27,29,30 y se observó que el límite superior del primer cuartil del cociente de la isoenzima MB de la creatincinasa en el IAMCEST fue 8 en un estudio previo que incluyó la población más amplia estudiada hasta ahora27.
Smith et al.12 consideraron que podía asumirse razonablemente un diagnóstico de IAMCEST en presencia de una arteria coronaria con una oclusión aguda (flujo TIMI 0-1) o una lesión coronaria no oclusiva aguda junto con un aumento significativo de la troponina I cardiaca. Estos autores establecieron arbitrariamente un valor de corte de 10 ng/ml para las concentraciones máximas de troponina I cardiaca de 24 h como límite relevante para el diagnóstico del IAMCEST. Es de destacar que los diferentes hospitales que participaron en el estudio tenían distintos límites superiores de la normalidad para la troponina I cardiaca (entre 0,1 y 0,6 ng/ml).
Dado que cada uno de los hospitales del presente estudio tenían diferentes valores de referencia de los biomarcadores cardiacos, se consideró que utilizar el cociente entre la determinación del biomarcador y el valor de referencia era un método más estandarizado y reproducible. Además, en su estudio de validación, Meyers et al.22 incluyeron también a pacientes con un cociente de troponina T cardiaca > 10. Los criterios de selección empleados en el presente estudio produjeron una población de pacientes con equivalente clínico de IAMCEST cuyas características bioquímicas y angiográficas eran similares a las de las series publicadas de pacientes con IAMCEST27,28,31 que tenían IAM de alto riesgo. Usando los cocientes de biomarcadores y el valor de corte mencionado, solo 3 pacientes de nuestra población de IAMCEST presentaron un valor absoluto de troponinas T o I por debajo del límite inferior considerado en el estudio de validación por Meyers et al.22; 2 de estos pacientes tuvieron reglas de Smith positivas y, por consiguiente, no puede considerarse que sea la causa de la diferencia descrita en la sensibilidad de las reglas de Smith. Hay varias diferencias en el diseño de estudio entre la presente investigación y la de Smith et al.12. La primera, que es un estudio de cohorte observacional; la segunda, que es un estudio de casos y controles. A la población de control del estudio de Smith no se la remitió necesariamente para ICPp y no siempre se la examinó con coronariografía. En cambio, se remitió para ICPp a todos nuestros pacientes y a todos se les practicó una coronariografía. Smith et al.12 excluyeron a los pacientes con insuficiencia respiratoria, frecuencia cardiaca > 130 lpm, hiperpotasemia o hipertensión grave, mientras que nuestro trabajo corresponde a un estudio de pacientes no seleccionados. Una población de pacientes con BRIHH no seleccionados remitidos para ICPp probablemente sea el contexto más realista en el que pueden identificarse algoritmos de ECG para el diagnóstico del IAMCEST y es ciertamente la población que obtendría más beneficio de la optimización del proceso diagnóstico.
La ICP puede producir un mayor aumento de la liberación de biomarcadores cardiacos que podría haber llevado a una clasificación errónea de algunos pacientes con SCA sin elevación del segmento ST en el grupo de IAMCEST. Sin embargo, dado el bajo número de complicaciones de la intervención que afectaran a las arterias coronarias y los valores muy altos de biomarcadores cardiacos observados en los pacientes con IAMCEST, parece improbable que esta limitación afectara de manera significativa a los resultados del estudio; además, este posible factor de confusión no se tuvo en cuenta en el estudio de Smith.
Una última limitación del estudio es el tamaño muestral relativamente pequeño, debido a la baja prevalencia del BRIHH en los pacientes remitidos para ICPp y a la falta de un ECG inicial en algunos de ellos. Sin embargo, esta limitación es aplicable también a los estudios previos sobre esta cuestión.
CONCLUSIONESEstablecer un diagnóstico electrocardiográfico de IAMCEST en presencia de BRIHH sigue siendo un verdadero reto. Los criterios y los algoritmos de Sgarbossa se asocian a una alta especificidad, pero con baja sensibilidad. Las reglas de Smith representan un importante avance; sin embargo, siguen teniendo la limitación de una sensibilidad subóptima. Deberá alentarse la realización de nuevos estudios para mejorar la eficacia diagnóstica del ECG en este contexto, evitar tratamientos innecesarios y agresivos a una mayoría de pacientes y, al mismo tiempo, proporcionar una reperfusión oportuna al subgrupo con alto riesgo de pacientes con IAMCEST y BRIHH.
CONFLICTO DE INTERESESNinguno.
- –
El diagnóstico de los infartos de miocardio es complejo en presencia de BRIHH.
- –
Los criterios de Sgarbossa se ven limitados por su baja sensibilidad.
- –
Los criterios de Smith parecen prometedores.
- –
Los criterios de Smith obtienen mejores resultados que las reglas de Sgarbossa.
- –
Sin embargo, los criterios de Smith tienen una sensibilidad subóptima.
- –
Los criterios de Smith no identifican a los pacientes con mayor riesgo. Los pacientes con IAM y criterios de Smith negativos con frecuencia sufren IAM muy graves.