Se han elaborado varias puntuaciones clínicas del riesgo para identificar a los pacientes con un riesgo de mortalidad por cualquier causa elevado a pesar del implante de un desfibrilador implantable. El objetivo de este trabajo es examinar y comparar la capacidad predictiva de 4 sistemas de puntuación sencillos (MADIT-II, FADES, PACE y SHOCKED) por lo que respecta a la predicción de la mortalidad tras implante de desfibrilador para la prevención primaria de la muerte súbita cardiaca en un país mediterráneo.
MétodosSe llevó a cabo un estudio multicéntrico retrospectivo en 15 hospitales españoles. Se incluyó a los pacientes consecutivos remitidos para implante de desfibrilador entre enero de 2010 y diciembre de 2011.
ResultadosSe incluyó a 916 pacientes con cardiopatía isquémica o no isquémica (media de edad, 62 ± 11 años; el 81,4% varones). Durante un periodo de 33,4 ± 12,9 meses, fallecieron 113 pacientes (12,3%), el 9,4% (86 pacientes) por causa cardiovascular. A los 12, 24, 36 y 48 meses, la tasa de mortalidad fue del 4,5, el 7,6, el 10,8 y el 12,3% respectivamente. Todas las puntuaciones de riesgo mostraron un aumento escalonado del riesgo de muerte a lo largo de todo el sistema de puntuación de cada una de ellas y las 4 identificaron a los pacientes en mayor riesgo de mortalidad. Las puntuaciones tuvieron asociación significativa con la mortalidad por cualquier causa en todo el periodo de seguimiento. La puntuación PACE fue la que mostró un valor del índice c más bajo, tanto si la población tenía una cardiopatía de origen isquémico (estadístico c = 0,61) como si era de origen no isquémico (estadístico c = 0,61), mientras que la puntuación MADIT-II (estadístico c = 0,67 y 0,65 en la miocardiopatía isquémica y no isquémica respectivamente), las puntuaciones SHOCKED (estadístico c = 0,68 y 0,66 respectivamente) y FADES (estadístico c = 0,66 y 0,60) mostraron unos valores del estadístico c similares (p ≥ 0,09).
ConclusionesEn esta cohorte de pacientes mediterráneos que no formaba parte de un ensayo clínico, las 4 puntuaciones de riesgo evaluadas mostraron un significativo aumento escalonado del riesgo de muerte. De entre las puntuaciones de riesgo existentes, MADIT-II, FADES y SHOCKED aportan un rendimiento ligeramente superior al de la puntuación PACE.
Palabras clave
La prevención de la muerte súbita cardiaca con el uso de desfibrilador automático implantable (DAI) mejora la supervivencia de los pacientes adecuadamente seleccionados1–3. Actualmente, la principal indicación para implante y recambio de un DAI es la prevención primaria4,5. Sin embargo, la mayoría de los pacientes a los que se implanta un DAI nunca llegan a recibir un tratamiento apropiado del dispositivo implantado y tienen un riesgo continuo de sufrir complicaciones, como las descargas inapropiadas y las infecciones5–7. Además, los pacientes con comorbilidades avanzadas a los que se implanta un DAI pueden fallecer por causas distintas de las arritmias ventriculares, como ictus, síndrome coronario agudo, cáncer o insuficiencia cardiaca (IC) progresiva. Por consiguiente, se han elaborado diversas puntuaciones clínicas de riesgo (PR) destinadas a identificar a los pacientes que tienen alto riesgo de muerte por cualquier causa a pesar del implante del DAI, por lo que es muy improbable que se beneficien con el implante de DAI. Algunas de las escalas clínicas más difundidas son las puntuaciones MADIT-II6, SHOCKED8, FADES9 y PACE10. No obstante, estas escalas no se han comparado nunca en una misma cohorte de pacientes, y menos aún en uno de los países mediterráneos, en los que se ha descrito que los resultados son diferentes, con una tasa de mortalidad más baja11. Así pues, actualmente hay cierta incertidumbre respecto a la utilidad clínica y la fiabilidad de los modelos de riesgo disponibles para predecir la mortalidad por cualquier causa de los pacientes de la práctica clínica cotidiana a los que se implanta un DAI para la prevención primaria de la muerte súbita cardiaca.
En este estudio multicéntrico retrospectivo, realizado sin metodología de ensayo clínico, el objetivo es examinar y comparar en una cohorte amplia de pacientes consecutivos la capacidad predictiva de 4 sistemas de puntuación sencillos en la predicción de la mortalidad tras el implante de un DAI en prevención primaria.
MÉTODOSEste estudio retrospectivo multicéntrico se llevó a cabo en 15 centros de España. Aunque el diseño era retrospectivo, todos los profesionales habían obtenido los datos de los pacientes de forma prospectiva. Estos datos incluían los de tipo demográfico, información clínica, datos de intervenciones, complicaciones derivadas de la intervención y seguimiento posterior. En cada uno de los centros, la información se recogió en un formulario estandarizado (se diseñó una base de datos en Access específicamente para este fin). Todas las variables se definieron a priori. En el anexo 1 del material suplementario se presentan las definiciones que se enviaron a los participantes. Con objeto de evitar el sesgo, se pidió a los participantes que incluyeran a todos los pacientes consecutivos remitidos para implante como prevención primaria (implante del DAI entre el 1 de enero de 2010 y el 31 de diciembre de 2011). Se consideró aptos para el estudio a los pacientes a los que se implantó un DAI según lo establecido en las recomendaciones actuales (anexo 2 del material suplementario) para la miocardiopatía isquémica y no isquémica12.
Los criterios de exclusión fueron: pacientes con antecedentes de intervención coronaria percutánea o cirugía de revascularización arterial coronaria en los 3 meses previos al implante del DAI, infarto de miocardio en los 40 días previos al implante del DAI y pacientes sin datos disponibles sobre la supervivencia durante el seguimiento (concretamente, los pacientes perdidos para el seguimiento fueron el 1,4%). Se excluyó también a los pacientes con antecedentes de miocardiopatía hipertrófica, canalopatías, displasia arritmogénica del ventrículo derecho o cardiopatías congénitas.
Definición del objetivo y seguimientoEl objetivo principal de este estudio es la mortalidad por cualquier causa durante el seguimiento. El tiempo de seguimiento de cada individuo se inició en el momento de implantarse el DAI y finalizó en la fecha de la muerte o del último seguimiento disponible. Se obtuvieron datos sobre la supervivencia durante el seguimiento a partir de los registros médicos locales o de atención primaria disponibles en cada centro y, en algunos casos, mediante contacto telefónico con los pacientes.
Se obtuvieron también datos sobre la mortalidad por causas específicas, que se clasificaron como de origen cardiovascular o no cardiovascular. La muerte de causa cardiovascular se definió como la muerte súbita o atribuida a infarto de miocardio, ictus, IC refractaria, accidente cerebrovascular, rotura de aneurisma o enfermedad renovascular (insuficiencia renal sin glomerulopatías u otras alteraciones del parénquima). Las demás causas de muerte se consideraron de origen no cardiovascular.
La muerte súbita se definió como la muerte repentina e inesperada de un paciente que hasta entonces se había considerado estable. Las muertes súbitas podían haber sido presenciadas (con o sin arritmia documentada) o no presenciadas (si el paciente había sido visto en las 24 h previas a la muerte pero sin haber sufrido una IC premonitoria, infarto de miocardio u otra clara causa de la muerte). La IC refractaria se definió como muerte por descompensación de una IC que no había respondido al tratamiento en ausencia de otra causa de muerte. El infarto agudo de miocardio se definió como un infarto que causara complicaciones eléctricas o mecánicas y condujera a una muerte temprana.
Análisis estadísticoLos datos se presentan como media ± desviación estándar los cuantitativos y como frecuencia y porcentaje los cualitativos.
Se calcularon las 4 PR para cada paciente a partir de los valores correspondientes de las variables pronósticas incluidas (tabla 1). Los componentes de cada una de las 4 PR evaluadas se registraron en el momento del ingreso hospitalario para el implante del DAI.
Variables pronósticas utilizadas en las cuatro puntuaciones de riesgo estudiadas y número de pacientes incluidos en cada categoría del presente estudio
| Puntuación | Variables | Categorías | Número de pacientes en cada categoría |
|---|---|---|---|
| MADIT-II | Edad > 70 años Anchura del QRS > 120 ms Presencia de FA NYHA > II BUN > 26 mg/dl | Riesgo bajo: 0 puntos Riesgo intermedio: 1 o 2 puntos Riesgo alto: ≥ 3 puntos | 0: 151 1: 240 2: 195 ≥ 3: 330 Total: 916 |
| SHOCKED | Edad ≥ 75 años (62 puntos) NYHA III (36 puntos) FA (27 puntos) EPOC (62 puntos) Enfermedad renal crónica (100 puntos) FEVI ≤ 20% (28 puntos) Diabetes mellitus (41 puntos) | En esta puntuación, la ecuación del modelo abreviado se presentaba en forma de un nomograma que puede llegar a un máximo de 360 puntos Tasas de mortalidad en función del quintil de riesgo. Sin embargo, en nuestro estudio solamente hubo 3 estratos (< 72; 73–144, y 145–195 puntos, puesto que la gama de valores de la escala SHOCKED en nuestra población fuede 0 a 195 puntos) | 1: 665 2: 231 3: 20 Total: 916 |
| FADES | NYHA ≥ III (1 punto) Edad avanzada: • 65-75 años (0,5 puntos) • Edad ≥ 75 años (2 puntos) Diabetes mellitus (1 punto) FEVI ≤ 25% (1 punto) Antecedentes de tabaquismo (1 punto) | Riesgo bajo: 0-1,5 puntos Riesgo intermedio: 2-2,5 puntos Riesgo alto: 3-5,5 puntos | 0-1,5: 424 2-2,5: 311 3-5,5: 181 Total: 916 |
| PACE | EAP (1 punto) Edad ≥ 70 años (1 punto) Creatinina en suero ≥ 2,0 mg/dl (2 puntos) FEVI ≤ 20% (1 punto) | Riesgo alto: ≥ 3 puntos | 0: 407 1: 364 2: 115 ≥ 3: 30 Total: 916 |
BUN: nitrógeno de urea en sangre; EAP: enfermedad arterial periférica; EPOC: enfermedad pulmonar obstructiva crónica; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; NYHA: New York Heart Association.
Se establecieron las categorías de riesgo para cada puntuación en función de lo observado en estudios publicados con anterioridad6,8–10. Así, la puntuación MADIT-II se clasificó en 4 grupos: 0, 1, 2 y ≥ 3 puntos. La puntuación FADES se clasificó en 3 grupos de riesgo: 0,0-1,5 puntos, 2,0-2,5 puntos y ≥ 3,0 puntos. De modo análogo, la puntuación PACE se dividió en 5 categorías: 0, 1, 2, 3 o ≥ 4 puntos. Por último, aunque el sistema de clasificación SHOCKED se basó inicialmente en quintiles de riesgo (0 a 360 puntos)8, en nuestro estudio hubo tan solo 3 estratos (< 72, 73–144 y 145–195 puntos; el intervalo de valores de la puntuación SHOCKED en nuestro estudio fue de 0 a 195 puntos).
Con objeto de evaluar la influencia de los datos no disponibles, se llevó a cabo un análisis de los datos no disponibles con la prueba MCAR de Little para determinar si la falta de estos valores se distribuía de manera completamente aleatoria.
Se elaboraron curvas de Kaplan-Meier para evaluar la supervivencia de los pacientes según su riesgo de muerte estimado según las PR estudiadas. Se utilizó el log rank test para comparar las distribuciones de supervivencia de las muestras.
Se utilizaron modelos de regresión de riesgos proporcionales de Cox para modelizar la mortalidad a largo plazo como función de las PR. La categoría de referencia en cada una de las 4 puntuaciones fue la más baja (0 para MADIT-II y PACE, < 1,5 para FADES y < 73 puntos para SHOCKED). La buena predicción se determinó mediante la capacidad de discriminación y la calibración (indicadores de rendimiento). Se utilizó la prueba de bondad de ajuste de Grønnesby y Borgan13 para calcular el valor de χ2 (la calibración describe el grado de concordancia numérica de las probabilidades predichas con los resultados reales). Esta prueba se basa en los residuos de tipo «martingala». El concepto en el que se basa esta prueba es dividir las observaciones en grupos en función de sus PR estimadas y comparar la cantidad de episodios observada con la esperada según el modelo dentro de los grupos de PR. Un modelo está bien calibrado cuando los valores predicho y observado concuerdan con cualquier agrupación razonable en la observación (ausencia de diferencias significativas [p > 0,05; cuanto mayor es el valor de p, mejor es la calibración] en la prueba de bondad de ajuste de Gronnesby y Borgan).
La discriminación es la capacidad del modelo para clasificar correctamente a los pacientes en las categorías de riesgo alto y bajo. Para llevar a cabo esta evaluación, se calculó el estadístico c a partir de los modelos de Cox. Los valores del estadístico c calculados a partir de los modelos de Cox se compararon con el método de Hanley-McNeil14.
Todas las comparaciones fueron bilaterales. Se consideró estadísticamente significativo un valor de p < 0,05. Los análisis se llevaron a cabo con el programa informático SPSS v. 19 y el programa STATA 13.0.
RESULTADOSEn total, hubo 916 pacientes con cardiopatías isquémicas o no isquémicas a los que se implantó un DAI con fines de prevención primaria. En la tabla 2 se resumen las características basales de la población estudiada. En nuestra cohorte, la mayoría de los pacientes (media de edad, 62,3 ± 11,0 años) eran varones (81,4%), y la media de la fracción de eyección del ventrículo izquierdo (FEVI) fue del 25,8 ± 7,5%. Utilizaba bloqueadores beta el 86,7% de los pacientes e inhibidores de la enzima de conversión de la angiotensina o antagonistas del receptor de la angiotensina II, el 89,4%. En 6 pacientes (0,65%), la información sobre la supervivencia durante el seguimiento se obtuvo mediante contacto telefónico; en los demás pacientes, la información se obtuvo de los registros clínicos locales. No fue posible calcular las puntuaciones de riesgo de 258 pacientes (el 21% del total de la muestra, n = 1.174) debido a que no se disponía de datos de ciertas variables. Por lo tanto, se excluyó a estos pacientes de los análisis principales. La prueba de Little confirmó que la falta de estos valores era completamente aleatoria (tabla 3).
Características basales de las poblaciones del presente estudio y los estudios MADIT-II, SHOCKED, FADES y PACE
| Cohorte del presente estudio (n = 916) | MADIT-II US8 (n = 1.271) | MADIT-II NON-US12 (n = 549) | SHOCKED9 (n = 17.991) | FADES10 (n = 935) | PACE11 (n = 2.717) | |
|---|---|---|---|---|---|---|
| Edad (años) | 62 ± 11 | 65 ± 11 | 63 ± 10 | 72,5 | 64 ± 10 | 65,6 ± 14,5 |
| Mujeres (%) | 18,9 | 27,0 | 19,0 | 22,5 | 13,0 | 21,7 |
| NYHA III-IV (%) | 41,5 | 6,0 | 19,0 | 40,2 | 49,0 | 26,6 |
| Creatinina (mg/dl) | 1,18 ± 0,6 | 1,1 ± 0,4 | 1,1 ± 0,3 | — | — | 1,26 ± 0,61 |
| ERC (%) | 28,6 | 22,0 | 27,0 | 15,2 | 32,0 | Creatinina > 2 mg/dl en un 6,5% |
| QRS ≥ 120 ms (%) | 32,3 | 62,0 (> 150 ms) | 71,0 (> 150 ms) | 41,0 | 37,0 (> 130 ms) | — |
| FEVI (%) | 25,8 ± 7,5 | 23 ± 5 | < 20% en un 31,6% | 29 ± 11 | 31,1 ± 14,6 | |
| MCI (%) | 52,8 | 100 | 58,5 | 100 | 58,9 | |
| Diabetes mellitus (%) | 36,6 | 33,6 | 33,0 | 33,6 | 25,0 | 35,8 |
| EPOC (%) | 15,1 | — | — | 18,4 | — | |
| EAP (%) | 8,6 | — | — | — | — | 8,9 |
| Seguimiento (años) | 2,8 ± 1,9 | 2,4 ± 1 | 4,4 [4,2-4,6] | 1,8 [0,99-3,62] | 3,10 ± 1,82 | |
| Mortalidad al final del seguimiento | 113 (12,3) | 212 (17,2) | 6.747 (37,5) | 159 (17,0) | 421 (15,5) | |
| Incidencia de mortalidad (cada 100 personas-años) | 4,4 | 6,9 | — | 8,5 | 9,5 | 5 |
EAP: enfermedad arterial periférica; EPOC: enfermedad pulmonar obstructiva crónica; ERC: enfermedad renal crónica; FEVI: fracción de eyección del ventrículo izquierdo; MCI: miocardiopatía isquémica; NYHA: New York Heart Association.
Salvo otra indicación, los valores expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
Diferencias en los datos basales y al ingreso entre la población con falta de datos y la población con todos los datos disponibles
| Con todos los datos (n = 916) | Falta de datos* (n = 258 [21%]) | p | |
|---|---|---|---|
| Edad (años) | 62,3 ± 11,0 | 61,4 ± 11,6 | 0,3 |
| Mujeres (%) | 18,9 | 17,8 | 0,8 |
| NYHA III-IV (%) | 41,5 | 40,8 | 0,9 |
| Creatinina (mg/dl) | 1,18 ± 0,6 | 1,1 ± 0,6 | 0,3 |
| ERC (%) | 28,6 | 28,3 | 1 |
| QRS ≥ 120 ms (%) | 32,3 | 31,6 | 1 |
| FEVI (%) | 25,8 ± 7,5 | 26,2 ± 7,8 | 0,5 |
| MCI (%) | 52,8 | 53,7 | 0,9 |
| Antecedentes de FA (%) | 36,6 | 34,2 | 0,5 |
| Diabetes mellitus (%) | 33,6 | 31,5 | 0,6 |
| EPOC (%) | 15,1 | 13,7 | 0,6 |
| EAP (%) | 8,6 | 6,9 | 0,5 |
| Mortalidad al final del seguimiento (%) | 12,3 | 11,9 | 1 |
EAP: enfermedad arterial periférica; EPOC: enfermedad pulmonar obstructiva crónica; ERC: enfermedad renal crónica; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; MCI: miocardiopatía isquémica; NYHA: New York Heart Association.
Además, en la tabla 2 se muestran también las diferencias basales entre distintas poblaciones (la cohorte de este estudio, las poblaciones de Estados Unidos y de fuera de Estados Unidos del estudio MADIT-II, las poblaciones de SHOCKED, FADES y PACE). De manera resumida, nuestra muestra era la de menor edad de las 5 series, pero era la que tenía el segundo mayor número de pacientes de las clases III–IV de la New York Heart Association, solo por des de la población del estudio FADES. Lo mismo ocurría con la tasa de enfermedad renal crónica. Por último, tenía el segundo mayor número de pacientes con antecedentes de fibrilación auricular y diabetes mellitus.
Durante los 33,4 ± 12,9 meses de seguimiento, fallecieron 113 pacientes (12,3%) y la mortalidad fue de causa cardiovascular en 86 (9,4%). A los 12, 24, 36 y 48 meses, las tasas de mortalidad fueron del 4,5, el 7,6, el 10,8 y el 12,3% respectivamente.
Un total de 247 pacientes (27%) recibieron una terapia apropiada del DAI a causa de al menos 1 episodio de taquicardia ventricular o fibrilación ventricular (estimulación antitaquicárdica en 101 pacientes, descarga de alta energía en 71 y estimulación antitaquicárdica más descarga de alta energía en los 86 restantes). Un total de 104 pacientes (8,85%) recibieron descargas inapropiadas del DAI principalmente por arritmias auriculares (n = 80, 76,9%).
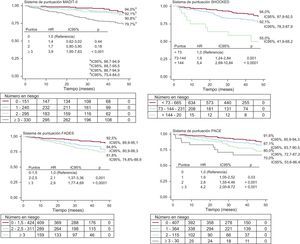
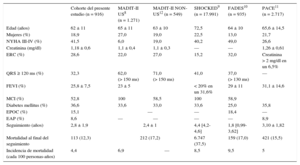
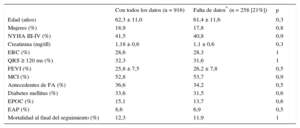
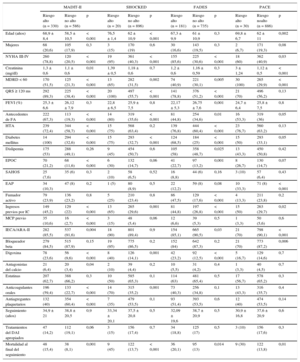
Las medias de las puntuaciones MADIT-II, SHOCKED, PACE y FADES fueron 1,96 ± 1,3 puntos, 54,8 ± 41,3 puntos, 0,76 ± 0,8 puntos y 1,8 ± 1,0 puntos respectivamente. Todas las PR mostraron un aumento escalonado del riesgo de muerte a todo lo largo del sistema de puntuación, en cada una de las 4 puntuaciones evaluadas en el estudio (figura). Además, tal como se muestra en la figura, las 4 PR diferenciaron de manera satisfactoria a los pacientes que se encontraban en las categorías de riesgo alto y todas, excepto la MADIT-II, identificaron a los clasificados en riesgo intermedio. En la tabla 4 se muestran las características demográficas y los parámetros de valoración de los pacientes de alto y de bajo riesgo según las 4 PR.
Características demográficas y parámetros de valoración de los pacientes de alto riesgo en comparación con los de riesgo no alto según las cuatro puntuaciones de riesgo evaluadas
| MADIT-II | SHOCKED | FADES | PACE | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Riesgo alto (n = 330) | Riesgo no alto (n = 586) | p | Riesgo alto (n = 20) | Riesgo no alto (n = 896) | p | Riesgo alto (n = 181) | Riesgo no alto (n = 735) | p | Riesgo alto (n = 30) | Riesgo noalto (n = 886) | p | |
| Edad (años) | 68,9 ± 8,4 | 58,5 ± 10,5 | < 0,001 | 76,5 ± 1,4 | 62 ± 10,9 | < 0,001 | 67,3 ± 9,9 | 61 ± 10,9 | 0,3 | 69,8 ± 6,7 | 62 ± 11 | 0,002 |
| Mujeres | 68 (20,6) | 105 (17,9) | 0,3 | 3 (15) | 170 (19) | 0,6 | 30 (16,6) | 143 (19,5) | 0,3 | 2 (6,7) | 171 (19,3) | 0,08 |
| NYHA III-IV | 260 (78,8) | 120 (20,5) | < 0,001 | 19 (95) | 361 (40,3) | < 0,001 | 155 (85,6) | 225 (30,6) | < 0,001 | 18 (60) | 362 (40,9) | 0,03 |
| Creatinina (mg/dl) | 1,3 ± 0,6 | 1,1 ± 0,6 | 0,01 | 1,39 ± 0,5 | 1,18 ± 0,6 | 0,7 | 1,2 ± 0,6 | 1,16 ± 0,59 | 0,3 | 3 ± 1,24 | 1,12 ± 0,5 | < 0,001 |
| MDRD < 60 | 170 (51,5) | 125 (21,3) | < 0,001 | 13 (65) | 282 (31,5) | 0,002 | 74 (40,9) | 221 (30,1) | 0,005 | 30 (100) | 265 (29,9) | < 0,001 |
| QRS ≥ 120 ms | 292 (89,3) | 225 (38,4) | < 0,001 | 20 (100) | 497 (55,7) | < 0,001 | 141 (78,8) | 376 (51,2) | < 0,001 | 21 (70) | 496 (56,2) | 0,13 |
| FEVI (%) | 25,3 ± 6,6 | 26,12 ± 7,9 | 0,3 | 22,8 ± 6,5 | 25,9 ± 7,5 | 0,8 | 22,17 ± 5,3 | 26,75 ± 7,6 | 0,001 | 24,7 ± 6,4 | 25,8 ± 7,5 | 0,8 |
| Antecedentes de FA | 222 (67,3) | 113 (19,3) | < 0,001 | 14 (80) | 319 (35,6) | < 0,001 | 81 (44,8) | 254 (34,6) | 0,01 | 16 (53,3) | 319 (36) | 0,05 |
| HTA | 239 (72,4) | 344 (58,7) | < 0,001 | 15 (75) | 568 (63,4) | 0,2 | 139 (76,8) | 444 (60,4) | < 0,001 | 23 (76,7) | 560 (63,2) | 0,13 |
| Diabetes mellitus | 14 (100) | 294 (32,6) | < 0,001 | 15 (75) | 293 (32,7) | < 0,001 | 124 (68,5) | 184 (25) | < 0,001 | 15 (50) | 293 (33,1) | 0,05 |
| Dislipemia | 175 (53) | 288 (49,1) | 0,26 | 9 (45) | 454 (50,7) | 0,6 | 105 (58) | 358 (48,7) | 0,025 | 13 (43,3) | 450 (50,8) | 0,42 |
| EPOC | 70 (21,2) | 68 (11,6) | < 0,001 | 6 (30) | 132 (14,7) | 0,06 | 41 (22,7) | 97 (13,2) | 0,001 | 8 (26,7) | 130 (14,7) | 0,07 |
| SAHOS | 25 (7,6) | 35 (6) | 0,3 | 2 (10) | 58 (6,5) | 0,52 | 16 (8,8) | 44 (6) | 0,16 | 3 (10) | 57 (6,4) | 0,43 |
| EAP | 34 (10,3) | 47 (8) | 0,2 | 1 (5) | 80 (8,9) | 0,5 | 22 (12,2) | 59 (8) | 0,08 | 10 (33,3) | 71 (8) | < 0,001 |
| Fumador activo | 79 (23,9) | 136 (23,2) | 0,8 | 5 (25) | 210 (23,4) | 0,8 | 86 (47,5) | 129 (17,6) | < 0,001 | 4 (13,3) | 211 (23,8) | 0,2 |
| Ingresos previos por IC | 149 (45,2) | 129 (22) | < 0,001 | 13 (65) | 265 (29,6) | 0,001 | 81 (44,8) | 197 (26,8) | < 0,001 | 15 (50) | 263 (29,7) | 0,02 |
| MCP previo | 35 (10,6) | 16 (2,7) | < 0,001 | 3 (15) | 48 (5,4) | 0,06 | 12 (6,6) | 39 (5,3) | 0,5 | 1 (3,3) | 50 (5,6) | 0,6 |
| IECA/ARA-II | 282 (85,5) | 537 (91,6) | 0,004 | 18 (90) | 801 (89,4) | 0,9 | 154 (85,1) | 665 (90,5) | 0,03 | 21 (70) | 798 (90,1) | < 0,001 |
| Bloqueador beta | 279 (84,5) | 515 (87,9) | 0,15 | 19 (95) | 775 (86,5) | 0,2 | 152 (84) | 642 (87,3) | 0,2 | 21 (70) | 773 (87,2) | 0,006 |
| Digoxina | 78 (23,6) | 56 (9,6) | < 0,001 | 8 (40) | 126 (14,1) | 0,001 | 42 (23,2) | 92 (12,5) | < 0,001 | 5 (16,7) | 129 (14,6) | 0,7 |
| Antagonistas del calcio | 21 (6,4) | 20 (3,4) | 0,04 | 2 (10) | 39 (4,4) | 0,2 | 10 (5,5) | 31 (4,2) | 0,4 | 1 (3,3) | 40 (4,5) | 0,7 |
| Estatinas | 207 (62,7) | 388 (66,2) | 0,3 | 10 (50) | 585 (65,3) | 0,1 | 114 (63) | 481 (65,4) | 0,5 | 17 (56,7) | 578 (65,2) | 0,3 |
| Anticoagulantes orales | 196 (59,4) | 133 (22,7) | < 0,001 | 14 (70) | 315 (35,2) | 0,001 | 73 (40,3) | 256 (34,8) | 0,1 | 13 (43,3) | 316 (35,7) | 0,4 |
| Antiagregantes plaquetarios | 132 (40) | 354 (60,4) | < 0,001 | 7 (35) | 479 (53,5) | 0,1 | 93 (51,4) | 393 (53,5) | 0,6 | 12 (40) | 474 (53,5) | 0,14 |
| Seguimiento (años) | 34,9 ± 21 | 38,8 ± 20,5 | 0,9 | 33,34 ± 20,1 | 37,5 ± 20,8 | 0,5 | 32,09 ± 19,6 | 38,7 ± 20,9 | 0,5 | 30,9 ± 16,8 | 37,6 ± 20,9 | 0,6 |
| Tratamientos del DAI apropiados | 47 (14,2) | 112 (19,1) | 0,06 | 3 (15) | 156 (17,4) | 0,7 | 34 (18,8) | 125 (17) | 0,5 | 3 (10) | 156 (17,6) | 0,3 |
| Mortalidad al final del seguimiento | 48 (15,4) | 38 (8,1) | 0,001 | 9 (45) | 122 (13,7) | < 0,001 | 36 (20,1) | 95 (13) | 0,014 | 9 (30) | 122 (13,8) | 0,01 |
ARA-II: antagonistas de los receptores de la angiotensina II; DAI: desfibrilador automático implantable; EAP: enfermedad arterial periférica; EPOC: enfermedad pulmonar obstructiva crónica; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; HTA: hipertensión arterial; IC: insuficiencia cardiaca; IECA: inhibidores de la enzima de conversión de la angiotensina; MCP: marcapasos; MDRD: Modification of Diet in Renal Disease; NYHA: New York Heart Association; SAHOS: síndrome de apneas-hipopneas obstructivas del sueño.
Los valores expresan n (%) o media ± desviación estándar.
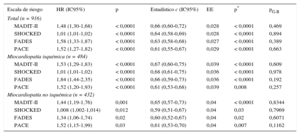
Todas las PR, como variables continuas, mostraron una asociación significativa con la mortalidad por cualquier causa durante todo el seguimiento (tabla 5). La capacidad de discriminación de las 4 puntuaciones se muestra en la tabla 5. Todas ellas mostraron un valor del estadístico c moderado, pero su rendimiento fue superior al del simple azar por lo que respecta a la predicción de muerte. La puntuación PACE fue la que mostró un valor más bajo del índice c (0,611) tanto si la población tenía cardiopatía isquémica (c = 0,61) como no isquémica (c = 0,61), mientras que las puntuaciones MADIT-II (c = 0,66 en general; c = 0,67 y c = 0,65 en la cardiopatía isquémica y no isquémica respectivamente), SHOCKED (c = 0,64 total; c = 0,68 y c = 0,59) y FADES (c = 0,63 total; c = 0,66 y c = 0,60) presentaron un estadístico c similar (p ≥ 0,09), con independencia de que se tratara de cardiopatía isquémica o no isquémica.
Capacidad de discriminación y de calibración de cada una de las cuatro puntuaciones de riesgo en estudio
| Escala de riesgo | HR (IC95%) | p | Estadístico c (IC95%) | EE | p* | pG-B |
|---|---|---|---|---|---|---|
| Total (n = 916) | ||||||
| MADIT-II | 1,48 (1,30-1,68) | < 0,0001 | 0,66 (0,60-0,72) | 0,028 | < 0,0001 | 0,469 |
| SHOCKED | 1,01 (1,01-1,02) | < 0,0001 | 0,64 (0,58-0,69) | 0,028 | < 0,0001 | 0,894 |
| FADES | 1,58 (1,33-1,87) | < 0,0001 | 0,63 (0,58-0,68) | 0,027 | < 0,0001 | 0,389 |
| PACE | 1,52 (1,27-1,82) | < 0,0001 | 0,61 (0,55-0,67) | 0,029 | < 0,0001 | 0,663 |
| Miocardiopatía isquémica (n = 484) | ||||||
| MADIT-II | 1,53 (1,29-1,83) | < 0,0001 | 0,67 (0,60-0,75) | 0,039 | < 0,0001 | 0,609 |
| SHOCKED | 1,01 (1,01-1,02) | < 0,0001 | 0,68 (0,61-0,75) | 0,036 | < 0,0001 | 0,978 |
| FADES | 1,84 (1,44-2,35) | < 0,0001 | 0,66 (0,59-0,73) | 0,036 | < 0,0001 | 0,192 |
| PACE | 1,52 (1,20-1,93) | < 0,0001 | 0,61 (0,53-0,68) | 0,039 | 0,008 | 0,257 |
| Miocardiopatía no isquémica (n = 432) | ||||||
| MADIT-II | 1,44 (1,19-1,76) | 0,001 | 0,65 (0,57-0,73) | 0,04 | < 0,0001 | 0,8344 |
| SHOCKED | 1,008 (1,002-1,014) | 0,012 | 0,59 (0,51-0,67) | 0,04 | 0,03 | 0,7969 |
| FADES | 1,34 (1,06-1,74) | 0,02 | 0,60 (0,52-0,67) | 0,04 | 0,02 | 0,6071 |
| PACE | 1,52 (1,15-1,99) | 0,03 | 0,61 (0,53-0,70) | 0,04 | 0,007 | 0,1162 |
EE: error estandarizado; G-B: prueba de Grønnesby y Borgan; HR: hazard ratio; IC95%: intervalo de confianza del 95%.
La significación en las pruebas de Hanly-McNeil realizadas fue p ≥ 0,16 para la comparación por pares con el estadístico c.
La calibración de todas las puntuaciones fue aceptable, ya que en la prueba de Grønnesby y Borgan se obtuvo p ≥ 0,19.
DISCUSIÓNEn esta cohorte amplia, que no correspondía a un ensayo clínico, de pacientes mediterráneos con DAI en prevención primaria de muerte súbita cardiaca, las PR clínicas generadas a partir de análisis post hoc de los ensayos clínicos MADIT-II6, SHOCKED8, FADES9 y PACE10 mostraron un significativo aumento escalonado del riesgo de muerte a lo largo de todo su sistema de puntuación. Además, las 4 PR identificaron de manera aceptable el grupo de riesgo alto (de muerte por cualquier causa) durante todo el seguimiento, tal como indica la asociación significativa entre las puntuaciones y la mortalidad por lo que respecta a la hazard ratio. Además, las puntuaciones MADIT-II, FADES y SHOCKED mostraron una capacidad discriminatoria aceptable por lo que respecta a los valores del estadístico c; la puntuación MADIT-II fue la mejor en los pacientes con y sin miocardiopatía isquémica, mientras que la puntuación PACE mostró una capacidad de discriminación ligeramente menor en ambos grupos. La probabilidad estimada de muerte durante el seguimiento mostró una buena calibración en esta cohorte.
En nuestro conocimiento, este es el primer estudio que compara diferentes PR contemporáneas en cuanto a la predicción de la mortalidad por cualquier causa de pacientes a los que se ha implantado un DAI con una indicación de prevención primaria. Hasta la fecha hay pocos estudios que hayan evaluado la validez externa de la puntuación MADIT-II en un conjunto de datos de pacientes independiente15,16. Sin embargo, hasta ahora ningún estudio ha comparado estos 4 modelos de PR directamente unos con otros para identificar el sistema de puntuación más exacto para perfeccionar la predicción del riesgo en el contexto del implante de un DAI.
Motivación del presente estudioLa mayor parte de los ensayos clínicos aleatorizados han puesto de manifiesto una reducción de la mortalidad asociada al uso de DAI en los pacientes con deterioro de la FEVI15–18. Además, se han hecho múltiples intentos de perfeccionar la estratificación del riesgo para un uso óptimo del tratamiento con DAI empleando algoritmos clínicos. No obstante, no se ha realizado nunca una comparación de estos diferentes modelos en una misma cohorte. Además, los modelos no han sido validados en un país mediterráneo, donde estudios previos han mostrado diferencias respecto a otras regiones del mundo. De hecho, en el ensayo MADIT-II, los pacientes de fuera de Estados Unidos presentaron diferencias significativas en sus características basales respecto a las de los pacientes de Estados Unidos, entre ellas una mayor frecuencia de bloqueo de rama izquierda del haz de His, una clase funcional por IC más avanzada más de 3 meses antes de la inclusión y mayores volúmenes cardiacos basales11. Por otra parte, durante el seguimiento, un análisis de subgrupos mostró un efecto más pronunciado del DAI con terapia de resincronización cardiaca en las mujeres del grupo de Estados Unidos, incluida una reducción significativa del 71% (p = 0,02) del riesgo de muerte, mientras que el tratamiento mediante DAI con terapia de resincronización cardiaca se asoció a un beneficio clínico significativo solo en los varones del grupo de fuera de Estados Unidos. Es importante señalar que se ha demostrado que la dieta mediterránea, de alta prevalencia en la población española en comparación con la de Estados Unidos, reduce no solo los factores de riesgo cardiovascular, sino también la incidencia de ictus19, lo cual podría dar lugar a resultados clínicos diferentes que en la población de Estados Unidos.
Tasa de supervivencia de los pacientes de alto riesgoTal como se había postulado, la tasa de incidencia de muerte (cada 100 personas-años) en la presente cohorte mediterránea es la más baja de las observadas en las diversas poblaciones evaluadas aquí (tabla 3). Además, se observaron también diferencias en la tasa de mortalidad entre las denominadas categorías de alto riesgo (tabla 4). En el estudio MADIT-II6, los pacientes que se encontraban en la categoría de riesgo muy alto presentaron una tasa de mortalidad por cualquier causa a 2 años del 50%. En nuestra muestra, los pacientes que cumplían el criterio de clasificación en el grupo de riesgo alto según este modelo mostraron una mortalidad por cualquier causa a 2 años del 20%. En el modelo del estudio SHOCKED, el 20% de los pacientes incluidos en el grupo de riesgo más alto presentaron una mortalidad a 2 años de casi un 40%. Lo mismo se observó en nuestro grupo de pacientes clasificados como de riesgo alto según este modelo (40%). En el estudio FADES original, en los grupos de riesgo previamente definidos, la incidencia acumulada de muerte sin DAI previo fue del 16% al cabo de 3 meses y de alrededor del 25% en la categoría de riesgo alto en comparación con el 46% observado en nuestros pacientes con 3 pos del algoritmo propuesto. Por último, el modelo PACE presentó una mortalidad por cualquier causa a 1 año del 16,5% en sus categorías de riesgo muy alto, lo cual concuerda con el 16,6% hallado aquí entre los pacientes con puntuación ≥ 3.
Capacidad de discriminaciónLas 4 PR permitieron identificar satisfactoriamente a los pacientes con mayor mortalidad en una cohorte de DAI para prevención primaria que no procedía de un ensayo clínico, y el mejor índice c para la predicción de la mortalidad en la población general (c = 0,66; intervalo de confianza del 95% [IC95%], 0,60-0,72) correspondió a la puntuación MADIT-II (c = 0,64; IC95%, 0,58-0,69). En nuestra muestra, al analizar las curvas de supervivencia según el sistema de puntuación derivado de las escalas de los estudios MADIT-II, SHOCKED y FADES, puede inferirse que las curvas de supervivencia de cada uno de los grupos de riesgo divergen rápidamente, lo cual apunta a buena capacidad de predicción de cada uno de estos sistemas en los pacientes clasificados según su riesgo basal de muerte. Sin embargo, el sistema de puntuación del estudio SHOCKED identificó mejor el riesgo de muerte de los pacientes ya estaban clasificados como de riesgo alto (hazard ratio = 5,4; IC95%, 2,69-10,84; p < 0,0001) (figura) y MADIT-II fue la peor de las 4 PR en la clasificación del subgrupo de pacientes de riesgo intermedio.
En general, la razón de que las puntuaciones MADIT-II, SHOCKED y FADES obtuvieran mejores resultados que la escala PACE podría explicarse por la composición y la ponderación de las diversas variables incluidas en cada una de las PR mencionadas. Este último esquema está formado por 4 variables clínicas, 3 de las cuales (edad, función renal y FEVI) se incluyen en los otros 3 algoritmos, pero incorpora también una cuarta variable (enfermedad arterial periférica) que los esquemas previos no tenían en cuenta. Otra diferencia podría tener su origen en el valor de corte elegido para la edad. Mientras que la puntuación PACE diferencia exclusivamente entre pacientes de edad ≥ 70 años, los modelos SHOCKED y FADES discriminan entre intervalos (tabla 1).
Trascendencia clínicaEstas observaciones tienen consecuencias importantes para los sistemas de asistencia sanitaria y para los pacientes. Proporcionan instrumentos cuantitativos y son fáciles de aplicar para evaluar el riesgo de muerte en una variedad de pacientes más amplia y con una capacidad de discriminación aceptable. Aportan un método práctico y sencillo para determinar la probabilidad de supervivencia específica de cada paciente a la cabecera del enfermo. Debe señalarse que, si bien estas 4 PR difieren en cierta medida en la población estudiada y los métodos de validación empleados, tienen en común el objetivo principal y hasta ahora no se habían examinado en un conjunto de pacientes independiente. Además, este estudio presenta las tasas de episodios clínicos observados en una muestra contemporánea de pacientes de un país mediterráneo.
En consecuencia, en nuestra opinión, el presente estudio aporta información adicional para asesorar a los pacientes que son aptos para DAI en prevención primaria, es decir, la decisión de implantar un DAI a pacientes con múltiples comorbilidades debe sopesarse teniendo en cuenta el considerable riesgo de muerte debido, entre otras cosas, a las comorbilidades que se reflejan en las puntuaciones comentadas aquí. No obstante, se hallaron algunas diferencias en las tasas de mortalidad observadas entre nuestro estudio y la población del ensayo MADIT-II, y este es el motivo de que, aunque pueda aportar orientación en casos individuales de alto riesgo, la decisión de implantar un DAI no debe basarse únicamente en eso. Barsheshet et al18 señalaron que los pacientes clasificados como de alto riesgo (según la PR del MADIT-II) podrían no obtener un beneficio de supervivencia con el implante de un DAI. Sin embargo, a la vista de los resultados del presente estudio, la exclusión de los pacientes basada únicamente en una puntuación alta no puede generalizarse de manera categórica.
LimitacionesEs importante señalar que el objetivo de este estudio es evaluar el riesgo de muerte por cualquier causa en pacientes a los que se implantó un DAI como prevención primaria. Aunque el estudio no es un ensayo clínico aleatorizado con un grupo de placebo para la comparación, este análisis incluyó un número de pacientes muy grande, lo cual permitió analizar más detalladamente un mayor número de factores clínicos para la predicción de la mala supervivencia al poco tiempo de implantarse un DAI.
El estudio tiene varias limitaciones que es preciso comentar. En primer lugar, su diseño retrospectivo aumenta el riesgo de sesgo y presencia de factores de confusión. Sin embargo, se incluyó a los pacientes consecutivos a los que se trató en nuestros centros con implante de DAI en prevención primaria, y el seguimiento de los dispositivos se llevó a cabo mediante un protocolo uniforme.
No se observaron diferencias estadísticamente significativas en los valores del estadístico c entre las PR estudiadas, lo que puede atribuirse al tamaño muestral relativamente bajo, la falta de homogeneidad o el escaso número de eventos registrados durante el seguimiento. Por lo tanto, estas conclusiones deben interpretarse como hipótesis y requieren más evaluación en estudios clínicos amplios.
Las PR MADIT-II y FADES se desarrollaron para estratificar el riesgo de muerte de pacientes que habían sufrido un infarto de miocardio. Aunque nuestros resultados se validaron en ambos subgrupos, es preciso tener precaución al aplicar estas PR a pacientes con miocardiopatía no isquémica portadores de un DAI. Es importante señalar que, como ya se ha indicado, se excluyó de nuestro análisis a los pacientes con antecedentes de miocardiopatía hipertrófica, canalopatías o displasia arritmogénica del ventrículo derecho; en consecuencia, estos resultados no deben generalizarse a dichos subgrupos.
También tiene importancia que estas puntuaciones se elaboraran para predecir la mortalidad y no la aplicación de terapias de los DAI, puesto que ello constituye el riesgo en competencia más importante para un efecto beneficioso del tratamiento con los dispositivos. De igual modo, las terapias de los DAI probablemente no se desencadenen por los factores utilizados en las puntuaciones estudiadas aquí, sino por la miocardiopatía subyacente (la cicatriz, el potencial de isquemia).
Se incluyó únicamente variables evaluadas en el momento de implantar el DAI y, por consiguiente, no se tuvo en cuenta los factores de riesgo que pudieran haberse instaurado a lo largo del tiempo; sin embargo, el objetivo de la evaluación del riesgo es evaluar el pronóstico en función de los parámetros basales.
Por último, no se pudo calcular las PR de los 258 pacientes de la cohorte inicial debido a la falta de datos en el momento de realizar el implante. No obstante, aunque este hecho teóricamente podría conducir a un sesgo de selección, el análisis de los datos no disponibles ha revelado que la falta de valores era completamente aleatoria.
CONCLUSIONESEn esta amplia cohorte no procedente de un ensayo clínico, formada por pacientes mediterráneos con implante de DAI en prevención primaria, las 4 PR evaluadas mostraron un significativo aumento escalonado en el riesgo de muerte. Además, de entre las PR actualmente existentes para predecir la mortalidad por cualquier causa, las escalas MADIT-II, FADES y SHOCKED aportan un rendimiento ligeramente mejor que la puntuación PACE.
CONFLICTO DE INTERESESE. Abu-Assi y M.A. Arias son Editores Asociados de Revista Española de Cardiología.
– La mayoría de los pacientes a los que se implanta un DAI están sujetos a los riesgos y las complicaciones del implante del DAI, pero en ningún momento sufren terapias apropiadas por una arritmia ventricular. Por consiguiente, se han elaborado puntuaciones de riesgo para identificar a los pacientes con un riesgo muy bajo de intervención del DAI o, por el contrario, con un riesgo muy alto de mortalidad por cualquier causa que, por lo tanto, es muy improbable que se beneficien con el implante de un DAI. No hay comparaciones sistemáticas de las escalas y, hasta la fecha, tan solo la puntuación MADIT se ha validado en una cohorte externa.
¿QUÉ APORTA DE NUEVO?– Se llevó a cabo una comparación directa de las 4 escalas de riesgo principales en una cohorte de pacientes externa. Todas las puntuaciones produjeron una capacidad de discriminación aceptable y mostraron buena correlación con la incidencia de mortalidad. Por primera vez se ha evaluado este resultado en una cohorte mediterránea, y se ha observado la incidencia de mortalidad más baja de todas las poblaciones estudiadas. En consecuencia, la exclusión de pacientes a causa de una puntuación alta no es totalmente generalizable, pero puede aportar orientación para pacientes concretos de alto riesgo.
Este trabajo no habría sido posible sin la inestimable colaboración de los médicos que participaron en el estudio que se presenta. El gran número de participantes no permite el reconocimiento individual que desearíamos y todos los participantes merecen. Por último, los autores dan las gracias al Dr. Jan Steffel por su ayuda en la revisión y la corrección de este artículo.
Luis González-Torres (Hospital Universitario Virgen Macarena, Sevilla); José Antonio Iglesias-Bravo (Hospital Fundación Jiménez Díaz, Madrid); Hugo Arguedas-Jiménez (Clínica Universidad de Navarra, Pamplona); Cristina González-Cambeiro y José Ramón González-Juanatey (Hospital Universitario Santiago de Compostela, Santiago de Compostela); Jesús Jiménez-López (Hospital Virgen de la Salud, Toledo); Oscar Salvador-Montañés (Hospital Universitario La Paz, Madrid); José Moreno-Arribas (Hospital Universitario San Juan, Sant Joan d’Alacant, Alicante); Agustín Fernández-Cisnal y Luis Tercedor-Sánchez (Hospital Virgen de las Nieves, Granada); Juan José Olalla Antolín (Hospital Marqués de Valdecilla, Santander); Ricardo Ruiz-Granell (Hospital Clínico Universitario de Valencia, Valencia); Larraitz Gaztañaga y José Ormaetxe (Hospital Universitario de Basurto, Bilbao); Pilar Cabanas-Grandío y Enrique García (Hospital Universitario de Vigo, Vigo); José Olagüe de Ros (Hospital Universitario La Fe, Valencia) y Alonso Pedrote-Martínez (Hospital Virgen del Rocío, Sevilla).