Hay pocos datos sobre la evaluación morfológica y funcional seriada del tratamiento con balón recubierto de paclitaxel mediante coronariografía, tomografía de coherencia óptica y reserva fraccional de flujo.
MétodosEn este estudio observacional, prospectivo y realizado en un solo centro, se trató a pacientes con lesiones de novo mediante balón recubierto de paclitaxel. Se realizaron mediciones en serie mediante coronariografía, tomografía de coherencia óptica y reserva fraccional de flujo antes y después de una angioplastia clásica con balón simple, así como a los 9 meses de seguimiento.
ResultadosEn este estudio participaron 20 pacientes (21 lesiones). El diámetro vascular de referencia era 2,68±0,34 mm y la pérdida luminal tardía, 0,01±0,21 mm. Las medianas de los cambios en el área luminal mínima entre la situación previa a la angioplastia clásica con balón simple y la situación posterior, y entre esta y el seguimiento aumentaron el 75,2% (intervalo intercuartílico, [37,2-164,7%] y el 50,0% [1,1-64,5%]) respectivamente. Se observaron disecciones de la íntima en todas las imágenes de tomografía de coherencia óptica tomadas tras la intervención; el 66,6% de ellas estaban selladas en las imágenes obtenidas en el seguimiento (mediana, 278 días). La reserva fraccional de flujo distal a la lesión de interés fue de 0,71±0,14 antes de la dilatación, 0,87±0,04 tras la dilatación y 0,83±0,08 en el seguimiento.
ConclusionesEl balón recubierto de paclitaxel restablece el flujo coronario modificando las placas ateromatosas, lo que causa un aumento del área luminal mínima. A los 9 meses de seguimiento, el flujo coronario era continuo y persistía la permeabilidad luminal, resultado de suprimir la progresión de la estenosis luminal producida por los efectos localizados del fármaco en las lesiones coronarias de novo.
Palabras clave
La colocación de stents ha mejorado de forma relevante la revascularización coronaria por vía percutánea durante las últimas 3 décadas. Aunque el uso de stents farmacoactivos (SFA) ha conllevado una disminución de las tasas de reestenosis del stent, la terapia con SFA se ve limitada por una cicatrización retardada, una mala aposición de aparición tardía y neoateroesclerosis, lo que lleva al aumento del riesgo de trombosis tardía del stent y reestenosis tardía1–3. Además, un vaso con andamiaje previene el agrandamiento tardío de la luz y la ventajosa remodelación vascular4. La liberación localizada de fármacos no basada en stents mediante balón recubierto de paclitaxel (BRP) ha resultado ser una nueva alternativa de tratamiento clínico que mantiene las propiedades antiproliferativas de los SFA5. Los resultados de un estudio reciente sobre el tratamiento de lesiones de novo en vasos de pequeño calibre utilizando solo BRP en pacientes no seleccionados mostraron tasas reducidas de revascularización de la lesión de interés y complicaciones cardiovasculares graves. El BRP se propuso como tratamiento alternativo a los SFA en vasos pequeños, con diámetros de referencia pequeños (≥ 2,0 y ≤ 2,75 mm)6. Aunque se ha señalado la efectividad angiográfica y clínica del BRP en lesiones de novo, no se ha descrito por completo su mecanismo de acción exacto. Hay pocos datos sobre los cambios intravasculares funcionales y morfológicos inducidos por el BRP con el paso del tiempo en las lesiones de novo. Por lo tanto, el objetivo de nuestro estudio es comprender mejor la respuesta al tratamiento de las lesiones de novo con BRP, poniendo especial énfasis en los mecanismos a corto y medio plazo. Para ello, se tomaron mediciones angiográficas seriadas de la reserva fraccional de flujo (RFF) y de tomografía de coherencia óptica (OCT) antes de la intervención, inmediatamente después y a los 9 meses de seguimiento de lesiones de novo tratadas con BRP.
MÉTODOSEste estudio tiene como objetivo evaluar los cambios morfológicos y funcionales inducidos por los BRP en lesiones coronarias de novo y se llevó a cabo como subestudio con OCT de un registro unicéntrico prospectivo7. El estudio fue aprobado por el Comité de Ética del Hospital Universitario de Ulsan y todos los participantes firmaron el consentimiento informado.
Selección de pacientesSe consideró aptos para el estudio a los pacientes con angina de pecho estable o inestable para los que estaba prevista una intervención coronaria percutánea programada. Debían presentar isquemia documentada. Las lesiones con un diámetro vascular de referencia de entre 2,5 y 3,5mm y una longitud ≤ 24mm se consideraron elegibles para la inclusión en este estudio. Los criterios de exclusión fueron: insuficiencia cardiaca (con fracción de eyección del ventrículo izquierdo<30%), infarto agudo de miocardio con diagnóstico de elevación de la troponina T, lesión del tronco común, lesión ostial (imposible de evaluar con OCT), lesiones muy calcificadas o trombóticas, esperanza de vida<1 año e insuficiencia renal conocida (creatinina>2 mg/dl).
Procedimiento de la intervención y adquisición y análisis de datos de tomografía de coherencia óptica y reserva fraccional de flujoTodos los pacientes recibieron dosis de carga de 200mg de ácido acetilsalicílico y 300-600mg de clopidogrel antes de la intervención; también se inyectó por vía intravenosa heparina no fraccionada 100 U/kg para mantener el tiempo de coagulación activado ≥ 250 s durante el procedimiento. Para preparar la lesión, se realizó una predilatación con un balón de tamaño optimizado mediante angiografía (relación balón/vaso, 1,0), de menor longitud que la prevista para el BRP, usando la presión teórica de inflado. El cardiólogo intervencionista encargado de la intervención decidió aplicar el BRP con base en la RFF medida tras la angioplastia clásica con balón simple (POBA)7. Con guía angiográfica, se colocó lo más rápido posible el BRP (SeQuent Please, B. Braun; Melsungen, Alemania), de un tamaño cuya relación balón/vaso era 1,0, y se infló durante 60 s a la presión teórica. Durante el procedimiento se utilizaron inhibidores de la glucoproteína IIb/IIIa, a criterio del hemodinamista.
Un investigador independiente, a quien se ocultaron los datos clínicos obtenidos antes de la POBA, tras la aplicación del BRP y tras 9 meses de seguimiento, analizó las angiografías coronarias mediante el Cardiovascular Angiography Analysis System (CAAS 5.10, Pie Medical Imaging B.V.; Maastricht, Países Bajos).
Se obtuvieron imágenes por OCT antes del procedimiento, tras la POBA (justo antes de la aplicación del BRP) y a los 9 meses de seguimiento a criterio del hemodinamista. Se utilizó una OCT de dominio de Fourier (C7XR, LightLab Imaging, Inc.; Westford, Massachusetts, Estados Unidos) con la técnica no oclusiva. Se avanzó el catéter distalmente respecto a la lesión sobre una guía convencional de 0,014”, y las imágenes se adquirieron con un pullback motorizado a 20 mm/s durante la inyección continua de 20 ml de medio de contraste. Un investigador totalmente independiente (J.N. No) realizó un análisis offline de las imágenes de OCT mediante un software registrado (LLI). Tras la calibración (z-offset), se analizó 1 de cada 5 secciones y se descartaron las imágenes con una rama lateral interpuesta.
La RFF se midió antes y después de la POBA (antes de la aplicación del BRP) y a los 9 meses de seguimiento, pero no se determinó en el caso de las lesiones subocluidas (99% de estenosis) sin una indicación clínica. Después de la inyección intracoronaria de 200 μg de nitroglicerina, se midió la RFF usando una guía coronaria de presión de 0,014” (PressureWire Certus, St. Jude Medical Systems; Uppsala, Suecia), ubicada distal a la lesión en condiciones de hiperemia inducida mediante la infusión de adenosina intravenosa (140-180 μg/kg/min).
Seguimiento y resultados clínicosSe programó un seguimiento clínico y angiográfico a los 9 meses para todos los pacientes. Se analizaron los datos angiográficos, las imágenes de OCT y las medidas de la RFF seriados. Los resultados clínicos se definieron según los criterios del Academic Research Consortium8. La reestenosis, como variable binaria, se definió como una estenosis angiográfica ≥ 50% del diámetro en el seguimiento. La pérdida luminal tardía se definió como la diferencia de diámetro luminal mínimo entre las imágenes tomadas tras el procedimiento y las obtenidas en el seguimiento en el mismo segmento (intrasegmentaria). Un comité de eventos clínicos validó todos los resultados.
Análisis estadísticoEl análisis estadístico se realizó con SPSS 18.0 (SPSS Inc.; Chicago, Illinois, Estados Unidos). Las variables continuas se presentan como media±desviación estándar o mediana [intervalo intercuartílico]. Se compararon entre 2 grupos usando la prueba de la t de Student para datos emparejados o la prueba del orden con signo de Wilcoxon, según correspondiera. Las variables cualitativas se presentan como números absolutos y porcentajes y se compararon mediante la prueba de la χ2 o la prueba exacta de Fischer, según correspondiera. Se consideró estadísticamente significativo un valor de p bilateral<0,05.
RESULTADOSCaracterísticas de los pacientes y los procedimientosEntre junio de 2012 y junio de 2013, se incluyó en este estudio a 20 pacientes (21 lesiones) con imágenes de OCT tras la POBA y a los 9 meses de seguimiento (figura 1). En la tabla 1 se muestran las características clínicas basales y del procedimiento.
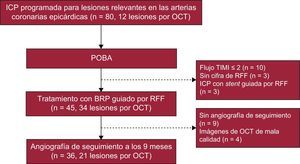
Diagrama de flujo de la aplicación de un BRP. Los cirujanos decidieron si implantar BRP o stent en función de la RFF tras una POBA. En este subestudio con OCT, se incluyeron 21 lesiones tratadas con BRP de un total de 45. BRP: balón recubierto de paclitaxel; ICP: intervención coronaria percutánea; OCT: tomografía de coherencia óptica; POBA: angioplastia clásica con balón simple; RFF: reserva fraccional de flujo; TIMI: Thrombolysis In Myocardial Infarction.
Características basales (n=20)
| Edad (años) | 58,6±6,6 |
| Varones | 13 (65,0) |
| Factores de riesgo cardiovascular | |
| Diabetes mellitus | 4 (20,0) |
| Hipertensión | 11 (55,0) |
| Fumador actual | 7 (35,0) |
| Hipercolesterolemia | 9 (45,0) |
| Antecedentes familiares de coronariopatía | 4 (20,0) |
| Manifestación clínica | |
| Angina estable | 11 (55,0) |
| Angina inestable | 9 (45,0) |
| Datos angiográficos (n = 21) | |
| Vaso sanguíneo | |
| DA | 15 (71,4) |
| CX | 2 (9,5) |
| CD | 4 (19,0) |
| Tipo de lesión (B2 y C) | 14 (66,6) |
| Angioplastia clásica con balón simple (n=21) | |
| Diámetro del balón (mm) | 3,06±0,29 |
| Presión del balón inflado (atm) | 11,2±2,2 |
| Tamaño del balón inflado (mm) | 3,09±0,23 |
| BRP (n = 21) | |
| Diámetro del BRP (mm) | 3,11±0,28 |
| Longitud del BRP (mm) | 22,7±4,4 |
| Presión del BRP inflado (atm) | 9,5±2,0 |
| Tamaño del BRP inflado (mm) | 3,22±0,29 |
BRP: balón recubierto de paclitaxel; CD: coronaria derecha; CX: circunfleja; DA: descendente anterior.
Los valores se presentan como n (%) o media±desviación estándar.
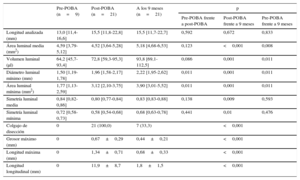
Los datos del análisis angiográfico de comparación cualitativa, las cifras de RFF y los resultados clínicos se presentan en la tabla 2. Se llevó a cabo seguimiento angiográfico en todos los pacientes. El diámetro vascular de referencia era 2,68±0,34 mm. La pérdida luminal tardía y la ganancia neta de las lesiones fueron 0,01±0,21 y 0,95±0,51 mm respectivamente. El diámetro luminal mínimo no mostró diferencia alguna entre el valor obtenido tras la aplicación del BRP y el obtenido a los 9 meses de seguimiento (2,16±0,27 frente a 2,14±0,35 mm; p=0,761). No se produjeron reestenosis angiográficas ni eventos clínicos adversos, excepto 1 caso de revascularización de una lesión que no era de interés.
Coronariografía cuantitativa y mediciones funcionales seriadas
| Pre-POBA (n=21) | Post-POBA (n=21) | A los 9 meses (n=21) | p | |||
|---|---|---|---|---|---|---|
| Pre-POBA frente a post-POBA | Post-POBA frente a 9 meses | Pre-POBA frente a 9 meses | ||||
| ACC | ||||||
| Diámetro de referencia (mm) | 2,68±0,34 | 2,83±0,34 | 2,75±0,33 | 0,005 | 0,003 | 0,131 |
| Diámetro luminal mínimo (mm) | 1,19±0,43 | 2,16±0,27 | 2,14±0,35 | <0,001 | 0,761 | <0,001 |
| Estenosis por diámetro (%) | 55,9±13,4 | 23,3±8,7 | 22,0±10,2 | <0,001 | 0,442 | <0,001 |
| Longitud de la lesión (mm) | 21,6±5,4 | 22,4±5,2 | 21,5±4,8 | 0,105 | 0,025 | 0,833 |
| Ganancia aguda (mm) | 0,97±0,44 | |||||
| Pérdida luminal tardía (mm) | 0,01±0,21 | |||||
| Ganancia neta (mm) | 0,95±0,51 | |||||
| Reestenosis binaria | 0 | |||||
| RFF | 0,71±0,14 | 0,87±0,04 | 0,83±0,08 | <0,001 | 0,329 | <0,001 |
POBA: angioplastia clásica con balón simple; ACC: análisis coronario cuantitativo; RFF: reserva fraccional de flujo.
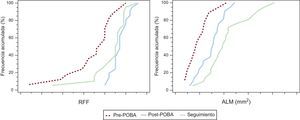
Cuatro vasos presentaron suboclusión (el 99% de estenosis); no se midió la RFF en estos vasos. Tras la angioplastia con balón, se midió el flujo coronario restablecido y se obtuvo un valor de RFF de 0,87±0,04 para todas las lesiones incluidas en el estudio. A los 9 meses de seguimiento, el flujo coronario restablecido se mantuvo sin que la cifra de RFF presentara una disminución significativa (0,83±0,08). En la tabla 2 y la figura 2 se muestran los valores seriados de la RFF.
Curvas de distribución acumulada. Se presentan cifras de RFF y ALM seriadas. La RFF post-POBA no fue significativamente distinta de la obtenida en el seguimiento a los 9 meses. Se produjo un aumento significativo del ALM desde el post-POBA hasta el seguimiento a los 9 meses. ALM: área luminal mínima; POBA: angioplastia clásica con balón simple; RFF: reserva fraccional de flujo.
No se consiguieron imágenes de OCT pre-POBA de 12 de las lesiones debido a la imposibilidad de atravesarlas con el catéter de OCT o por falta de llenado con el contraste mediante el catéter de OCT en el caso de las oclusiones totales. Sin embargo, se adquirieron 21 imágenes de OCT post-POBA y de seguimiento. En las tablas 3 y 4 se presentan los resultados de las OCT seriadas y los cambios porcentuales. El área y el volumen luminales medios medidos por OCT aumentaron significativamente desde el post-POBA hasta el seguimiento (área, 4,52 frente a 5,18mm2; p<0,001; volumen, 72,8 frente a 93,8 ml; p=0,001). El diámetro y el área luminales mínimos se incrementaron significativamente tras la POBA (1,5 frente a 1,96 mm; p=0,001; 1,77 frente a 3,12 mm2; p=0,001), y aumentaron aún más a los 9 meses (1,96 frente a 2,22 mm; p=0,011; 3,12 frente a 3,90 mm2; p=0,011). Las simetrías luminales media y mínima no variaron desde el post-POBA hasta el seguimiento a los 9 meses, posiblemente debido al sellado de las disecciones de la placa ateromatosa. Las medianas de los cambios porcentuales de las áreas luminales mínimas entre pre-POBA y post-POBA, así como entre esta y el seguimiento, mostraron un aumento del 75,2% [37,2-164,7%] y el 50,0% [1,1-64,5%] respectivamente. Las disecciones post-POBA se habían sellado en 14 lesiones (66,7%) a los 9 meses de seguimiento y se produjo una disminución del tamaño de los colgajos disecados (tabla 3). El grosor (0,67±0,29 frente a 0,44±0,21 mm; p=0,001) y la longitud (1,34±0,71 frente a 0,68±0,33 mm; p<0,001) máximos de los colgajos disecados residuales en las imágenes de corte transversal disminuyeron significativamente (figura 3). La longitud de los colgajos disecados en las imágenes de corte longitudinal también se redujo significativamente (11,9±8,7 frente a 1,8±1,5 mm; p<0,001). No hubo complicaciones debidas a estos procedimientos.
Análisis de las tomografías de coherencia óptica seriadas
| Pre-POBA (n=9) | Post-POBA (n=21) | A los 9 meses (n=21) | p | |||
|---|---|---|---|---|---|---|
| Pre-POBA frente a post-POBA | Post-POBA frente a 9 meses | Pre-POBA frente a 9 meses | ||||
| Longitud analizada (mm) | 13,0 [11,4-16,6] | 15,5 [11,8-22,8] | 15,5 [11,7-22,7] | 0,592 | 0,672 | 0,833 |
| Área luminal media (mm2) | 4,59 [3,79-5,12] | 4,52 [3,64-5,28] | 5,18 [4,68-6,53] | 0,123 | <0,001 | 0,008 |
| Volumen luminal (μl) | 64,2 [45,7-93,4] | 72,8 [59,3-95,3] | 93,8 [69,1-112,5] | 0,086 | 0,001 | 0,011 |
| Diámetro luminal mínimo (mm) | 1,50 [1,19-1,78] | 1,96 [1,58-2,17] | 2,22 [1,95-2,62] | 0,011 | 0,001 | 0,011 |
| Área luminal mínima (mm2) | 1,77 [1,13-2,59] | 3,12 [2,10-3,75] | 3,90 [3,01-5,52] | 0,011 | 0,001 | 0,011 |
| Simetría luminal media | 0,84 [0,82-0,86] | 0,80 [0,77-0,84] | 0,83 [0,83-0,88] | 0,138 | 0,009 | 0,593 |
| Simetría luminal mínima | 0,72 [0,58-0,73] | 0,58 [0,54-0,68] | 0,68 [0,63-0,78] | 0,441 | 0,01 | 0,476 |
| Colgajo de disección | 0 | 21 (100,0) | 7 (33,3) | <0,001 | ||
| Grosor máximo (mm) | 0 | 0,67±0,29 | 0,44±0,21 | <0,001 | ||
| Longitud máxima (mm) | 0 | 1,34±0,71 | 0,68±0,33 | <0,001 | ||
| Longitud longitudinal (mm) | 0 | 11,9±8,7 | 1,8±1,5 | <0,001 | ||
POBA: angioplastia clásica con balón simple.
Los valores expresan mediana [intervalo intercuartílico], n (%) o media±desviación estándar.
La simetría luminal se encuentra entre 0 y 1. Un valor de 1 significa simetría total; la simetría disminuye al reducirse el valor.
Cambios porcentuales del análisis coronario cuantitativo, la tomografía de coherencia óptica y la reserva fraccional de flujo
| Pre-POBA frente a post-POBA | Post-POBA frente a 9 meses | Pre-POBA frente a 9 meses | |
|---|---|---|---|
| ACC | |||
| Pacientes | 21 | 21 | 21 |
| Cambio en el diámetro luminal mínimo (%) | 75 [55,3 a 142,2] | 1,3 [–7,4 a 4,2] | 79,6 [44,3 a 159,6] |
| Cambio en la estenosis por diámetro (%) | –65,3 [–70,2 a –42,6] | –2,9 [–25,3 a 15,6] | –62,0 [76,4 a –37,1] |
| OCT | |||
| Pacientes | 9 | 21 | 21 |
| Cambio en el área luminal mínima (%) | 75,2 [37,2 a 164,7] | 50,0 [1,1 a 64,5] | 123,7 [56,5 a 276,9] |
| Cambio en el área luminal media (%) | 6,0 [0,5 a 22,5] | 22,8 [5,4 a 39,1] | 31,7 [18,7 a 41,0] |
| RFF | |||
| Pacientes | 17 | 21 | 21 |
| Cambio en la RFF (%) | 11,3 [5,5 a 21,7] | –1,7 [–10,3 a 2,1] | 7,5 [–0,6 a 22,3] |
OCT: tomografía de coherencia óptica; POBA: angioplastia clásica con balón simple; ACC: análisis coronario cuantitativo; RFF: reserva fraccional de flujo.
Los valores expresan mediana [intervalo intercuartílico].
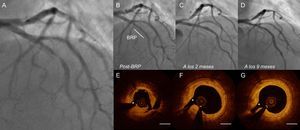
Caso representativo de tratamiento con BRP. Mujer de 67 años con angina inestable y oclusión casi total de la arteria coronaria descendente anterior izquierda (A). Se le aplicó un BRP SeQuent Please de 3,0/20 mm (B. Braun; Melsungen, Alemania). Después del tratamiento, la arteria mostró estenosis residual mínima y una disección de tipo A no limitadora del flujo. Se realizaron coronariografías tras la angioplastia con balón (B), a los 2 meses debido a molestias torácicas atípicas (C) y en el seguimiento a los 9 meses (D). Después de la angioplastia con balón, la OCT reveló un lumen relativamente bien expandido, aunque se produjo rotura de la placa (E). A los 2 meses, la OCT presentaba una luz de mayor tamaño; ya no se apreciaba el colgajo disecado (F). A los 9 meses, la luz se mostraba bien preservada y el área de la placa rota estaba completamente cicatrizada (G). BRP: balón recubierto de paclitaxel; OCT: tomografía de coherencia óptica. *Rama septal pequeña. Barra = 1 mm.
Este estudio observacional prospectivo muestra que la estrategia de dilatación con balón seguida de BRP para el tratamiento de las lesiones coronarias de novo restablece y mantiene el flujo coronario por medio de un efecto mecánico a corto plazo y un efecto farmacológico continuo. En el aspecto mecánico, la angioplastia con balón dilata el lumen y a la vez comprime y diseca la placa de ateroma. Esto conduce a un aumento absoluto del área luminal mínima, de modo que ya no se genera isquemia. La angioplastia con balón simple originalmente surgió como terapia de revascularización que restituye el flujo coronario modificando intencionadamente la placa ateromatosa9. Sin embargo, tenía limitaciones importantes, como la retracción elástica y la reestenosis10. Por el contrario, el BRP se desarrolló para la administración de una dosis única de paclitaxel durante el periodo de 1 min de inflado del balón, probado en un ensayo preclínico5. Dado que los efectos principales del BRP dependen de la rápida transferencia del agente antiproliferativo a la pared vascular, se adoptó el paclitaxel para usarlo en balones recubiertos de fármaco con índices de retención tisular prolongada11. El paclitaxel ejerce efectos antiproliferativos potentes mediante la unión a la subunidad de tubulina, lo que da lugar a la interrupción de la función de los microtúbulos y, consecuentemente, a la antiproliferación prolongada12. Como resultado, el paclitaxel puede inhibir la proliferación y la migración de las células del músculo liso arterial tras su uso local13. En varios ensayos clínicos aleatorizados se han mostrado mejores resultados angiográficos del tratamiento con BRP no solo en cuanto a las reestenosis del stent en comparación con la angioplastia con balón simple14 o el SFA15, sino también en la microangiopatía respecto al SFA16. Los principales procesos fisiopatológicos de la reestenosis tras una angioplastia con balón son la remodelación arterial y la hiperplasia de la íntima17. Un estudio reciente ha mostrado que el tratamiento satisfactorio con BRP de lesiones coronarias de novo después de predilatar conlleva un aumento luminal tardío4. Señalaron que, mediante liberación local de un fármaco en la pared vascular, era posible conseguir efectos positivos de reducción de la hiperplasia de la íntima e incluso de aumento del lumen vascular. Recientemente, demostramos con ecocardiografía intravascular que el tratamiento de las lesiones de novo con BRP aumenta las áreas vascular y luminal y reduce la masa de las placas ateromatosas tras 9 meses (en prensa), lo que indica que se evitó la constricción arterial con el paclitaxel.
En este estudio, el área luminal había crecido tras 9 meses; esto apunta a que, con el uso de un recubrimiento de paclitaxel, se impidieron tanto la hiperplasia de la íntima como la constricción arterial. El mecanismo de supresión de la progresión de las placas ateromatosas o la remodelación vascular asociado a la liberación local de paclitaxel es un mecanismo posible. Hay estudios con animales de experimentación que han puesto de manifiesto que el paclitaxel causa apoptosis y necrosis de las células endoteliales y del músculo liso18. Se obtuvieron datos de OCT que mostraron una regresión del volumen de la íntima en las lesiones de reestenosis del stent, lo que puede explicarse por mecanismos citotóxicos19. Además, es posible que el proceso de cicatrización de las disecciones de la íntima causadas por la angioplastia con balón se resuelva con la reducción del tejido de la íntima, sin proliferación recurrente adicional por la actividad citostática del paclitaxel20. Como consecuencia, el paclitaxel puede inhibir la proliferación y la migración de las células del músculo liso tras su uso local, lo que lleva a la permeabilidad coronaria. Los resultados de este estudio indican que el agrandamiento luminal se obtuvo principalmente durante el periodo de seguimiento a medio plazo.
En las adquisiciones de OCT post-POBA, se observaron disecciones extensas de la íntima en todas las lesiones tratadas con BRP. No todas las disecciones se trataron con stents debido a los buenos resultados angiográficos y las cifras de RFF aceptables (> 0,8). Dos tercios de las disecciones habían cicatrizado en el momento del seguimiento, lo que dio lugar a una mejora de la simetría luminal. Tras el sellado y la disminución de tamaño de las disecciones, el valor de la RFF obtenido en el seguimiento a los 9 meses no mostró ningún cambio significativo respecto al valor post-POBA.
LimitacionesEn primer lugar, es posible que se haya producido un sesgo de selección en determinados casos. Además, no se consideró elegibles para la inclusión a los pacientes con síndrome coronario agudo persistente, debido a la naturaleza compleja del estudio (es decir, RFF y OCT antes y después de la intervención). Por lo tanto, solo se incorporó al estudio a los pacientes programados. En segundo lugar, aunque los resultados clínicos y angiográficos son prometedores, la índole de este registro, en el que se aplicó el BRP de manera selectiva según la RFF medida tras la POBA, no permite la comparación con una técnica de referencia. Sin embargo, este estudio podría reforzar los resultados de estudios previos con BRP. En tercer lugar, el número de pacientes incluidos es relativamente bajo. Solo se consiguió obtener los cambios seriados en las imágenes de OCT, incluidos los datos de las lesiones antes de la dilatación, de 9 lesiones. En cuarto lugar, la adquisición mediante OCT se realizó tras la POBA (justo antes de la aplicación del BRP) y el tamaño del BRP inflado era considerablemente mayor que el del balón inflado. En consecuencia, el BRP podría haber añadido modificaciones a la lesión predilatada no presentes en las imágenes de OCT adquiridas. No obstante, en este estudio se han utilizado técnicas muy sensibles que permiten la evaluación exacta de los mecanismos a corto y medio plazo implicados en el restablecimiento y el mantenimiento del flujo coronario. Además, el tratamiento usado en este estudio no se dirigió a todas las lesiones de una coronariopatía y, por lo tanto, los resultados no se pueden trasladar a pacientes que no cumplan los criterios de inclusión o que se encuentren fuera del ámbito de aplicación del protocolo del estudio.
CONCLUSIONESEl BRP restablece el flujo coronario modificando las placas ateromatosas, lo que causa un aumento del área luminal mínima. Al realizar un seguimiento seriado a medio plazo con RFF y OCT, se observó que el flujo coronario se mantenía, el tamaño luminal aumentaba y los vasos estaban cicatrizados en las lesiones coronarias de novo tratadas con BRP. Se requieren estudios adicionales para generalizar estos datos.
CONFLICTO DE INTERESESNinguno.
- –
El BRP aporta unos resultados angiográficos mejores que el SFA en las microangiopatías. No obstante, los cambios funcionales y morfológicos inducidos con el tiempo por los BRP no se han estudiado en profundidad en las lesiones coronarias de novo.
- –
En determinadas lesiones seleccionadas para el tratamiento con BRP, el flujo coronario se mantiene mediante el aumento de tamaño de la luz vascular; además, tras la angioplastia con balón, disminuyen o se sellan las disecciones a medio plazo. Es necesario investigar más para confirmar estos hallazgos.
Los autores desean agradecer al personal técnico y de enfermería del Departamento de Cardiología del Hospital Universitario de Ulsan por su colaboración; especialmente a Jeom-Nam No, que ha contribuido al éxito de la implementación del programa y la realización del estudio.