El aumento de la grasa epicárdica (GE) es un nuevo factor de riesgo de enfermedad coronaria (EC). El estudio se propone profundizar en el papel de la GE como marcador de EC centrándose en su espesor, el perfil de expresión de los microARN (miARN) y los factores que podrían influir en ello.
MétodosSe recogieron prospectivamente 155 autopsias de víctimas de muerte súbita cardiaca por EC y 84 de controles con muerte súbita no debida a EC. En un subgrupo se analizaron el espesor de la GE y su patrón de expresión de miARN.
ResultadosEl grosor de GE estaba incrementado y brindaba buena precisión para discriminar a los pacientes (entre otras mediciones, área bajo la curva de la puntuación de GE, 0,718; p < 0,001). La GE de los pacientes presentó 14 miARN suprarregulados y 14 infrarregulados, y se validaron por reacción en cadena de la polimerasa en tiempo real miR-34a-3p, -34a-5p, -124-3p, -125a-5p, 628-5p, -1303 y -4286. Las proporciones de miR-34a-3p y -34a-5p en la GE de los pacientes fueron mayores que en los controles (con progresión entre la GE de coronarias sin estenosis, con estenosis estables y con placas complicadas) y solo se correlacionaron con la edad en los controles. La discreta correlación del miR-34a-5p en el hígado y la GE de los pacientes (r = 0,295; p = 0,020) aumentó llamativamente al considerar exclusivamente la GE de placas complicadas (r = 0,799; p = 0,017). Se observaron correlaciones similares con la proteína C reactiva ultrasensible y el miR-34a-5p en las muestras de GE e hígado.
ConclusionesEl patrón de expresión de miARN en la GE de la EC típicamente muestra un aumento de miR-34a-3p y -34a-5p que es independiente de la edad, el grosor de la GE, las mediciones antropométricas y la presencia de lesiones coronarias subyacentes.
Palabras clave
La muerte súbita cardiaca (MSC) es la principal causa de muerte súbita no traumática inesperada en los adultos de los países occidentales. Con frecuencia es la primera manifestación de la enfermedad cardiovascular1, con una incidencia estimada de 1,40-6,68/100.000 habitantes/año1. La enfermedad coronaria (EC) es la causa de mayor prevalencia en los países industrializados, y supone del 60 al 80% del total de casos de MSC2,3.
Recientemente se ha propuesto el empleo del grosor de la grasa epicárdica (GE) como nuevo factor de riesgo cardiovascular4–6. Se considera que se trata de grasa parda/beis y muestra una especial actividad transcriptómica, que incluye la expresión de adipocinas proinflamatorias y antifibrinolíticas7–10. Está situada entre el miocardio y el pericardio visceral, y se concentra principalmente a lo largo de las principales arterias coronarias. Así pues, su estrecha relación espacial con estas estructuras es el fundamento que permite sospechar que, por vía paracrina o vasocrina, la GE podría fomentar la EC y posiblemente su desestabilización11.
Otras grasas ectópicas, como las asociadas con la enfermedad de hígado graso no alcohólico (EHGNA), se han asociado también con factores de riesgo cardiovascular, EC y eventos cardiovasculares12–15. Es de destacar que la EHGNA se ha asociado con el grosor de la GE16,17 y la EC17, pero es poco lo que se sabe acerca de los mecanismos subyacentes, que continúan siendo independientes de los factores de riesgo cardiovascular, incluido el síndrome metabólico17.
Los micro-ARN (miARN) son pequeños ARN sin función de codificación de proteínas que se expresan ampliamente en tejidos sanos y enfermos. Pueden desempeñar un papel clave como efectores de vías desreguladas (que pueden ser dianas terapéuticas) y también como biomarcadores útiles. Algunos de ellos se han relacionado con la dislipemia18,19, la adipogénesis20,21, la EHGNA (en especial el miR-34a22,23) y una amplia variedad de trastornos cardiacos24. Recientemente, en 2 artículos se ha descrito una firma proinflamatoria de miARN que afecta a la vía de señalización de la insulina en la GE de pacientes con EC25,26. Aunque presentaron datos de gran valor y muy novedosos, hay determinados aspectos que continúan inexplorados. Uno de ellos es la variabilidad de la expresión del miARN de la GE en función de la presencia y la estabilidad de las placas ateroescleróticas. Otro ejemplo es la posibilidad de que el aumento del grosor de la GE pueda explicar el aumento de los miARN en los pacientes con EC. Este estudio tiene como objetivo responder a estas incógnitas para caracterizar mejor la distribución y el espesor de la GE y su perfil de expresión de miARN como marcador de la EC en las víctimas de MSC. Primero, formaron el grupo no solo pacientes con lesiones coronarias estables, sino también pacientes con lesiones inestables. Segundo, además de los análisis de los miARN, se realizaron mediciones sistemáticas de la GE para determinar su correlación con la EC y la cantidad de miARN. Tercero, se estudiaron los perfiles de expresión de miARN de la GE en función de la presencia o ausencia de una estenosis subyacente significativa. Cuarto, se estudió la relación entre el miR-34a-5p de la GE y el hígado. Por último, el tamaño muestral de este estudio fue como mínimo del doble de pacientes que el de los estudios previos25,26.
MÉTODOSGrupos clínicosEntre 2008 y 2013 se incluyeron prospectivamente 155 casos de MSC debida a EC (MSC-EC, pacientes) y 84 de muerte súbita (MS) inesperada no debida a una EC (MS-no-EC, controles) con pruebas de toxicología negativas. La definición de la MS se atuvo a lo establecido en las recomendaciones internacionales1. En las autopsias de MSC por EC, se identificó como mínimo 1 estenosis coronaria significativa (> 75%) o placas complicadas (con erosión, rotura, trombosis o hemorragia intraplaca) o signos histológicos agudos o ya cicatrizados de infartos de miocardio27. Los controles con MS-no-EC fueron 38 casos de MS no cardiaca y 46 de MSC no isquémica (miocarditis y miocardiopatías primarias). La información clínica premortem, las circunstancias de la muerte, los datos de la autopsia como el índice de masa corporal, el perímetro abdominal, exploración cardiaca y hepática y los análisis toxicológicos ordinarios se atuvieron a lo establecido en la vigente guía27.
El protocolo del estudio cumplió las normas éticas de la Declaración de Helsinki de 1975 y fue aprobado por el comité de investigación humana del centro. Los pacientes y los controles habían fallecido en el momento de la inclusión en el estudio y todas las muestras biológicas analizadas se habían obtenido en la autopsia forense exigida por la legislación española en casos de MS inesperada fuera del hospital. Por consiguiente, no se obtuvo un consentimiento informado por escrito.
Parámetros analíticosSiempre que fue posible, se determinaron los parámetros analíticos en sangre periférica obtenida post mortem. Las concentraciones de colesterol total, triglicéridos y GGT se determinaron con métodos enzimáticos y el colesterol unido a lipoproteínas de alta densidad, con métodos directos (Architect 16000, Abbott Diagnostic). Cuando los triglicéridos eran < 300 mg/dl, el colesterol unido a lipoproteínas de baja densidad se calculó con la fórmula de Friedewald. El colesterol unido a lipoproteínas de muy baja densidad se obtuvo a partir de triglicéridos / 5. Los valores de lipoproteína(a) y apolipoproteínas A y B se determinaron por nefelometría cinética (Immage Nephelometer, Beckman Coulter Inc.; Brea, California, Estados Unidos) y la proteína C reactiva de alta sensibilidad se determinó con métodos de turbidimetría cinética (Immage Nephelometer).
Grosor de la grasa epicárdicaDurante el examen macroscópico del corazón, se realizaron cortes transversales cada 0,5cm, empezando en el ápex cardiaco, siempre en paralelo a los surcos auriculoventriculares, con objeto de registrar el grosor máximo de la GE en cada lugar (figura 1 del material suplementario). Se designó como puntuación de GE la suma total de los grosores de la GE de cada individuo, y se consideró que ello constituía una estimación de la cantidad total de GE presente en el corazón.
Obtención de muestras de tejido para los análisis de miARNSe obtuvieron muestras de GE de los pacientes, principalmente de las arterias coronarias con una estenosis significativa, algunas de la proximidad de placas complicadas y algunas de arterias coronarias sin estenosis, mientras que las muestras de GE de los controles procedieron siempre de arterias coronarias sin estenosis. Las muestras se lavaron de inmediato con solución salina tamponada con fosfato fría, con objeto de eliminar la contaminación de sangre, y se conservaron luego en ARN (Ambion; Austin, Texas, Estados Unidos) a –20°C hasta el momento de su estudio. Se obtuvieron muestras de hígado en fresco y se procesaron según lo descrito anteriormente15.
Extracción del ARNSe extrajo el ARN total de la GE con el kit de aislamiento de miARN mirVana-Paris (Ambion), según el protocolo del fabricante. La concentración de ARN y su pureza se determinaron con un espectrofotómetro NanoDrop ND-1000 (Nanodrop Technologies; Wilmington, Delaware, Estados Unidos). La calidad del ARN para los array de expresión de miARN se evaluó con el Agilent Bioanalyzer 2100 (Agilent Technologies; Santa Clara, California, Estados Unidos).
Perfiles de expresión de miARNEl ARN para los análisis de microarray incluyó 3 muestras de GE de los controles (concretamente, 1 muestra de la GE próxima a la arteria descendente anterior izquierda sana de cada control) y 3 muestras de GE de los pacientes (de arterias coronarias con una estenosis estable significativa, en concreto 2 de la arteria descendente anterior izquierda y 1 de la arteria coronaria derecha). Los análisis se realizaron en el Servicio de Array del centro (Instituto de Investigación Sanitaria La Fe, Valencia, España) con el Array GeneChip miRNA 3.0 (Affymetrix; Santa Clara, California, Estados Unidos), que contiene sondas de 1.733 miARN humanos maduros (miRBase versión 17).
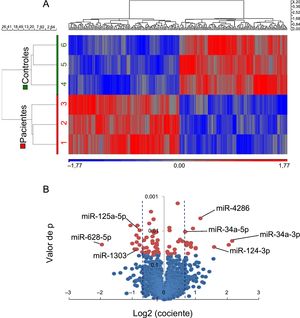
Los datos se analizaron con el software PARTEK Genomic Suite (PARTEK; St. Louis, Missouri, Estados Unidos) y se normalizó mediante un algoritmo Robust Multiarray Analysis. Se obtuvo una lista de los miARN con diferencias significativas (cambio de ± 1,5 veces; p < 0,05) entre los pacientes y los controles. Las herramientas bioinformáticas (mirbase.org, microrna.org, targetscan.org y herramientas Diana) permitieron elegir 7 miARN de entre los que tenían una expresión diferente, cuyas dianas intervenían en la ateroesclerosis, el metabolismo lipídico o la fisiopatología adipocitaria: miR-34a-3p, -34a-5p, -124-3p, -125a-5p, -628-5p, -1303 y -4286.
Cuantificación del miARN mediante reacción en cadena de polimerasa cuantitativa en tiempo real en muestras de grasa epicárdica y hepáticaLos miARN seleccionados se validaron en 28 muestras de GE de 28 controles y en 186 muestras de GE de 99 pacientes (se obtuvo 1 muestra de GE procedente de una arteria coronaria con estenosis estable significativa en 78 pacientes, 1 muestra de GE procedente de una placa complicada en los 21 pacientes restantes y, por último, 1 muestra de GE de una arteria coronaria sin placas de ateroesclerosis en 87 de los pacientes anteriormente mencionados). Dado que las cantidades de ARN pequeño nuclear RNU6B fueron muy variables en el presente análisis de reacción en cadena de polimerasa cuantitativa en tiempo real, se eligió en su lugar el miARN-363-3p como control endógeno, con una expresión estable en los arrays y en las cuantificaciones mediante reacción en cadena de polimerasa en tiempo real. Se cuantificó el miR-34a-5p hepático en muestras de hígado procedentes de 23 controles y 62 pacientes de los que se habían obtenido también muestras de GE emparejadas (se obtuvo 1 muestra de GE procedente de una arteria coronaria sin estenosis significativa de cada uno de los 23 controles, 1 muestra de GE procedente de una arteria coronaria con una estenosis estable significativa de 54 pacientes, 1 muestra de GE procedente de una placa complicada de los 8 pacientes restantes y, por último, 1 muestra de GE de una arteria coronaria sin placas de ateroesclerosis de 55 de los pacientes anteriormente mencionados).
Las determinaciones de la reacción en cadena de polimerasa cuantitativa en tiempo real se realizaron mediante la PCR de microARN RT miRCURY LNA Universal (Exiqon; Vedbaek, Dinamarca) y un instrumento Light Cycler 480 II (Roche Applied Science; Penzberg, Alemania) siguiendo las instrucciones del fabricante.
Análisis estadísticoLas variables cualitativas se expresan en forma de porcentajes y se compararon con la prueba de la χ2. Dependiendo de la normalidad de la prueba, las variables continuas se expresan en forma de media ± desviación estándar, media ± error estándar de la media o mediana [intervalo intercuartílico] y se compararon con la prueba de la t de Student, un ANOVA o la prueba de la U de Mann-Whitney, según procediera. La cuantificación de los miARN se presenta en forma de múltiplos de cambio relativo respecto a los resultados obtenidos en la GE de las arterias coronarias sanas de los controles. Las correlaciones se determinaron con la prueba de la ro de Spearman o el coeficiente de correlación de Pearson, según procediera. Para evaluar los resultados obtenidos con los clasificadores, se elaboraron las curvas de características operativas del receptor. Se consideró estadísticamente significativo un valor de p < 0,05. Los análisis estadísticos se realizaron con el programa Statistical Package for the Social Sciences versión 20.0 for Windows (SPSS Inc.; Chicago, Illinois, Estados Unidos).
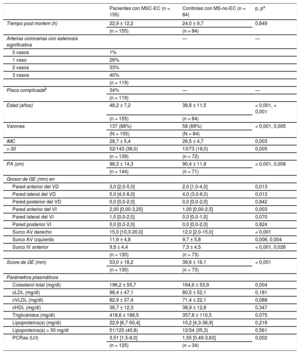
RESULTADOSPoblación del estudioNo se observaron diferencias significativas en los intervalos post mortem. En la tabla 1 se presentan las características generales de los pacientes y los controles. En comparación con los controles, los pacientes eran de más edad, principalmente varones y mostraban unos valores superiores de los parámetros antropométricos, el colesterol total y la proteína C reactiva de alta sensibilidad. Se observaron placas ateroescleróticas complicadas en un 34% de los pacientes y su presencia se asoció solo con la edad (pacientes con y sin placas complicadas, 46,2 ± 8,4 frente a 48,6 ± 6,1 años; p = 0,002).
Parámetros generales de los pacientes con MSC-EC frente a los controles con MS-no-EC
| Pacientes con MSC-EC (n = 155) | Controles con MS-no-EC (n = 84) | p, pa | |
|---|---|---|---|
| Tiempo post mortem (h) | 22,9 ± 12,2 | 24,0 ± 9,7 | 0,649 |
| (n = 155) | (n = 84) | ||
| Arterias coronarias con estenosis significativa | — | — | |
| 0 vasos | 1% | ||
| 1 vaso | 26% | ||
| 2 vasos | 33% | ||
| 3 vasos | 40% | ||
| (n = 119) | |||
| Placa complicadab | 34% | — | — |
| (n = 119) | |||
| Edad (años) | 48,2 ± 7,2 | 38,6 ± 11,5 | < 0,001, < 0,001 |
| (n = 155) | (n = 84) | ||
| Varones | 137 (88%) | 58 (69%) | < 0,001, 0,005 |
| (N = 155) | (N = 84) | ||
| IMC | 28,7 ± 5,4 | 26,5 ± 4,7 | 0,003 |
| > 30 | 52/143 (36,0) | 13/73 (18,0) | 0,005 |
| (n = 139) | (n = 72) | ||
| PA (cm) | 98,3 ± 14,3 | 90,4 ± 11,9 | < 0,001, 0,008 |
| (n = 144) | (n = 71) | ||
| Grosor de GE (mm) en | |||
| Pared anterior del VD | 3,0 [2,0-5,0] | 2,0 [1,0-4,0] | 0,013 |
| Pared lateral del VD | 5,0 [4,0-8,0] | 4,0 (3,0-6,0) | 0,013 |
| Pared posterior del VD | 0,0 [0,0-2,0] | 0,0 [0,0-2,0] | 0,842 |
| Pared anterior del VI | 2,00 [0,00-3,25] | 1,00 [0,00-2,5] | 0,003 |
| Pared lateral del VI | 1,0 [0,0-2,0] | 0,0 [0,0-1,0] | 0,070 |
| Pared posterior VI | 0,0 [0,0-2,0] | 0,0 [0,0-2,0] | 0,824 |
| Surco AV derecho | 15,0 [10,3-20,0] | 12,0 [2,0-15,0] | < 0,001 |
| Surco AV izquierdo | 11,9 ± 4,8 | 9,7 ± 5,8 | 0,006, 0,004 |
| Surco IV anterior | 9,9 ± 4,4 | 7,3 ± 4,5 | < 0,001, 0,026 |
| (n = 130) | (n = 73) | ||
| Score de GE (mm) | 53,0 ± 18,2 | 39,6 ± 16,1 | < 0,001 |
| (n = 130) | (n = 73) | ||
| Parámetros plasmáticos | |||
| Colesterol total (mg/dl) | 196,2 ± 55,7 | 164,6 ± 53,9 | 0,004 |
| cLDL (mg/dl) | 98,4 ± 47,1 | 80,5 ± 52,1 | 0,181 |
| cVLDL (mg/dl) | 82,9 ± 37,4 | 71,4 ± 22,1 | 0,088 |
| cHDL (mg/dl) | 36,7 ± 12,3 | 38,9 ± 12,8 | 0,347 |
| Triglicéridos (mg/dl) | 418,6 ± 188,5 | 357,8 ± 110,5 | 0,075 |
| Lipoproteína(a) (mg/dl) | 22,9 [6,7-50,4] | 10,2 [4,3-36,9] | 0,216 |
| Lipoproteína(a) > 30 mg/dl | 51/125 (40,8) | 12/34 (35,3) | 0,561 |
| PCRas (U/l) | 3,51 [1,5-8,0] | 1,55 [0,49-3,63] | 0,002 |
| (n = 125) | (n = 34) | ||
AV: auriculoventricular; cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; EC: enfermedad coronaria; GE: grasa epicárdica; IMC: índice de masa corporal; IV: interventricular; MS: muerte súbita; MSC: muerte súbita cardiaca; PA: perímetro abdominal; PCRas: proteína C reactiva de alta sensibilidad; puntuación de GE: suma total de las mediciones del grosor de la grasa epicárdica de cada individuo; VD: ventrículo derecho; VI: ventrículo izquierdo.
Salvo otra indicación, los valores expresan media ± desviación estándar, mediana [intervalo intercuartílico] o n/N (%).
Modelo de regresión (método anterógrado condicional) que incluye las variables edad, sexo, IMC, perímetro abdominal, surco AV derecho, pared anterior del VD, pared lateral del VD, surco AV izquierdo, pared anterior del VI, tabique IV a lo largo de la arteria coronaria descendente anterior, puntuación de GE, colesterol total y PCRas.
Los pacientes presentaron en diferentes localizaciones mayor grosor de la GE que los controles (tabla 1). Tras un ajuste en un modelo multivariable teniendo en cuenta la edad, el sexo, el índice de masa corporal y el perímetro abdominal, solo el grosor de la GE en el surco auriculoventricular izquierdo y el surco interventricular anterior siguieron mostrando un aumento significativo. El grosor máximo de la GE se observó en los surcos auriculoventriculares en ambos grupos.
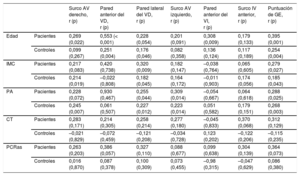
Se observó una correlación significativa del grosor de la GE en cada localización con la puntuación de GE total (figura 2 del material suplementario). En diferentes lugares del ventrículo derecho y de los surcos auriculoventriculares, el grosor de la GE mostró con frecuencia una leve correlación positiva con la edad, el índice de masa corporal y el perímetro abdominal, que fue rara en el caso de la GE en localizaciones del ventrículo izquierdo (tabla 2).
Correlaciones entre las mediciones de la GE y los parámetros epidemiológicos, antropométricos y analíticos de los pacientes con MSC-EC (n = 130) y los controles con MS-no-EC (n = 73)
| Surco AV derecho, r (p) | Pared anterior del VD, r (p) | Pared lateral del VD, r (p) | Surco AV izquierdo, r (p) | Pared anterior del VI, r (p) | Surco IV anterior, r (p) | Puntuación de GE, r (p) | ||
|---|---|---|---|---|---|---|---|---|
| Edad | Pacientes | 0,269 (0,022) | 0,553 (< 0,001) | 0,228 (0,054) | 0,201 (0,091) | 0,308 (0,009) | 0,179 (0,133) | 0,395 (0,001) |
| Controles | 0,099 (0,267) | 0,251 (0,004) | 0,176 (0,046) | 0,082 (0,358) | 0,136 (0,124) | 0,117 (0,189) | 0,254 (0,004) | |
| IMC | Pacientes | 0,217 (0,083) | 0,420 (0,738) | 0,320 (0,009) | 0,182 (0,147) | –0,038 (0,764) | 0,065 (0,605) | 0,279 (0,027) |
| Controles | 0,214 (0,019) | –0,022 (0,808) | 0,182 (0,045) | 0,164 (0,172) | –0,011 (0,903) | 0,174 (0,056) | 0,185 (0,043) | |
| PA | Pacientes | 0,228 (0,072) | 0,930 (0,467) | 0,255 (0,044) | 0,309 (0,014) | –0,054 (0,667) | 0,064 (0,618) | 0,288 (0,025) |
| Controles | 0,245 (0,007) | 0,061 (0,507) | 0,227 (0,012) | 0,223 (0,014) | 0,051 (0,582) | 0,179 (0,151) | 0,268 (0,003) | |
| CT | Pacientes | 0,283 (0,171) | 0,214 (0,305) | 0,258 (0,214) | 0,277 (0,180) | –0,045 (0,833) | 0,370 (0,068) | 0,312 (0,129) |
| Controles | –0,021 (0,829) | –0,072 (0,459) | –0,121 (0,208) | –0,034 (0,728) | 0,123 (0,202) | –0,122 (0,206) | –0,115 (0,235) | |
| PCRas | Pacientes | 0,263 (0,203) | 0,386 (0,057) | 0,327 (0,110) | 0,088 (0,677) | 0,099 (0,638) | 0,304 (0,139) | 0,364 (0,073) |
| Controles | 0,016 (0,870) | 0,087 (0,378) | 0,100 (0,309) | 0,073 (0,455) | –0,98 (0,315) | –0,047 (0,629) | 0,086 (0,380) |
AV: auriculoventricular; CT: colesterol total; EC: enfermedad coronaria; IMC: índice de masa corporal; IV: interventricular; MS: muerte súbita; MSC: muerte súbita cardiaca; PA: perímetro abdominal; PCRas: proteína C reactiva de alta sensibilidad; puntuación de GE: suma total de las mediciones del grosor de la grasa epicárdica de cada individuo; VD: ventrículo derecho; VI: ventrículo izquierdo.
La significación estadística (p < 0,05) se evaluó mediante una correlación de Pearson.
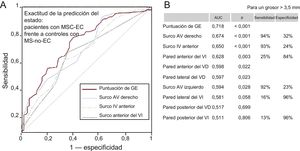
Los valores de grosor de la GE permitían diferenciar bien a los pacientes de los controles (figura 1). La mejor área bajo la curva fue la observada para la puntuación de GE, seguida del surco auriculoventricular derecho y el surco interventricular anterior. Estos análisis mostraron alta sensibilidad, pero con baja especifidad para el punto de corte de 3,5mm, y se obtuvieron estimaciones opuestas para las paredes anterior, posterior y lateral del ventrículo izquierdo.
Exactitud de las mediciones de la GE en cuanto a la predicción del estado en los pacientes con MSC-EC (n = 130) y los controles con MS-no-EC (n = 73). A: solo se muestran las AUC con los valores de p más estadísticamente significativos y su línea de referencia. B: se indican todas las AUC con la combinación más útil de sensibilidad y especificidad para cada medida de la GE (umbral, > 3,5 mm). AUC: área bajo la curva; AV: auriculoventricular; EC: enfermedad coronaria; GE: grasa epicárdica; IV: interventricular; MS: muerte súbita; MSC: muerte súbita cardiaca; puntuación de GE: suma total de las mediciones del grosor de la GE en cada individuo; VD: ventrículo derecho; VI: ventrículo izquierdo.
La significación estadística (p < 0,05) se evaluó con el método de la curva de características operativas del receptor.
El perfil de expresión de miARN mostró agrupaciones separadas para los pacientes y los controles (figura 2A). Se observó una desregulación significativa en 28 miARN maduros: 14 con aumento y 14 con disminución en los pacientes (tabla 1 del material suplementario). Para validar estos resultados, se seleccionaron 7 miARN en función de sus posibles dianas (metabolismo lipídico, fisiopatología adipocitaria u otras vías relacionadas que intervienen en la ateroesclerosis y la desestabilización de la placa), a saber: miR-34a-3p, -34a-5p, -124-3p, -4286, -125a-5p, -628-5p y -1303 (figura 2B).
Perfil de expresión de miARN en muestras de GE de 3 pacientes con MSC-EC y 3 controles con MS-no-EC. A: agrupación jerárquica no supervisada que muestra patrones de expresión de miARN diferentes (en rojo, de aumento de los miARN; en azul, de disminución de los miARN). B: gráfico de volcán en el que se muestra la magnitud de los cambios de los miARN con una expresión diferente (líneas sombreadas, cambio de ±1,5 veces; p < 0,05). EC: enfermedad coronaria; GE: grasa epicárdica; miARN: micro-ARN; MS: muerte súbita; MSC: muerte súbita cardiaca. La significación estadística (p < 0,05) se evaluó mediante un ANOVA. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
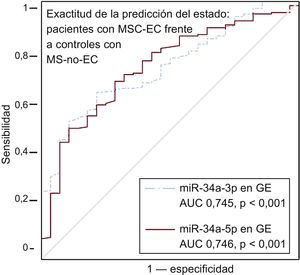
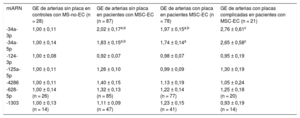
Se observó mayor cantidad de miR-34a-3p y -5p en la GE de los pacientes que en la de los controles, con independencia de la presencia o ausencia de placas de ateroesclerosis en su proximidad (tabla 3). Al examinarlo específicamente en los pacientes, no se observaron diferencias en ninguno de los miARN analizados por lo que respecta a la presencia o ausencia de estenosis coronarias subyacentes. Sin embargo, se observó una tendencia a una mayor desregulación de los miR-34a-3p y -34a-5p en la GE adyacente a placas de ateroesclerosis complicadas (tabla 3). La exactitud en la predicción del grupo clínico (pacientes o controles) fue estadísticamente significativa para los miR-34a-3p y -34a-5p de la GE (figura 3).
Cantidad de miARN determinada mediante reacción en cadena de la polimerasa cuantitativa en tiempo real en extractos de GE procedentes de controles con MS-no-EC y pacientes con MSC-EC, en estos según la presencia o ausencia de estenosis ateroesclerótica estable y de placas inestables subyacentes
| miARN | GE de arterias sin placa en controles con MS-no-EC (n = 28) | GE de arterias sin placa en pacientes con MSC-EC (n = 87) | GE de arterias con placa en pacientes MSC-EC (n = 78) | GE de arterias con placas complicadas en pacientes con MSC-EC (n = 21) |
|---|---|---|---|---|
| -34a-3p | 1,00 ± 0,11 | 2,02 ± 0,17a,b | 1,97 ± 0,15a,b | 2,76 ± 0,61c |
| -34a-5p | 1,00 ± 0,14 | 1,83 ± 0,15a,b | 1,74 ± 0,14a | 2,65 ± 0,58c |
| -124-3p | 1,00 ± 0,08 | 0,92 ± 0,07 | 0,98 ± 0,07 | 0,95 ± 0,19 |
| -125a-5p | 1,00 ± 0,11 | 1,26 ± 0,10 | 0,99 ± 0,09 | 1,30 ± 0,19 |
| -4286 | 1,00 ± 0,11 | 1,40 ± 0,15 | 1,13 ± 0,19 | 1,05 ± 0,24 |
| -628-5p | 1,00 ± 0,14 (n = 26) | 1,32 ± 0,13 (n = 85) | 1,22 ± 0,14 (n = 77) | 1,25 ± 0,18 (n = 20) |
| -1303 | 1,00 ± 0,13 (n = 14) | 1,11 ± 0,09 (n = 47) | 1,23 ± 0,15 (n = 41) | 0,93 ± 0,19 (n = 14) |
GE: grasa epicárdica; miARN: micro-ARN; MSC-EC: muerte súbita cardiaca debida a enfermedad coronaria; MS-no-EC: muerte súbita no debida a enfermedad coronaria.
Los valores expresan media ± error estándar de la media. La expresión de miARN se presenta como múltiplo de cambio relativo respecto a la concentración en la GE de arterias sin placa de los controles con MS-no-EC.
Cualquier grupo en comparación con los controles:
Exactitud de las determinaciones de miRNA-34a-3p y miRNA-34a-5p de la GE en cuanto a la predicción del estado de los pacientes con MSC-EC (n = 186) y los controles con MS-no-EC (n = 28). Se presentan las curvas ROC para los miARN con resultados estadísticamente significativos y sus líneas de referencia. AUC: área bajo la curva; EC: enfermedad coronaria; GE: grasa epicárdica; miARN: micro-ARN; MS: muerte súbita; MSC: muerte súbita cardiaca; ROC: características operativas del receptor. La significación estadística (p < 0,05) se evaluó con el método de ROC.
Solo en el grupo de control hubo una correlación significativa de los miR-34a-3p y -34a-5p de la GE con la edad, y también una correlación de los miR-34a-3p, -34a-5p y -124-3p con la puntuación de GE y varias mediciones individuales del grosor de la GE (tabla 2 del material suplementario). No se observó ninguna otra correlación de posible relevancia (r > 0,5) y estadísticamente significativa en los controles ni en los pacientes.
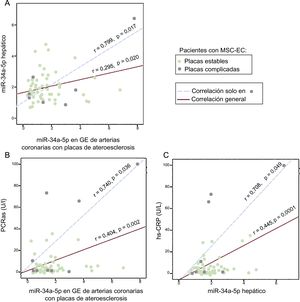
Este grupo anteriormente describió un aumento de miR-34a-5p hepáticos en las víctimas de una MS con EC o EHGNA15, y en el presente estudio se determinó simultáneamente en extractos de hígado y de GE de controles y pacientes. Se observó una correlación leve y significativa entre la cantidad de miR-34a-5p en el hígado y en la GE próxima a la estenosis coronaria de los pacientes, que aumentaba notablemente en el subgrupo de muestras de GE procedentes de placas complicadas (figura 4A). Además, se exploró la relación de la proteína C reactiva de alta sensibilidad y el miR-34a-5p determinado en muestras de GE o de hígado procedentes de los mismos pacientes (figura 4B y C). Nuevamente, las correlaciones apenas significativas observadas en la GE adyacente a las placas de ateroesclerosis pasaron a ser más intensas al analizar solo la GE procedente de placas de ateroesclerosis complicadas. En cambio, no se observaron correlaciones significativas en la GE de las arterias coronarias sin estenosis de los mismos pacientes ni en la GE de los controles (datos no mostrados).
Correlaciones entre cantidad de miR-34a-5p en muestras de GE y hepáticas y entre cada uno de ellos y la PCRas de los pacientes con MSC-EC (n = 78). La GE se obtuvo de arterias coronarias con EC. A: correlación entre los valores de miR-34a-5p en la GE y el hígado. B: correlación entre los valores de miR-34a-5p en la GE y la PCRas. C: correlación entre los valores de miR-34a-5p hepáticos y la PCRas. EC: enfermedad coronaria; GE: grasa epicárdica; MSC: muerte súbita cardiaca; PCRas: proteína C reactiva de alta sensibilidad. La significación estadística (p < 0,05) se evaluó mediante correlaciones de Pearson.
La serie que se presenta aquí confirma el concepto conocido de que la MSC-EC predomina en los varones de más edad y que muestran un perfil antropométrico más desfavorable (mayores índice de masa corporal y perímetro abdominal) en comparación con las víctimas de una MS-no-EC. Y lo que es más importante, se ha explorado el papel de la GE en la EC desde una doble perspectiva innovadora, por lo que respecta al grosor anatómico y al efecto fisiopatológico mediado por los miARN.
El grosor de la GE en diferentes localizaciones mostró un aumento significativo en los pacientes respecto a los controles en los modelos univariable y multivariable, a pesar de que algunos parámetros analíticos importantes (colesterol total y proteína C reactiva de alta sensibilidad) perdieron la significación estadística en el modelo multivariable (tabla 1). Se presenta por primera vez en la literatura una buena exactitud del grosor de la GE post mortem en casi todas las localizaciones para predecir que la EC fue la causa de la muerte (figura 1). En consonancia con los conocimientos ya existentes4, se propone que la grasa no se acumula de manera homogénea en el corazón; de hecho, los depósitos predominan en los surcos auriculoventriculares, donde hay más espacio que se puede llenar (figura 5). Sin embargo, el hallazgo de GE en la superficie del ventrículo izquierdo fuera de los surcos es claramente anormal. Así, se observó una sensibilidad alta y una especificidad baja para el grosor de la GE en los surcos auriculoventriculares y lo inverso para el grosor de la GE en la superficie del ventrículo izquierdo (figura 1), lo cual concuerda con lo descrito anteriormente en estudios de ecocardiografía28.
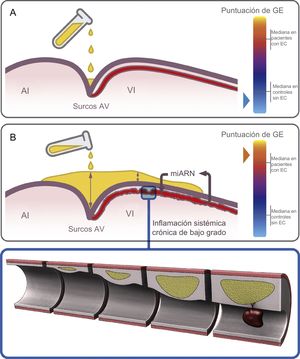
Hipótesis para la acumulación de GE dependiente de la región y su papel en el corazón. Los depósitos de grasa se inician en los surcos y luego se extienden a la superficie del VD y finalmente a la del VI. A: representación esquemática del depósito inicial de GE en los surcos AV de un individuo de control, con una puntuación de GE baja. B: en un estadio de depósito avanzado, la GE se acumula no solo en los surcos (con la máxima profundidad), sino también en el surco interventricular anterior y la superficie del VI en un paciente con EC y una puntuación de GE alta; la inflamación sistémica crónica de bajo grado induce una alteración del perfil de miARN en la GE que circunda las arterias coronarias, y ello fomenta la ateroesclerosis y la desestabilización de las placas. AI: aurícula izquierda; AV: auriculoventricular; EC: enfermedad coronaria; GE: grasa epicárdica; puntuación de GE: suma total de las mediciones del grosor de la GE en cada individuo; VD: ventrículo derecho; VI: ventrículo izquierdo.
La inflamación crónica de bajo grado que caracteriza la EC puede inducir un perfil de expresión de miARN diferente en la GE29,30. Hasta donde se sabe, solo hay 2 estudios en los que se haya evaluado el papel de los miARN de la GE en la EC estable y se han basado en un reducido número de muestras obtenidas durante la realización de intervenciones de bypass o de cirugía valvular25,26. En cada uno de estos estudios se identificó un perfil de miARN específico en los pacientes con EC, pero no hubo correlaciones con el grosor de la GE y no se realizaron subanálisis respecto a la estabilidad de las placas subyacentes a la GE. Al igual que otros autores31, se obtuvieron muestras de GE post mortem de buena calidad. Los resultados obtenidos confirman que la EC se asocia con una desregulación del patrón de expresión de miARN en la GE (figura 2). Existen diferencias considerables entre el diseño de del presente estudio y el de los 2 previos25,26, lo cual explica las diferencias en los miARN identificados. Esta serie pone de manifiesto por primera vez que la asociación lineal existente en los controles entre el grosor de la GE o la edad y la cantidad de miARN se pierde cuando la EC está establecida (tabla 2 del material suplementario). Es probable que el cambio del perfil de miARN sea gradual debido al incremento de miR-34a-3p y -34a-5p en la GE de las arterias coronarias sanas de los controles, de los pacientes sin estenosis, alrededor de estenosis estables o de placas complicadas (sin diferencias estadísticas en estos últimos 2 grupos) (tabla 3). Así pues, se demuestra que, siempre que la GE cambia hacia un perfil más desfavorable, la cantidad de miR34a-3p y -34a-5p aumenta de tal manera que la edad y el grosor de la GE llegan a perder su influencia previa en ellos. Además, se propone que la desregulación de los miARN en la GE podría preceder a la aparición de la EC en las arterias coronarias subyacentes como signo de una enfermedad sistémica latente, ya que la GE de las arterias coronarias sin una estenosis significativa en los pacientes también estaba alterada en comparación con la de los controles (tabla 3 y figura 5).
La diabetes mellitus no se incluyó en el modelo multivariable. Un motivo es que no se disponía de ese dato en los registros forenses. Además, la glucemia en la bioquímica post mortmem no fue útil (su valor depende del tiempo transcurrido desde la última comida, y es muy variable en las víctimas de una MS). Anteriormente se ha descrito la alteración inducida por la hiperglucemia en el perfil de expresión de miARN en la GE32,33, y hay que reconocer que las diferencias en el perfil de expresión de miARN podrían deberse en parte a diferencias en el metabolismo glucémico.
El reducido número de pacientes con placas complicadas impide extraer conclusiones firmes, pero apunta claramente a la expresión de miARN en la GE como otro factor que interviene en la desestabilización de la placa de ateroesclerosis. Es posible que nuevos estudios prospectivos centrados en las placas complicadas permitan superar esta limitación.
Por último, como un avance respecto a las observaciones previas15, una nueva observación de una correlación positiva entre la cantidad de miR-34a-5p en las muestras de GE y hepáticas de los pacientes y de ambas con la concentración de proteína C reactiva de alta sensibilidad respalda la existencia de un efecto nocivo de la inflamación sistémica como promotor de la EHGNA y la EC y puede ayudar a explicar también el mecanismo por el que la inflamación desencadena la desestabilización de las placas coronarias con ateroesclerosis (figura 4).
CONCLUSIONESEn resumen, el grosor de la GE está aumentado en las víctimas de una MSC-EC, no está correlacionada con parámetros analíticos y, cuando se encuentra en la superficie del ventrículo izquierdo, muestra buena especificidad para la identificación de EC y tiene mala correlación con la edad y las variables antropométricas. Este tejido muestra un perfil de expresión de miARN desregulado en los pacientes con EC, que es independiente del grosor, afecta también a la GE de las arterias coronarias sin estenosis y se presenta en paralelo a la inflamación sistémica, lo cual respalda el concepto de que la ateroesclerosis es una enfermedad sistémica. Por último, la tendencia a una mayor desregulación en la zona próxima a las placas complicadas deberá confirmarse en el futuro.
FINANCIACIÓNEste trabajo fue financiado mediante subvenciones del Instituto de Salud Carlos III, Fondo Europeo de Desarrollo Regional «European Union. A way of making Europe» (RD12/0042/0029, PI14/01477 y La Fe Biobank PT17/0015/0043), y el «Premio Borrasca» (Sociedad Española de Trombosis y Hemostasia). A. Braza-Boïls cuenta con el apoyo de Roche «Stop Brain Drain»-Instituto de Investigación Sanitaria La Fe (2017/0055) y J. Marí-Alexandre, con el de una subvención de la Fundación Española de Trombosis y Hemostasia, 2016.
CONFLICTO DE INTERESESNo se declara ninguno.
- –
La GE puede cambiar su comportamiento metabólico en circunstancias patológicas. Las arterias coronarias están rodeadas de GE. El aumento del grosor de la GE y también la presencia de EHGNA han aparecido como nuevos factores de riesgo cardiovascular para la EC, si bien aún no se conocen con exactitud los mecanismos subyacentes. Los miARN regulan las vías fisiológicas y patológicas. El miR-34a-5p hepático está aumentado cuando hay una EHGNA o una EC.
- –
El perfil de expresión de miARN en la GE de víctimas de una MSC-EC está desregulado. El incremento de miR-34-3p y -34-5p observado en los pacientes no tiene relación con la edad, el grosor de la GE o los parámetros antropométricos y muestran una tendencia positiva considerando la GE de arterias coronarias con una carga de ateroesclerosis creciente. Los pacientes presentan una correlación significativa de la cantidad de miR-34a-5p en la GE y extractos de hígado, y también de la proteína C reactiva de alta sensibilidad y el miR-34a-5p de la GE, sobre todo cuando la GE está próxima a una placa complicada. Serán necesarios nuevos estudios para clarificar el mecanismo de acción por el que la GE resulta nociva en el fomento de la EC y su desestabilización.
Los autores agradecen a José Ramón Sanz y la Asociación Valenciana de Cardiopatías Familiares y Muerte Súbita por su ayuda técnica.