Palabras clave
INTRODUCCIÓN
La angioplastia coronaria transluminal percutánea (ACTP) constituye un procedimiento ampliamente utilizado para la revascularización miocárdica. Aunque las complicaciones de la ACTP se han reducido de manera significativa, la reestenosis ocurre en casi el 35%-50% de los casos1. La lesión causada en la pared del vaso por el inflado del balón desencadena una cascada de reacciones, siendo la estimulación de las células musculares lisas (CMLs) y/o fibroblastos un acontecimiento crítico en la iniciación de la hiperplasia intimal1-10. Sin embargo, el empleo en la clínica humana de varios agentes antiproliferativos que inhiben la acción de los factores de crecimiento ha fracasado en la prevención de la reestenosis11,12. En la actualidad, la reendotelización precoz (restauración de la integridad y función del endotelio vascular lesionado lo más rápidamente posible) constituye un concepto emergente para reducir la incidencia de reestenosis12. El endotelio vascular es la barrera entre la sangre circulante y la pared vascular e inhibe la proliferación de las células miointimales5,13,14, produce factores que regulan el crecimiento vascular y la función plaquetaria, y contribuye de forma importante a la regulación global de la coagulación y la trombosis12,15-17. Sin embargo, algunos autores encontraron que en las zonas reendotelizadas se desarrolló más neoíntima que en las no reendotelizadas18 y que las zonas reendotelizadas fueron más trombogénicas que las no endotelizadas19. Estos resultados, contradictorios con los previamente citados12,15-17, sugieren la importancia que puede tener el tipo de agente farmacológico empleado para inducir la reendotelización12,17. Así, la utilización del factor de crecimiento derivado del endotelio vascular (VEGF), si bien causa la reendotelización20, produce de manera simultánea la extravasación de fibrinógeno y trombina dentro de la pared del vaso, como consecuencia de lo cual cabe esperar trombosis, inflamación y mitogénesis12,17. White et al21 han descrito que la administración sistémica de estrógenos reduce la formación de neoíntima, en parte facilitando la reendotelización de la pared dañada sin causar las complicaciones citadas.
Ningún trabajo previo ha evaluado el papel del AMPc en la inhibición de la proliferación miointimal tras la lesión causada en la pared arterial por balón de angioplastia en animales vivos. Diversos datos indirectos sugieren que el AMPc podría facilitar la reendotelización selectiva de la zona lesionada y, de este modo, incidir en la reducción de la proliferación miointimal sin causar las complicaciones citadas. Las prostaglandinas E2 (PGE2) e I2 (PGI2), sintetizadas en el endotelio vascular, inhiben la agregación plaquetaria22 e inducen la inhibición de la proliferación fibromuscular aumentando la síntesis de AMPc al activar la adenilciclasa vía proteína G acoplada al receptor22,23. Estudios in vitro sugieren que el aumento de AMPc en las células endoteliales podría incrementar la capacidad antitrombótica del endotelio vascular, dado que el AMPc inhibe la expresión del factor tisular inducida por ciertas citocinas16, que el aumento de la permeabilidad de las células endoteliales ocurre como consecuencia del descenso del AMPc celular, y el AMPc previene y normaliza por completo los cambios inducidos por la hipoxia en la función de barrera que ejerce el endotelio24,25. Estudios ex vivo demostraron que el AMPc previene el aumento de la permeabilidad microvascular inducida por la isquemia-reperfusión26, así como la liberación de ciertas citocinas27,28. Recientemente, Nguyen et al23 demostraron en ratas recién nacidas la gran importancia que tiene el AMPc en el cierre del ductus arterioso. Cuando las concentraciones de AMPc en el tejido ductal se reducen de manera significativa se produce la migración y proliferación de las células musculares lisas en la región subintimal y el posterior cierre del ductus, mientras que cuando las concentraciones intracelulares de AMPc en el tejido ductal se mantienen elevadas se evita la migración y proliferación de las células musculares lisas en la región subintimal, lo cual condiciona que el ductus permanezca permeable.
Finalmente, se sabe que la reendotelización comienza 2-4 h después de la lesión de la pared del vaso17 y, por otro lado, que la elevación del AMPc por estimulación de la producción endógena es eficaz durante al menos 12 h24.
A la vista de los propuestos efectos del AMPc sobre la prevención y normalización de los cambios inducidos por la deprivación de oxígeno en la función de barrera que ejerce el endotelio, pretendemos comprobar la hipótesis de la posible regulación por la elevación temporal de la concentración sistémica de AMPc sobre la biología de las células endoteliales, y proliferación de fibroblastos y células musculares lisas in vivo, en un modelo animal, como es la lesión de la arteria carótida y arteria coronaria descendente anterior del cerdo.
MÉTODOS
En nuestro estudio empleamos cerdos debido a que es el animal que más se parece al ser humano, tanto en la morfología como en la fisiología cardiovascular29.
Se emplearon un total de 39 cerdos domésticos, de pesos comprendidos entre los 25 y 35 kg. Los animales fueron tratados de acuerdo con el Real Decreto 223/1988 de 14 de marzo sobre protección de los animales utilizados para experimentación y otros fines científicos (BOE 1988; n.º 67; 8509-8512). Se colocaron en jaulas y se les administraron comida y agua ad libitum. Doce horas antes del experimento, los animales no tuvieron acceso a la comida pero sí al agua. La anestesia se indujo con una combinación de 10 mg/kg de ketamina, 2 mg/kg de xilacina y 0,04 mg/kg de atropina administrada intramuscularmente, seguida de una mezcla de oxígeno al 1%, óxido nitroso al 2% y halotano al 2%, administrado con una máscara de Hall. Tras la intubación endotraqueal, la anestesia se mantuvo con la misma mezcla de gases y se procedió a la canulación quirúrgica de la arteria femoral derecha, colocándose un introductor valvulado (INPUT. TS 10 Fr, Arterial Vascular Engineering, Inc. Galway, Irlanda). A continuación se administró un bolo de 100 U/kg de heparina no fraccionada intravenosa (heparina sódica ROVI S.A., Madrid, España) para permitir la introducción de los catéteres de angioplastia sin la activación del sistema de coagulación. Durante la anestesia la presión sistémica se monitorizó continuamente y se efectuaron estudios gasométricos.
Protocolo experimental
Los animales fueron divididos en dos grupos (grupo control y de estudio), y cada uno de ellos fue subdividido en dos subgrupos. Los grupos fueron ciegos para el patólogo y para el encargado de la medición del AMPc.
Grupo control
A1. Valoración del grado de reendotelización. Este grupo estaba compuesto por 5 cerdos en los que se causó lesión de ambas arterias carótidas con balón de 6 x 40 mm. Treinta minutos antes de causar la lesión se administraron 2 ml de suero fisiológico. Estos animales fueron sacrificados a los 8 días bajo anestesia general. Antes de sacrificarlos se les inyectaron 500 ml de una solución al 0,5% de azul de Evans por una vena periférica, con el fin de valorar macroscópicamente el área del endotelio vascular que permanecía denudada. Asimismo, se valoraron la cicatrización y el grado de reendotelización mediante microscopia electrónica e inmunohistoquímica.
A2. Valoración del grado de reestenosis. Este subgrupo estaba compuesto de otros 10 cerdos en los que se causó lesión en una de las dos ramas de la arteria coronaria izquierda (descendente anterior [DA] o circunfleja [Cx]) con aterotomo de Simpson. A estos cerdos se les suministraron 2 cm de suero fisiológico por una vena periférica 30 min antes de causar las lesiones vasculares. Asimismo, se extrajeron muestras de sangre para determinar las concentraciones intracelulares de AMPc en condiciones basales (inmediatamente tras la anestesia), a los 30 y 60 min de administrar el suero o el forskolin, y a los 90 min de causar la lesión de la DA. Estos animales fueron sacrificados bajo anestesia general a los 28-30 días de efectuar la lesión. En los segmentos de las arterias lesionadas y segmento proximal sano se efectuó el estudio histológico e inmunohistoquímico.
Grupo de estudio
B1. Valoración del grado de reendotelización. Este subgrupo de otros 5 animales se diferencia del A1 en que 30 min antes de efectuar las lesiones en ambas carótidas se suministraron, por una vena periférica, 10 mg de forskolin, un activador de la adenilciclasa.
B2. Valoración del grado de reestenosis. Este subgrupo de otros 9 animales se diferencia del A2 en que 30 min antes de efectuar las lesiones en ambas carótidas y arterias coronarias se suministraron, por una vena periférica, 10 mg de forskolin.
Técnicas de lesión vascular
Lesión de ambas arterias carótidas con balón
La arteria femoral izquierda fue disecada y ligada distalmente. Un catéter con un balón de 6 mm con una guía de 0,25 pulgadas fueron introducidos por la arteria femoral izquierda. Empleando un monitor fluoroscópico, el catéter fue colocado en la parte media de la arteria carótida izquierda. El balón de angioplastia se infló con contraste radioopaco por dos veces a 14 atm durante 60 s. Con el fin de causar la denudación del endotelio vascular, después del segundo inflado el balón fue inflado por tercera vez a 10 atm y, manteniéndolo inflado, el catéter fue retirado de la zona de lesión. Se empleó el mismo procedimiento para causar el daño de la media y la denudación del endotelio vascular, en la arteria homónima contralateral.
Lesión de la arteria coronaria descendente anterior con aterotomo de Simpson
Mediante control fluoroscópico se avanzó un catéter guía de angioplastia hasta el origen de la coronaria izquierda. Tras la realización de un angiograma de control (Hexabrix 320, Lab Guerbet S.A., Madrid, España) se avanzó una guía de angioplastia de 0,014 pulgadas hasta el segmento distal de la arteria coronaria que se pretendía intervenir, y sobre dicha guía se avanzó el aterotomo direccional de Simpson (Atherocath-GTO®, Devices for Vascular Intervention, Inc., California, EE.UU.) hasta el segmento medio del vaso. Una vez inflado el balón del aterotomo (2-3 atm) se realizaron seis avances consecutivos de la cuchilla del aterotomo sin modificar la posición del catéter. A continuación se desinfló el balón y se retiró el aterotomo, realizándose una angiografía de control para valorar la presencia de sobredilatación, disección, espasmo o compromiso del flujo en la arteria intervenida. Tras la sutura de la arteria femoral se permitió la recuperación de los animales, que fueron mantenidos con dieta normal durante 4 semanas.
Medición de AMPc intracelular
Tanto en el grupo de estudio como en el grupo control se valoraron las concentraciones intraleucocitarias de AMPc mediante la técnica de enzimoinmunoanálisis (ELISA). En todos los casos se partió de un volumen conocido de sangre (5 ml), que fue recogido en tubos venoject estériles con EDTA k3. Se procedió a la separación del plasma y de los leucocitos mediante un gradiente de densidad con Ficoll (1/4 del volumen de sangre total) (ISO-PREP for isolation of human lymphocytes. Robbins Scientific Corporation. Sunnyvale, CA). Se centrifugaron las muestras a 1.800 rpm durante 45 min a 4 °C; las fases plasmática y leucocitaria se recogieron en tubos independientes, se realizó un lavado de la fase leucocitaria con el fin de eliminar los restos de Ficoll y se procedió al recuento del número de linfocitos en la cámara Neubauer. La cantidad de linfocitos extraídos se expresó en número de células/100 µl.
El contenido intraleucocitario de AMPc se extrajo mediante sucesivos ciclos de congelación y descongelación. Posteriormente se centrifugó a 5.000 rpm durante 5 min a 4 °C, y el sobrenadante se recogió en tubos Eppendorf estériles, que se almacenaron a 80 °C hasta su posterior utilización. La cuantificación de las concentraciones intracelulares de AMPc se realizó mediante ELISA empleando equipos comerciales específicos para su determinación (Cayman Chemical, R and D systems Europe, Abingdon, OX, Reino Unido). Los valores de AMPc se expresaron como pmol/106 células.
Estudio histomorfométrico e inmunohistoquímico
Se efectuaron las tinciones de hematoxilina y eosina, el método de tricrómico de Masson y el de orceína para fibras elásticas. La tinción de orceína facilitó la valoración del grado de lesión causado por el balón en la pared de cada uno de los segmentos. De acuerdo con la clasificación previamente aportada30 y la extensión circunferencial de la lesión, la lesión causada será de grado: 0 = lesión no apreciable; 1 = lesión de la lámina elástica interna (LEI) y media comprimida pero no lacerada; 2 = lesión de la LEI, media lacerada pero la lámina elástica externa (LEE) permanece intacta y la extensión circunferencial de la lámina es igual o inferior al 25% de la circunferencia del vaso; 3 = se diferencia del grado 2 en que la extensión de la lesión es igual o superior al 25% y menor del 50% de la circunferencia del vaso; 4 = la lesión afecta la LEI, la media y la LEE y la extensión de la lesión es igual o inferior al 25% de la circunferencia del vaso, y 5 = se diferencia del grado 4 en que la extensión de la lesión es igual o superior al 25% y menor del 50% de la circunferencia del vaso.
Valoración del grado de reendotelización (subgrupos A1 y B1)
Las arterias, una vez inyectadas con azul de Evans, fueron abiertas longitudinalmente y fotografiadas con una lupa Wild (Leitz) a unos aumentos de 31,5, 35, 40 y 45. La película utilizada fue de 35 mm (Ilford pan-F 50 ASA). Posteriormente, sobre los negativos revelados se procedió a realizar las mediciones de las áreas del endotelio teñidas de azul empleando el programa Leica Q5000IW.
En todos los casos se obtuvo una muestra, sección transversal del vaso de 1 mm de grosor, en la zona de la lesión macroscópica más severa para llevar a cabo la microscopia electrónica. El resto de la arteria fue fijada en formol tamponado para efectuar el estudio inmunohistoquímico.
Microscopia electrónica. Las muestras, una por cada arteria (zona de lesión) fueron fijadas en glutaraldehído al 2,5% en tampón fosfato y de cada muestra se obtuvieron 4-5 bloques. Después se realizó una fijación secundaria con tretóxido de osmio al 2% tamponado que se incluyó en araldita previa estabilización con acetato de uranilo. Se realizaron cortes de una micra, teñidos con azul de Toluidina para la selección de cortes ultrafinos. Éstos fueron contrastados con citrato de plomo.
Inmunohistoquímica. Se seleccionaron cortes incluidos en parafina de la zona de la lesión macroscópica más severa. Se realizó recuperación de la capacidad antigénica con calor en olla a presión durante 3 min en tampón citrato. Se empleó un anticuerpo monoclonal antiactina de músculo liso y anticélulas endoteliales CD31 (Dakopatts A/s, Dinamarca), y el método de estreptavidina-biotina-peroxidasa, que en resumen consiste en efectuar la desparafinación de los cortes en xilol durante 1 h a temperatura ambiente, la hidratación de los cortes por inmersión en alcoholes de concentraciones decrecientes, la inhibición de la actividad peroxidasa endógena por incubación en peróxido de hidrógeno al 3%, el lavado con tampón fosfato (PBS) a pH 7,4, la incubación de los cortes con suero normal de cerdo a una dilución 1:20 en una solución de albúmina al 1% durante 1 h, la incubación de los cortes con el anticuerpo correspondiente, el lavado en PBS pH 7,4 durante 30 min, la incubación de los cortes con antisuero biotinilado de ratón (Biomeda, Foster City, CA) a dilución 1:400 en PBS + BSA, el lavado en PBS pH 7,4, la aplicación sobre los cortes del complejo estreptavidina-biotina-peroxidasa a dilución 1:800 en PBS + BSA, el lavado en PBS PH 7,4, el revelado de la reacción con diaminobencidina (DAB) durante 8-20 min, el lavado de los cortes con agua destilada dura nte 15 min, la deshidratación de los cortes por inmersión en alcoholes de concentraciones crecientes en pases de 5 min cada uno, el aclarado de los cortes en xilol durante 5 min y, finalmente, el montaje de los cortes con resina sintética DePex (Probus S.A, Badalona). La zona de regeneración de cada uno de los segmentos lesionados (control y grupo de estudio) fueron semicuantificados de 0 a 3 en función del máximo de la tinción inmunohistoquímica: grado 0 = tinción no detectable; 1 = tinción positiva en < 25% de las células; 2 = tinción positiva en el 25-50% de las células, y 3 = tinción positiva en más del 50% de las células30.
Se cuantificaron la longitud de la zona de lesión y el recuento de células endoteliales de cada uno de los segmentos lesionados (control y grupo de estudio). La longitud de la zona denudada se expresó en micras y el número de células en valores absolutos.
Valoración del grado de reestenosis y remodelado arterial geométrico del vaso (subgrupos A2 y B2)
Por cada segmento afectado y zona sana adyacente a la zona de lesión se efectuaron mediciones histomorfométricas. De acuerdo con estudios previos30,31 se midieron: a) área de regeneración que corresponde al área de cicatrización del vaso caracterizada por la ausencia de fibras elásticas (tinción con orceína); b) área de la media que corresponde al área comprendida entre la lámina elástica interna y la lámina elástica externa; c) área total de la pared del vaso lesionado (ATPVL) que corresponde al área comprendida entre la lámina elástica externa y la luz del vaso; d) área total de la pared del vaso sano (ATPVS) comprendida entre la lámina elástica externa y la luz del vaso; e) área de la luz residual del vaso (ALRV), y f) área de la luz del vaso de la zona sana adyacente (ALVS). De estas mediciones derivarán los siguientes cálculos, tanto para las arterias del grupo control como para las del grupo de estudio:
1. Porcentaje de reducción del área de luz del segmento afectado con relación al área de luz del segmento adyacente sano = [ALVS-ALRV] x 100/ALVS.
2. Remodelado arterial geométrico o cambios en la pared del vaso entre el segmento sano y el lesionado = ATPVL-ATPVS.
Estudio estadístico
Los datos se procesaron en la Unidad de Investigación del Hospital Clínico San Carlos, con el programa SAS versión 6.12 bajo Windows. Los datos cuantitativos se expresan como media ± desviación y los datos cualitativos en forma de porcentajes.
La correlación de datos cuantitativos se analizaron mediante el coeficiente de correlación de Pearson o el de Spearman, dependiendo de la distribución de los datos.
Se estudió la homogeneidad del grado de lesión en ambos grupos de estudio mediante la prueba de Kruskal-Wallis. Se efectuó MANOVA para medidas repetidas para comparar las concentraciones de AMPc entre los dos grupos y entre las cuatro mediciones efectuadas en cada uno de ellos.
Se usaron diferentes modelos de regresión lineal para valorar el efecto del aumento de AMPc respecto al control. Se emplearon como variables dependientes el porcentaje de estenosis de la luz del vaso y el remodelado arterial geométrico del vaso, y como variables independientes el grado de lesión y los valores de AMPc basal, y a los 30, 60 y 180 min. Se estudió la relación con el grado de respuesta vascular a la lesión y el grado de tinción inmunohistoquímica dentro de cada grupo con el coeficiente de correlación de Spearman.
RESULTADOS
Ningún animal presentó problemas dignos de reseñar. En el subgrupo A1, la lesión fue de grado 1 en una carótida, de grado 2 en tres, de grado 3 en cinco y de grado 4 en otra carótida. En el subgrupo B1, la lesión fue de grado 1 en 2 carótidas, de grado 2 en 2 arterias, de grado 3 en cuatro y de grado 4 en 2 carótidas. En los subgrupos A2 y B2, las lesiones fueron de grado 4 y 5 en 7 y 8 arterias, respectivamente, y de grado 3 en las restantes 3 y 2 carótidas. El estudio estadístico puso de manifiesto que en ambos grupos no existen diferencias en el grado de lesión causada por el balón (subgrupos A1y B1) y el aterotomo (subgrupos A2 y B2).
Se emplearon 10 mg de forskolin, un activador de la adenilciclasa, en dosis única para aumentar las concentraciones intracelulares del AMPc. Durante los primeros 10-15 min de la administración intravenosa lenta de dicho fármaco se produjo un aumento significativo de la frecuencia cardíaca basal (87 ± 10 frente a 216 ± 18 lat/min tras la administración) y una reducción significativa de la presión arterial sistémica (112 ± 4 mmHg basal frente a 45 ± 2 mmHg). El efecto cronotrópico del forskolin se debe a que dicho fármaco es un activador de la tirosinhidroxilasa, una enzima llave en la síntesis de adrenalina y noradrenalina, lo que se traduce en un aumento de los valores circulantes de las catecolaminas y el consiguiente incremento de la frecuencia cardíaca32. No obstante, dado que el forskolin activa la adenilciclasa, se produce un aumento del AMPc, un relajante de la musculatura lisa33, con la consiguiente reducción de la presión sistémica.
Área total de lesión por balón-área no reendotelizada (subgrupos A1 y B1)
El estudio estadístico del análisis planimétrico demostró que no existían diferencias estadísticamente significativas entre el área total de la zona inicialmente lesionada por el balón en el grupo control (151 ± 26,5 mm2) y el grupo tratado con forskolin (155,5 ± 23,1 mm2).
La evaluación de la zona no reendotelizada (zona teñida de azul) efectuada con la administración de azul de Evans puso de manifiesto que existen diferencias estadísticamente significativas (p = 0,02) en el porcentaje de la zona de lesión no reendotelizada entre el grupo control (29,3 ± 8,5%) y el grupo tratado con forskolin (20,1 ± 7,5%).
La evaluación del área reendotelizada efectuada con CD31 puso de manifiesto que no existe diferencia estadísticamente significativa en la longitud de la lesión entre el grupo control (2.719,4 ± 1.859 µ) y el de estudio (1.859 ± 986,5 µ), mientras que existió diferencia con significación estadística (p = 0,01) en el número total de células que expresan positividad para CD31 (células endoteliales) entre el grupo control (10,8 ± 9,11 células) y el de estudio (38,4 ± 11 células).
No se encontraron diferencias estadísticamente significativas en el porcentaje de células que expresan positividad para la alfaactina entre el grupo control (23,3 ± 6,8%) y el grupo tratado con forskolin (22,3 ± 2,3%).
Microscopia electrónica
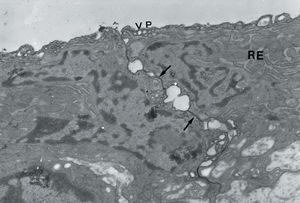
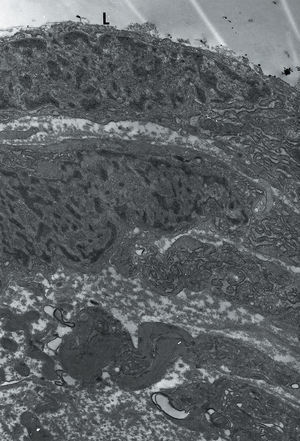
En la periferia de la lesión y en continuidad con el endotelio no lesionado se apreciaban células endoteliales cubriendo de forma discontinua la lesión. Estas células presentaban un aspecto menos aplanado que la célula endotelial habitual, el citoplasma sobresalía hacia la luz y entre las células adyacentes se observaron uniones bien constituidas (fig. 1A). En las zonas centrales de la lesión se objetivaron células musculares modificadas que se disponían paralelas a la luz del vaso, tapizaban la lesión, evidenciaban un retículo endoplásmico rugoso muy dilatado, en su citoplasma se podían observar filamentos y en la membrana citoplásmica densidades focales, pero carentes de membrana basal (fig. 1B). Estas células, al ser células musculares modificadas, expresan positividad para la alfaactina.
Fig. 1. A: microscopia electrónica, AD x 70.000. Se observan 2 células endoteliales que ponen de manifiesto uniones (flechas), retículo endoplásmico rugoso y dilatado (RD). Se aprecian vacuolas de pinocitosis (VP). B: microscopia electrónica AD x 4.800. Recubriendo la luz (L) se observan localmente células que presentan características de células activas con presencia de miofilamentos y áreas densas en la membrana citoplásmica y membrana basal incompleta.
Valoración del grado de reestenosis y remodelado arterial geométrico del vaso
Subgrupos A2 y B2
En la tabla 1 se aportan los valores de las variables evaluadas en ambos subgrupos de animales.
El MANOVA para medidas repetidas demostró que en cada uno de los dos grupos se producen diferencias estadísticamente significativas sólo entre los valores de AMPc obtenidos en condiciones basales y los obtenidos a los 90 min de efectuar la lesión vascular. El mismo test demostró que entre ambos grupos existen diferencias significativas entre los valores de AMPc obtenidos a los 30 y 60 min.
El análisis de correlación demostró que tanto en el grupo control como en el de estudio existe una correlación inversa entre los valores de AMPc antes de efectuar la lesión y el remodelado arterial geométrico (r = 0,76 y r = 0,77, respectivamente) y una relación directa con el porcentaje de estenosis (r = 0,72 y r = 0,90, respectivamente). Es decir, concentraciones de AMPc elevadas se relacionan con una menor proliferación fibromuscular en la zona de lesión y un aumento del diámetro de la luz del vaso lesionado con respecto al diámetro del segmento sano. El análisis de regresión modelo lineal confirmó dichos coeficientes de correlación (grupo control; remodelado arterial geométrico del vaso: R2 = 58%, error estándar de estimación [EEE] = 10,0229; porcentaje de estenosis; R2 = 53%, EEE = 0,01921. Grupo de estudio; remodelado arterial geométrico del vaso: R2 = 59%, EEE = 0,02294. Porcentaje de estenosis: R2 = 80,5%, EEE = 0,015909).
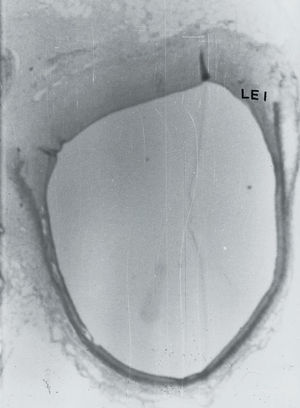
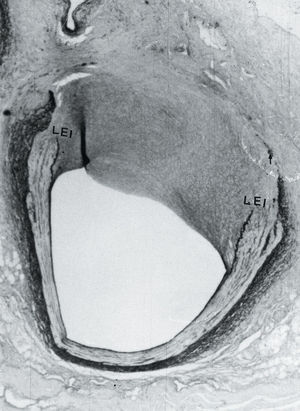
Asimismo, encontramos que, en cuatro de los 10 animales empleados en el grupo control, se produjo una reducción significativa de la luz del vaso con respecto al segmento sano (fig. 2A), siendo el porcentaje de reducción de 17, 18, 48 y de 29%, mientras que en los restantes 6 cerdos el calibre de la luz del vaso no se modificó (n = 2) o se produjo un aumento de la luz del vaso (fig. 2B) que osciló entre un 8 y un 43% (n = 4). En los segmentos arteriales en los que se redujo la luz del vaso se produjo un engrosamiento de la pared del vaso, mientras que en las restantes 6 arterias tuvo lugar un adelgazamiento de la pared del vaso. En dos de los animales tratados con forskolin, a pesar de que se les administró la misma dosis de dicho fármaco, las concentraciones de AMPc no variaron de forma significativa (basal; 0,052 y 0,0043 frente a 0,061 y 0,038, respectivamente) y, en estos animales, a los 30 días se produjo una reducción significativa en el calibre de la luz del vaso (de 6 y 27%, respectivamente), mientras que en los restantes animales del mismo grupo se produjo un aumento de la luz, acompañada de un remodelado arterial geométrico positivo de la pared del vaso. En estos 6 animales (cuatro del grupo control y dos del grupo tratado), el valor medio del AMPc intraleucocitario basal era de 0,048 ± 0,019, mientras que en los restantes cerdos el valor medio del AMPc era de 0,104 ± 0,029, existiendo una diferencia estadísticamente significativa (p = 0,001) entre ambos valores. El porcentaje de reducción de la luz del vaso lesionado con respecto a la luz del segmento sano era de 24 ± 14%, mientras que en los restantes cerdos el valor medio era de 13 ± 17%, existiendo una diferencia estadísticamente significativa (p = 0,0003) entre ambos valores. El remodelado arterial geométrico del vaso era de 17 ± 18,5 y de 10,2 ± 20, respectivamente, existiendo una diferencia estadísticamente significativa (p = 0,01) entre ambos valores.
Fig. 2. A: microscopia óptica, x20. Se aprecia una proliferación fibromuscular que reduce la luz del vaso. B: microscopia óptica, x20. Se observa proliferación fibromuscular que no reduce la luz del vaso. LEI: lámina elástica interna.
DISCUSIÓN
Nuestro trabajo demostró en animales vivos que el aumento de las concentraciones de AMPc causó, a los 8 días, un aumento estadísticamente significativo en el número de células endoteliales y redujo de manera significativa el área denudada pero no reendotelizada con respecto al grupo control. La migración de las células endoteliales es un proceso relacionado con la angiogénesis normal y patológica, y con la reendotelización que tiene lugar tras la lesión de la pared vascular con balón34. Aunque el proceso de migración de las células endoteliales no es conocido en su totalidad, se sabe que se producen uniones y desuniones celulares controladas, contracción de los filamentos citoplásmicos, cambios en la plasticidad del citosqueleto y comunicaciones celulares controladas35. Todos estos procesos son regulados por numerosos factores, pero las señales de dichos factores son transducidos por corrientes iónicas, proteincinasas y por el AMPc36. Por tanto, al ser el AMPc uno de los factores más relevantes en la transducción de estas señales se puede sugerir que el aumento en el número de células endoteliales encontradas en nuestro trabajo puede ser atribuido al aumento de las concentraciones intracelulares del AMPc.
De acuerdo con estudios previos5,12-17, existe una clara relación inversa entre la integridad del endotelio vascular y la proliferación de las células musculares lisas. Por tanto, dado que en los animales tratados con forskolin a los 8 días el número de células endoteliales era muy superior al del grupo de estudio, cabría esperar que en los animales tratados con forskolin y sacrificados a los 28-30 días se produjese una reducción significativa en el porcentaje de estenosis de las arterias coronarias tratadas con respecto al grupo control. En el presente estudio encontramos que concentraciones de AMPc elevadas se relacionan con una menor proliferación fibromuscular en la zona de lesión y un aumento del diámetro de la luz del vaso lesionado con respecto al diámetro del segmento sano, pero no encontramos diferencias estadísticamente significativas en el porcentaje de estenosis entre el grupo control y el de estudio. Dado que se trata de animales de la misma especie, de pesos similares, la lesión se indujo con el mismo procedimiento, no hay variación en el grado de lesión causada en las arterias lesionadas, no se produjo ningún cambio en la alineación, hábitat y condiciones ambientales durante la duración del estudio, nuestros resultados son, al menos en apariencia, contradictorios. La explicación de esta contradicción se puede encontrar en el comportamiento de los animales del grupo control. Habitualmente, en los numerosos trabajos publicados relacionados con el tema, en el grupo control se produce reestenosis en la totalidad de los animales que lo componen, mientras que en el grupo de estudio se produce una reducción significativa de la reestenosis. Nosotros encontramos que sólo 4 de las 10 arterias que componen el grupo control (40%) presentaron reestenosis significativa. Lo mismo ocurrió en 2 animales del grupo de estudio, en los cuales, a pesar de administrar la misma dosis de forskolin, no se produjo aumento de las concentraciones del AMPc intracelular. En estos 6 animales, el valor del AMPc intraleucocitario era significativamente inferior a su respectivo valor obtenido en los restantes animales sin estenosis. Se ha demostrado que el aumento de la producción intracelular de AMPc produce la supresión o disminución de la liberación de los mediadores inflamatorios37, por lo que se podría sugerir que las concent raciones intracelulares de AMPc pueden condicionar el remodelado arterial geométrico y el diámetro de la luz del vaso de los segmentos lesionados, bloqueando o reduciendo la liberación de los mediadores de la inflamación.
Este trabajo fue financiado con las becas SEC-NOVARTIS 1998, y beca concedida por la Comunidad Autónoma de Madrid 08.4/0001/99. Correspondencia: Dr. P. Fantidis. Servicio de Cardiología Intervencionista. Hospital Clínico San Carlos. Prof. Martín Lagos, s/n. 28040 Madrid. Correo electrónico: pfantidis@hcsc.insalud.es Recibido el 11 de octubre del 2000. Aceptado para su publicación el 2 de febrero del 2001.