Palabras clave
INTRODUCCIÓN
El ventrículo derecho (VD) está compuesto por 2 unidades anatómicamente diferentes: el sinus y el infundíbulo. Varias observaciones filogenéticas sugieren que el infundíbulo aparece en los primeros cordados. El sinus, en cambio, se desarrolla más tardíamente en la filogenia, apareciendo en los vertebrados, más precisamente en el cocodrilo. Esto podría estar vinculado al desarrollo de una bomba pulmonar especializada para mejorar la eficiencia de la unidad cardiorrespiratoria en animales de respiración terrestre1-4. La compleja geometría del VD y el tipo de patrón de contracción han constituido una seria limitación para la exacta evaluación cuantitativa de su mecánica1.
Más recientemente, el desarrollo de técnicas de la imagen (tomografía computarizada, resonancia magnética, ecocardiografía acústica), así como la sonomicrometría y métodos de conductancia, han permitido estimar el volumen del VD y obtener su bucle presión-volumen (P-V)2,5-9.
En estudios recientes, en los que se ha trabajado en ovejas anestesiadas con una técnica sonomicromé trica6, nuestro grupo9,10 caracterizó las fases del ciclo cardíaco y del bucle P-V del VD con presión pulmonar normal, demostrando claras diferencias con respecto al ventrículo izquierdo (VI). De forma resumida, el VD, a diferencia del VI, presenta un bucle P-V de forma triangular, una elastancia máxima (Emáx) temprana, y una eyección prolongada, subdividida en 2 fases (temprana y tardía), relacionado con su patrón de contracción asincrónico, secuencial o peristáltico desde el sinus hacia el conus. Además, el VD carece de fases isovolumétricas y la elastancia máxima (Emáx), el pico negativo de la primera derivada de la presión ventricular (-dP/dtmáx) y el fin de la eyección no ocurren en el mismo instante9,10. Hemos sugerido, al igual que otros autores, que estas diferencias pueden depender de las particulares condiciones de carga para cada ventrículo y, por lo tanto, estarían reflejando las diferentes impedancias características de los lechos vasculares sistémico y pulmonar1,5,9-11.
Nuestra hipótesis consistió en que el diferente patrón de contracción entre el VI (sincrónico o uniforme) y el VD (asincrónico, secuencial o peristáltico) refleja las diferentes poscargas a que están sometidos normalmente ambos ventrículos. Por tanto, el objetivo del presente trabajo consistió en caracterizar las modificaciones del comportamiento mecánico del VD durante un aumento agudo de su poscarga.
MATERIAL Y MÉTODO
Preparado quirúrgico
Los experimentos fueron realizados en 7 ovejas de raza merina con un peso promedio de 29 ± 6 kg, anestesiadas con pentobarbital sódico intravenoso a una dosis de 35 mg/kg. Los animales fueron traqueotomizados y la respiración fue mantenida con un respirador a presión positiva (Dragger Polyred 20l) y una fracción inspirada de oxígeno de 40%. Se monitorizaron las presiones parciales de O2 y CO2 arteriales. Fueron ajustados el volumen corriente y la frecuencia respiratoria para mantener la pO2 superior a 90 mmHg, la pCO2 en valores de 35-40 mmHg y el pH entre 7,35 y 7,4. Se introdujo un catéter de polietileno en la vena safena para la administración de la solución anestésica y los fluidos de reposición. Un catéter con microtransductor en su extremo distal (Millar Mikro-tip, SPC 370 7 Fr) fue ubicado en la aorta abdominal a través de la arteria femoral y conectado a su unidad de control (Millar TC 5l0). Los animales fueron colocados en decúbito lateral derecho y se expuso el corazón por medio de una toracotomía lateral izquierda localizada en el quinto espacio intercostal. El pericardio fue abierto y utilizado como una cuna de sostén para el corazón. Alrededor de la vena cava posterior supradiafragmática se colocó un oclusor neumático hecho con un manguito de goma siliconada conectado a una jeringa con suero fisiológico. En la arteria pulmonar se colocó un transductor de flujo Doppler (A-Series flowprobe, Transonic Systems Inc.). Tres microtransductores (Konigsberg P7, l200 Hz) fueron introducidos: uno en el VD, otro en el VI y otro dentro de la arteria pulmonar, a través de incisiones en las paredes de estas estructuras. Se implantaron 4 pares de cristales piezo-
eléctricos de 3 MHz y 5 mm de diámetro en el epicardio, siguiendo una disposición ortogonal a través de los diámetros del ventrículo izquierdo con un eje mayor base-ápex (-a-) y un eje menor anteroposterior (-b-), así como a través de los diámetros septum-pared libre del VI (-c-) y del VD (-d-). Estos dos últimos se obtuvieron con un cristal de doble faz (2 mm de diámetro) implantado en el septum intraventricular y un cristal (5 mm de diámetro) en cada una de las paredes libres del VI y del VD9,10.
Protocolo experimental
Los transductores ultrasónicos fueron conectados al sonomicrómetro (Triton Technology, modelo l20, l00 Hz) con confirmación de óptima calidad de señal por medio de un osciloscopio. El sensor de flujo pulmonar fue conectado a un flujímetro ultrasónico (Transonic Systems Inc.) sincronizado con el sonomicrómetro. Los microtransductores de presión fueron calibrados in vitro a 37 ºC. Después de la preparación quirúrgica, los registros fueron realizados en condiciones basales y durante un aumento agudo de la poscarga del VD. La hipertensión arterial pulmonar (HTP) fue provocada mediante la infusión i.v. en un bolo de 1 mg de endotoxina de Escherichia coli. La oveja es muy sensible a la endotoxina y presenta una respuesta cardiovascular trifásica tras la infusión de endotoxina12: a) una primera fase precoz de HTP inmediatamente después de la endotoxemia, vinculada con la liberación de tromboxano A213; b) una segunda fase hipodinámica donde la presión arterial pulmonar (PAP) desciende al igual que el gasto cardíaco (GC), manteniéndose constante la presión arterial sistémica media (PAM), y c) una fase final hiperdinámica caracterizada por el aumento del GC e hipotensión sistémica. La resistencia vascular sistémica desciende debido a la vasoplejía producida por la superproducción de óxido nítrico al estimularse la isoforma inducible de la óxido nítrico-sintetasa12. Se analizaron únicamente los datos extraídos durante la primera fase de HTP.
Se realizaron oclusiones rápidas y transitorias (durante un máximo de l2 s) de la vena cava posterior con el objetivo de calcular la relación trabajo sistólico-volumen diastólico final (TSVDF).
Los experimentos fueron realizados siguiendo las normas éticas y las recomendaciones internacionales sobre investigación en animales de laboratorio, ratificadas en Helsinki y actualizadas en l985 por la Sociedad Americana de Fisiología14.
Adquisición de datos
Las presiones ventriculares, de aorta y arteria pulmonar, así como el flujo pulmonar y las señales ultrasónicas de los diámetros ventriculares, fueron monitorizadas simultáneamente en tiempo real y digitalizadas on line cada 5 ms con un conversor analógico-digital (Data Translation 2808) acoplado a un microprocesador. Los datos digitalizados fueron procesados off-line usando un programa especialmente desarrollado en nuestro laboratorio.
En cada ciclo cardíaco, el inicio de la eyección se definió en el momento del pico positivo de la dP/dt, el cual coincidió con el inicio del descenso de la curva de volumen correspondiente, mientras que el fin de la eyección se determinó en el momento del mínimo valor del volumen ventricular, el cual coincidió para el VD con un flujo pulmonar de 0. El punto en el cual se alcanzó el máximo valor del cociente entre presión y volumen del VD y VI (Emáx) fue definido como el punto sistólico final. El fin de la diástole fue definida como el momento en el cual comienza el ascenso rápido de la dP/dt. Por tanto, cada ciclo fue individualizado desde el fin de la diástole previa al fin de la diástole presente.
Necropsia
Al concluir el experimento, el animal fue sacrificado con una inyección intravenosa de cloruro de potasio bajo anestesia profunda. Extraído el corazón, se confirmó la posición correcta de los cristales piezoeléctricos implantados. Luego se escindieron las aurículas y el tejido valvular; la pared libre del VD fue separada del VI y sus volúmenes, por separado, se cuantificaron por desplazamiento de agua8.
Cálculos
Asumiendo el modelo elipsoidal de la cavidad ventricular izquierda8, el VVI fue calculado de acuerdo con la siguiente ecuación:
VVI = (a.b.c. π/6) - VMV (1)
donde VMV es el volumen desplazado por la masa del VI determinada post mortem, como se ha descrito con anterioridad; a, b, c, son los diámetros externos del VI, ápex-base, anteroposterior y septum-pared libre, respectivamente.
El volumen del VD fue calculado de acuerdo con el modelo elipsoidal de sustracción8 según el cual el volumen de la pared libre del VD y el volumen del VI (dentro de sus límites epicárdicos) se restan del volumen total de ambos ventrículos (dentro de sus límites epicárdicos). El volumen biventricular se calculó hallando sus 3 diámetros axiales (a, b, c + d) de la fórmula general del elipsoide, donde d es el diámetro septum-pared libre del VD. El volumen de la pared libre del VD (VPV) fue determinado post mortem, al igual que VMV. Por tanto, la fórmula que calcula el VVD es la siguiente:
VVD = π/6.a.b. (c+d) - π/6.a.b.c - VPV (2)
= π/6.a.b.d - VPV (3)
Se calcularon las resistencias vasculares sistémicas y pulmonares (RVS y RVP) de acuerdo con el cociente entre la diferencia de presiones en cada circuito y el gasto cardíaco (GC). La presión auricular media fue estimada por la presión diastólica final (PDF) de cada ventrículo, respectivamente:
RVS = PAM - PDFVI/GC (4)
RVP = PAPM - PDFVD/GC (5)
donde PAM es la presión arterial sistémica media y PAPM es la presión arterial pulmonar media.
El volumen de eyección (VE) fue calculado de acuerdo con la siguiente ecuación:
VE = GC/FC (6)
donde FC es la frecuencia cardíaca.
Los primeros latidos inmediatos a la oclusión de la vena cava posterior fueron descartados siendo seleccionados los latidos tras la producción de un descenso significativo de las presiones y volúmenes. Los latidos seleccionados fueron consecutivos, descartándose los latidos extrasistólicos y postextrasistólicos. Utilizando los latidos seleccionados se calculó la relación TSVDF mediante el análisis de regresión lineal. Dicha relación fue ajustada de acuerdo con la siguiente ecuación:
TS = MW. (VDF-VW) (7)
donde MW es la pendiente, VDF es el volumen diastólico final y VW es la intersección sobre el eje de volumen. El MW constituye el índice de contractilidad miocárdica más confiable debido a que es independiente de las condiciones de carga, geometría y FC15,16.
La primera derivada de la presión del VD y del VI (dP/dt) se calculó digitalmente, así como la primera derivada de los volúmenes ventriculares (dV/dt).
Análisis estadístico
Los datos se expresaron como media ± desviación estándar. Se compararon los datos mediante el uso del test no paramétrico para muestras pareadas (test de Wilcoxon). La significación estadística fue establecida por un valor de p < 0,05.
RESULTADOS
Datos hemodinámicos
Después de 3-5 minutos de la infusión i.v. de endotoxina, la poscarga del VD medida por la PAPM aumentó de 11,9 ± 1,3 a 24 ± 3,6 mmHg (p < 0,05). Durante este período, la RVP se incrementó significativamente (p < 0,05) en tanto no hubo modificaciones significativas de los siguientes parámetros: FC, VE, GC, PAM, RVS, VDF y MW del VD (tabla 1).
Fases del ciclo cardíaco
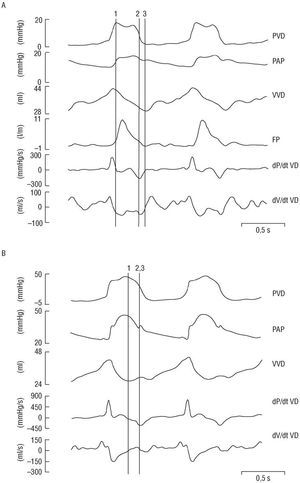
El aumento agudo de la poscarga (PAPM) produjo los siguientes cambios en el VD: a) la Emáx se desplazó hacia el fin de la eyección (127,5 ± 18,5 ms) y el tiempo de eyección se acortó (57,5 ± 20,3 ms), de manera que dP/dtmáx coincidió con el fin de la eyección; b) el tiempo entre el comienzo de la fase de eyección y la dP/dtmáx no cambió (300 ± 20; 310 ± 22 ms) (tabla 2), y c) la eyección puso de manifiesto una única fase (fig. 1A y 1B).
Fig. 1. Registros de las presiones ventriculares y arteriales, volumen ventricular, flujo pulmonar y primera derivada de la presión y volumen ventricular. A: en condiciones basales. B: durante la hipertensión arterial pulmonar. FP: flujo pulmonar; PVD: presión ventricular derecha; PAP: presión arterial pulmonar; VVD: volumen ventricular derecho; dP/dt y dV/dt VD: primera derivada de la presión y volumen ventricular derecho, respectivamente. 1: Emáx, 2: -dP/dtmáx, 3: fin de la eyección.
El tiempo entre el comienzo de la fase de eyección del VI y fin de sístole, dP/dtmáx y fin de eyección no cambiaron significativamente durante de la HTP provocada experimentalmente (tabla 2).
Relación presión-volumen
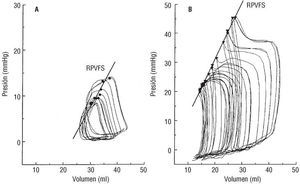
La morfología del bucle P-V del VD no se modificó durante la maniobra de precarga (oclusión de vena cava posterior) (fig. 2A). Después del aumento de la poscarga del VD, su bucle P-V adoptó una forma rectangular, con la aparición de fases isovolumétricas sistólica y diastólica, y la presión del VD alcanzó su máximo valor al fin de la eyección (fig. 2B).
Fig. 2. Bucles P-V del ventrículo derecho con la relación P-V de fin de sístole (RPVFS), registrados durante la oclusión de la vena cava posterior. A: en condiciones basales. B: durante la hipertensión arterial pulmonar.
DISCUSIÓN
Redington et al7 obtuvieron bucles P-V del VD de morfología rectangular en pacientes con presión ventricular derecha sistólica elevada secundaria a estenosis valvular pulmonar y tetralogía de Fallot. Burstin et al17 y Triffon et al18 describieron la existencia de fase de relajación isovolumétrica en el VD en pacientes con HTP. Zwissler et al19 demostraron que los bucles presión-longitud de las cámaras de entrada y salida del VD adoptaban una forma rectangular durante la HTP provocada por microembolización pulmonar.
Nosotros demostramos que los cambios de precarga del VD no modifican la morfología triangular característica del bucle P-V9,10, al igual que Redington et al7.
Con PAP normal, el VD presenta un patrón de contracción asincrónico, peristáltico, con un desfasaje temporal entre el infundíb ulo y el sinus del 15% del ciclo cardíaco2,9. Esta asincronía en la contracción de ambas cámaras explica la fase de eyección prolongada del VD (subdividida en 2 fases: temprana y tardía)9, la forma triangular de su bucle P-V7,9,10, la ausencia de fases isovolumétricas1,9,11 y su eficiencia de ciclo del 60%5. En el presente estudio demostramos que el patrón de contracción asincrónico (peristáltico) característico del VD con PAP normal cambia a un patrón de contracción sincrónico (uniforme) durante la HTP aguda y moderada, adoptando las características mecánicas propias del VI: a) el bucle P-V del VD se hace rectangular, con fases isovolumétricas de contracción y relajación; b) la fase de eyección del VD se acorta, perdiendo sus dos fases (temprana y tardía) descritas anteriormente9, adoptando el patrón de contracción del VI (una única fase); c) el fin de la eyección coincide con la dP/dtmáx, por lo que la dP/dtmáx puede ser utilizada para marcar el fin de la eyección del VD, como ocurre usualmente en el VI20, y d) el tiempo entre el comienzo de la fase de eyección del VD y el fin de sístole se hace similar al del VI. Debido a que el GC y la relación TSVDF se mantienen constantes, descartamos la existencia de isquemia durante la HTP provocada en nuestros experimentos. En este sentido, Schwartz et al21 demostraron que la función contráctil del VD se mantiene durante un aumento de presión arterial pulmonar moderada (presión sistólica del VD de 40-45 mmHg) y que el fallo mecánico del VD por isquemia miocárdica se produce cuando la HTP es severa (>= 60 mmHg).
Consideraciones funcionales
Este estudio demuestra que el cambio del patrón de contracción asincrónico (secuencial o peristáltico) del VD con PAP normal a un patrón de contracción sincrónico (uniforme) con HTP le permite al VD mantener su función sistólica (GC) sin modificar su precarga (VDF) ni su contractilidad (TSVDF). Este patrón de contracción sincronizado que adquiere el VD durante un aumento agudo y moderado de su poscarga, adoptando las características mecánicas y de ciclo propias del VI, nos permite plantear un nuevo mecanismo de reserva mecánica del VD, aún no descrito, y al cual denominamos «izquierdización» del comportamiento mecánico del VD. Por tanto, el VD tendría otro mecanismo de adaptación fásico (latido a latido) además de los mecanismos de Frank-Starling e inotrópicos, para regular su rendimiento mecánico. Borrego et al22 demostraron que con el pericardio cerrado, la máxima presión que el VD puede soportar es significativamente mayor que con el pericardio abierto. Por tanto, la «izquierdización» del VD, con pericardio cerrado, podría mantene rse con presiones pulmonares mayores, sin disminución de la función ventricular derecha, y estaría limitado por la aparición de un compromiso isquémico de dicho ventrículo21.
Trabajos recientes demuestran que pacientes con insuficiencia cardíaca y retardo en la conducción intraventricular presentan una significativa mejoría de la función contráctil estimulando eléctricamente con marcapasos la región con activación retardada20,21. La estimulación aguda con marcapasos en corazones normales produce descoordinación del movimiento de la pared reduciendo la función contráctil, en tanto que
la estimulación con marcapaso de la región con retardo patológico de la activación (y con un apropiado retardo auriculoventricular con marcapaso bicameral) podría mejorar la sincronía de la contracción y la función sistólica23. Estos trabajos concuerdan con nuestros hallazgos, con la diferencia de que nosotros describimos la sincronización de la contracción del VD frente a un aumento agudo y moderado de su poscarga, y a partir de un VD que en condiciones fisiológicas (poscarga normal) tiene un patrón de contracción asin-
crónico.
De Vroomen et al25, trabajando con ovejas recién nacidas describieron un aumento de la contractilidad del VD en respuesta a un aumento de su poscarga sin aumento de su volumen diastólico final. Estos autores utilizan como índice de contractilidad la relación presión-volumen sistólica final, el cual tiene el inconveniente de modificarse con las variaciones de poscarga, a diferencia de la relación TSVDF, con la cual nosotros cuantificamos la contractilidad. Esta última ha demostrado ser el índice de contractilidad más confiable debido a que es independiente de las condiciones de carga, frecuencia cardíaca y geometría ventricular16. De todos modos, sus observaciones se aproximan a las realizadas por nosotros en ovejas adultas. Estos mismos autores25 tratan de explicar sus hallazgos a través de supuestos mecanismos de aumento de la actividad del calcio, de catecolaminas o intermediado por el endotelio endocárdico, sin demostrar experimentalmente la posible existencia de los mismos. En cambio, nuestros experimentos demuestran que durante el aumento de poscarga la fase de eyección se acorta, realizándose en una sola fase (al igual que el VI), lo cual determina un patrón de contracción sincrónico.
Chen et al26 demostraron un aumento de contractilidad del VD en perros trasplantados a los que se les produjo previamente una HTP moderada inducida por monocrotalina utilizando como índice de contractilidad el TSVDF, al igual que nosotros, pero sin explicar su mecanismo.
Futuros estudios deberán cuantificar la «izquierdización» del comportamiento mecánico del VD frente a diferentes grados de aumento de su poscarga, así como también analizar otros mecanismos posibles que puedan sincronizar el patrón de contracción del VD (p. ej., estimulación adrenérgica). Todo ello redundará en una mejor comprensión de la fisiopatología y tratamiento de la disfunción del VD en diversas situaciones clínicas (tromboembolismo pulmonar, cardiopatías congénitas, postoperatorio de cirugía cardíaca, trasplante cardíaco ortotópico).
CONCLUSIONES
Frente a un aumento agudo y moderado de su poscarga el VD adquiere las características mecánicas del VI. Esta «izquierdización» del comportamiento mecánico del VD se produce porque su contracción asincrónica desde su cámara de entrada a la de salida, con poscarga normal se sincroniza en condiciones de poscarga aumentada. Dicha sincronización de la contracción del VD constituye un mecanismo de compensación propio de este ventrículo que le permite mantener su función sistólica en situación de poscarga aumentada, independiente de la precarga y de la contractilidad.
Correspondencia: Dr. F. Ginés. Facultad de Medicina. Universidad de la República. Gral. Flores, 2125. 11800 Montevideo. Uruguay. Correo electrónico: jgrig@fmed.edu.uy Recibido el 2 de noviembre del 2000. Aceptado para su publicación el 1 de marzo del 2001.