Palabras clave
INTRODUCCIÓN
La baja incidencia de cardiopatía isquémica en la población de sexo femenino durante su edad fértil, junto con el progresivo aumento en la incidencia de enfermedad cardiovascular a partir de la menopausia, hizo sospechar que las hormonas femeninas ejercían un efecto beneficioso y protector1. Si bien los estrógenos no han demostrado hasta ahora un efecto bene ficioso sobre la prevención secundaria de las enfer-
medades cardiovasculares2, estudios observacionales amplios sí han demostrado un claro beneficio sobre la prevención primaria de las mismas3. Los mecanismos específicos que conducen a este beneficio están todavía poco aclarados, pero probablemente sean multifactoriales4,5. Se ha demostrado que los estrógenos tienen un efecto favorable sobre el perfil lipídico que, sin embargo, parece ser responsable sólo del 30% de la reducción del riesgo cardiovascular por parte del tratamiento estrogénico6. Además, los estrógenos tienen una acción directa sobre el endotelio y la pared arterial produciendo vasodilatación y, en consecuencia, una disminución de las resistencias vasculares4-6.
El mecanismo exacto por el cual los estrógenos producen este efecto vasodilatador es aún desconocido. Estudios previos han demostrado un efecto agudo de los estrógenos sobre la producción del óxido nítrico, en concreto estimulando la actividad de la óxido nítrico sintetasa7 y otro efecto crónico, estimulando la expresión de la misma enzima8, encargada de generar el óxido nítrico en el endotelio. Por otro lado, otros autores han demostrado que el efecto vasodilatador observado tras la administración aguda de estradiol está mediado por un mecanismo antagonista del calcio y, por tanto, dependiente del endotelio. Nuestro objetivo fue estudiar si la administración aguda de estradiol potencia la vasodilatación dependiente del endotelio en un modelo experimental humano in vitro, y si este efecto se halla mediado por el óxido nítrico.
MÉTODOS
Muestras arteriales
Se obtuvo un segmento distal de la arteria mamaria interna utilizada durante la cirugía de revascularización de pacientes con enfermedad coronaria. Esta arteria constituye un espécimen que se puede obtener de enfermos sometidos a cirugía de revascularización miocárdica sin que suponga un riesgo añadido para ellos y, además, suele tener poca afección aterosclerótica. Durante el acto quirúrgico, la arteria mamaria interna izquierda fue disecada meticulosamente obteniéndose un segmento de 10 mm de su extremo más distal.
Una vez extraído, el segmento arterial fue introducido en un recipiente estéril con solución tampón de Krebs-Henseleit modificada (composición en mmol/l: NaCl 118; glucosa 11; NaHCO3 25; KCl 4,7; MgSO4 1,2; KH2PO4 1,2; CaCl2 1,2 y EDTA 0,03) a una temperatura de 37 °C para pasar a su inmediato procesamiento en cámara de baño de órganos.
Reactivos
El 17-ß estradiol fue preparado en una dilución con solvente de etanol al 1/1.000. La noradrenalina se diluyó en una disolución de HCL al 1% y posteriormente en agua destilada hasta obtener la dilución requeri da para obtener una concentración final en baño de 106 mol/l. El inhibidor del óxido nítrico L-NNA y la acetilcolina se disolvieron asimismo en agua destilada. Los reactivos fueron preparados a diario y se añadieron al baño de órganos en volúmenes de 100 µl. Las respectivas concentraciones se expresan como concentraciones molares finales en el baño de órganos. Todos los reactivos se obtuvieron en Sigma Química (Alcobendas, España).
Baño de órganos
Preparación de tejidos
Los segmentos arteriales fueron disecados cuidadosamente para retirar el tejido adiposo y conectivo circundantes, obteniéndose anillos arteriales de 3-5 mm de longitud. Se tuvo especial cuidado en preservar la capa endotelial. Cada anillo arterial fue colocado en una cámara de baño de órganos con 10 ml de solución tampón de Krebs-Henseleit modificada. Se mantuvo un aporte constante de gas a la solución tampón que consistió en una mezcla de 95% de O2 y de 5% de CO2; así mismo, a través de un sistema de bomba de calor se mantuvo una temperatura constante de 37 °C. Cada anillo fue conectado a un transductor capaz de detectar cambios de tensión, que se registraron en un polígrafo multicanal (Letica S.A., L'Hospitalet, España).
Se dejó que los anillos se equilibraran durante unos 40 min hasta que se obtuvo una tensión basal de 1,5 g. En experimentos previos hemos observado que una tensión basal o en reposo de 1,5 g es la óptima para que se produzca una respuesta contráctil correcta en anillos de arteria mamaria interna humana (observaciones no publicadas).
Tras alcanzar el equilibrio, los anillos fueron con traídos con 106 mol/l de noradrenalina. Esta primera contracción fue, de hecho, considerada como una precontracción, pues tras la misma no se añadió acetilcolina y sólo se usó a modo de precondicionamiento para optimizar la reactividad de la muestra arterial. Posteriormente, tras un período de lavado y una vez estabilizado el anillo arterial en la linea basal de nuevo, se inició el estudio experimental propiamente dicho.
Protocolo de reactividad vascular in vitro
Los anillos arteriales fueron de nuevo contraídos con 106 mol/l de noradrenalina. Únicamente se consideraron para el análisis final de resultados aquellos anillos con contracciones basales en respuesta a la adición de noradrenalina iguales o superiores a 1 g, considerando que éstos son los que presentan una curva de relajación valorable. Una vez alcanzada una fase estable o de meseta se añadió al medio acetilcolina en concentraciones crecientes (desde 109 hasta 102 mol/l) para evaluar la relajación o vasodilatación dependiente del endotelio. Tras un período de lavado con solución tampón de 30 min se añadieron al medio 106 mol/l de 17-ß-estradiol. Esta dosis, aunque alcanza concentraciones superiores a las fisiológicas en el plasma, es similar a la utilizada en experimentos previamente descritos de similar metodología al presente9-11. Después de 15 min los anillos volvieron a ser contraídos con 106 mol/l de noradrenalina, hasta obtener una tensión estable. Entonces, nuevamente se volvieron a añadir concentraciones crecientes de acetilcolina (109 a 102 mol/l) para valorar la respuesta relajante en presencia de estradiol en el medio.
De manera simultánea, algunos anillos estudiados fueron tratados con anterioridad con un inhibidor de la óxido nítrico sintetasa, N(‡)-nitro-L-arginina (L-NNA), para evaluar el efecto de esta inhibición sobre la acción vasodilatadora del estradiol. De este modo, se añadieron 104 mol/l de L-NNA al medio en situación basal, antes de añadir al medio noradrenalina, y nuevamente antes de la segunda contracción, tras haber enriquecido el medio con estradiol.
Para cada anillo se determinó la máxima tensión o contracción desarrollada tras la adición de noradrenalina al medio, así como la mínima tensión o máxima relajación alcanzada tras la adición de acetilcolina. El porcentaje de cambio entre ambas tensiones se utilizó para expresar la actividad relajante de la acetilcolina. Estas determinaciones se realizaron del mismo modo antes y después de la adición de estradiol al medio, en los anillos con y sin L-NNA.
Análisis estadístico
Todos los valores se expresan como media ± desviación estándar. Se utilizó la prueba de la t de Student para comparar medias apareadas. Se consideró significativo un valor de p < 0,05. Los valores de n se refieren al número de anillos arteriales analizados.
RESULTADOS
Se estudiaron un total de 59 anillos procedentes de 19 muestras de arteria mamaria interna humana (10 varones y 9 mujeres, edad media 67 ± 11 años) obtenidos durante la cirugía de revascularización coronaria. Todos los pacientes tenían enfermedad corona ria de grado severo, con indicación clínica y angiográfica de tratamiento quirúrgico. Además, todos ellos recibieron tratamiento vasodilatador con nitratos, bloqueadores betaadrenérgicos y/o antagonistas del calcio. Dicho tratamiento fue suspendido en las 8-10 h previas a la cirugía, sin que existieran diferencias de medicación entre los grupos estudiados. De los 59 anillos arteriales estudiados, en 18 se observó una contracción igual o superior a 1 g tras la adición de 106 mol/l de noradrenalina al baño de órganos, y son los estudiados.
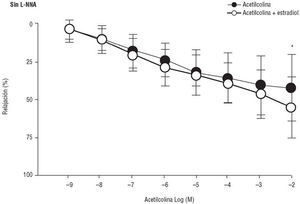
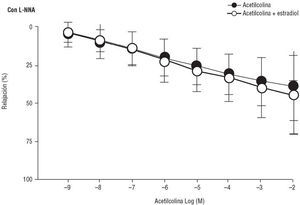
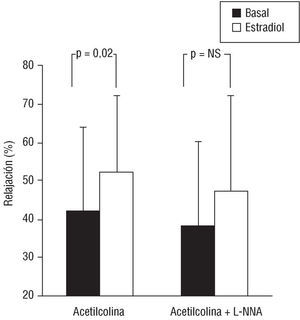
En la tabla 1 se expone la respuesta contráctil inducida por la adición de 106 mol/l de noradrenalina al baño, así como la posterior relajación máxima obtenida en respuesta a la acetilcolina, en los 18 anillos arteriales finalmente analizados, tanto en situación basal como en presencia de estradiol. En los anillos procesados sin L-NNA, la adición de estradiol al medio potenció la relajación en respuesta a la acetilcolina (52 ± 20% con estradiol frente 42 ± 22% en situación basal; n = 10; p = 0,02) (fig. 1), sin cambiar la contracción máxima obtenida (1.945 ± 864 g frente a 1.835 ± 805 g, respectivamente; p = NS). Sin embargo, en los anillos procesados con L-NNA, la vasodilatación dependiente del endotelio no aumentó de manera significativa tras la adición de estradiol al medio (47 ± 25% con estradiol frente a 38 ± 22% sin estradiol; n = 8; p = NS) (figs. 2 y 3). La respuesta contráctil a la noradrenalina tampoco varió significativamente en los anillos procesados con L-NNA antes y después de la adición de estradiol al medio: 1.993 ± 490 frente a 2.100 ± 580 g; p = NS).
Fig. 1. Curvas de relajación en respuesta a la acetilcolina en ausencia de L-NNA.
Fig. 2. Curvas de relajación en respuesta a la acetilcolina en presencia de L-NNA.
Fig. 3. Respuesta vasodilatadora a la acetilcolina en presencia o no de L-NNA.
De los anillos procesados sin L-NNA, cinco procedían de pacientes de sexo masculino y cinco de pacientes de sexo femenino. La relajación inducida por la acetilcolina aumentó significativamente tras la adición de estradiol, sin que se detectaran diferencias significativas entre los anillos procedentes de varones y de mujeres (incremento del 34 ± 24% frente a un incremento del 22 ± 20%, respectivamente; p = NS).
DISCUSIÓN
En este estudio, la presencia de estradiol potenció de manera significativa la vasodilatación dependiente del endotelio inducida por acetilcolina en anillos de arteria mamaria interna humana; este efecto se redujo cuando se añadió al medio un inhibidor de la óxido nítrico sintetasa (L-NNA), sugiriendo que el efecto está mediado por un aumento en la liberación de óxido nítrico.
Nuestros resultados concuerdan con los descritos por Gisclard et al12, que demostraron que la acetilcolina producía una relajación dependiente del endotelio significativamente mayor en anillos de conejos hembra ooforectomizadas que habían seguido tratamiento sustitutivo con estrógenos que en anillos procedentes de conejos hembra ooforectomizadas que no habían recibido terapia hormonal. Del mismo modo, cuando los anillos arteriales de conejos hembra que habían recibido estrógenos eran desendotelizados, la acetilcolina no producía relajación alguna.
Además de actuar potenciando la vasodilatación dependiente del endotelio, los estrógenos han demostrado tener capacidad vasodilatadora directa. Así, el estradiol es capaz de relajar anillos arteriales de conejos contraídos previamente con endotelina, con independencia de si hay o no endotelio, y de la adición de un inhibidor de la óxido nítrico sintetasa, L-NAME9. En arterias procedentes de humanos, usando también cámaras de baño de órganos, Mügge et al han demostrado que el estradiol relaja los anillos de arteria coronaria obtenida a partir de corazones explantados y precontraídos con la prostaglandina PGF2α10 de un modo dependiente de la dosis e independiente de la existencia o no de endotelio. Chester et al, también utilizando arterias coronarias humanas obtenidas a partir de corazones explantados, han observado este mismo efecto relajante del estradiol sobre anillos precontraídos con un análogo del tromboxano A2; del mismo modo, dicho efecto se ha observado con independencia de la presencia o no de endotelio o de la adición de L-NAME al medio13. Finalmente, se ha demostrado que el estradiol disminuye la contracción inducida por un agonista de los canales del calcio, lo que sugiere que los estrógenos pueden tener un cierto efecto antagonista del calcio y, por tanto, vasodilatador14.
Así pues, y de acuerdo con estos estudios previos, el estradiol potenciaría, por un lado, la vasodilatación dependiente del endotelio, y por otro, actuaría como un vasodilatador arterial directo, por un mecanismo independiente del endotelio. El hecho diferencial entre estos diversos estudios y que podría justificar la discrepancia de los resultados fue la dosis empleada de estradiol. A este respecto, estudios posteriores realizados en baño de órganos utilizando anillos arteriales procedentes de conejos hembra han aclarado que la adición de L-NNA al medio es capaz de inhibir de manera significativa la relajación inducida por concentraciones bajas de estradiol (109 a 106 mol/l), pero no la inducida por concentraciones mayores de estradiol (105 a 104 mol/l)11.
En el presente estudio utilizamos dosis bajas, aunque suprafisiológicas, de estradiol (106 mol/l), ob servando que se potencia significativamente la vasodilatación dependiente del endotelio mediada por acetilcolina, y que este efecto se reduce al añadir el inhibidor de la óxido nítrico sintetasa, L-NNA. En este sentido, nuestro estudio difiere de los previos realizados con arterias humanas en los que se evaluó la capacidad vasodilatadora de diferentes dosis de estradiol sobre anillos precontraídos con distintas sustancias, es decir, se evaluó el efecto vasodilatador directo del estradiol. Por otro lado, nuestros resultados coinciden con los de Collins et al, que demostraron que el estradiol, a la concentración de 106 mol/l, potenciaba la vasodilatación dependiente del endotelio en anillos de arterias de conejo11. Finalmente, este efecto se ha observado también in vivo, en arterias coronarias de pacientes menopáusicas, en las que la infusión intracoronaria de estradiol a dosis similares a las fisiológicas aumentó la respuesta vasodilatadora a la acetilcolina; este efecto se inhibió al infundir L-NAME intracoronario15. Nuestros resultados utilizando un modelo in vitro con anillos de arterias humanas confirman los hallazgos previos obtenidos en estos modelos animales in vitro y los obtenidos in vivo en pacientes.
Por tanto, el estradiol a dosis bajas, similares o ligeramente superiores a las fisiológicas, actuaría potenciando la vasodilatación dependiente del endotelio a través de un mecanismo mediado por el óxido nítrico, hecho demostrado por la menor relajación observada en presencia de L-NNA en nuestro estudio. Además, a concentraciones mayores, el estradiol podría tener un efecto vasodilatador directo, probablemente mediado por un antagonismo de los canales del calcio; este último hecho justificaría que en nuestro estudio se observara una cierta tendencia a una mayor relajación tras la adición de estradiol a pesar de la presencia concomitante de L-NNA.
Limitaciones del estudio
No hemos conseguido demostrar una diferencia significativa en el grado de relajación observada tras la adición de estradiol entre anillos arteriales procedentes de varones y de mujeres. Este hecho ha sido demostrado con anterioridad en otros estudios y probablemente esté en relación con la distinta distribución de receptores estrogénicos en ambos sexos16,17. Creemos que el reducido tamaño de la muestra analizada puede justificar que no hayamos encontrado esta diferencia. En este sentido, la baja rentabilidad de los estudios efectuados en baño de órganos que utilizan especímenes procedentes de humanos ha sido ya descrita con anterioridad. Así, se sabe que la vasorreactividad de las arterias humanas estudiada en el baño de órganos no tiene tan buenos resultados como los obtenidos al estudiar arterias de animales18. En nuestro caso, la rentabilidad ha sido del 30%. Además, la recogida de la muestra en nuestro caso se vio sometida a una inevitable variabilidad por las diferentes calidades y calibres de cada arteria mamaria interna, de la que utilizamos su segmento más distal, que habitualmente mide unos 2 mm de diámetro o menos, sobre todo en mujeres. La manipulación de anillos arteriales tan pequeños puede conllevar un cierto daño endotelial, lo que ha podido repercutir, a su vez, en una menor relajación dependiente del endotelio. Finalmente, hemos trabajado con arterias procedentes de pacientes con factores de riesgo y arteriosclerosis demostrada, y en el caso de las muestras de pacientes de sexo femenino, menopáusicas. Todos ellos son factores ampliamente relacionados con disfunción endotelial19, lo que justifica también la pequeña vasodilatación observada en respuesta a la adición de acetilcolina en la presente investigación. El corto período de lavado del tratamiento vasodilatador, por otro lado inevitable en pacientes con enfermedad coronaria sintomática como los evaluados, ha podido, además, influir en este resultado. A pesar de todo ello, el porcentaje de relajación dependiente del endotelio observado en nuestro estudio no difiere en gran medida del descrito previamente para arterias mamarias internas humanas, que fue del 56 ± 9%20.
CONCLUSIONES
Este estudio demuestra que el estradiol produce in vitro un aumento en la vasodilatación dependiente del endotelio en anillos arteriales de arteria mamaria interna humana, efecto que disminuye al añadir al medio un inhibidor de la síntesis de óxido nítrico (L-NNA). Por tanto, el efecto vasodilatador del estradiol dependería en parte de una mayor disponibilidad de óxido nítrico, bien porque su producción es mayor, bien porque su degradación es menor21. Sin embargo, el efecto vasodilatador del estradiol no depende únicamente del óxido nítrico, puesto que incluso al estar éste inhibido persiste un cierto efecto potenciador de la vasodilatación mediada por acetilcolina por parte del estradiol.
AGRADECIMIENTO
Deseamos expresar nuestro profundo agradecimiento a los cirujanos, anestesiólogos diplomados de enfermería y a todo el personal de los quirófanos de cirugía cardíaca del Hospital Clínic de Barcelona por su ayuda, que fue esencial para el desarrollo de este estudio.
Estudio realizado con la ayuda de una beca del Ministerio de Sanidad y Consumo (DGYCIT 96/0025). Correspondencia: Dra. M. Heras. IMCV. Hospital Clínic. Villarroel, 170. 08036 Barcelona. Correo electrónico: mheras@clinic.ub.es Recibido el 19 de septiembre del 2000. Aceptado para su publicación el 23 de febrero del 2001.