El estudio de la mecánica miocárdica tiene un papel potencial en la detección de afectación cardiaca en pacientes con amiloidosis. El objetivo de este estudio fue caracterizar la mecánica miocárdica ventricular izquierda y derecha mediante ecocardiografía de rastreo de marcas (speckle tracking) tridimensional y examinar su relación con el péptido natriurético cerebral.
MétodosSe estudió a pacientes con amiloidosis de cadenas ligeras y se obtuvieron los valores de deformación (strain) longitudinal y circunferencial del ventrículo izquierdo (n=40) y de strain longitudinal y desplazamiento radial del ventrículo derecho (n=26) mediante ecocardiografía speckle tracking tridimensional. Se determinaron las concentraciones de péptido natriurético cerebral.
ResultadosTodos los parámetros de la mecánica miocárdica mostraron diferencias al comparar los distintos grupos de terciles de péptido natriurético cerebral. Los valores de strain longitudinal de los ventrículos izquierdo y derecho mostraron alta correlación (r=0,95; p<0,001). Se observó una reducción del strain longitudinal (–9±4 frente a –16±2; p<0,001) y el strain circunferencial del ventrículo izquierdo (–24±6 frente a –29±4; p=0,01) en los pacientes con afectación cardiaca, y el deterioro más notable fue en los segmentos basales. Se observó una disminución del strain longitudinal (–9±3 frente a –17±3; p<0,001) y el desplazamiento radial del ventrículo derecho (2,7±0,8 frente a 3,8±0,3; p=0,002) en los pacientes con afectación cardiaca. En el análisis multivariable, el strain longitudinal del ventrículo izquierdo se asoció a la presencia de afectación cardiaca (odds ratio = 1,6; intervalo de confianza del 95%, 1,04-2,37; p=0,03) con independencia de que el péptido natriurético cerebral y la troponina I mostraran criterios de amiloidosis cardiaca.
ConclusionesLa mecánica miocárdica ventricular izquierda y derecha obtenida mediante ecocardiografía speckle tracking tridimensional se altera de manera creciente a medida que aumenta el péptido natriurético cerebral en la amiloidosis de cadenas ligeras. Parece que existe una asociación intensa entre el strain longitudinal del ventrículo izquierdo y la afectación cardiaca, más allá de los biomarcadores como el péptido natriurético cerebral y la troponina I.
Palabras clave
La amiloidosis sistémica, en su variante de cadenas ligeras (AL), se caracteriza por la discrasia de células plasmáticas como origen de cadenas ligeras de inmunoglobulinas monoclonales, que son tóxicas y se depositan en múltiples órganos. Más de la mitad de los pacientes (51-63%) afectados por este trastorno muestran afectación cardiaca en el momento del diagnóstico1–3; este es el factor pronóstico más importante por lo que respecta a la progresión natural de esta enfermedad4,5.
La detección de la afectación cardiaca se ha basado clásicamente en unos hallazgos característicos en la biopsia endomiocárdica, dentro de un contexto clínico o analítico apropiado, o en los signos ecocardiográficos de amiloidosis asociados a un resultado positivo de una biopsia no cardiaca6,7. Estudios recientes indican que ciertos biomarcadores cardiacos específicos, como el péptido natriurético cerebral (BNP) y la troponina cardiaca, son potentes instrumentos diagnósticos y pronósticos en la amiloidosis AL1,8. Se ha demostrado que la fracción aminoterminal del propéptido natriurético cerebral (NT-proBNP) es un marcador sensible de la afectación cardiaca en los pacientes con amiloidosis, lo cual le da mayor valor, que va más allá de los signos electrocardiográficos y ecocardiográficos clásicos para la diferenciación de la afectación cardiaca1. Además, este biomarcador es un factor independiente predictivo de la supervivencia a la amiloidosis AL1,8 y se ha utilizado para clasificar a los pacientes en diferentes grupos pronósticos8.
Junto con la ecocardiografía convencional, las técnicas ecográficas como el Doppler y, más recientemente, el estudio de la mecánica miocárdica derivada de la ecocardiografía de rastreo de marcas o speckle tracking (STE)9,10 han mostrado una posible utilidad en la detección de la afectación cardiaca y la predicción del pronóstico de los pacientes con amiloidosis11–13. Aunque los algoritmos de la STE bidimensional se han aplicado a la evaluación de la afectación cardiaca en los pacientes con amiloidosis13–15, las técnicas de imagen bidimensionales tienen posibles limitaciones técnicas como consecuencia de la incapacidad de seguir el movimiento fuera del plano16. Además, la estructura y la función del ventrículo derecho (VD), que son otra característica pronóstica de posible importancia17,18, solo se han estudiado muy poco empleando esta técnica. El objetivo de este estudio es caracterizar la mecánica miocárdica del ventrículo izquierdo (VI) y el VD derivada de la STE tridimensional en pacientes con amiloidosis AL y examinar la relación entre la mecánica ventricular y las concentraciones de BNP circulantes en estos pacientes.
MÉTODOSSe obtuvieron prospectivamente (entre mayo de 2011 y agosto de 2012) datos de pacientes a los que se realizó una evaluación para determinar la amiloidosis en el Tufts Medical Center. El estudio recibió la aprobación del comité ético del centro, y los participantes en el estudio dieron su consentimiento informado. En el momento de la evaluación, a la mayoría de los participantes en el estudio se les había diagnosticado anteriormente de amiloidosis AL; a los pacientes sin un diagnóstico definitivo en la visita realizada en la clínica, se les realizaron las pruebas apropiadas para descartar o establecer la enfermedad.
En todos los participantes, el diagnóstico de amiloidosis AL se confirmó mediante una tinción positiva de rojo Congo para amiloide (en un aspirado de grasa, médula ósea o en una biopsia de un órgano), evidencia de la presencia de amiloide de cadenas ligeras (mediante tinción inmunohistoquímica o microscopia de inmunofluorescencia) y detección de un trastorno proliferativo plasmocitario monoclonal (determinado mediante inmunofijación en suero/orina, análisis de la proporción de cadenas ligeras libres en suero o examen de una muestra de médula ósea). En el contexto citado, se consideró que había afectación cardiaca cuando se cumplía al menos uno de los siguientes criterios: a) tinción de rojo Congo positiva para amiloide en una biopsia endomiocárdica; b) grosor de la pared del VI > 12 mm (en ausencia de posibles causas evidentes de la magnitud del aumento del grosor de la pared); c) grosor de la pared libre del VD > 5 mm (en ausencia de hipertensión pulmonar); d) síntomas de insuficiencia cardiaca (clase funcional de la New York Heart Association ≥ II), y e) BNP ≥ 88 ng/l o troponina I ≥ 0,1μg/l, compatible con afectación cardiaca por amiloidosis AL de estadio II o III según los biomarcadores8.
EcocardiografíaA los pacientes con amiloidosis AL confirmada o sospechada (y confirmada posteriormente), se les realizó una ecocardiografía transtorácica el día de la evaluación clínica ambulatoria. El estudio se llevó a cabo con el escáner comercial Artida 4D System (Toshiba Medical Systems; Tustin, California, Estados Unidos). Se realizaron exámenes de ecocardiografía estándar bidimensional y Doppler con el transductor PST-30SBT, según las recomendaciones de la American Society of Echocardiography19. Posteriormente, se examinó a todos los participantes en el estudio con la STE tridimensional, una técnica que se ha validado para la evaluación de la mecánica regional y global del VI20.
La obtención de series de datos tridimensionales y el análisis off-line de speckle tracking se realizaron aplicando métodos descritos con anterioridad21,22. En resumen, las series de datos tridimensionales consistieron en volúmenes piramidales completos del VI, obtenidos con el transductor Matrix Array PST-25SX desde una posición apical y creados con la combinación de seis subvolúmenes operados mediante electrocardiografía. El análisis off-line de speckle tracking se realizó con el programa de seguimiento del movimiento de la pared Wall Motion Tracking (Toshiba Medical Systems) y ocultando los datos clínicos al investigador. El análisis empezó con un ajuste del eje para exponer el borde endocárdico real; luego, se aplicó un trazado semiautomático de los bordes endocárdico y epicárdico con marcas manuales de seis puntos de referencia en el borde endocárdico. A continuación se inició el rastreo automático de los bordes, durante la totalidad del ciclo cardiaco, y las imágenes tridimensionales de las paredes del VI se dividieron automáticamente en un modelo de 16 segmentos. Por último, los trazados resultantes se modificaron manualmente solo en las áreas en que no se habían rastreado correctamente los bordes endocárdico y epicárdico verdaderos. El análisis del VD fue similar al del VI, colocando múltiples puntos de referencia (en vez de los puntos prefijados) por todo el límite endocárdico, para obtener un trazado tridimensional de la región de interés (miocardio del VD). Después del rastreo automático de los bordes, las imágenes tridimensionales del VD se dividieron automáticamente en un modelo de 16 segmentos, formado por seis segmentos basales, seis medioventriculares y cuatro apicales. El rastreo de los trazados endocárdico y epicárdico fue modificado manualmente por el operador en caso necesario.
Se evaluó visualmente la calidad del rastreo en cada segmento del VI. Las decisiones relativas a la exclusión de estudios ecocardiográficos respecto a los resultados quedaron al criterio del investigador y se basaron tanto en la calidad de la imagen tridimensional general (antes de intentar el análisis) como en la exactitud del rastreo del movimiento miocárdico real del VI (durante el intento de análisis). Si no era posible realizar un rastreo automático ni manual de uno o varios segmentos, se excluía el caso; así pues, se consideró la totalidad de los 16 segmentos en los casos incluidos.
Parámetros mecánicos del miocardioPara el análisis del VI, el estudio se centró en el strain (deformación) longitudinal y el strain circunferencial sistólicos máximos (LSt y CSt), que indican la deformación miocárdica en dirección tangencial y en dirección circunferencial, respectivamente, respecto al borde endocárdico; ambos parámetros han mostrado una notable reproducibilidad20. En cada individuo, se calcularon los parámetros de strain globales mediante el promedio de los valores máximos correspondientes a cada uno de los 16 segmentos del VI. Se calcularon los parámetros de strain regional mediante el promedio de los valores máximos de segmentos específicos correspondientes a los valores basal (6 segmentos), medioventricular (6 segmentos) y apical (4 segmentos).
Para el análisis del VD, el estudio se centró en los valores de LSt y desplazamiento radial sistólicos, que corresponden, respectivamente, a la deformación miocárdica en dirección transversal y al desplazamiento hacia el centro de la cavidad del VD respecto al borde endocárdico. Se eligieron estas variables porque el acortamiento en la dirección base-vértice (longitudinal) explica la mayor parte del vaciado sistólico del VD, mientras que el movimiento del miocardio hacia dentro (dirección radial) completa la función sistólica del VD23.
Determinaciones de biomarcadoresSe extrajeron muestras de sangre venosa para la determinación del BNP como parte de la evaluación completa respecto a la amiloidosis el día de la evaluación clínica ambulatoria, antes del examen ecocardiográfico. Se realizaron inmunoanálisis de micropartículas con quimioluminiscencia para la determinación de la concentración plasmática de BNP (análisis de BNP ARCHITECT; Abbott Diagnostics; Lake Forest, Ilinois, Estados Unidos) en el analizador ARCHITECT i2000SR (Abbott Diagnostics). El límite de detección inferior fue de 0,5 ng/l. Los coeficientes de variación intraanalítica e interanalítica máximos fueron de entre el 3 y el 6%.
ReproducibilidadPor lo que respecta a la reproducibilidad, en el presente estudio participaron dos evaluadores de la STE tridimensional experimentados. Todos los conjuntos de datos tridimensionales del VD fueron analizados de nuevo por el mismo investigador (con una separación entre los exámenes de al menos 8 semanas) y por un segundo investigador al que se ocultaron los datos de los pacientes. Los resultados de reproducibilidad de los parámetros derivados de la STE tridimensional del VI ya se han publicado con anterioridad por el presente grupo y las medias de las variabilidades intraobservador e interobservadores de los datos combinados fueron respectivamente: el 5±5% y el 6±7% para el LSt y el 6±6% y el 8±9% para el CSt21,24.
Análisis estadísticoLas variables discretas se expresan en frecuencias y porcentajes. Se evaluó la normalidad de la distribución de las variables continuas (mediante la prueba de Kolmogorov-Smirnov) y se expresan en media±desviación estándar o mediana [intervalo intercuartílico], según corresponda. Se utilizó la prueba de la χ2 y un análisis de la varianza de una vía (para las variables discretas y continuas respectivamente) para las comparaciones de los grupos de pacientes según los terciles de BNP (primer tercil, BNP < 86 ng/l; segundo tercil, BNP de 86 a 403; tercer tercil, BNP > 403 ng/l). Tras el análisis de la varianza, se determinaron las diferencias entre los correspondientes pares de grupos con una aplicación post-hoc de la prueba HSD (honest significant difference) de Tukey o la prueba de Games-Howell, según correspondiera, en función de la normalidad y la homogeneidad de la varianza de las variables en cada tercil. Las comparaciones de los pacientes con afectación cardiaca o sin ella se realizaron con la prueba de la t de Student para datos no emparejados. Después de la prueba de normalidad y la construcción de gráficos de dispersión de puntos para los pares de valores de las variables continuas, se evaluó la correlación entre ellas mediante los coeficientes de correlación de Pearson y la ρ de Spearman, según correspondiera. Para el examen más detallado de los parámetros de strain globales y regionales del VI, se utilizó un análisis de regresión logística multivariable simultáneo, utilizando la variable de strain global o regional del VI con la mayor asociación en el análisis univariable, junto con los criterios de BNP (≥ 88 ng/l) y troponina I (≥ 0,1μg/l) de afectación cardiaca, con objeto de examinar su valor predictivo de afectación cardiaca. No se realizaron análisis multivariables de los parámetros de strain del VD debido al número de participantes con datos analizables de estos parámetros. Las variabilidades intraobservador e interobservadores de los parámetros de la STE tridimensional del VD se calcularon mediante la diferencia absoluta del correspondiente par de determinaciones de los parámetros de mecánica miocárdica repetidas, expresada como porcentaje de su promedio. Se consideró estadísticamente significativo un valor de p<0,05. El análisis estadístico se llevó a cabo con el programa IBM SPSS Statistics 20.0 (IBM Corp.; Armonk, New York, Estados Unidos).
RESULTADOSSe realizó una ecocardiografía estándar y una STE tridimensional a 44 pacientes con diagnóstico de amiloidosis AL. Se excluyó del análisis del strain del VI a 4 pacientes por imposibilidad de realizar un rastreo exacto del movimiento del miocardio, y se excluyó del análisis del VD a 18 pacientes por imposibilidad de realizar un rastreo exacto del movimiento del miocardio del VD. Así pues, hubo 40 y 26 participantes que formaron las cohortes de pacientes con evaluaciones aceptables de VI y VD mediante ecografía estándar y STE tridimensional. Las variabilidades intraobservador e interobservadores obtenidas para los parámetros de mecánica miocárdica derivados de la STE tridimensional del VD fueron: LSt, el 5±4% y el 6±5%; desplazamiento radial, el 7±5% y el 8±7%. Las características clínicas de esta población en estudio se presentan en la tabla 1.
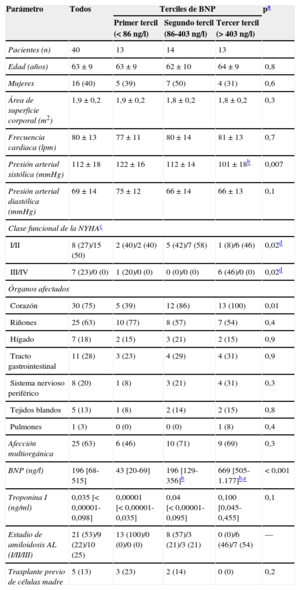
Características clínicas basales de los pacientes con amiloidosis y según concentración de péptido natriurético cerebral
| Parámetro | Todos | Terciles de BNP | pa | ||
|---|---|---|---|---|---|
| Primer tercil (< 86 ng/l) | Segundo tercil (86-403 ng/l) | Tercer tercil (> 403 ng/l) | |||
| Pacientes (n) | 40 | 13 | 14 | 13 | |
| Edad (años) | 63±9 | 63±9 | 62±10 | 64±9 | 0,8 |
| Mujeres | 16 (40) | 5 (39) | 7 (50) | 4 (31) | 0,6 |
| Área de superficie corporal (m2) | 1,9±0,2 | 1,9±0,2 | 1,8±0,2 | 1,8±0,2 | 0,3 |
| Frecuencia cardiaca (lpm) | 80±13 | 77±11 | 80±14 | 81±13 | 0,7 |
| Presión arterial sistólica (mmHg) | 112±18 | 122±16 | 112±14 | 101±18b | 0,007 |
| Presión arterial diastólica (mmHg) | 69±14 | 75±12 | 66±14 | 66±13 | 0,1 |
| Clase funcional de la NYHAc | |||||
| I/II | 8 (27)/15 (50) | 2 (40)/2 (40) | 5 (42)/7 (58) | 1 (8)/6 (46) | 0,02d |
| III/IV | 7 (23)/0 (0) | 1 (20)/0 (0) | 0 (0)/0 (0) | 6 (46)/0 (0) | 0,02d |
| Órganos afectados | |||||
| Corazón | 30 (75) | 5 (39) | 12 (86) | 13 (100) | 0,01 |
| Riñones | 25 (63) | 10 (77) | 8 (57) | 7 (54) | 0,4 |
| Hígado | 7 (18) | 2 (15) | 3 (21) | 2 (15) | 0,9 |
| Tracto gastrointestinal | 11 (28) | 3 (23) | 4 (29) | 4 (31) | 0,9 |
| Sistema nervioso periférico | 8 (20) | 1 (8) | 3 (21) | 4 (31) | 0,3 |
| Tejidos blandos | 5 (13) | 1 (8) | 2 (14) | 2 (15) | 0,8 |
| Pulmones | 1 (3) | 0 (0) | 0 (0) | 1 (8) | 0,4 |
| Afección multiorgánica | 25 (63) | 6 (46) | 10 (71) | 9 (69) | 0,3 |
| BNP (ng/l) | 196 [68-515] | 43 [20-69] | 196 [129-356]b | 669 [505-1.177]b,e | < 0,001 |
| Troponina I (ng/ml) | 0,035 [< 0,00001-0,098] | 0,00001 [< 0,00001-0,035] | 0,04 [< 0,00001-0,095] | 0,100 [0,045-0,455] | 0,1 |
| Estadio de amiloidosis AL (I/II/III) | 21 (53)/9 (22)/10 (25) | 13 (100)/0 (0)/0 (0) | 8 (57)/3 (21)/3 (21) | 0 (0)/6 (46)/7 (54) | — |
| Trasplante previo de células madre | 5 (13) | 3 (23) | 2 (14) | 0 (0) | 0,2 |
AL: amiloidosis sistémica, en su variante de cadenas ligeras; BNP: péptido natriurético cerebral; NYHA: New York Heart Association.
Los valores expresan n (%), media±desviación estándar o mediana [intervalo intercuartílico].
Para los pacientes con afectación cardiaca (total, n=30; primer tercil, n=5; segundo tercil, n=12; tercer tercil, n=13).
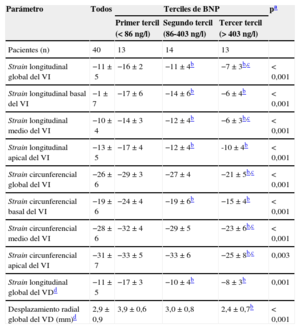
En la tabla 2 se presentan los parámetros de ecocardiografía estándar bidimensional y Doppler de todos los participantes en el estudio, y según cifras de BNP. De igual modo, en la tabla 3 se presentan las diferencias significativas entre los terciles de BNP para todos los parámetros de mecánica miocárdica global y regional derivada de la STE tridimensional (figura 1).
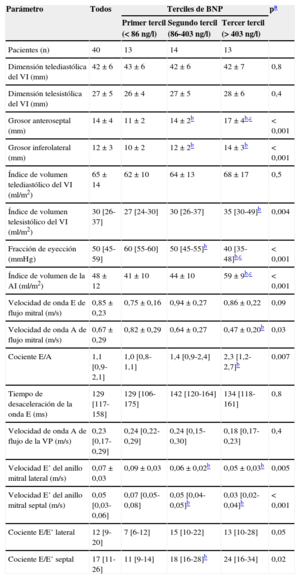
Parámetros ecocardiográficos estándar en el conjunto de pacientes con amiloidosis y según concentración de péptido natriurético cerebral en el momento de la evaluación clínica
| Parámetro | Todos | Terciles de BNP | pa | ||
|---|---|---|---|---|---|
| Primer tercil (< 86 ng/l) | Segundo tercil (86-403 ng/l) | Tercer tercil (> 403 ng/l) | |||
| Pacientes (n) | 40 | 13 | 14 | 13 | |
| Dimensión telediastólica del VI (mm) | 42±6 | 43±6 | 42±6 | 42±7 | 0,8 |
| Dimensión telesistólica del VI (mm) | 27±5 | 26±4 | 27±5 | 28±6 | 0,4 |
| Grosor anteroseptal (mm) | 14±4 | 11±2 | 14±2b | 17±4b,c | < 0,001 |
| Grosor inferolateral (mm) | 12±3 | 10±2 | 12±2b | 14±3b | < 0,001 |
| Índice de volumen telediastólico del VI (ml/m2) | 65±14 | 62±10 | 64±13 | 68±17 | 0,5 |
| Índice de volumen telesistólico del VI (ml/m2) | 30 [26-37] | 27 [24-30] | 30 [26-37] | 35 [30-49]b | 0,004 |
| Fracción de eyección (mmHg) | 50 [45-59] | 60 [55-60] | 50 [45-55]b | 40 [35-48]b,c | < 0,001 |
| Índice de volumen de la AI (ml/m2) | 48±12 | 41±10 | 44±10 | 59±9b,c | < 0,001 |
| Velocidad de onda E de flujo mitral (m/s) | 0,85±0,23 | 0,75±0,16 | 0,94±0,27 | 0,86±0,22 | 0,09 |
| Velocidad de onda A de flujo mitral (m/s) | 0,67±0,29 | 0,82±0,29 | 0,64±0,27 | 0,47±0,20b | 0,03 |
| Cociente E/A | 1,1 [0,9-2,1] | 1,0 [0,8-1,1] | 1,4 [0,9-2,4] | 2,3 [1,2-2,7]b | 0,007 |
| Tiempo de desaceleración de la onda E (ms) | 129 [117-158] | 129 [106-175] | 142 [120-164] | 134 [118-161] | 0,8 |
| Velocidad de onda A de flujo de la VP (m/s) | 0,23 [0,17-0,29] | 0,24 [0,22-0,29] | 0,24 [0,15-0,30] | 0,18 [0,17-0,23] | 0,4 |
| Velocidad E’ del anillo mitral lateral (m/s) | 0,07±0,03 | 0,09±0,03 | 0,06±0,02b | 0,05±0,03b | 0,005 |
| Velocidad E’ del anillo mitral septal (m/s) | 0,05 [0,03-0,06] | 0,07 [0,05-0,08] | 0,05 [0,04-0,05]b | 0,03 [0,02-0,04]b | < 0,001 |
| Cociente E/E’ lateral | 12 [9-20] | 7 [6-12] | 15 [10-22] | 13 [10-28] | 0,05 |
| Cociente E/E’ septal | 17 [11-26] | 11 [9-14] | 18 [16-28]b | 24 [16-34] | 0,02 |
AI: aurícula izquierda; BNP: péptido natriurético cerebral; VI: ventrículo izquierdo; VP: vena pulmonar.
Parámetros derivados de la ecocardiografía speckle tracking tridimensional en el conjunto de los pacientes con amiloidosis y según concentración de péptido natriurético cerebral en el momento de la evaluación clínica
| Parámetro | Todos | Terciles de BNP | pa | ||
|---|---|---|---|---|---|
| Primer tercil (< 86 ng/l) | Segundo tercil (86-403 ng/l) | Tercer tercil (> 403 ng/l) | |||
| Pacientes (n) | 40 | 13 | 14 | 13 | |
| Strain longitudinal global del VI | −11±5 | −16±2 | −11±4b | −7±3b,c | < 0,001 |
| Strain longitudinal basal del VI | −1±7 | −17±6 | −14±6b | −6±4b | < 0,001 |
| Strain longitudinal medio del VI | −10±4 | −14±3 | −12±4b | −6±3b,c | < 0,001 |
| Strain longitudinal apical del VI | −13±5 | −17±4 | −12±4b | -10±4b | < 0,001 |
| Strain circunferencial global del VI | −26±6 | −29±3 | −27±4 | −21±5b,c | < 0,001 |
| Strain circunferencial basal del VI | −19±6 | −24±4 | −19±6b | −15±4b | < 0,001 |
| Strain circunferencial medio del VI | −28±6 | −32±4 | −29±5 | −23±6b,c | < 0,001 |
| Strain circunferencial apical del VI | −31±7 | −33±5 | −33±6 | −25±8b,c | 0,003 |
| Strain longitudinal global del VDd | −11±5 | −17±3 | −10±4b | −8±3b | 0,001 |
| Desplazamiento radial global del VD (mm)d | 2,9±0,9 | 3,9±0,6 | 3,0±0,8 | 2,4±0,7b | < 0,001 |
BNP: péptido natriurético cerebral; VI: ventrículo izquierdo; VD: ventrículo derecho.
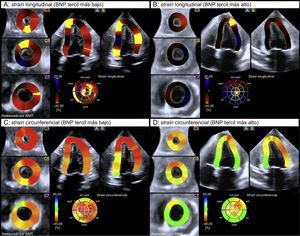
Ecocardiografía speckle tracking tridimensional con codificación por colores que muestra el strain longitudinal global y el strain circunferencial telesistólicos del ventrículo izquierdo, en 2 pacientes con péptido natriurético cerebral situado en el tercil más bajo (A y C) y en el tercil más alto (B y D). Obsérvese la alteración significativa de la mecánica del miocardio en el ventrículo izquierdo en el paciente del tercil más alto de péptido natriurético cerebral (B y D) según el código de colores. BNP: péptido natriurético cerebral; WMT: Wall Motion Tracking. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
En los 26 pacientes con evaluación de la STE tridimensional disponible tanto del VI como del VD, los valores de LSt global de VI y VD mostraron una correlación excelente (r=0,95; p<0,001), mientras que los demás parámetros mecánicos del miocardio globales de VI y VD mostraron una buena correlación (LSt del VI y desplazamiento radial del VD, r=–0,80; p<0,001; CSt del VI y LSt de VD, r=0,78; p<0,001; CSt del VI y desplazamiento radial del VD, r=–0,81; p<0,001).
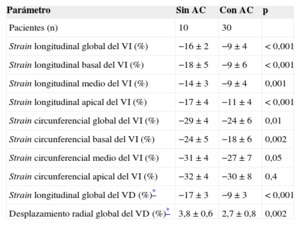
En la tabla 4 se presentan los resultados de los análisis del strain del VI y el VD en los participantes con y sin afectación cardiaca. Los valores de LSt y CSt globales del VI presentaron una reducción significativa en los pacientes con afectación cardiaca, debido principalmente a la alteración de los segmentos basales. Así pues, la media de la diferencia absoluta de los valores basales de LSt y CSt de los pacientes con y sin afectación cardiaca fue del 9 y el 7% respectivamente. Esto constituye una reducción relativa de los valores basales de LSt y CSt a causa de la afectación cardiaca de alrededor de un 50 y un 25% respectivamente, lo cual indica que el principal deterioro de la deformación asociada a afectación cardiaca al nivel basal se producía en la dirección longitudinal. Tanto el LSt global como el desplazamiento radial del VD se redujeron también en los pacientes con afectación cardiaca (figura 2), aunque el LSt mostró una diferencia media significativamente mayor entre los pacientes con y sin afectación cardiaca (9%). En el análisis multivariable, las tres variables candidatas preespecificadas fueron el LSt global del VI (es decir, el strain global o regional del VI que tenía la máxima asociación en el análisis univariable), la presencia de afectación cardiaca según valores de BNP (≥ 88 ng/l) y la presencia de afectación cardiaca según cifras de troponina I (≥ 0,1μg/l). El valor de LSt global del VI se asoció a la presencia de afectación cardiaca independientemente de los criterios de amiloidosis cardiaca del BNP y troponina I (odds ratio=1,6; intervalo de confianza del 95%, 1,04-2,37; p=0,03).
Parámetros derivados de la ecocardiografía speckle tracking tridimensional en pacientes con amiloidosis con o sin afectación cardiaca
| Parámetro | Sin AC | Con AC | p |
|---|---|---|---|
| Pacientes (n) | 10 | 30 | |
| Strain longitudinal global del VI (%) | −16±2 | −9±4 | < 0,001 |
| Strain longitudinal basal del VI (%) | −18±5 | −9±6 | < 0,001 |
| Strain longitudinal medio del VI (%) | −14±3 | −9±4 | 0,001 |
| Strain longitudinal apical del VI (%) | −17±4 | −11±4 | < 0,001 |
| Strain circunferencial global del VI (%) | −29±4 | −24±6 | 0,01 |
| Strain circunferencial basal del VI (%) | −24±5 | −18±6 | 0,002 |
| Strain circunferencial medio del VI (%) | −31±4 | −27±7 | 0,05 |
| Strain circunferencial apical del VI (%) | −32±4 | −30±8 | 0,4 |
| Strain longitudinal global del VD (%)* | −17±3 | −9±3 | < 0,001 |
| Desplazamiento radial global del VD (%)* | 3,8±0,6 | 2,7±0,8 | 0,002 |
AC: afectación cardiaca; VI: ventrículo izquierdo; VD: ventrículo derecho.
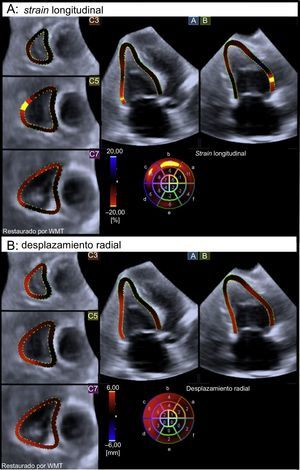
Ecocardiografía speckle tracking tridimensional con código de colores que muestra el strain longitudinal global (A) y el desplazamiento radial (B) telesistólicos del ventrículo derecho en un paciente con afectación cardiaca. Obsérvese la alteración significativa de la mecánica del miocardio del ventrículo derecho, según el código de colores. WMT: Wall Motion Tracking. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Este es el primer estudio en el que se analizan conjuntamente los parámetros de mecánica miocárdica del VI y el VD mediante STE tridimensional; además, en este estudio se evaluaron también las relaciones entre la mecánica del miocardio y la concentración de BNP circulante y la afectación cardiaca. El presente trabajo aporta una perspectiva de interés respecto a la función miocárdica de los pacientes con amiloidosis AL evaluados mediante STE tridimensional: a) los valores de la mecánica miocárdica del VI y el VD presentan una alteración creciente a medida que aumentan los BNP; b) el deterioro funcional del VD y el VI parece tener un comportamiento paralelo, según indican las relaciones lineales observadas entre los parámetros mecánicos del miocardio, y c) la reducción significativa del LSt es un marcador de afectación cardiaca, aparte de los valores de BNP y de troponina I circulantes.
Se ha observado que la proteína natriurética cerebral es un instrumento diagnóstico y pronóstico relevante en la amiloidosis AL1,8. Probablemente sea un marcador de la toxicidad miocárdica asociada al amiloide y el deterioro funcional de los miocitos debido al depósito de amiloide25. Estos dos mecanismos del daño miocárdico pueden determinar alteraciones de la mecánica miocárdica del VI y el VD11,12 que pueden medirse con la STE13–15. Así pues, a medida que ambos ventrículos liberan BNP debido a la toxicidad de las cadenas ligeras y el depósito de amiloide, la deformación miocárdica se ve afectada proporcionalmente, tal como indica su asociación con el biomarcador (tabla 3). Se realizó también un análisis post-hoc de las relaciones entre los terciles de troponina I y la mecánica miocárdica (consúltese la información sobre los análisis de la troponina I en el material suplementario). Los resultados de este análisis (material suplementario) fueron coherentes con la relación demostrada con el BNP, de tal manera que la mecánica miocárdica del VI y el VD se alteraba de manera creciente a medida que aumentaban los valores de troponina I. Sin embargo, las desviaciones estándares correspondientes a los valores medios de strain y de desplazamiento en los diversos terciles de troponina I fueron superiores a las observadas en el BNP. Teniendo en cuenta estos datos, el BNP parece diferenciar mejor estos diversos grados de deterioro de la mecánica miocárdica. A este respecto, está justificada una comparación de los valores de BNP con los del parámetro relativamente novedoso de la troponina de alta sensibilidad3.
Se ha demostrado que la función circunferencial, derivada principalmente del acortamiento de las fibras musculares epicárdicas, facilita el mantenimiento de la función sistólica en diferentes trastornos cardiovasculares con la máxima afectación de las fibras musculares endocárdicas24. En el presente trabajo, tanto las funciones longitudinales como las circunferenciales se vieron alteradas cuando había afectación cardiaca (tabla 4), lo que probablemente esté relacionado con el depósito de amiloide transmural por todo el miocardio del VI. Sin embargo, el deterioro del acortamiento circunferencial fue menor que el del acortamiento longitudinal, por lo que el primero podría representar un vector menos sensible de la deformación, similar a lo que ocurre en otros trastornos, en respuesta a un daño concreto (hemodinámico, isquémico, estructural o tóxico) experimentado por el miocardio24. Es de destacar también que la alteración de la mecánica miocárdica, tanto en el acortamiento longitudinal como en el circunferencial, tuvo su máxima intensidad en los segmentos basales del VI (tabla 4); estos resultados concuerdan con observaciones previamente realizadas respecto al LSt regional en la amiloidosis de cadenas ligeras26. Aunque este estudio no se diseñó para esclarecer aspectos relativos a la disfunción sistólica global y regional del VI en la amiloidosis, es un trabajo generador de hipótesis en cuanto al potencial diagnóstico e incluso pronóstico de estas observaciones.
La evaluación de la afectación del miocardio del VD en la amiloidosis AL es escasa y resulta difícil en comparación con la evaluación ecocardiográfica del grosor de la pared del VI como criterio de la afectación cardiaca17,18. Hay controversia respecto a la evolución temporal del deterioro funcional del VD, y mientras que algunos autores han descrito disfunción del VD en las fases iniciales del trastorno27, otros señalan que esta se produce más tarde que el depósito de amiloide en el VI28. No obstante, parece haber coincidencia en que la disfunción del VD no puede explicarse solo por el depósito de amiloide y en que la interdependencia hemodinámica e histológica del VD y el VI desempeña un papel importante en la función del VD18,28. El presente estudio indica que el deterioro funcional sistólico del VD va en paralelo con el del VI, tanto en su acortamiento longitudinal (LSt del VD) como en su movimiento miocárdico hacia el interior (desplazamiento radial del VD). Sea cual fuere el mecanismo subyacente, el examen de detección de la disfunción del VD debe formar parte de la evaluación ecocardiográfica en la amiloidosis AL17,18. La evaluación de una estructura geométricamente compleja como la del VD mediante la mecánica miocárdica derivada de la STE tridimensional puede aportar nuevas perspectivas respecto a la evolución temporal y el grado de deterioro funcional del VD en la amiloidosis AL.
A pesar de la bibliografía existente sobre las funciones diagnóstica y pronóstica de los péptidos natriuréticos y las troponinas en la amiloidosis AL, la naturaleza dinámica de los biomarcadores circulantes debe tenerse en cuenta al evaluar la afectación cardiaca. Así pues, el aumento de los péptidos natriuréticos o las troponinas puede usarse como marcador de la afectación cardiaca en un determinado momento de la evolución de la enfermedad, pero después del tratamiento o la estabilización del paciente, las concentraciones circulantes del mismo biomarcador pueden volver a valores normales o inferiores. Esto podría explicar por qué el deterioro del LSt del VI se asoció a la afectación cardiaca de manera independiente de los valores de BNP y troponina I en esta cohorte de pacientes, dadas las diferencias existentes en el estadio de la enfermedad en el momento de la evaluación. En otras publicaciones se ha consignado una reducción del valor pronóstico de las concentraciones de biomarcadores circulantes después de la aplicación de estrategias de tratamiento en la amiloidosis AL29. En consecuencia, la hipótesis de un mayor potencial diagnóstico y pronóstico de la determinación del acortamiento longitudinal a lo largo de todo el curso de la enfermedad, y no solo antes de iniciar el tratamiento, es algo que requerirá mayor investigación.
LimitacionesUna de las limitaciones de este estudio es su pequeño tamaño muestral, en especial por lo que respecta a la mecánica miocárdica del VD. Además, la potencia estadística del análisis de regresión logística relativo al VI podría ser baja para detectar otras asociaciones independientes con la afectación cardiaca, es decir, los valores de BNP o troponina I; se debe seguir considerando a estos biomarcadores como posibles instrumentos para detectar afectación cardiaca. No obstante, el análisis del VI mediante la STE tridimensional produjo unos resultados que concuerdan con las observaciones previas y son coherentes con el conocimiento general derivado de la bibliografía existente. Aunque la viabilidad del análisis de STE tridimensional del VI fue del 90% (40 de 44), que es un porcentaje bastante alto y probablemente se deba a la buena interfase endocárdica ecográfica entre tejido y sangre en los casos de amiloidosis, la del análisis de STE tridimensional del VD llegó tan solo al 59% (26 de 44). Una razón probable de esta limitación es el uso de un programa informático no dedicado al análisis de la STE tridimensional del VD y la posición anterior del VD detrás del esternón, lo cual puede implicar limitaciones técnicas en la obtención de las imágenes.
CONCLUSIONESEl presente trabajo aporta una perspectiva de interés respecto a la función miocárdica de los pacientes con amiloidosis AL evaluados mediante STE tridimensional. Los parámetros de mecánica miocárdica del VI y el VD derivados de la STE tridimensional, que parecen tener un comportamiento paralelo, se ven alterados de manera creciente a medida que aumentan los valores de BNP. De entre los parámetros de la mecánica miocárdica del VI, el LSt global parece tener una asociación intensa con la afectación cardiaca, más allá de los biomarcadores circulantes como BNP y troponina I.
FINANCIACIÓNJ.A. Urbano-Moral ha recibido una subvención de investigación de la Fundación Alfonso Martín Escudero (Madrid, España).
CONFLICTO DE INTERESESN.G. Pandian ha recibido pagos por conferencias de Toshiba Medical Systems. El Cardiovascular Imaging and Hemodynamic Laboratory del Tufts Medical Center ha recibido subvenciones de equipamiento de Toshiba Medical Systems (Tustin, California, Estados Unidos).