La influencia del riesgo cardiovascular en el pronóstico de pacientes con ecocardiograma de esfuerzo (EE) sin isquemia inducible no se ha evaluado. El objetivo es determinar predictores de eventos, con especial atención al riesgo cardiovascular.
MétodosSe incluyó a 1.640 pacientes con EE sin isquemia: 1.206 sin cardiopatía isquémica (CI), cuyo riesgo de muerte cardiovascular se estimó según el SCORE (Systematic COronary Risk Evaluation) europeo, y 434 con CI. El objetivo primario fue la supervivencia libre de eventos (SLEv) (muerte cardiaca, síndrome coronario agudo no fatal y revascularización en el seguimiento).
ResultadosTras una mediana de seguimiento de 35 [23-54] meses, no hubo diferencias significativas entre la SLEv de los pacientes con SCORE ≥ 10 o diabetes y pacientes con CI (el 89,8 frente al 87,1%). Al año la SLEv era alta en todos los grupos (el 99,4% si SCORE < 5; el 100% si SCORE 5-9; el 98% si SCORE ≥ 10 o diabetes y el 97% si CI), con un descenso a los 3 años si SCORE ≥ 10 o diabetes (94,5%), similar al de los pacientes con CI (91,1%, diferencias no significativas). Las tasas de eventos anualizadas fueron del 2,8 y el 2,55% respectivamente, significativamente superiores a las de los grupos con SCORE < 5 (0,6%) y 5-9 (0,12%). Los eventos más frecuentes fueron el síndrome coronario agudo sin elevación del segmento ST no fatal y la revascularización. Fueron predictores de eventos cardiacos: la CI conocida, un SCORE ≥ 10 o diabetes, el aclaramiento de creatinina, la fracción eyección del ventrículo izquierdo y el dolor durante la EE.
ConclusionesUn EE sin isquemia implica buen pronóstico inicial, posteriormente modulado por el riesgo cardiovascular.
Palabras clave
La ecocardiografía de esfuerzo (EE) es la técnica de imagen de detección de isquemia más fisiológica y ofrece ventajas como su bajo coste y la ausencia de radiación. Aunque se ha cuestionado su limitado valor diagnóstico en comparación con técnicas anatómicas1,2, su gran valor pronóstico se ha demostrado en distintos escenarios clínicos3–9. Diversos avances han facilitado su implementación (segundo armónico, adquisición continua, comparación simultánea basal y ejercicio o el uso de contraste). Las indicaciones y la capacitación para su empleo se han establecido por consenso de expertos10. El objetivo fue identificar variables predictoras de eventos en los pacientes con EE sin isquemia inducible, con especial interés en determinar cómo el riesgo cardiovascular (RCV) modifica el riesgo de eventos cardiacos.
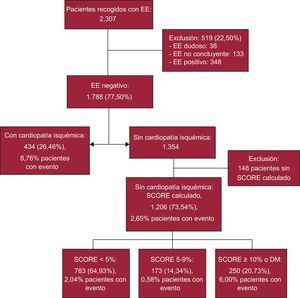
MÉTODOSSe realizó un estudio observacional de cohortes retrospectivo, con 2.307 pacientes consecutivos remitidos para EE, realizado en cinta sin fin (Bruce o Naughton) con monitorización por electrocardiograma de 12 derivaciones. La adquisición de imágenes se realizó en 4, 3 y 2 cámaras más un eje corto o en 5 cámaras (dependiendo de la calidad de la ventana paraesternal o del uso de contraste) en situación basal y tras el esfuerzo inmediato o a pico de esfuerzo con adquisición continua, comparación side by side y almacenaje digital. Las anomalías de la contractilidad se evaluaron en un modelo de 16 segmentos del ventrículo izquierdo, y se empleó contraste en 329 pacientes (20,1%). Los criterios de inclusión fueron edad > 18 años y EE sin isquemia inducida, esto es, sin alteraciones nuevas de la contractilidad segmentaria con el esfuerzo respecto al reposo, independientemente de que basalmente estuviera alterada en pacientes con cardiopatía. El estudio se consideró sin isquemia inducible atendiendo a la contractilidad segmentaria, y no según la clínica o las alteraciones electrocardiográficas. Se excluyeron los estudios ecocardiográficos positivos, dudosos o no concluyentes (no interpretables por mala ventana o adquisición defectuosa). No hubo ningún caso de complicación fatal. Se recogieron datos demográficosy variables clínicas y derivadas de la EE.
Se definió como cardiopatía isquémica (CI) conocida el antecedente de infarto de miocardio, revascularización percutánea o quirúrgica previa o lesión coronaria significativa en angiografía previa. En pacientes sin CI y sin diabetes mellitus (DM), se estimó el RCV mediante la escala del SCORE (Systematic Coronary Risk Evaluation) europeo calibrada para la población española de riesgo de muerte cardiovascular a 10 años según la edad, el sexo, la presión arterial sistólica, el colesterol total y el tabaquismo11. Se clasificó a los pacientes sin CI en 3 grupos: SCORE < 5% (considerado riesgo bajo-intermedio), 5–9% (riesgo alto) y ≥ 10% o DM (riesgo muy alto). El seguimiento se realizó a través de historia electrónica y en papel, llamada telefónica y registro de mortalidad.
La variable de resultado principal fue la compuesta por evento fatal (muerte súbita de origen no explicado y muerte cardiaca por insuficiencia cardiaca o por síndrome coronario agudo [SCA]), SCA no fatal (se identificó separadamente si se trataba de SCA con o sin elevación del segmento ST) y la revascularización tardía. El SCA se definió como síntomas o alteraciones electrocardiográficas compatibles con isquemia con un aumento de marcadores cardiacos (troponina T). La revascularización tardía hace referencia a la realizada en el seguimiento, no a la revascularización precoz si se realizó cateterismo cardiaco, a pesar de la normalidad de la EE. Se definió arbitrariamente como «pronóstico a corto plazo» el referente al año tras la EE y «pronóstico a largo plazo» el obtenido a 3 años.
Análisis estadísticoEl análisis descriptivo se muestra como frecuencias y porcentajes para las variables categóricas y en media ± desviación estándar para las variables continuas. Dicho análisis se realizó con toda la muestra en general y por cada grupo de RCV. Se evaluó la asociación entre la variable RCV respecto a la variable de resultado general evento y los diferentes tipos de eventos que la formaban. Para la comparación de eventos entre grupos, se calculó la tasa de eventos anualizados de cada grupo y se utilizó el test de log rank. Además, también se evaluaron las comparaciones múltiples, ajustadas por la corrección de Bonferroni. En el análisis univariable, la asociación entre las variables recogidas en el estudio y la variable resultado se midió a partir de modelos univariables de regresión de Cox. Todas las variables que fueran significativas a un nivel del 0,20 se consideraron variables independientes potenciales para el modelo multivariable de supervivencia (regresión de Cox). Los factores predictores finales fueron las variables estadísticamente significativas a un nivel del 0,05. El modelo se calibró mediante el test de Hosmer-Lemeshow y la capacidad predictiva del modelo se evaluó calculando el área bajo la curva ROC (Receiver Operating Characteristics), ambos al final del seguimiento. Además, se midió la supervivencia de los pacientes con EE negativa, dependiendo de los grupos de riesgo, mediante curvas de Kaplan-Meier. Para ello se utilizó el test de log rank. Todos los efectos se consideraron estadísticamente significativos cuando p < 0,05. Todos los análisis se realizaron mediante el software SAS, versión 9.4. (SAS Institute Inc.) y las figuras, mediante R v3.0.1.
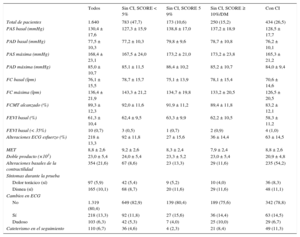
RESULTADOSDe 2.307 EE realizadas entre enero de 2007 y diciembre de 2012, se excluyó a 348 pacientes con EE positivo y 171 con EE dudoso o no concluyente. De las 1.788 EE sin isquemia, solo se incluyeron finalmente 1.640 (434 con CI y los 1.206 sin CI en los que había datos para calcular el SCORE europeo). La media de edad era 63,5 ± 10,7 años y eran varones el 52,8%. De los 1.206 pacientes sin CI, el SCORE fue < 5 en 783 (65%), SCORE 5-9 en 173 (14,3%) y SCORE ≥ 10 o DM en 250 (20,7%) (figura 1). De los 434 pacientes con CI, 242 tenían historia de infarto previo y 356, de revascularización percutánea o quirúrgica. Las características demográficas, clínicas y del tratamiento farmacológico se presentan en la tabla 1. Los datos de la EE se muestran en la tabla 2. Un 21,6% del total de pacientes presentaban alteraciones de la contractilidad basales. Al tratarse de EE sin isquemia no hubo incremento del índice de contractilidad segmentaria. La fracción de eyección del ventrículo izquierdo (FEVI) media fue del 61,3% ± 10,4%. Del total de 1.640, 84 pacientes (5,12%) tenían una FEVI < 50% y menos del 1% de los pacientes, FEVI < 35%.
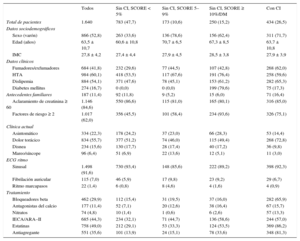
Características demográficas y clínicas del grupo total y en función del riesgo cardiovascular
| Todos | Sin CI, SCORE < 5% | Sin CI, SCORE 5–9% | Sin CI, SCORE ≥ 10%/DM | Con CI | |
|---|---|---|---|---|---|
| Total de pacientes | 1.640 | 783 (47,7) | 173 (10,6) | 250 (15,2) | 434 (26,5) |
| Datos sociodemográficos | |||||
| Sexo (varón) | 866 (52,8) | 263 (33,6) | 136 (78,6) | 156 (62,4) | 311 (71,7) |
| Edad (años) | 63,5 ± 10,7 | 60,6 ± 10,8 | 70,7 ± 6,5 | 67,3 ± 8,5 | 63,7 ± 10,8 |
| IMC | 27,8 ± 4,2 | 27,4 ± 4,4 | 27,9 ± 4,5 | 28,5 ± 3,8 | 27,9 ± 3,9 |
| Datos clínicos | |||||
| Fumadores/exfumadores | 684 (41,8) | 232 (29,6) | 77 (44,5) | 107 (42,8) | 268 (62,0) |
| HTA | 984 (60,1) | 418 (53,5) | 117 (67,6) | 191 (76,4) | 258 (59,6) |
| Dislipemia | 884 (54,1) | 371 (47,6) | 78 (45,1) | 153 (61,2) | 282 (65,3) |
| Diabetes mellitus | 274 (16,7) | 0 (0,0) | 0 (0,0) | 199 (79,6) | 75 (17,3) |
| Antecedentes familiares | 187 (11,4) | 92 (11,8) | 9 (5,2) | 15 (6,0) | 71 (16,4) |
| Aclaramiento de creatinina ≥ 60 | 1.146 (84,6) | 550 (86,6) | 115 (81,0) | 165 (80,1) | 316 (85,0) |
| Factores de riesgo ≥ 2 | 1.017 (62,0) | 356 (45,5) | 101 (58,4) | 234 (93,6) | 326 (75,1) |
| Clínica actual | |||||
| Asintomático | 334 (22,3) | 178 (24,2) | 37 (23,0) | 66 (28,3) | 53 (14,4) |
| Dolor torácico | 834 (55,7) | 377 (51,2) | 74 (46,0) | 115 (49,4) | 268 (72,8) |
| Disnea | 234 (15,6) | 130 (17,7) | 28 (17,4) | 40 (17,2) | 36 (9,8) |
| Mareo/síncope | 96 (6,4) | 51 (6,9) | 22 (13,6) | 12 (5,1) | 11 (3,0) |
| ECG ritmo | |||||
| Sinusal | 1.498 (91,6) | 730 (93,4) | 148 (85,6) | 222 (89,2) | 398 (92,3) |
| Fibrilación auricular | 115 (7,0) | 46 (5,9) | 17 (9,8) | 23 (9,2) | 29 (6,7) |
| Ritmo marcapasos | 22 (1,4) | 6 (0,8) | 8 (4,6) | 4 (1,6) | 4 (0,9) |
| Tratamiento | |||||
| Bloqueadores beta | 462 (29,9) | 112 (15,4) | 31 (19,5) | 37 (16,0) | 282 (65,9) |
| Antagonistas del calcio | 177 (11,4) | 52 (7,1) | 20 (12,6) | 38 (16,4) | 67 (15,7) |
| Nitratos | 74 (4,8) | 10 (1,4) | 1 (0,6) | 6 (2,6) | 57 (13,3) |
| IECA/ARA–II | 685 (44,3) | 234 (32,1) | 71 (44,7) | 136 (58,6) | 244 (57,0) |
| Estatinas | 758 (49,0) | 212 (29,1) | 53 (33,3) | 124 (53,5) | 369 (86,2) |
| Antiagregante | 551 (35,6) | 101 (13,9) | 24 (15,1) | 78 (33,6) | 348 (81,3) |
ARA-II: antagonistas del receptor de la angiotensina II; CI: cardiopatía isquémica; DM: diabetes mellitus; ECG: electrocardiograma; HTA: hipertensión arterial; IECA: inhibidores de la enzima de conversión de la angiotensina; IMC: índice de masa corporal; SCORE: Systematic COronary Risk Evaluation.
Los valores expresan n (%) o media ± desviación estándar.
Datos derivados de la ecocardiografía de esfuerzo y cateterismo en el seguimiento del grupo total y en función del riesgo cardiovascular
| Todos | Sin CI, SCORE < 5% | Sin CI, SCORE 5 9% | Sin CI, SCORE ≥ 10%/DM | Con CI | |
|---|---|---|---|---|---|
| Total de pacientes | 1.640 | 783 (47,7) | 173 (10,6) | 250 (15,2) | 434 (26,5) |
| PAS basal (mmHg) | 130,4 ± 17,6 | 127,3 ± 15,9 | 138,8 ± 17,0 | 137,2 ± 18,9 | 128,5 ± 17,7 |
| PAD basal (mmHg) | 77,5 ± 10,3 | 77,2 ± 10,3 | 79,8 ± 9,6 | 78,7 ± 10,8 | 76,2 ± 10,1 |
| PAS máxima (mmHg) | 168,4 ± 23,1 | 167,5 ± 24,0 | 173,2 ± 21,0 | 173,2 ± 23,8 | 165,3 ± 21,2 |
| PAD máxima (mmHg) | 85,0 ± 10,7 | 85,1 ± 11,5 | 86,4 ± 10,2 | 85,2 ± 10,7 | 84,0 ± 9,4 |
| FC basal (lpm) | 76,1 ± 15,5 | 78,7 ± 15,7 | 75,1 ± 13,9 | 78,1 ± 15,4 | 70,6 ± 14,6 |
| FC máxima (lpm) | 136,4 ± 21,9 | 143,3 ± 21,2 | 134,7 ± 19,8 | 133,2 ± 20,5 | 126,5 ± 20,5 |
| FCMT alcanzado (%) | 89,3 ± 12,3 | 92,0 ± 11,6 | 91,9 ± 11,2 | 89,4 ± 11,8 | 83,2 ± 12,1 |
| FEVI basal (%) | 61,3 ± 10,4 | 62,4 ± 9,5 | 63,3 ± 9,9 | 62,2 ± 10,5 | 58,3 ± 11,2 |
| FEVI basal (< 35%) | 10 (0,7) | 3 (0,5) | 1 (0,7) | 2 (0,9) | 4 (1,0) |
| Alteraciones ECG esfuerzo (%) | 218 ± 13,3 | 92 ± 11,8 | 27 ± 15,6 | 36 ± 14,4 | 63 ± 14,5 |
| MET | 8,8 ± 2,6 | 9,2 ± 2,6 | 8,3 ± 2,4 | 7,9 ± 2,4 | 8,8 ± 2,6 |
| Doble producto (×103) | 23,0 ± 5,4 | 24,0 ± 5,4 | 23,3 ± 5,2 | 23,0 ± 5,4 | 20,9 ± 4,8 |
| Alteraciones basales de la contractilidad | 354 (21,6) | 67 (8,6) | 23 (13,3) | 29 (11,6) | 235 (54,2) |
| Síntomas durante la prueba | |||||
| Dolor torácico (sí) | 97 (5,9) | 42 (5,4) | 9 (5,2) | 10 (4,0) | 36 (8,3) |
| Disnea (sí) | 165 (10,1) | 68 (8,7) | 20 (11,6) | 29 (11,6) | 48 (11,1) |
| Cambios en ECG | |||||
| No | 1.319 (80,4) | 649 (82,9) | 139 (80,4) | 189 (75,6) | 342 (78,8) |
| Sí | 218 (13,3) | 92 (11,8) | 27 (15,6) | 36 (14,4) | 63 (14,5) |
| Dudoso | 103 (6,3) | 42 (5,3) | 7 (4,0) | 25 (10,0) | 29 (6,7) |
| Cateterismo en el seguimiento | 110 (6,7) | 36 (4,6) | 4 (2,3) | 21 (8,4) | 49 (11,3) |
CI: cardiopatía isquémica; DM: diabetes mellitus; ECG: electrocardiograma; FC: frecuencia cardiaca; FCMT: frecuencia cardiaca máxima teórica; FEVI: fracción de eyección del ventrículo izquierdo; PAD: presión arterial diastólica; PAS: presión arterial sistólica; SCORE: Systematic COronary Risk Evaluation.
Los valores expresan n (%) o media ± desviación estándar.
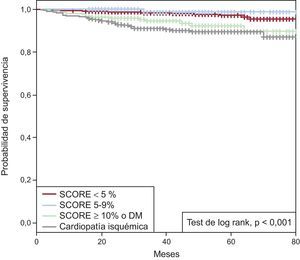
En pacientes con EE sin isquemia y tras una mediana de seguimiento de 35 [23-54] meses, la supervivencia libre de eventos (SLEv) al final de seguimiento estimada mediante curvas de Kaplan-Meier fue del 93,1% del grupo total. Considerando la SLEv según el RCV, fue del 95,4, el 98,7 y el 89,8% de los pacientes con SCORE < 5, 5–9 o ≥ 10 o DM respectivamente, sin diferencias significativas a final de seguimiento entre el grupo de CI conocida y los pacientes con SCORE ≥ 10 o DM (el 87,1 frente al 89,8%; p = 0,193). En estos 2 grupos de mayor RCV, la SLEv fue significativamente inferior (p < 0,001) que en los 2 grupos con SCORE < 10 (figura 2).
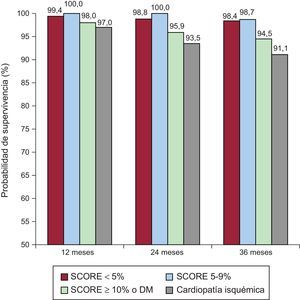
La SLEv se valoró en diferentes momentos del seguimiento con la intención de conocer si hay un momento tras la EE a partir del cual aumente el riesgo en función del RCV. En el grupo total sin CI, la SLEv fue del 99,2, el 98,4 y el 97,6% a 1, 2 y 3 años. Considerando el RCV a corto plazo (1 año de seguimiento), la SLEv fue alta en todos los grupos (el 99,4% con SCORE < 5, el 100% con SCORE 5–9, el 98% con SCORE ≥ 10 o DM y el 97% con CI conocida). A los 2 años la SLEv era del 98,8, el 100, el 95,9 y el 93,5% respectivamente. A largo plazo (3 años del seguimiento), se mantuvo similar en los 2 grupos de menor RCV (el 98,4% con SCORE < 5 y el 98,7% con SCORE 5–9; p = 0,40). Sin embargo, en el grupo con SCORE ≥ 10 o DM la SLEv a 3 años había disminuido significativamente respecto al grupo con SCORE < 5 (94,5%; p < 0,001) y era similar a la de los pacientes con CI conocida (91,1%; p = 0,24) (figura 3).
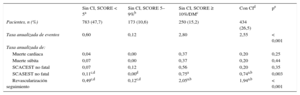
Tipo de eventosDe los 1.640 pacientes con EE sin isquemia, 70 (4,3%) sufrieron al menos 1 evento cardiaco y la media de tiempo desde la EE hasta el primer evento en el grupo total fue de 18 (6-30) meses. La mortalidad cardiaca fue del 0,12% (2 pacientes) en el primer año y el 0,79% (13 pacientes con eventos fatales cardiacos) en todo el seguimiento. Entre los eventos no fatales totales, hubo 27 (1,6%) casos de SCA (9 de SCA con elevación del segmento y 18 sin elevación del segmento) y 54 (3,3%) de revascularización tardía a lo largo del seguimiento. El cateterismo cardiaco en el seguimiento se realizó en el 6,7% de los pacientes y fue significativamente más frecuente en el grupo con CI (11,3%) que en los 2 grupos con SCORE < 10 (tabla 2). La revascularización en el seguimiento fue en el 16,67% de los casos antes de 6 meses desde la realización de la EE. Las tasas anualizadas de eventos en general fueron del 0,6, el 0,12, el 2,8 y el 2,55% en los respectivos grupos de riesgo. Considerando específicamente el tipo de eventos según el RCV, no hubo diferencias entre grupos en eventos fatales ni en el SCA con elevación del segmento ST no fatal. El SCA sin elevación del segmento ST fue significativamente más frecuente en el grupo con SCORE ≥ 10 o DM que entre los pacientes con SCORE < 5 (tasa anualizada, el 0,75 frente al 0,11%; p < 0,008) y similar a la del grupo de CI (tasa anualizada, 0,74%). La revascularización tardía fue significativamente más frecuente en los grupos con SCORE ≥ 10 o DM y de CI que en los 2 grupos de menor riesgo, pero similar entre ellos (tasas anualizadas del 2,05 y el 1,94% respectivamente) (tabla 3).
Tasa anualizada de eventos en función del riesgo cardiovascular
| Sin CI, SCORE < 5a | Sin CI, SCORE 5–9%b | Sin CI, SCORE ≥ 10%/DMc | Con CId | pe | |
|---|---|---|---|---|---|
| Pacientes, n (%) | 783 (47,7) | 173 (10,6) | 250 (15,2) | 434 (26,5) | |
| Tasa anualizada de eventos | 0,60 | 0,12 | 2,80 | 2,55 | < 0,001 |
| Tasa anualizada de: | |||||
| Muerte cardiaca | 0,04 | 0,00 | 0,37 | 0,20 | 0,25 |
| Muerte súbita | 0,07 | 0,00 | 0,37 | 0,20 | 0,44 |
| SCACEST no fatal | 0,07 | 0,12 | 0,56 | 0,20 | 0,35 |
| SCASEST no fatal | 0,11c,d | 0,00d | 0,75a | 0,74a,b | 0,003 |
| Revascularización seguimiento | 0,49c,d | 0,12c,d | 2,05a,b | 1,94a,b | < 0,001 |
CI: cardiopatía isquémica; DM: diabetes mellitus; SCACEST: síndrome coronario agudo con elevación del segmento ST; SCASEST: síndrome coronario agudo sin elevación del segmento ST; SCORE: Systematic COronary Risk Evaluation.
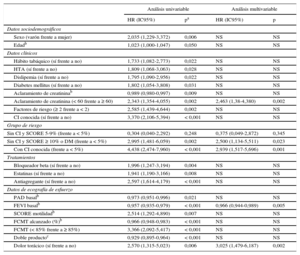
En el análisis univariable, la edad, el sexo masculino, los factores de RCV clásicos (tabaquismo, dislipemia, hipertensión arterial y DM) fueron predictores de eventos. La presencia de 2 o más factores de RCV o de CI conocida o de un SCORE de riesgo ≥ 10 o DM en los pacientes sin CI suponía un riesgo de eventos significativamente aumentado. Un aclaramiento de creatinina < 60 aumentó significativamente el riesgo de eventos. El tratamiento con antiagregantes, bloqueadores beta o estatinas, todos ellos por ser habituales en los pacientes con CI conocida (el 81,3% con antiagregantes, el 65,89% con bloqueadores beta y el 86,21% con estatinas), fue también predictor de eventos. Entre las variables derivadas de la EE, el riesgo de eventos aumentó significativamente en pacientes con dolor torácico durante la EE, con menor FEVI basal, con menor porcentaje de frecuencia cardiaca máxima alcanzada y con un doble producto más bajo (tabla 4). Las alteraciones electrocardiográficas durante la prueba no fueron predictoras de eventos. En el análisis multivariable, la existencia de CI conocida, un riesgo cardiovascular muy alto (SCORE ≥ 10 o DM), un aclaramiento de creatinina < 60, una FEVI basal disminuida y el dolor torácico durante la prueba fueron predictores de eventos cardiacos. Los pacientes con CI y sin CI con SCORE ≥ 10 o DM tenían, respectivamente, 2,9 (p = 0,001) y 2,5 (p = 0,023) veces más riesgo de eventos cardiacos que los pacientes con SCORE < 5. Los pacientes con un aclaramiento de creatinina < 60 tenían 2,5 veces más riesgo de eventos cardiacos que los que tenían aclaramiento ≥ 60. En cuanto a las variables relacionadas con la EE, a mayor FEVI basal, la probabilidad de sufrir eventos cardiacos disminuía (tabla 4). El modelo final presentó un buen ajuste de datos (Hosmer-Lemeshow, p = 0,100) y una adecuada discriminación (área bajo la curva, 0,746; intervalo de confianza del 95%, 0,685-0,807).
Variables predictoras de eventos en la ecocardiografía de esfuerzo sin isquemia: análisis univariable y multivariable
| Análisis univariable | Análisis multivariable | |||
|---|---|---|---|---|
| HR (IC95%) | pa | HR (IC95%) | p | |
| Datos sociodemográficos | ||||
| Sexo (varón frente a mujer) | 2,035 (1,229-3,372) | 0,006 | NS | NS |
| Edadb | 1,023 (1,000-1,047) | 0,050 | NS | NS |
| Datos clínicos | ||||
| Hábito tabáquico (sí frente a no) | 1,733 (1,082-2,773) | 0,022 | NS | NS |
| HTA (sí frente a no) | 1,809 (1,068-3,063) | 0,028 | NS | NS |
| Dislipemia (sí frente a no) | 1,795 (1,090-2,956) | 0,022 | NS | NS |
| Diabetes mellitus (sí frente a no) | 1,802 (1,054-3,808) | 0,031 | NS | NS |
| Aclaramiento de creatininab | 0,989 (0,980-0,997) | 0,009 | NS | NS |
| Aclaramiento de creatinina (< 60 frente a ≥ 60) | 2,343 (1,354-4,055) | 0,002 | 2,463 (1,38-4,380) | 0,002 |
| Factores de riesgo (≥ 2 frente a < 2) | 2,585 (1,439-4,644) | 0,002 | NS | NS |
| CI conocida (sí frente a no) | 3,370 (2,106-5,394) | < 0,001 | NS | NS |
| Grupo de riesgo | ||||
| Sin CI y SCORE 5-9% (frente a < 5%) | 0,304 (0,040-2,292) | 0,248 | 0,375 (0,049-2,872) | 0,345 |
| Sin CI y SCORE ≥ 10% o DM (frente a < 5%) | 2,995 (1,481-6,059) | 0,002 | 2,500 (1,134-5,511) | 0,023 |
| Con CI conocida (frente a < 5%) | 4,438 (2,474-7,960) | < 0,001 | 2,939 (1,517-5,696) | 0,001 |
| Tratamientos | ||||
| Bloqueador beta (sí frente a no) | 1,996 (1,247-3,194) | 0,004 | NS | NS |
| Estatinas (sí frente a no) | 1,941 (1,190-3,166) | 0,008 | NS | NS |
| Antiagregante (sí frente a no) | 2,597 (1,614-4,179) | < 0,001 | NS | NS |
| Datos de ecografía de esfuerzo | ||||
| PAD basalb | 0,973 (0,951-0,996) | 0,021 | NS | NS |
| FEVI basalb | 0,957 (0,935-0,979) | < 0,001 | 0,966 (0,944-0,989) | 0,005 |
| SCORE motilidadb | 2,514 (1,292-4,890) | 0,007 | NS | NS |
| FCMT alcanzado (%)b | 0,966 (0,948-0,983) | < 0,001 | NS | NS |
| FCMT (< 85% frente a ≥ 85%) | 3,366 (2,092-5,417) | < 0,001 | NS | NS |
| Doble productoc | 0,929 (0,895-0,964) | < 0,001 | NS | NS |
| Dolor torácico (sí frente a no) | 2,570 (1,315-5,023) | 0,006 | 3,025 (1,479-6,187) | 0,002 |
ACa: antagonistas del calcio; ARA–II: antagonistas del receptor de la angiotensina II; CI: cardiopatía isquémica; DM: diabetes mellitus; ECG: electrocardiograma; FCMT: frecuencia cardiaca máxima teórica; FEVI: fracción de eyección del ventrículo izquierdo; HR: hazard ratio; HTA: hipertensión arterial; IC95%: intervalo de confianza del 95%; IECA: inhibidores de la enzima de conversión de la angiotensina; NS: no significativo en el modelo multivariable; PAD: presión arterial diastólica; PAS: presión arterial sistólica; SCORE: Systematic COronary Risk Evaluation.
Para el cálculo de p se han utilizado modelos univariables y multivariables de regresión de Cox. También se analizaron las variables dolor torácico, los tratamientos con ACa, nitratos e IECA/ARA-II, PAS basal, MET, cambios en el ECG y la disnea en el análisis univariable. Ninguna de ellas salía estadísticamente significativa (p > 0,05). Para el modelo multivariable, el área bajo la curva = 0,746 (IC95%, 0,685-0,807; pHosmer-Lemeshow = 0,10) (ambos estimados al final del seguimiento).
Los resultados demuestran que el pronóstico de los pacientes sin CI con EE sin isquemia es excelente. En el estudio de McCully et al.12, la supervivencia total estimada a 1 y 3 años fue del 99,5 y el 98,6% de 1.325 pacientes con EE normal sin CI ni disfunción ventricular. En los 1.206 pacientes sin CI, los datos pronósticos son muy similares (el 99,2 y el 97,6% a 1 y 3 años). Por lo tanto, el valor pronóstico favorable del EE sin isquemia en nuestro medio se asemeja al de centros con amplia experiencia. También comparamos los resultados obtenidos con el metanálisis de Metz et al.13, que incluyeron a 3.021 pacientes con EE negativo y cuya tasa de muerte cardiaca o infarto agudo de miocardio fue del 1,56% en un seguimiento medio de 33 meses. En el presente estudio, la tasa conjunta de muerte cardiaca o súbita y SCA no fatal fue superior (el 2,3% tras una mediana de seguimiento de 35 meses). El tiempo de seguimiento y la diferente clasificación de infarto agudo de miocardio tras la incorporación de las troponinas (disponibles en el estudio) pueden ser la causa de la diferencia.
Encontrar variables predictoras de eventos en pacientes con EE sin isquemia es del máximo interés porque con frecuencia se da el alta a estos pacientes desde las consultas de cardiología. En otros estudios, la mayoría de las variables predictoras de eventos en pacientes con EE negativo se obtienen de la propia prueba. Así, un EE normal pero submáximo (FC < 85%)14,15 o una capacidad funcional disminuida (< 7 MET en varones o < 5 en mujeres) supone una mayor tasa de eventos8,16. En este estudio, una frecuencia cardiaca máxima alcanzada < 85% fue también predictora de eventos en el análisis univariable. En consonancia con estudios previos17, las alteraciones electrocardiográficas durante la prueba no fueron predictoras de eventos. El único predictor de eventos en el análisis multivariable derivado de la EE fue la aparición de dolor torácico durante la prueba. Los demás predictores en el análisis multivariable fueron factores clínicos (alto RCV y función renal) y la FEVI basal, lo que indica la importancia que tienen las características del paciente en el pronóstico cuando en la EE no hay isquemia inducida.
La influencia del perfil de riesgo de CI en el riesgo de eventos de pacientes con EE negativo se ha evaluado escasamente. Algunos estudios demuestran que los pacientes con EE negativo tienen una tasa de eventos < 1% al año independientemente de la probabilidad pretest12,18. En el presente estudio no se ha utilizado la probabilidad pretest de enfermedad coronaria, ya que se estima mediante puntuaciones clínicas que incluyen la tipicidad del dolor (angina típica, angina atípica o dolor no anginoso). El carácter retrospectivo del estudio impedía valorar con fiabilidad las características del dolor para su adecuada clasificación. Además, solo un 55% de los pacientes habían consultado por dolor torácico. Por ello, elegimos el RCV estimado mediante los factores de RCV para conocer su influencia en la aparición de eventos. Hasta donde conocemos, este es el primer estudio que establece el riesgo de eventos y su aparición en relación con el tiempo en pacientes con EE negativa en función del RCV. Los datos obtenidos indican que, a pesar del excelente pronóstico que implica inicialmente una EE negativa en todos los grupos, el número de eventos a largo plazo está modulado por el RCV. Así, el descenso de la SLEv a largo plazo se modifica poco si el SCORE es < 10, y se mantiene > 98% a los 3 años, pero es más llamativo en el grupo con SCORE ≥ 10 o DM o el de pacientes con CI (< 95%). La influencia que esta conclusión tiene en el tratamiento del paciente es evidente. En primer lugar, el tiempo de garantía del efecto pronóstico favorable de la EE negativa se mantiene durante 1 año independientemente del RCV, para ir disminuyendo con el tiempo en pacientes con CI (el 91,1% a los 3 años) o con SCORE ≥ 10 o DM (el 94,5% a los 3 años). En segundo lugar, si bien no se puede recomendar el uso de métodos diagnósticos adicionales o tratamientos antiisquémicos, sin duda se debe extremar las medidas de prevención primaria en pacientes con SCORE ≥ 10 o DM y de prevención secundaria en pacientes con enfermedad coronaria a pesar de la ausencia de isquemia inducida.
Fortalezas y limitacionesSe trata de un estudio retrospectivo y observacional en una población de escasa movilidad geográfica y fácil seguimiento, cuyo único hospital de referencia es el nuestro, y que describe bien el tipo de pacientes remitidos a un hospital general no terciario para detección de isquemia. Solo un 0,95% de los pacientes tienen seguimiento < 6 meses y un 3,3%, < 1 año. Las limitaciones de la EE son las propias de la técnica, en la que la interpretación de la contractilidad es dependiente del operador. Respecto a los datos de eventos coronarios en el seguimiento y a diferencia de estudios más antiguos, el uso de troponinas permite diferenciar de manera sensible un episodio anginoso o no coronario de un infarto agudo de miocardio. La baja tasa de eventos primarios refleja la fiabilidad de la técnica, pero es en sí misma una limitación. Hay que recordar que el cateterismo diagnóstico y la revascularización realizados a pesar de la negatividad de la EE no se consideraron como eventos y no falsean los resultados. El tratamiento que se describe corresponde al que tomaban al acudir a la EE, sin que se conozca si hubo cambios en él tras la EE negativa y su efecto en el pronóstico.
CONCLUSIONESUna EE sin isquemia implica un buen pronóstico inicial, posteriormente modulado por el RCV.
FINANCIACIÓNEste estudio se ha podido realizar gracias al consentimiento del Comité Ético del Hospital de Galdakao y a una beca del Departamento de Sanidad del Gobierno Vasco: n.° de expediente 2012111009.
CONFLICTO DE INTERESESNinguno.
- –
Diversos estudios han determinado y coincidido en el buen pronóstico que implica un EE sin isquemia inducible.
- –
Asimismo se han encontrado variables clínicas y derivadas de la prueba que indican qué pacientes podrían sufrir eventos con mayor probabilidad.
- –
Sin embargo, ningún estudio ha relacionado el pronóstico con el perfil de RCV en estos pacientes.
- –
Son predictores de eventos en el presente estudio la existencia de cardiopatía isquémica previa, un SCORE ≥ 10 o DM, la insuficiencia renal, la disfunción ventricular izquierda y el dolor torácico durante la prueba. Algunos de estos predictores están en la línea de otros estudios.
- –
Este estudio aporta como novedad el implicar al riesgo cardiovascular en el pronóstico de los pacientes con EE sin isquemia, de manera que aquellos con SCORE < 10 presentan un pronóstico favorable que se mantiene en el seguimiento, mientras que los pacientes con SCORE ≥ 10 o diabetes tienen un riesgo de eventos que se incrementa con el tiempo transcurrido desde la EE y se asemeja al de los pacientes con cardiopatía isquémica conocida.