El consumo de estanoles vegetales puede contribuir a un mejor control a largo plazo del colesterol. El objetivo es evaluar la eficacia del aporte de estanoles vegetales, a dosis de 2 g/día, en la reducción de las cifras de colesterol unido a lipoproteínas de baja densidad de los pacientes con hipercolesterolemia.
MétodosSe realizó un ensayo clínico aleatorizado, a doble ciego y controlado con placebo, en el que se incluyó a 182 sujetos adultos diagnosticados de hipercolesterolemia. Se administró yogur líquido con 2 g de estanoles vegetales a 91 sujetos del grupo intervención y yogur no suplementado a 91 del grupo control. La variable principal fue la variación del perfil lipídico a los 12 meses.
ResultadosEn comparación con el placebo, a los 12 meses se observó una disminución significativamente superior del colesterol unido a lipoproteínas de baja densidad en el grupo que tomó estanoles: 13,7 (intervalo de confianza del 95%, 3,2-24,1) mg/dl (p = 0,011). En este grupo fue significativamente superior la proporción de sujetos que redujeron en más del 10% sus cifras de colesterol unido a lipoproteínas de baja densidad (riesgo relativo = 1,7; intervalo confianza del 95%, 1,1-2,7). En el grupo tratado, el colesterol unido a lipoproteínas de baja densidad descendió, en promedio, un 11,0 ± 23,9%.
ConclusionesLos resultados confirman que la administración de estanoles vegetales en dosis de 2 g/día durante 1 año produce una reducción significativa (ligeramente superior al 10%) de las concentraciones de colesterol unido a lipoproteínas de baja densidad en sujetos con hipercolesterolemia.
Registro del ensayo (www.ClinicalTrials.gov): Current Controlled Trials NCT01406106.
Palabras clave
A pesar de las recomendaciones de las guías de práctica clínica para reducir el colesterol total (CT) y el colesterol unido a lipoproteínas de baja densidad (cLDL) de los sujetos con hipercolesterolemia, un elevado porcentaje de pacientes presentan cifras superiores a los objetivos recomendados en prevención tanto primaria como secundaria1–3.
Para algunos sujetos con elevado riesgo cardiovascular (RCV), se podría utilizar dosis menores de fármacos hipolipemiantes si se realizaran suficientes cambios en su dieta habitual4. La ingesta diaria de estanoles también es una medida dietética que ha demostrado disminuir el CT y el cLDL5. Además, su utilización junto con estatinas aporta un efecto adicional en la reducción de lípidos6. Sin embargo, hay controversia sobre la recomendación de suplementar la dieta con fitosteroles7.
La evidencia disponible sobre la efectividad de los fitosteroles se ha incluido en diferentes guías de práctica clínica4,8–11, aunque la recomendación de consumirlos figura en menor número de ellas8,11.
Se han llevado a cabo estudios sobre este tema, aunque en múltiples ocasiones han sido de corta duración y con un número de pacientes pequeño12–14. Además, la mayoría de los estudios sobre eficacia de los estanoles se han desarrollado fuera de España, muy probablemente en poblaciones con hábitos de vida y dietéticos diferentes. Por lo tanto, son necesarios estudios en este ámbito, rigurosos y de mayor duración, que cuantifiquen con precisión la magnitud de sus efectos a largo plazo. Considerando todo lo anterior, el objetivo de este estudio es evaluar la eficacia del aporte de estanoles vegetales en dosis de 2 g/día para la reducción de las cifras de cLDL de los pacientes diagnosticados de hipercolesterolemia. Además, se cuantificó el efecto del aporte diario de estanoles en los demás parámetros del perfil lipídico, se evaluó la presencia de efectos adversos y se identificaron los factores asociados a una mayor reducción de las cifras de cLDL.
MÉTODOSSe realizó un ensayo clínico aleatorizado, a doble ciego y en paralelo con grupo control placebo. Se seleccionó a los participantes en nueve consultas de medicina de familia de tres centros de salud del área sanitaria de Albacete. Los criterios de inclusión fueron: sujetos diagnosticados de hipercolesterolemia límite (CT, 200-249mg/dl) o definida (CT ≥ 250mg/dl) con cLDL ≥ 130mg/dl y de edad ≥ 18 años, usuarios de los centros participantes. Se excluyó a los que presentaban hipersensibilidad conocida o contraindicación para los estanoles u otros componentes del alimento que los contiene (yogur líquido), con cifras de triglicéridos ≥ 400mg/dl, incapacidad física para colaborar y enfermedad crónica grave orgánica o psiquiátrica que dificultara la movilidad del paciente para acudir a las visitas o el consumo del producto lácteo. Todos los sujetos incluidos firmaron el consentimiento informado para participar tras la explicación adecuada del estudio. Este fue aprobado por el Comité Ético de Investigación Clínica del Área Sanitaria de Albacete y se ajustó a las directrices éticas pertinentes para ensayos clínicos (Real Decreto 223/2004) y la Declaración de Helsinki.
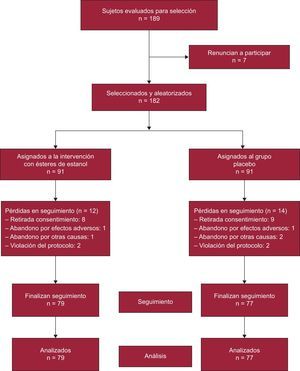
El cálculo del tamaño muestral se basó en un valor medio esperado de cLDL de 190 ± 36mg/dl15 en los participantes y en demostrar un efecto del 10% en cuanto a la reducción de cLDL para los que consumieran estanoles durante 1 año. Para obtener una potencia del 90% con un error alfa del 0,05 (hipótesis bilateral), se requerían 152 sujetos (76 en grupo activo y 76 en grupo a placebo). Asumiendo una proporción de pérdidas del 20%, se seleccionó a 182 sujetos distribuidos en dos grupos de igual tamaño (91 por grupo) para conseguir la máxima potencia estadística. De los 189 sujetos evaluados para la selección, 7 no aceptaron participar en el estudio (tasa de aceptación, 96,3%) (figura). El periodo de reclutamiento abarcó desde marzo de 2010 a febrero de 2011.
Se asignó a los 182 sujetos al grupo experimental o al control de manera aleatoria y equiprobable. La asignación se generó informáticamente a través de una secuencia de números aleatorios, siguiendo un sistema de bloques de tamaño 4 (asegurando que en un intervalo corto hubiera similar número de pacientes en ambos grupos). Esta asignación la realizó de manera centralizada un investigador del Servicio de Farmacia de la Gerencia de Atención Primaria de Albacete ajeno a las entrevistas y los análisis. La información con el número de identificación del paciente y el número de producto asignado se custodió en el servicio de farmacia en sobres sellados, opacos y numerados. Los envases con yogur (con o sin estanoles) se entregaron enmascarados a los pacientes. Para proteger el enmascaramiento, placebo y producto suplementado tenían idéntica apariencia y estaban identificados exclusivamente mediante un código cuya asignación era desconocida por paciente e investigador. Para garantizar la objetividad en la medición de los resultados, el estudio se realizó en condiciones de enmascaramiento para pacientes, investigadores y responsables del análisis de datos.
Respecto a la intervención, se administró un yogur líquido, comercializado en España, que contiene 2 g de ésteres de estanol vegetal por envase: sitostanol y campestanol (dosis recomendada por la American Heart Association, 1,5-3,0 g). Tanto el producto enriquecido como el placebo tenían las mismas características (composición, aspecto externo y sabor), pero el placebo no contenía ésteres de estanol. Se administró un envase diario, tras la comida principal, durante 12 meses. La composición de cada envase era: proteínas, 1,8 g; hidratos de carbono, 9,8 g; grasas (salvo estanol), 1,4 g; estanol vegetal, 2 g; vitamina B6, 0,6 mg; ácido fólico, 60 μg. Los participantes continuaron con los tratamientos hipolipemiantes prescritos previamente y los nuevos que se precisaran. A todos los participantes se les recomendó la pauta terapéutica más adecuada en cada caso (medidas higiénico-dietéticas o medicación hipolipemiante, siguiendo las recomendaciones de la guía europea de prevención cardiovascular)16. Se indicó la práctica de ejercicio físico (al menos 30 min/día durante 4-5 días/semana) y las recomendaciones generales incluidas en la dieta mediterránea (cantidad y tipo de grasas, hidratos de carbono y proteínas).
La duración del seguimiento de los participantes fue de 12 meses. Tras obtener su consentimiento, se los citó para la visita inicial y toma de muestras para análisis. En la visita inicial, se aleatorizó a los participantes a uno de los dos grupos, se completaron los datos de anamnesis, analítica y exploración física y se dispensó el producto lácteo que correspondiera a cada caso (las sucesivas entregas se realizaron según su fecha de caducidad). Se realizaron visitas de seguimiento al cabo de 1, 3, 6 y 12 meses para registrar parámetros analíticos y de exploración física, según correspondiera. La variable principal fue la diferencia en las cifras de cLDL al cabo de 12 meses. Se midió el perfil lipídico (CT, cLDL, cHDL [colesterol unido a lipoproteínas de alta densidad] y triglicéridos) al cabo de 3 y 12 meses. Las determinaciones analíticas se practicaron en muestras tomadas de sangre venosa tras un ayuno no inferior a 12 h; la concentración plasmática de CT se determinó mediante el método CHODPAP y la de cLDL, con el método de Friedewald. Estas determinaciones se realizaron en el laboratorio de referencia (Complejo Hospitalario Universitario de Albacete), que está acreditado por la Sociedad Española de Bioquímica Clínica. Otras variables determinadas fueron: características sociodemográficas (edad, sexo, estado civil, nivel de instrucción y categoría social), cumplimiento terapéutico mediante el test de Morisky-Green17 (se consideró buena adherencia que se respondiera adecuadamente a las cuatro preguntas dicotómicas del cuestionario, referidas al olvido de la toma del producto lácteo y la adecuación a la pauta), acontecimientos adversos, adherencia a recomendaciones dietéticas, consumo de alimentos (cuestionario hábitos)18, aparición de eventos cardiovasculares (cardiopatía isquémica, enfermedad cerebrovascular aterotrombótica y enfermedad arterial periférica), datos antropométricos (peso, talla e índice de masa corporal), actividad física, hábito tabáquico, presión arterial sistólica y diastólica, RCV (tablas SCORE [Systematic Coronary Risk Evaluation] para países de bajo RCV y REGICOR [Registre Gironí del Cor]), problemas de salud (Clasificación Internacional de Atención Primaria-2 de la WONCA [World Organization of National Colleges, Academies, and Academic Associations of General Practitioners/Family Physicians]), seguimiento de tratamiento farmacológico hipolipemiante y consumo de otros medicamentos. Se consideró causa de finalización del estudio: completado el periodo de observación, fallecimiento, violación del protocolo, acontecimiento adverso grave, enfermedad intercurrente que imposibilitara la ingesta alimentaria y abandono del paciente o retirada del consentimiento. No se realizaron cambios en el protocolo durante el trascurso del ensayo.
Respecto al análisis estadístico, se realizó una descripción de las características basales de los participantes de ambos grupos (medidas de tendencia central y dispersión). Posteriormente, se clasificó a los sujetos de ambos grupos en diferentes niveles de reducción de cLDL y de CT y se realizó un análisis bruto para evaluar los siguientes parámetros y sus intervalos de confianza del 95% (IC95%): aumento absoluto de beneficio, aumento relativo de beneficio y número de pacientes que es necesario tratar. Además, se describió y se comparó la incidencia de las variables resultado en ambos grupos (comparación de proporciones mediante prueba de la χ2 o comparación de medias mediante prueba de la t de Student o de la U de Mann-Whitney, con un error alfa del 5%). La modificación de los parámetros en cada grupo se analizó mediante la prueba de la t para medidas repetidas. La posible existencia de factores de confusión o la interacción de otras variables en la relación entre la intervención propuesta y las variables resultado se evaluaron mediante modelos de regresión logística (variable dependiente: nivel de reducción de los parámetros lipídicos). Mediante regresión lineal múltiple, se analizaron las posibles variables relacionadas con una mayor reducción de las cifras de cLDL en el grupo que tomó estanoles y en el total de los participantes incluyendo en el modelo la siguientes variables: sexo, edad en años, estado civil, clase social, número de problemas de salud, número de medicamentos consumidos, consumo de tabaco, realización de actividad física, cifras plasmáticas de cLDL y CT, peso e índice de masa corporal, RCV determinado mediante SCORE y seguimiento de dieta hipolipemiante al inicio del estudio. El análisis de eficacia se realizó por intención de tratar, y cada individuo permaneció en el grupo al que fue asignado inicialmente. En este análisis se incluyó a todos los sujetos evaluados a los 3 y a los 12 meses, respectivamente, con independencia del cumplimiento de la toma del producto lácteo. La cifra de cLDL analizada fue la determinada en la visita correspondiente. Los análisis se realizaron con el programa SPSS.v.20.0.
RESULTADOSDe los 182 sujetos que iniciaron el estudio, 79 completaron el seguimiento en el grupo intervención y 77 en el grupo control. Los grupos no fueron diferentes en el porcentaje de sujetos que completaron el estudio (el 86,8 frente al 84,6%; p = 0,672). La distribución de los pacientes perdidos se muestra en la figura.
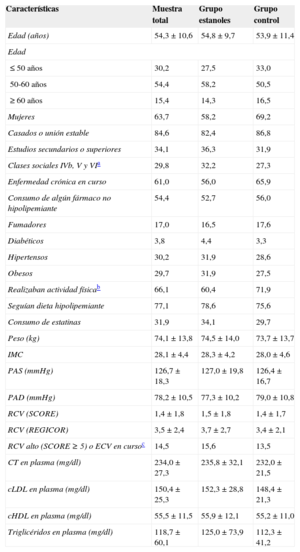
La media de edad era 54,3 ± 10,6 años. Las características basales de ambos grupos se muestran en la tabla 1. Al inicio del estudio tomaban estatinas 31 sujetos del grupo tratado con estanoles (34,1%) y 27 del control (29,7%); 18 pacientes del grupo intervención tomaban simvastatina; 10, atorvastatina; 2, rosuvastatina y 1, pravastatina. En el grupo control 17 sujetos tomaban simvastatina; 8, atorvastatina; 1, pravastatina y 1, fluvastatina. Ambos grupos manifestaron similares hábitos alimentarios respecto a frecuencia de consumo de aceite, verduras, ensaladas, carne, pescado y otros alimentos.
Características basales de los participantes
| Características | Muestra total | Grupo estanoles | Grupo control |
|---|---|---|---|
| Edad (años) | 54,3 ± 10,6 | 54,8 ± 9,7 | 53,9 ± 11,4 |
| Edad | |||
| ≤ 50 años | 30,2 | 27,5 | 33,0 |
| 50-60 años | 54,4 | 58,2 | 50,5 |
| ≥ 60 años | 15,4 | 14,3 | 16,5 |
| Mujeres | 63,7 | 58,2 | 69,2 |
| Casados o unión estable | 84,6 | 82,4 | 86,8 |
| Estudios secundarios o superiores | 34,1 | 36,3 | 31,9 |
| Clases sociales IVb, V y VIa | 29,8 | 32,2 | 27,3 |
| Enfermedad crónica en curso | 61,0 | 56,0 | 65,9 |
| Consumo de algún fármaco no hipolipemiante | 54,4 | 52,7 | 56,0 |
| Fumadores | 17,0 | 16,5 | 17,6 |
| Diabéticos | 3,8 | 4,4 | 3,3 |
| Hipertensos | 30,2 | 31,9 | 28,6 |
| Obesos | 29,7 | 31,9 | 27,5 |
| Realizaban actividad físicab | 66,1 | 60,4 | 71,9 |
| Seguían dieta hipolipemiante | 77,1 | 78,6 | 75,6 |
| Consumo de estatinas | 31,9 | 34,1 | 29,7 |
| Peso (kg) | 74,1 ± 13,8 | 74,5 ± 14,0 | 73,7 ± 13,7 |
| IMC | 28,1 ± 4,4 | 28,3 ± 4,2 | 28,0 ± 4,6 |
| PAS (mmHg) | 126,7 ± 18,3 | 127,0 ± 19,8 | 126,4 ± 16,7 |
| PAD (mmHg) | 78,2 ± 10,5 | 77,3 ± 10,2 | 79,0 ± 10,8 |
| RCV (SCORE) | 1,4 ± 1,8 | 1,5 ± 1,8 | 1,4 ± 1,7 |
| RCV (REGICOR) | 3,5 ± 2,4 | 3,7 ± 2,7 | 3,4 ± 2,1 |
| RCV alto (SCORE ≥ 5) o ECV en cursoc | 14,5 | 15,6 | 13,5 |
| CT en plasma (mg/dl) | 234,0 ± 27,3 | 235,8 ± 32,1 | 232,0 ± 21,5 |
| cLDL en plasma (mg/dl) | 150,4 ± 25,3 | 152,3 ± 28,8 | 148,4 ± 21,3 |
| cHDL en plasma (mg/dl) | 55,5 ± 11,5 | 55,9 ± 12,1 | 55,2 ± 11,0 |
| Triglicéridos en plasma (mg/dl) | 118,7 ± 60,1 | 125,0 ± 73,9 | 112,3 ± 41,2 |
cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; CT: colesterol total; ECV: enfermedad cardiovascular; IMC: índice de masa corporal; PAD: presión arterial diastólica; PAS: presión arterial sistólica; REGICOR: Registre Gironí del Cor; RCV: riesgo cardiovascular; SCORE: Systematic Coronary Risk Evaluation.
Los valores expresan porcentajes o media ± desviación estándar.
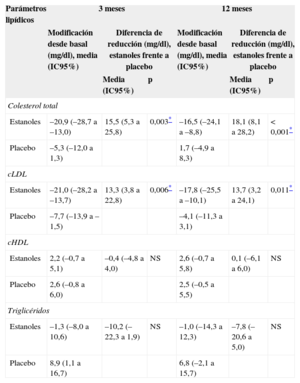
En la tabla 2 se muestran las diferencias entre los grupos de intervención y placebo respecto a los parámetros lipídicos a los 3 y 12 meses de seguimiento. Al comparar la modificación de las cifras de los diferentes parámetros lipídicos entre ambos grupos durante el seguimiento, se observó una mayor reducción media del CT en el grupo de intervención tanto a los 3 meses (15,5 [IC95%, 5,3-25,8] mg/dl; p = 0,003) como a los 12 meses (18,1 [IC95%, 8,1-28,2] mg/dl; p < 0,001). La disminución del cLDL también era superior en los que tomaron estanoles al cabo de 3 meses (13,3 [IC95%, 3,8-22,8] mg/dl; p = 0,006) y a los 12 meses (13,7 [IC95%, 3,2-24,1] mg/dl; p = 0,011). No aparecieron diferencias estadísticamente significativas entre uno y otro grupo respecto al cHDL, triglicéridos, CT/cHDL y cLDL/cHDL.
Evolución de los parámetros lipídicos y diferencias entre los grupos de intervención y placebo respecto a la reducción de esos parámetros al cabo de 3 y 12 meses
| Parámetros lipídicos | 3 meses | 12 meses | ||||
|---|---|---|---|---|---|---|
| Modificación desde basal (mg/dl), media (IC95%) | Diferencia de reducción (mg/dl), estanoles frente a placebo | Modificación desde basal (mg/dl), media (IC95%) | Diferencia de reducción (mg/dl), estanoles frente a placebo | |||
| Media (IC95%) | p | Media (IC95%) | p | |||
| Colesterol total | ||||||
| Estanoles | –20,9 (–28,7 a –13,0) | 15,5 (5,3 a 25,8) | 0,003* | –16,5 (–24,1 a –8,8) | 18,1 (8,1 a 28,2) | < 0,001* |
| Placebo | –5,3 (–12,0 a 1,3) | 1,7 (–4,9 a 8,3) | ||||
| cLDL | ||||||
| Estanoles | –21,0 (–28,2 a –13,7) | 13,3 (3,8 a 22,8) | 0,006* | –17,8 (–25,5 a –10,1) | 13,7 (3,2 a 24,1) | 0,011* |
| Placebo | –7,7 (–13,9 a –1,5) | –4,1 (–11,3 a 3,1) | ||||
| cHDL | ||||||
| Estanoles | 2,2 (–0,7 a 5,1) | –0,4 (–4,8 a 4,0) | NS | 2,6 (–0,7 a 5,8) | 0,1 (–6,1 a 6,0) | NS |
| Placebo | 2,6 (–0,8 a 6,0) | 2,5 (–0,5 a 5,5) | ||||
| Triglicéridos | ||||||
| Estanoles | –1,3 (–8,0 a 10,6) | –10,2 (–22,3 a 1,9) | NS | –1,0 (–14,3 a 12,3) | –7,8 (–20,6 a 5,0) | NS |
| Placebo | 8,9 (1,1 a 16,7) | 6,8 (–2,1 a 15,7) | ||||
cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; IC95%: intervalo de confianza del 95%; NS: no significativo.
El grupo que tomó estanoles mostraba a los 12 meses una reducción media del cLDL respecto al inicial significativamente superior que el control (el 11,0 frente al 0,9%; IC95%, 2,1-18,1%; p = 0,014). También fue superior la reducción del CT (el 6,1 frente al 1,3%; IC95%, 3,0-11,7%; p = 0,001).
Se comprobó que la proporción de sujetos que redujo sus cifras de cLDL fue significativamente superior en el grupo tratado con estanoles tanto a los 3 meses (riesgo relativo [RR] = 1,38; IC95%, 1,10-1,74) como a los 12 meses (RR = 1,47; IC95%, 1,13-1,91). También se observó una proporción significativamente superior de sujetos que alcanzaron una reducción del 10% en las cifras de cLDL del grupo tratado respecto al grupo controlado con placebo a los 3 meses (RR = 1,74; IC95%, 1,16-2,62) y al año (RR = 1,72; IC95%, 1,11-2,65). Al cabo de 12 meses, el aumento absoluto del beneficio por alcanzar una reducción de cLDL del 10% fue del 20% (IC95%, 5-34%); el aumento relativo del beneficio, del 42% (IC95%, 10-62%), y un número de pacientes que es necesario tratar de 5. Respecto a la reducción del 10% del CT al año, también fue mayor en los que consumieron estanoles (RR = 2,57; IC95%, 1,38-4,77).
En cuanto a efectos secundarios, 7 pacientes (7,7%) del grupo intervención y 6 (6,7%) del grupo control experimentaron alguno, sin diferencias estadísticamente significativas entre un grupo y otro respecto a efectos adversos (p = 0,733). Todos los efectos secundarios en ambos grupos fueron de tipo gastrointestinal (epigastralgia, sensación de plenitud, meteorismo).
Respecto a la adherencia al producto lácteo, el 73,0% (IC95%, 65,7-80,2%) de los participantes manifestaron un cumplimiento adecuado a los 3 meses y el 72,2% (IC95%, 64,7-79,7%), al año. No se observaron diferencias intergrupales estadísticamente significativas respecto al cumplimiento a los 3 meses (el 68,7 frente al 77,6%) y a los 12 meses (el 68,8 frente al 75,5%).
Tanto a los 3 como a los 12 meses, no se observaron diferencias intergrupales estadísticamente significativas respecto a la toma de estatinas y el cumplimiento de las recomendaciones dietéticas. Al cabo de 12 meses consumían estatinas 28 pacientes del grupo de intervención (35,4%) y 25 del control (32,9%). A lo largo de todo el seguimiento, se prescribió una estatina a 2 pacientes del grupo intervención y 2 del grupo control. No se modificaron la dosis ni el tipo de estatina en ninguno de los grupos durante todo el seguimiento.
Al comparar ambos grupos respecto a la modificación de parámetros antropométricos, presión arterial y RCV durante el seguimiento, no hubo diferencias estadísticamente significativas.
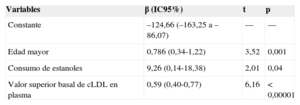
En las tablas 3 y 4 se muestran los factores relacionados en la regresión lineal múltiple con mayor reducción de las cifras de cLDL a los 12 meses, en el total de participantes y en los sujetos que consumieron estanoles respectivamente. Las variables relacionadas con una mayor reducción de las cifras de cLDL a los 12 meses en todos los participantes fueron, además del tipo de tratamiento (β = 9,26; IC95%, 0,14-18,38), tener más edad (β = 0,79; IC95%, 0,34-1,22) y presentar una cifra inicial de cLDL superior (β = 0,59; IC95%, 0,40-0,77).
Modelo de regresión lineal múltiple para las variables relacionadas con mayor reducción de las cifras de colesterol unido a lipoproteínas de baja densidad en todos los participantes
| Variables | β (IC95%) | t | p |
|---|---|---|---|
| Constante | –124,66 (–163,25 a –86,07) | — | — |
| Edad mayor | 0,786 (0,34-1,22) | 3,52 | 0,001 |
| Consumo de estanoles | 9,26 (0,14-18,38) | 2,01 | 0,04 |
| Valor superior basal de cLDL en plasma | 0,59 (0,40-0,77) | 6,16 | < 0,00001 |
cLDL: colesterol unido a lipoproteínas de baja densidad; IC95%: intervalo de confianza del 95%.
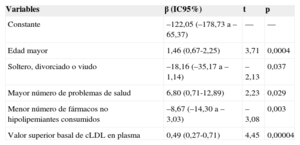
Modelo de regresión lineal múltiple para las variables relacionadas con mayor reducción de las cifras de colesterol unido a lipoproteínas de baja densidad en el grupo de intervención
| Variables | β (IC95%) | t | p |
|---|---|---|---|
| Constante | –122,05 (–178,73 a –65,37) | — | — |
| Edad mayor | 1,46 (0,67-2,25) | 3,71 | 0,0004 |
| Soltero, divorciado o viudo | –18,16 (–35,17 a –1,14) | –2,13 | 0,037 |
| Mayor número de problemas de salud | 6,80 (0,71-12,89) | 2,23 | 0,029 |
| Menor número de fármacos no hipolipemiantes consumidos | –8,67 (–14,30 a –3,03) | –3,08 | 0,003 |
| Valor superior basal de cLDL en plasma | 0,49 (0,27-0,71) | 4,45 | 0,00004 |
cLDL: colesterol unido a lipoproteínas de baja densidad; IC95%: intervalo de confianza del 95%.
Los estudios sobre efectividad de estanoles en hipercolesterolemia muestran una amplia variabilidad en cuanto a su diseño, si se considera la duración de su consumo, el producto administrado, el tamaño muestral o las características epidemiológicas de la población. Los resultados del presente estudio muestran que, en comparación con el consumo de yogur con placebo, la ingesta diaria de 2 g de estanoles vegetales se asoció a una disminución > 10% de los valores plasmáticos de cLDL respecto a los iniciales, tanto a los 3 meses como tras 1 año de consumo. Esta reducción del 10% de cLDL podría suponer una reducción del riesgo de enfermedad cardiovascular8,9,19.
Los resultados de este estudio coinciden con los de un reciente metanálisis que evaluó el efecto de los fitosteroles incorporados en nueve tipos de alimentos distintos y consumidos durante diferentes lapsos20. Los estudios previos con estanoles administrados en forma de yogur han mostrado reducciones de cLDL y CT similares21 o inferiores22 a las del presente estudio. También se ha observado una disminución similar al suplementar con estanoles otros alimentos23. Como en estudios previos, los resultados no mostraron modificaciones de cHDL y triglicéridos12,21.
Respecto a la diferencia con estudios previos, este aporta resultados a largo plazo del efecto de los estanoles, pues son escasos los estudios realizados con una duración superior a 4 semanas y la gran mayoría ellos no superaron los 2 meses24–26. Además, se ha demostrado ese efecto en el cLDL en una amplia muestra de pacientes con hipercolesterolemia atendidos en atención primaria, siguiendo las recomendaciones terapéuticas habituales de práctica clínica adaptadas a la población española. También se ha comprobado que los efectos secundarios manifestados tras consumir estanoles durante 1 año no son más graves que los descritos previamente18,24.
Los resultados del presente estudio concuerdan con la evidencia disponible y permiten considerar los alimentos con estanoles para los pacientes en prevención primaria cuyo RCV no justifique la administración de estatinas27,28 y los que necesiten un tratamiento simultáneo con estatinas6,28,29. Por lo tanto, los estanoles pueden ser útiles en prevención tanto primaria como secundaria6 por permitir la utilización de dosis menores de estatinas y evitar los posibles efectos secundarios de estas.
Por otra parte, se ha comprobado que la edad y las concentraciones iniciales de cLDL se relacionaron con mayor reducción del cLDL. Similares resultados se han indicado en varios metanálisis22,30, aunque explicaban el efecto de la edad en función del de la cifras iniciales de cLDL, mientras que en el presente estudio el efecto de la edad se mantiene al excluir el cLDL basal del modelo de regresión. La distribución etaria de la muestra podría tener alguna relación con estos resultados.
LimitacionesEntre las limitaciones de este estudio, cabe señalar que las modificaciones de la dieta o del uso de estatinas podrían alterar los resultados; sin embargo, no hubo cambios significativos respecto al inicio, por lo que es poco probable que las reducciones en el perfil lipídico observadas se debieran a cambios en la dieta o en la toma de estatinas. Además, se comprobó la ausencia de diferencias entre el grupo que tomó estanoles y el control respecto a toma de hipolipemiantes y consumo de alimentos. Por otra parte, como limitación se podría plantear que el uso de estanoles podría afectar a la adherencia a las estatinas, pero se ha comprobado en estudios previos que el consumo diario de alimentos con estanoles no modificó la adherencia31. Las características del medio en que se realizó este estudio podrían representar una limitación que dificultara la extrapolación de sus resultados; sin embargo, se trata de un ensayo clínico aleatorizado sobre pacientes dislipémicos habituales de las consultas de atención primaria, cuyas características no deben ser diferentes de las de otras poblaciones de pacientes con hipercolesterolemia.
Tras comprobar la efectividad de los estanoles vegetales para reducir las concentraciones de CT y cLDL al cabo de 1 año, probablemente sean necesarios nuevos estudios controlados de mayor duración que permitan determinar su efectividad en la disminución de eventos cardiovasculares4, pues hasta este momento no se dispone de datos de su efecto en prevención de enfermedad cardiovascular9. También se precisan nuevos estudios diseñados específicamente para conocer los factores asociados a la magnitud de la reducción del cLDL tras el consumo de estanoles a largo plazo. Además, mediante esas investigaciones con estanoles consumidos durante más tiempo, se podrá estudiar si la aparición de efectos adversos se modifica9. Por otra parte, son necesarios nuevos estudios sobre adherencia a los estanoles y los posibles factores relacionados con ella, como el tipo de alimento suplementado, la dosis diaria o el número de tomas al día.
CONCLUSIONESLos resultados obtenidos demuestran la eficacia de los estanoles vegetales en la reducción del cLDL de sujetos con hipercolesterolemia pues, en este estudio aleatorizado y controlado con placebo, muestran que, en comparación con el consumo de yogur sin estanoles, la ingesta diaria de 2 g de estanoles vegetales durante 1 año se asocia a una disminución del cLDL plasmático. Esta reducción superó el 10% respecto a los valores iniciales tanto a los 3 meses como al cabo de 1 año de consumo, y podría resultar clínicamente relevante. Estos resultados permiten considerar para pacientes con hipercolesterolemia el consumo de estanoles vegetales en una toma diaria, si se tiene en cuenta, además de su efectividad, la adecuada adherencia y los escasos efectos adversos.
FINANCIACIÓNEste estudio ha sido financiado por la FISCAM (Fundación para la Investigación Sanitaria en Castilla-La Mancha), resolución de fecha 23 de diciembre de 2009 (publicado en el Diario Oficial de Castilla-La Mancha el 4 de enero de 2010). Esta beca permitió adquirir el producto administrado.
CONFLICTO DE INTERESESNinguno.
Los autores agradecen a todos los pacientes y profesionales que han participado en la realización de este estudio.