Escasean datos a largo plazo sobre la relación entre disfunción endotelial tras infarto agudo de miocardio con elevación del segmento ST y futuros eventos clínicos adversos. El objetivo de este estudio es evaluar de manera no invasiva si la disfunción endotelial 4–6 semanas tras una intervención coronaria percutánea primaria por infarto agudo de miocardio con elevación del segmento ST predice la aparición futura de eventos clínicos.
MétodosEste estudio prospectivo de cohortes se llevó a cabo en 70 pacientes del ensayo aleatorizado RESPONSE, a los que se evaluó de manera no invasiva la función endotelial 4–6 semanas después de la intervención coronaria percutánea primaria. Se determinó la función endotelial por el método de tonometría arterial periférica con hiperemia reactiva; la disfunción endotelial se identificó por un índice<1,67.
ResultadosEl índice de tonometría arterial periférica con hiperemia reactiva fue en promedio 1,90±0,58. Un total de 35 (50%) pacientes presentaban disfunción endotelial y 35 (50%) tenían función endotelial normal. Las «complicaciones» periintervención (como shock cardiogénico o bloqueo auriculoventricular completo) fueron más frecuentes entre los pacientes con disfunción endotelial que entre quienes no la presentaban (el 25,7 frente al 2,9%; p<0,01). Durante un seguimiento medio de 4,0±1,7 años, 20 pacientes (28,6%) presentaron eventos adversos cardiovasculares mayores: se produjeron eventos de este tipo en 9 pacientes (25,7%) con disfunción endotelial y 11 (31,5%) con función endotelial normal (p=0,52). Se observó asociación entre la prevalencia basal de diabetes mellitus y la aparición de eventos adversos cardiovasculares mayores durante el seguimiento (análisis univariable, hazard ratio=2,8; intervalo de confianza del 95%, 1,0-7,8; p<0,05) e incluso en los análisis multivariable el riesgo parecía aumentar, aunque sin alcanzar significación estadística (análisis multivariable, hazard ratio=2,5; intervalo de confianza del 95%, 0,8-7,5).
ConclusionesEn esta serie de pacientes que habían sobrevivido a un infarto agudo de miocardio con elevación del segmento ST, la disfunción endotelial evaluada mediante tonometría arterial periférica con hiperemia reactiva 4–6 semanas tras el infarto de miocardio, no predijo los eventos clínicos futuros en una media de seguimiento de 4 años.
Palabras clave
La disfunción endotelial de los vasos de resistencia y conductancia coronarios, que se observa con mayor frecuencia en presencia de determinados factores de riesgo cardiovascular, contribuye significativamente al proceso de aterogénesis1–5 y puede causar isquemia miocárdica6–8. La mejora de la evolución clínica en respuesta a la modificación de los factores de riesgo puede ser consecuencia principalmente de la recuperación funcional de la función vasomotora coronaria deteriorada, mientras que las alteraciones estructurales del vaso aterosclerótico se mantienen sin cambios9. En estudios previos se ha demostrado que la disfunción endotelial se asocia a aumento del riesgo en los pacientes sin lesiones coronarias obstructivas10–14, así como a aumento del riesgo de reestenosis tras el implante de stents en pacientes sin infarto de miocardio15,16. Durante un seguimiento medio de 14 meses, una población de pacientes con infartos de miocardio no complicados mostró un aumento del riesgo de eventos clínicos si presentaban tanto diabetes mellitus como disfunción endotelial17.
Sin embargo, hasta el momento, los datos clínicos a largo plazo sobre la evolución clínica de los pacientes en relación con la función endotelial tras un infarto agudo de miocardio con elevación del segmento ST (IAMCEST) son escasos18. La mayor parte de los estudios antes citados utilizaron técnicas no invasivas para evaluar la función endotelial en arterias periféricas, y se ha demostrado que esta se correlaciona con la función endotelial coronaria19,20. Mientras que los métodos basados en ultrasonidos para evaluar la dilatación de la arteria humeral mediada por el flujo requieren formación y experiencia considerables, la tonometría arterial periférica con hiperemia reactiva (TAP-HR) es un método independiente del operador que se ha validado por comparación con el método basado en ultrasonidos y con la evaluación de la función endotelial coronaria basada en acetilcolina21–23. Además, se ha demostrado que el índice de TAP-HR de la función endotelial periférica está reducido en presencia de disfunción endotelial coronaria confirmada23.
En el presente subestudio prospectivo del ensayo RESPONSE24, se examinó a pacientes con IAMCEST usando la TAP-HR 4-6 semanas tras el tratamiento con intervención coronaria percutánea primaria (ICPp), con objeto de evaluar la hipótesis de que la disfunción endotelial medida a las 4-6 semanas de la ICPp puede predecir la evolución clínica a largo plazo después de un IAMCEST.
MÉTODOSPoblación en estudio y diseñoEste estudio prospectivo de cohorte se llevó a cabo en 70 pacientes con IAMCEST del ensayo RESPONSE24 tratados con ICPp por IAMCEST (≤ 12 h tras el inicio de los síntomas) a los que se evaluó la función endotelial de manera no invasiva por el método de TAP-HR al cabo de 4-6 semanas. Las intervenciones de ICPp se llevaron a cabo entre octubre de 2007 y diciembre de 2008 en el Thoraxcentrum Twente. De un total de 75 pacientes con IAMCEST del ensayo RESPONSE con determinaciones de TAP-HR disponibles, 71 tenían registros de TAP-HR analizables y, excepto 1 caso, se dispuso del seguimiento de todos esos pacientes, con lo que la población del presente estudio fue de 70 pacientes. Los participantes fueron objeto de seguimiento hasta la aparición de un primer evento adverso cardiovascular mayor (MACE) o, de no producirse MACE alguno, hasta el final del estudio en mayo de 2013. Desde el momento de inclusión en el estudio hasta el final del periodo de seguimiento, se documentaron los siguientes eventos adversos: revascularización del vaso diana, revascularización arterial coronaria, intervenciones realizadas por una enfermedad arterial periférica obstructiva, ictus y muerte por cualquier causa. El ensayo aleatorizado RESPONSE cuantificó qué repercusión en el riesgo cardiovascular tenía un programa de prevención práctico, de base hospitalaria y coordinado por enfermería, integrado en la asistencia clínica habitual de los pacientes dados de alta tras un síndrome coronario agudo, en comparación con la asistencia habitual sola. Se clasificó entonces el control de los factores de riesgo, basándose en el número de factores de riesgo sobre los que se pretendía actuar24. De manera resumida, los pacientes debían tener entre 18 y 80 años de edad y no debía haberse programado ninguna intervención quirúrgica ni otras ICP adicionales en las 8 semanas siguientes a la ICPp; además, no debían presentar insuficiencia cardiaca congestiva de clase funcional III o IV de la New York Heart Association y su esperanza de vida debía ser ≥ 2 años.
Dado que los procesos de inflamación y reparación del infarto de miocardio podrían haber alterado las mediciones de la función endotelial durante las primeras semanas siguientes al IAMCEST y la disfunción endotelial podría no haberse recuperado por completo durante el tratamiento médico, la función endotelial se determinó 4–6 semanas después de la ICPp25–27. Todos los pacientes se visitaron en la clínica ambulatoria y en el departamento de investigación del Thoraxcentrum Twente, donde se realizaron las determinaciones no invasivas de la función endotelial aplicando unas reglas estrictas en un laboratorio específicamente dedicado a ello28. No se evaluó sistemáticamente mediante angiografía de seguimiento. Todos los pacientes dieron su consentimiento informado por escrito tanto para la participación en el ensayo RESPONSE como para su inclusión en el subestudio. El ensayo y el subestudio se atuvieron a las normas establecidas en la Declaración de Helsinki para la investigación en el ser humano, y los aprobó el Comité de Ética Médica de Twente en Enschede (Países Bajos).
Intervención coronaria y tratamiento médico concomitanteLos pacientes recibieron tratamiento en la ambulancia con un bolo intravenoso de 5.000 UI de heparina no fraccionada, una dosis de carga ≥ 300 mg de ácido acetilsalicílico (por vía oral o intravenosa) y una dosis de carga de 600 mg de clopidogrel por vía oral. A 50 pacientes (71,4%) se les administró un bolo intracoronario de abciximab en dosis ajustadas por el peso, tras visualizar la arteria coronaria responsable. Las ICPp se llevaron a cabo por lo general por vía femoral empleando vainas de 6 Fr. El tratamiento farmacológico, el uso de catéteres de aspiración, la preparación de la lesión (frente a implante directo de stents) y la posdilatación del stent se realizaron según lo indicado en las guías actuales y según el juicio y criterio del operador. Tras la ICPp, un equipo de cardiología evaluó las angiografías coronarias y, en caso necesario, se trató otras lesiones coronarias de los pacientes con nuevas ICP por etapas, por lo general 1-2 semanas tras la ICPp.
Evaluación no invasiva de la función endotelial con el método de tonometría arterial periférica con hiperemia reactivaLa función endotelial se evaluó con el método de TAP-HR. Se determinó la amplitud de la onda de pulso digital con el dispositivo sensor EndoPAT-2000 y sondas de pletismografía digital (Itamar Medical; Caesarea, Israel), tanto en la situación basal como durante la hiperemia inducida por la isquemia. Todas las determinaciones se realizaron a primera hora de la mañana en un laboratorio dedicado específicamente a ello, después de que los pacientes hubieran permanecido en ayunas durante un mínimo de 8 h. Los pacientes debían evitar también el consumo de cafeína, fumar o tomar medicaciones vasoactivas. Al menos 15 min antes de las determinaciones, se realizaba una lectura de la presión arterial y se extraía una muestra de sangre en el brazo de control. Antes de realizar medición alguna, los pacientes pasaban por un periodo de aclimatación de 20 min en una sala en silencio, tendidos en una cama de hospital y a una temperatura ambiente de 21–23°C.
El método de TAP-HR se ha descrito detalladamente con anterioridad28,29. Resumidamente, las determinaciones se realizaron usando sondas en los dedos índice del brazo en estudio y el brazo de control. Se registraron determinaciones basales durante 5 min antes de la inducción de la isquemia; para ello se hinchaba el manguito de presión arterial en la parte superior del brazo en estudio durante 5 min hasta valores de presión suprasistólicos. Esto producía liberación de óxido nítrico por el endotelio funcional y, por consiguiente, vasodilatación, que los sensores del manguito digital registraban a través del análisis de la onda pulsada del dedo latido a latido30. Tras deshinchar el manguito de presión arterial, se calculaba el cociente de la amplitud del pulso en el dedo hiperémico respecto a la amplitud basal. A continuación, se dividía este cociente por el obtenido en el brazo de control, con objeto de calcular el índice de TAP-HR (en el que los valores altos indican buena función endotelial)30. Recientemente, Hamburg et al31 han demostrado que cabe prever que se alcanza la respuesta hiperémica máxima a los 90-120 s de deshinchar el manguito. En consecuencia, en el presente estudio, el índice de TAP-HR reactiva se calculó mediante el cociente del análisis de la onda pulsada hiperémica media de un periodo de 30 s, empezando a los 90 s de deshinchado el manguito, dividido por el análisis de la onda pulsada basal (mediciones basales medias durante 3,5 min) y estandarizado respecto a las mediciones simultáneas realizadas en el brazo de control. La función endotelial se dividió en dos grupos: uno con disfunción endotelial (TAP–HR<1,67) y otro con función endotelial normal (TAP–HR ≥ 1,67)29.
Características de los pacientes y definicionesSe documentó la siguiente información: edad, sexo, índice de masa corporal, hipertensión arterial (presión arterial>140/90mmHg o tratamiento con medicación antihipertensiva), antecedentes de tabaquismo (ex fumador o fumador actual), antecedentes de infarto de miocardio o revascularización coronaria mediante ICP o cirugía de revascularización aortocoronaria, tiempo entre inicio de los síntomas e ICPp, presencia de diabetes mellitus (según la historia clínica del paciente o tratamiento con insulina o fármacos antihiperglucémicos) y antecedentes de hiperlipemia o tratamiento con fármacos hipolipemiantes.
El objetivo fue el compuesto denominado MACE de muerte por cualquier causa, infarto de miocardio, revascularización coronaria, ictus y revascularización por enfermedad arterial periférica de nueva aparición.
Análisis estadísticosLos datos se presentan en forma de frecuencias (%) o de media±desviación estándar. Se utilizó la prueba de la χ2 para las variables discretas y la de la t de Student para las variables continuas en las comparaciones de los pacientes con función endotelial normal frente a los pacientes con disfunción endotelial. Se elaboraron curvas de Kaplan-Meier de supervivencia sin MACE para ambos grupos de pacientes. Las diferencias entre las dos curvas se evaluaron mediante test de log rank. Se llevó a cabo un análisis de regresión de Cox univariable y multivariable con objeto de evaluar el efecto de la disfunción endotelial en los MACE e introducir un ajuste respecto a los factores de riesgo cardiovascular tradicionales (diabetes mellitus, hipertensión, hipercolesterolemia, tabaquismo). Se calcularon las hazard ratio con sus correspondientes intervalos de confianza del 95%. Se consideró estadísticamente significativo un valor de p<0,05. Todos los análisis se llevaron a cabo con el programa SPSS (versión 16.0).
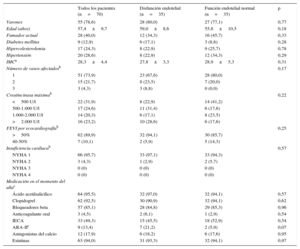
RESULTADOSCaracterísticas de los pacientes y de la intervención, curso clínico hospitalario y función endotelialDel total de 70 pacientes (media de edad, 56,9±9,6 años), 55 (78,6%) eran varones. Las ICPp se llevaron a cabo por vía femoral en todos los pacientes excepto 1 (98,4%); a 8 pacientes (11,4%) se les había tatado anteriormente con una intervención percutánea y 1 (1,4%) tenía antecedentes de implante de un injerto arterial coronario; se realizó aspiración manual del trombo en 38 pacientes (62,3%), implante directo de stent en 36 (51,4%) y posdilatación del stent en 56 (93,3%). En el momento del alta, la fracción de eyección del ventrículo izquierdo estaba preservada (> 50%) en 62 pacientes (89,9%). Las tablas 1 y 2 muestran información adicional sobre la población en estudio, las técnicas empleadas en la intervención y el curso clínico hospitalario.
Datos demográficos, características de los pacientes, parámetros de evolución clínica y deterioro ventricular izquierdo y medicación
| Todos los pacientes (n=70) | Disfunción endotelial (n=35) | Función endotelial normal (n=35) | p | |
|---|---|---|---|---|
| Varones | 55 (78,6) | 28 (80,0) | 27 (77,1) | 0,77 |
| Edad (años) | 57,4±9,7 | 59,0±8,6 | 55,8±10,5 | 0,18 |
| Fumador actual | 28 (40,0) | 12 (34,3) | 16 (45,7) | 0,33 |
| Diabetes mellitus | 9 (12,9) | 6 (17,1) | 3 (8,6) | 0,28 |
| Hipercolesterolemia | 17 (24,3) | 8 (22,9) | 9 (25,7) | 0,78 |
| Hipertensión | 20 (28,6) | 8 (22,9) | 12 (34,3) | 0,29 |
| IMCa | 28,3±4,4 | 27,8±3,3 | 28,9±5,3 | 0,31 |
| Número de vasos afectadosb | 0,17 | |||
| 1 | 51 (73,9) | 23 (67,6) | 28 (80,0) | |
| 2 | 15 (21,7) | 8 (23,5) | 7 (20,0) | |
| 3 | 3 (4,3) | 3 (8,8) | 0 (0,0) | |
| Creatincinasa máximab | 0,22 | |||
| <500 U/l | 22 (31,9) | 8 (22,9) | 14 (41,2) | |
| 500-1.000 U/l | 17 (24,6) | 11 (31,4) | 6 (17,6) | |
| 1.000-2.000 U/l | 14 (20,3) | 6 (17,1) | 8 (23,5) | |
| >2.000 U/l | 16 (23,2) | 10 (28,6) | 6 (17,6) | |
| FEVI por ecocardiografíab | 0,25 | |||
| >50% | 62 (89,9) | 32 (94,1) | 30 (85,7) | |
| 40-50% | 7 (10,1) | 2 (5,9) | 5 (14,3) | |
| Insuficiencia cardiacab | 0,57 | |||
| NYHA 1 | 66 (95,7) | 33 (97,1) | 33 (94,3) | |
| NYHA 2 | 3 (4,3) | 1 (2,9) | 2 (5,7) | |
| NYHA 3 | 0 (0) | 0 (0) | 0 (0) | |
| NYHA 4 | 0 (0) | 0 (0) | 0 (0) | |
| Medicación en el momento del altac | ||||
| Ácido acetilsalicílico | 64 (95,5) | 32 (97,0) | 32 (94,1) | 0,57 |
| Clopidogrel | 62 (92,5) | 30 (90,9) | 32 (94,1) | 0,62 |
| Bloqueadores beta | 57 (85,1) | 28 (84,8) | 29 (85,3) | 0,96 |
| Anticoagulante oral | 3 (4,5) | 2 (6,1) | 1 (2,9) | 0,54 |
| IECA | 33 (49,3) | 15 (45,5) | 18 (52,9) | 0,54 |
| ARA-IIc | 9 (13,4) | 7 (21,2) | 2 (5,9) | 0,07 |
| Antagonistas del calcio | 12 (17,9) | 6 (18,2) | 6 (17,6) | 0,95 |
| Estatinas | 63 (94,0) | 31 (93,3) | 32 (94,1) | 0,97 |
ARA-II: antagonista del receptor de la angiotensina II; FEVI: fracción de eyección del ventrículo izquierdo; IECA: inhibidores de la enzima de conversión de la angiotensina; IMC: índice de masa corporal; NYHA: clase funcional de la New York Heart Association.
Los datos expresan n (%) o media ± desviación estándar.
Los porcentajes se calculan en función de los valores conocidos.
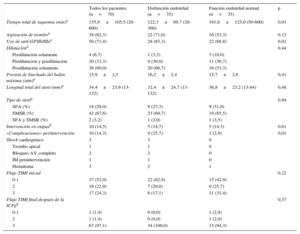
Datos de la técnica de la intervención e información de la angiografía coronaria
| Todos los pacientes (n=70) | Disfunción endotelial (n=35) | Función endotelial normal (n=35) | p | |
|---|---|---|---|---|
| Tiempo total de isquemia (min)a | 155,9±105,5 (20-600) | 122,3±69,7 (20-360) | 191,6±125,0 (50-600) | 0,01 |
| Aspiración de tromboa | 38 (62,3) | 22 (71,0) | 16 (53,3) | 0,12 |
| Uso de anti-GPIIb/IIIaa | 50 (71,4) | 28 (93,3) | 22 (68,8) | 0,01 |
| Dilatacióna | 0,44 | |||
| Predilatación solamente | 4 (6,7) | 1 (3,3) | 3 (10,0) | |
| Predilatación y posdilatación | 20 (33,3) | 9 (30,0) | 11 (36,7) | |
| Posdilatación solamente | 36 (60,0) | 20 (66,7) | 16 (53,3) | |
| Presión de hinchado del balón máxima (atm)a | 15,9±2,5 | 16,2±2,4 | 15,7±2,6 | 0,41 |
| Longitud total del stent (mm)a | 34,4±23,9 (13-132) | 32,4±24,7 (13-132) | 36,8±23,2 (13-84) | 0,48 |
| Tipo de stenta | 0,94 | |||
| SFA (%) | 18 (29,0) | 9 (27,3) | 9 (31,0) | |
| SMSR (%) | 42 (67,6) | 23 (69,7) | 19 (65,5) | |
| SFA y SMSR (%) | 2 (3,2) | 1 (3,0) | 1 (3,5) | |
| Intervención en etapasb | 10 (14,5) | 5 (14,7) | 5 (14,3) | 0,61 |
| «Complicaciones» periintervención | 10 (14,3) | 9 (25,7) | 1 (2,9) | 0,01 |
| Shock cardiogénico | 3 | 3 | 0 | |
| Trombo apical | 1 | 1 | 0 | |
| Bloqueo AV completo | 2 | 2 | 0 | |
| IM periintervención | 1 | 1 | 0 | |
| Hematoma | 3 | 2 | 1 | |
| Flujo TIMI inicial | 0,22 | |||
| 0-1 | 37 (52,9) | 22 (62,9) | 15 (42,9) | |
| 2 | 16 (22,9) | 7 (20,0) | 9 (25,7) | |
| 3 | 17 (24,3) | 6 (17,1) | 11 (31,4) | |
| Flujo TIMI final después de la ICPpb | 0,37 | |||
| 0-1 | 1 (1,4) | 0 (0,0) | 1 (2,9) | |
| 2 | 1 (1,4) | 0 (0,0) | 1 (2,9) | |
| 3 | 67 (97,1) | 34 (100,0) | 33 (94,3) |
Anti-GPIIb/IIIa: antagonista del receptor de la glucoproteína IIb/IIIa; AV: auriculoventricular; ICPp: intervención coronaria percutánea primaria; IM: infarto de miocardio; SFA: stent farmacoactivo; SMSR: stent metálico sin recubrimiento; TIMI: Thrombolysis In Myocardial Infarction.
Los datos expresan n (%) o media ± desviación estándar.
Los porcentajes se calculan en función de los valores conocidos.
Tras 4–6 semanas de la ICPp, se identificó disfunción endotelial (índice de TAP-HR<1,67) en 35 pacientes (50%); los otros 35 presentaban función endotelial normal (índice de TAP–HR ≥ 1,67). En el grupo de pacientes con disfunción endotelial, la media del índice de TAP-HR determinado fue 1,48±0,12 (1,10-1,65). En los pacientes con función endotelial normal, la media de TAP–HR fue 2,31±0,56 (1,67-3,63).
Entre estos dos grupos de pacientes no hubo diferencias en los siguientes parámetros: datos demográficos y características de los pacientes, tipo de stent (p. ej., uso de stents farmacoactivos), frecuencia de uso de intervenciones en etapas y otros muchos parámetros relacionados con la intervención y medicación prescrita al alta (tabla 2). Las diferencias significativas entre los grupos consistieron en menor tiempo de isquemia total, mayor frecuencia de complicaciones periintervención como shock cardiogénico y mayor uso de antagonistas de los receptores de glucoproteína IIb/IIIa en los pacientes con disfunción endotelial (tabla 2).
Seguimiento a largo plazo y eventos adversos cardiovasculares mayoresLa duración media del seguimiento respecto a los MACE fue de 4,0±1,7 años hasta la aparición del (primer) MACE o la supervivencia libre de eventos. De los 70 pacientes, 50 se mantuvieron sin eventos de este tipo, mientras que 20 (28,6%) presentaron MACE. Fallecieron 4 pacientes, 2 con disfunción endotelial y 2 con función endotelial normal (p=0,69). De los 13 pacientes a los que se practicaron intervenciones de revascularización coronaria, 7 presentaban disfunción endotelial y 6, función endotelial normal (p=0,50); 2 pacientes presentaron ictus y en ambos casos la función endotelial era normal (p=0,25). De los 13 pacientes a los que se practicó una intervención de revascularización coronaria, el infarto agudo de miocardio fue el motivo para ello en 2 pacientes con disfunción endotelial y ninguno con función endotelial normal (p=0,25). Requirieron tratamiento por enfermedad arterial periférica de nueva aparición 3 pacientes con función endotelial normal frente a ninguno con disfunción endotelial (p=0,12).
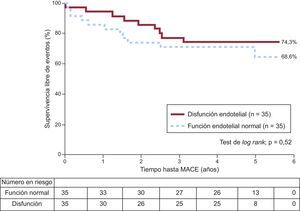
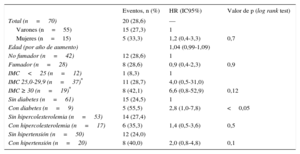
Disfunción endotelial, factores de riesgo cardiovascular tradicionales y evolución clínicaDurante el seguimiento, se produjeron MACE en 9 (25,7%) de 35 pacientes con disfunción endotelial y 11 (31,4%) de 35 con función endotelial normal (p=0,52) (figura). No hubo diferencias significativas en el riesgo de MACE entre pacientes con disfunción endotelial y con función endotelial normal (hazard ratio=0,8; intervalo de confianza del 95%,=0,8; intervalo de confianza del 95%, 0,3-1,8). De los 51 pacientes con afección de un solo vaso, 10 (19,6%) presentaron MACE en comparación con 9 (50%) de los 18 con enfermedad multivaso (p<0,05), pero la presencia de enfermedad multivaso no mostró una relación significativa con la disfunción endotelial (p=0,17). De los factores de riesgo cardiovascular tradicionales, la diabetes mellitus (hazard ratio=2,8; intervalo de confianza del 95%, 1,0-7,8) mostró asociación con los MACE en el análisis univariable (tabla 3); incluso en los análisis multivariable el riesgo parecía aumentar, aunque no de manera significativa (hazard ratio=2,5; intervalo de confianza del 95%, 0,8-7,5) (tabla 4).
Supervivencia sin eventos adversos cardiovasculares mayores de los pacientes con disfunción endotelial frente a los pacientes con función endotelial normal. Durante un periodo de seguimiento de 4,0±1,7 años, 50 pacientes (de un total de 70) experimentaron algún evento adverso cardiovascular mayor. No hubo diferencias significativas en el riesgo de presentar un evento adverso cardiovascular mayor entre pacientes con función endotelial normal y pacientes con disfunción endotelial (hazard ratio=0,8; intervalo de confianza del 95%, 0,3-1,8). MACE: eventos adversos cardiovasculares mayores.
Asociación entre factores de riesgo cardiovascular y eventos adversos cardiovasculares mayores
| Eventos, n (%) | HR (IC95%) | Valor de p (log rank test) | |
|---|---|---|---|
| Total (n=70) | 20 (28,6) | — | |
| Varones (n=55) | 15 (27,3) | 1 | |
| Mujeres (n=15) | 5 (33,3) | 1,2 (0,4-3,3) | 0,7 |
| Edad (por año de aumento) | 1,04 (0,99-1,09) | ||
| No fumador (n=42) | 12 (28,6) | 1 | |
| Fumador (n=28) | 8 (28,6) | 0,9 (0,4-2,3) | 0,9 |
| IMC<25 (n=12) | 1 (8,3) | 1 | |
| IMC 25,0-29,9 (n=37)* | 11 (28,7) | 4,0 (0,5-31,0) | |
| IMC ≥ 30 (n=19)* | 8 (42,1) | 6,6 (0,8-52,9) | 0,12 |
| Sin diabetes (n=61) | 15 (24,5) | 1 | |
| Con diabetes (n=9) | 5 (55,5) | 2,8 (1,0-7,8) | <0,05 |
| Sin hipercolesterolemia (n=53) | 14 (27,4) | ||
| Con hipercolesterolemia (n=17) | 6 (35,3) | 1,4 (0,5-3,6) | 0,5 |
| Sin hipertensión (n=50) | 12 (24,0) | ||
| Con hipertensión (n=20) | 8 (40,0) | 2,0 (0,8-4,8) | 0,1 |
HR: hazard ratio; IC95%: intervalo de confianza del 95%; IMC: índice de masa corporal.
Análisis multivariable: riesgo de eventos adversos cardiovasculares mayores por la función endotelial, ajustado por factores de riesgo cardiovascular
| Función endotelial (disfunción frente a normal) | HR (IC95%) |
|---|---|
| Hazard ratio bruta | 0,8 (0,3-1,8) |
| Ajuste por edad (variable continua) y sexo | 0,8 (0,3-2,0) |
| Ajuste por diabetes basal | 0,6 (0,3-1,6) |
| Ajuste por IMC (variable discreta) basal | 0,9 (0,4-2,3) |
| Ajuste por diabetes e IMC (variable discreta) | 0,8 (0,3-2,0) |
| Ajuste por edad y sexo, diabetes e IMC (variable discreta) | 0,8 (0,3-2,0) |
IC95%: intervalo de confianza del 95%; IMC: índice de masa corporal.
Aunque la disfunción endotelial es un componente clave de la aterogénesis que contribuye al desarrollo de la enfermedad cardiovascular y predice la evolución clínica de los pacientes con o sin enfermedad coronaria manifiesta1–7, su importancia en la categoría de riesgo más alta (la de los pacientes con IAMCEST) está menos clara. En el presente estudio de cohorte prospectivo llevado a cabo en pacientes con IAMCEST del ensayo RESPONSE, en el que se utilizó el tratamiento médico aplicando conceptos farmacológicos basados en la evidencia24, la disfunción endotelial se asoció a mayor frecuencia de «complicaciones» periintervención agudas (como shock cardiogénico, bloqueo auriculoventricular completo o trombo ventricular izquierdo), pero no mostró relación alguna con la evolución clínica a largo plazo tras una ICPp. La tasa de MACE de los pacientes con disfunción endotelial fue similar a la de los pacientes con función endotelial normal. Estas observaciones contradicen la hipótesis inicial de que la disfunción endotelial podría predecir la evolución clínica a largo plazo tras una ICPp para el tratamiento de un IAMCEST.
Los pacientes con diabetes mellitus en la situación basal presentaron una tasa de MACE significativamente superior durante el seguimiento. Incluso en los análisis multivariable el riesgo parecía aumentar, aunque no de manera significativa, lo cual podría estar relacionado con el pequeño número de pacientes incluidos. Además, no se puede descartar la posibilidad de que algunos pacientes que inicialmente no eran diabéticos pudieran haberla contraído (aún no detectada) durante los 4 años de seguimiento. No obstante, los datos indican que el tradicional factor de riesgo cardiovascular diabetes, junto con otros factores de riesgo, puede tener importancia para el pronóstico incluso en una población con conocido aumento del riesgo cardiovascular32. Los resultados del presente estudio pueden indicar que, en los pacientes con IAMCEST, que se corresponden con la etapa más avanzada de la aterosclerosis coronaria8,33, el grado total de alteración de la pared vascular (es decir, el volumen de placa) y el número y la vulnerabilidad de las lesiones ateroscleróticas (es decir, las placas propensas a rotura), factores ambos que se sabe aumentados en los pacientes con diabetes33, podrían tener más importancia que la disfunción endotelial por lo que respecta al riesgo cardiovascular total.
Estudios previos sobre la disfunción endotelial y la evolución clínicaSuwaidi et al10 fueron de los primeros en poner de manifiesto que los pacientes con enfermedad coronaria no obstructiva y disfunción endotelial grave (evaluada de manera invasiva con acetilcolina) presentaban un aumento del riesgo de eventos cardiovasculares durante una media de seguimiento de 28 meses. Se demostró también que la disfunción endotelial coronaria en ausencia de enfermedad coronaria obstructiva se asociaba de manera independiente a un aumento del riesgo cerebrovascular13. Schächinger et al11 demostraron, mediante medición invasiva de la función endotelial, que el deterioro significativo de la reactividad vascular coronaria epicárdica dependiente de endotelio es un predictor independiente de la futura aparición de eventos cardiovasculares.
Otros grupos de investigación han evaluado la función endotelial periférica midiendo con métodos no invasivos la dilatación mediada por el flujo en la arteria humeral, y han observado que la disfunción endotelial predice de manera independiente la evolución cardiovascular a largo plazo en los pacientes con enfermedad arterial periférica12. En dos estudios, la disfunción endotelial, evaluada con la dilatación mediada por el flujo, mostró una relación significativa con la reestenosis en el stent tras la ICP14,15; los pacientes con disfunción endotelial presentaron también mayor número de eventos cardiovasculares durante los 12 meses de seguimiento15. Guazzi et al17, en un estudio de pacientes con infarto de miocardio no complicado (predominantemente casos de infarto agudo de miocardio sin elevación del segmento ST [80%]), observaron un aumento del riesgo de eventos cardiovasculares durante una media de seguimiento de 14 meses si los pacientes presentaban a la vez disfunción endotelial y diabetes mellitus.
Tan solo un estudio, llevado a cabo por Wang et al18, ha examinado también la posible repercusión de la disfunción endotelial en la evolución clínica de los pacientes tras presentar un IAMCEST. En dicho estudio, que contó con un seguimiento de 1 año, la disfunción endotelial predijo de manera independiente los eventos cardiovasculares, además de la diabetes mellitus y la fracción de eyección del ventrículo izquierdo18. En el estudio que se presenta, se identificó también la diabetes como significativo factor predictivo de eventos adversos, pero la función endotelial no tuvo valor predictivo por lo que respecta a la evolución clínica. El presente estudio tuvo múltiples diferencias respecto al estudio chino antes mencionado. Varias de estas diferencias pueden haber contribuido a producir las discrepancias en los resultados. Las principales diferencias entre los dos estudios son que sus poblaciones de pacientes fueran predominantemente caucásicas o chinas, una media de seguimiento de 4 frente a 1 año, el empleo de TAP-HR frente al método de dilatación mediada por flujo, el uso de nitratos (un 87% de los pacientes chinos recibían tratamiento con nitratos), y el momento en que se determinó la función endotelial, que fue 28-42 días frente a 5 días tras el IAMCEST. Esa determinación más temprana de la función endotelial en el estudio de Wang et al. implica un riesgo de modificación significativa como consecuencia de la inflamación que se asocia a la «reparación del miocardio» tras un IAMCEST, proceso este que en gran parte ha finalizado al cabo de 3 semanas, lo cual está más próximo al momento en que se llevaron a cabo las determinaciones de la función endotelial en el presente estudio. Anteriormente se ha demostrado que después de la ICP se produce mejoría de la función endotelial de los pacientes con infarto agudo de miocardio sin elevación del segmento ST34.
LimitacionesDado el pequeño tamaño de la población en estudio y el número de eventos, los resultados obtenidos deben interpretarse con precaución; no obstante, otros muchos estudios de la función endotelial han evaluado también poblaciones de pacientes relativamente pequeñas10,17. El presente estudio piloto no permite extraer conclusiones respecto a los pacientes que no sobrevivieron durante las primeras 4–6 semanas tras el IAMCEST ni respecto a aquellos cuyo estado clínico impidió la inclusión en el estudio. El sistema empleado para realizar las determinaciones de la función endotelial podría no ser el ideal para identificar la disfunción endotelial de pacientes con un IAMCEST reciente. Además, la presencia de lesiones no tratadas, con estenosis ≥ 50% del diámetro en la intervención inicial, podría haber tenido influencia en la aparición de MACE, y este parámetro podría no ser un objetivo clínico óptimo en este contexto. Anteriormente se han presentado estudios de reproducibilidad realizados con la TAP-HR, pero no los llevaron a cabo laboratorios de estudio locales. Es posible que en el futuro sean necesarios nuevos estudios a gran escala, que empleen otras técnicas, para evaluar la posible repercusión de la disfunción endotelial presente tras una ICPp en la evolución clínica de los pacientes.
Además, en el estudio RESPONSE se evaluó la repercusión que tenían en el riesgo cardiovascular las clínicas de prevención secundaria llevadas por enfermeras en comparación con el uso de la asistencia estándar24. No se puede descartar la posibilidad de que los profesionales de la salud puedan haber prestado más atención a la modificación óptima del estilo de vida y la prescripción del tratamiento farmacológico, según lo establecido en las guías. Por otra parte, el cumplimiento de los participantes en el ensayo puede haber sido superior a la media. En consecuencia, el tratamiento médico y la función endotelial podrían haber sido algo mejores que en los pacientes de la práctica clínica habitual.
Las determinaciones de la función endotelial se llevaron a cabo después de 4–6 semanas, cuando todos los pacientes recibían un tratamiento similar con medicación de prevención secundaria, que incluía estatinas y con frecuencia inhibidores de la enzima de conversión de la angiotensina, lo cual puede haber tenido un efecto general favorable en la función endotelial de la población de este estudio35–38. No obstante, no hubo diferencias significativas en el tratamiento médico de los pacientes con y sin disfunción endotelial. Sin embargo, la medicación utilizada se registró en el momento del alta, y no cuando se llevó a cabo la determinación de la función endotelial.
De hecho, la función endotelial coronaria después de un IAMCEST tiene un carácter dinámico, y puede verse deteriorada durante unas pocas semanas tras el IAMCEST. Anteriormente se ha demostrado que mejora entre el día 9 y el seguimiento al año de los pacientes a los que se ha administrado tratamiento trombolítico39, pero la disfunción endotelial puede ser menor en los pacientes que han recibido tratamiento con ICPp40. Los procesos de inflamación y reparación del miocardio que ha experimentado el infarto, que pueden alterar la función endotelial durante las primeras semanas, se han completado ya a las 4–6 semanas de la ICPp25–27. Por consiguiente, cabe asumir que la mayor parte de los cambios de la función endotelial han finalizado al cabo de 4–6 semanas. Dado que la inmensa mayoría de los MACE se produjeron después de ese plazo, las determinaciones de la función endotelial realizadas en este estudio y la evaluación de su posible relación con la futura aparición de MACE debería tener relevancia clínica. No obstante, no se puede descartar la posibilidad de que la determinación de la función endotelial en un solo momento pueda no reflejar adecuadamente la función endotelial de todo el periodo. Para tener en cuenta el carácter dinámico de la función endotelial, sería de gran interés disponer de datos secuenciales sobre la función endotelial después de un IAMCEST.
Implicaciones del estudioEl presente estudio, con una media de seguimiento de 4 años, aporta unos datos únicos sobre la función endotelial y la evolución clínica a largo plazo de los pacientes con IAMCEST tratados con ICPp. Estos resultados indican que la determinación de la función endotelial basada en la técnica de TAP-HR (como posible marcador indirecto sustitutivo del riesgo cardiovascular) puede tener escasa utilidad para los pacientes que han tenido recientemente un IAMCEST. En dichos pacientes, los factores de riesgo tradicionales (como la diabetes) podrían tener mayor trascendencia que la disfunción endotelial por lo que respecta a la evolución clínica.
CONCLUSIONESEn esta serie de pacientes que sobrevivieron a un IAMCEST, la disfunción endotelial, evaluada mediante la TAP-HR 4-6 semanas después de la ICPp, no predijo la aparición futura de MACE durante un seguimiento medio de 4 años. Aún pueden ser necesarios futuros estudios a gran escala que empleen otras técnicas para determinar la disfunción endotelial después de la ICPp.
CONFLICTO DE INTERESESEl departamento de investigación del Thoraxcentrum Twente ha recibido subvenciones de investigación financiadas por AstraZeneca, Biotronik, Boston Scientific y Medtronic. C. von Birgelen ha sido consultor para Boston Scientific y Medtronic y ha recibido pagos por conferencias de AstraZeneca. R.J.G. Peters ha sido consultor para Amgen, AstraZeneca y Sanofi y ha recibido pagos por conferencias de AstraZeneca, Boehringer Ingelheim y Sanofi.