INTRODUCCIÓN Y OBJETIVOS: No se conoce bien la influencia en el tamaño de la lesión de los catéteres irrigados. Tampoco están bien caracterizadas las posibles diferencias de los dos sistemas con circuito abierto y cerrado. Diseñamos este estudio para comparar las lesiones de los catéteres irrigados, comparándolas con las producidas por catéteres estándar de 4 mm y evaluamos la correlación anatomopatológica y la liberación de marcadores bioquímicos, incluyendo la troponina cardíaca I en un modelo experimental.
MÉTODOS: Este estudio se realizó en 20 cerdos, aplicando 1-8 pulsos de radiofrecuencia con energías de 15, 25 y 50 W, y duración de 15-60 s. A los 7 días, el animal fue sacrificado para estudio anatomopatológico.
RESULTADOS: Se produjeron un total de 54 lesiones, 25 con catéteres estándar y 29 con irrigados. El volumen medio de las lesiones con catéteres estándar fue de 146 ± 110 μl y con irrigados de 856 ± 864 μl (p < 0,001). Los valores pico de troponina fueron también superiores para los catéteres irrigados (18 ± 15 ng/ml) que para los estándares (6,5 ± 3 ng/ml). La correlación entre el tamaño de la lesión y las concentraciones de troponina fueron 0,86 y 0,79 con los catéteres estándar e irrigados, respectivamente. La incidencia de cratering fue superior con los estándar (60%) que con los irrigados (27%).
CONCLUSIÓN: Las lesiones producidas con un catéter irrigado son superiores a las causadas por catéteres estándar. El valor pico de troponina postablación tiene una buena correlación con el tamaño real de la necrosis.
Palabras clave
Ablación
Catéteres
Ablación con catéter
Radiofrecuencia
Troponina
INTRODUCCIÓN
Las lesiones 1,2 producidas durante la ablación con radiofrecuencia y catéteres estándar tienen aproximadamente un diámetro de 5-7 mm y un volumen de 200 μl. Los datos de la bibliografía han demostrado la importancia del enfriamiento de la punta del catéter para la creación de lesiones más grandes. En general, el volumen obtenido con los catéteres irrigados es superior al obtenido con los catéteres estándar de punta de 4 mm 3-8. Las concentraciones de la troponina I cardíaca (cTnI) han sido caracterizadas previamente como un buen marcador bioquímico para evaluar las pequeñas lesiones miocárdicas producidas tras la ablación con radiofrecuencia y catéter 9-16. Sin embargo, no tenemos datos con los catéteres irrigados y éste sería un parámetro útil para evaluar el tamaño de la lesión producida. El enfriamiento de la punta del catéter se puede realizar mediante infusión de salino fisiológico durante la aplicación de radiofrecuencia lo cual, además, reduce la probabilidad de subidas bruscas de la impedancia 6. Están disponibles actualmente dos sistemas para el enfriamiento de la punta del catéter, sistemas abiertos y cerrados, según si el suero salino fluye o no al torrente sanguíneo 3,8. No hay estudios que comparen ambos sistemas.
El propósito de este estudio fue comparar el efecto de los distintos catéteres de ablación sobre el tamaño de la lesión miocárdica. Aunque se han publicado series de lesiones producidas con catéteres irrigados, muy pocas han efectuado la ablación en un modelo in vivo, que creemos permite acercarse mejor al efecto real de la lesión producida en el hombre 3,6,8. MATERIAL Y MÉTODOS
Material y preparación experimental
Preparación experimental
El protocolo experimental fue aprobado por el comité del hospital y sigue las guías de cuidados estándares de animales para experimentación. Se estudiaron 20 cerdos, con peso entre 20 y 55 kg. La anestesia se realizó con 25 mg/kg intravenosos de pentobarbital, y posteriormente se realizó intubación endotraqueal, con ventilación mecánica. La anestesia general se mantuvo con isofluorano. Se canalizaron la vena yugular derecha y la arteria y vena femorales derechas. Se monitorizaron las 12 derivaciones del electrocardiograma y los electrogramas intracavitarios en un polígrafo multicanal (Cardiac Pathways Corp, Sunnyvalley, CA, EE.UU.).
Material empleado para la ablación
Catéteres
Ablación con catéter estándar. Se empleó un catéter de punta de 4 mm de 7 F (EP technologies, CA, EE.UU.).
Ablación con catéteres irrigados. Se emplearon dos tipos de catéteres irrigados: con perfusión interna de salino (sistema cerrado) y con perfusión al exterior (sistema abierto). El medio de enfriamiento fue suero salino (0,9%) a temperatura ambiente.
Sistema cerrado. El sistema de circuito cerrado empleado era el correspondiente al catéter Chilli ¨ Cooled Ablation Catheter (Cardiac Pathways Corp, Sunnyvalley, CA, EE.UU.). Se trata de un catéter cuatripolar, de punta de 4 mm, de platino-iridio, que contiene una luz interna para la circulación de salino hacia la punta del electrodo. Durante la aplicación de radiofrecuencia, una bomba de infusión (modelo 8004, Cardiac Pathways) hace circular el suero salino a través del electrodo, con un flujo de 36 ml/min. La temperatura se monitoriza con un sensor de termopar en la punta del electrodo.
Sistema abierto. Empleamos un catéter Celsius Thermo-Cool ¨, de Cordis Webster, 8 F. Es un catéter cuatripolar de punta de 3,5 mm. El catéter incorpora un sensor termopar en la punta del electrodo. En la parte distal del catéter existen 6 orificios para la salida del suero salino a la punta y así poder enfriarla. En este catéter el suero salino fluye directamente a la sangre. Antes de introducirlo se aconseja realizar un test de permeabilidad del sistema de infusión. Se emplearon dos velocidades de flujo, baja durante el mapeo (2 ml/min) y alta durante la ablación (17 ml/min). El cambio a flujo alto se realizó unos segundos antes de comenzar la aplicación de radiofrecuencia, momento en el que la temperatura baja unos 2-5 ¡C, lo que nos indica la efectividad del enfriamiento.
Protocolo de ablación con radiofrecuencia
Uno de los tres tipos de catéteres empleados (estándar de 4 mm, sistema abierto o cerrado) se eligieron de forma aleatorizada y se introdujeron en el animal con control fluoroscópico. Antes de cada ablación se registró la localización anatómica de cada aplicación de radiofrecuencia efectuada, para facilitar la identificación de las lesiones específicas en el examen anatomopatológico.
Para los catéteres estándar la aplicación de radiofrecuencia se preprogramó a 60 s y a una energía de 50 W. Se empleó un generador EPT 1.000 (EP Technologies, Mountain View, CA, EE.UU.). Para los catéteres irrigados, la radiofrecuencia se empleó de forma aleatorizada con una energía de 15, 25 o 50 W durante 60 s en cada punto (8 en el ventrículo izquierdo y 21 en el derecho). Los generadores de radiofrecuencia empleados fueron Atakr de Medtronic, Minneapolis, EE.UU., y un modelo 8004 de Cardiac Pathways. La aplicación se interrumpió si el cerdo presentaba fibrilación ventricular o tras aumento brusco de la impedancia. La radiofrecuencia se aplicó entre la punta del electrodo y un parche indiferente en piel. Para cada aplicación se registraron el voltaje, la corriente, la energía, la temperatura y la impedancia.
Muestras bioquímicas
Se analizaron las concentraciones séricas de creatincinasa (CK) MB masa, cTnI, mioglobina, y actividad de CK. Se sabe por estudios previos que estos marcadores bioquímicos pueden ser medidos en el cerdo y que no son específicos de especie 17. Se tomaron muestras de sangre periférica para su análisis (5,5 ml de sangre en tubo seco) de acuerdo con el esquema prefijado. La primera muestra se recogió justo después del acceso venoso periférico (muestra inicial). El resto se tomaron tras colocar los catéteres, 20 min tras la última aplicación, a las 2, 24, 48 h y el día del sacrificio (día 7). Las muestras se centrifugaron, alicuotaron y congelaron a -20 ¡C hasta su procesamiento. Los marcadores cardíacos cTnI, mioglobina, y CK-MB masa se determinaron usando la técnica sándwich, con anticuerpos monoclonales dobles, mediante un analizador enzimático de inmunofluoroensayo (bipartición radial) Stratus II (Dade-Behring). La actividad de CK se analizó con un equipo Integra (Roche). Las concentraciones de cTnI se determinaron también con un analizador automático Dimension RxL-HM (Dade-Behring), para contrastarlo con el método previo.
Anatomía patológica
El corazón se explantó una semana después de la ablación y se conservó en una solución de formol al 10% hasta su procesamiento. Tras examinar la superficie epicárdica para objetivar la presencia de lesiones transmurales, se abrieron los ventrículos y se examinó la presencia macroscópica de las lesiones. Se realizaron múltiples cortes transversales del corazón para el análisis de las dimensiones de la lesión. La anchura, longitud y profundidad de las lesiones se midieron con un compás. El volumen se calculó a partir de las 3 dimensiones en cada corte.
Estadística
Los datos se expresan como media ± desviación estándar. Para comparar variables discretas empleamos el test de la χ 2. La correlación entre distintas variables se analizó mediante los coeficientes de correlación de Pearson. El test de la t de Student se empleó para la comparación del tamaño de las lesiones para cada electrodo. Se consideraron estadísticamente significativos los valores de p < 0,05. RESULTADOS
Se realizaron un total de 54 aplicaciones en 20 cerdos, empleando los distintos electrodos. El peso de los corazones no fue diferente entre los animales en los que se efectuó ablación con catéter estándar (215 ± 39 g) frente a irrigados (199 ± 33 g) (tabla 1). En 3 de 54 (5%) aplicaciones se escuchó un plop. Debido a alta impedancia o temperatura observamos cortes prematuros de la energía en 10 de 54 (18%) aplicaciones. A 50 W, se observaron siete (28%) subidas bruscas de impedancia en 25 aplicaciones con catéteres estándar y tres de 29 (10%) para catéteres irrigados. Con energía de 15 y 25 W en catéteres irrigados no hubo subidas bruscas de impedancia, y las tres fueron con energías de 50 W. En 14 aplicaciones se encontró un trombo en la superficie de la punta del catéter (10 con catéteres estándar y cuatro con irrigados), y hallamos un trombo en el interior de la luz, al realizar el test de permeabilidad, en 3 aplicaciones con sistema abierto. Durante 49 de 54 aplicaciones se observaron múltiples rachas de extrasístoles y taquicardia ventricular, con inducción de fibrilación ventricular en 18 cerdos, que fueron desfibrilados de inmediato. Ninguno de los animales tenía derrame pericárdico cuando se explantó el corazón.
Estudio bioquímico
Todos los animales presentaron valores anormales de cTnI y el resto de marcadores tras la ablación con los 3 tipos de catéteres. Las concentraciones de CK-MB masa y cTnI fueron significativamente más altas en el grupo de irrigados (11,3 ± 6 y 18 ± 15 μg/ml) que en el grupo de ablación estándar (5,8 ± 2 y 6,5 ± 3 μg/ml, respectivamente) (p < 0,01) (tabla 2).
Con catéteres estándar, el coeficiente de correlación entre la cTnI y el tamaño de la lesión fue r = 0,86. La fórmula:
Tamaño de la lesión = 250 cTnI pico-800 μl
predijo adecuadamente el tamaño de la lesión creada (tabla 3). Con los catéteres irrigados el coeficiente de correlación entre la cTnI y el tamaño de la lesión fue r = 0,79. La fórmula:
Tamaño de la lesión = 61,5 cTnI pico-116 μl
predijo de manera adecuada el tamaño de la lesión. También evaluamos las concentraciones de cTnI en 20 cerdos, 4 con catéter estándar y 13 con irrigados, con el sistema Dimension. La correlación con las concentraciones de cTnI obtenidas con el sistema Stratus fue excelente, r = 0,996 (cTnI Stratus = 1,76 cTnI Dimension - 0,22 ng/ml). No hubo diferencias en la comparación de ambos métodos (Stratus y Dimension).
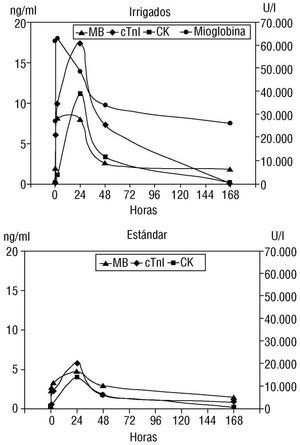
Con respecto a la cinética, el valor pico medio de cTnI ocurrió a las 24 h de la ablación, tanto con catéteres irrigados como estándar. A las 48 h de la ablación sólo la cTnI estuvo marcadamente elevada, pero los otros marcadores bioquímicos estuvieron dentro de los límites normales, excepto un ligero incremento de las concentraciones de CK. A los 7 días, sólo la cTnI permaneció elevada. Las concentraciones de cTnI, mioglobina, CK y CK-MB se alcanzaron más precozmente de lo esperado, en comparación con los datos derivados de pacientes con cardiopatía isquémica. En la figura 1 se observa la cinética media para todos los marcadores bioquímicos, para catéteres estándar e irrigados.
Fig. 1. Cinética de los marcadores bioquímicos evaluados en nuestro estudio. Se representa los valores medios de cada marcador en cada muestra. La hora 0 es el final de la ablación. El valor pico máximo de troponina I cardíaca (cTnI) se registró a las 24 horas postablación. A las 48 horas tras la ablación, sólo las concentraciones de cTnI estaban marcadamente elevadas, pero el resto de marcadores bioquímicos estuvieron dentro de los valores normales, excepto un ligero aumento de (CK). A los 7 días, sólo las concentraciones de cTnI persistían anormalmente elevadas.
Tamaño de las lesiones
El examen macroscópico del corazón puso de manifiesto las lesiones producidas por la radiofrecuencia, como áreas equimóticas en las superficies endocárdica o epicárdica. Se encontraron un total de 20 lesiones producidas por catéteres estándar y 22 con catéteres irrigados. Se observaron 42 aplicaciones por visión macroscópica del endocardio y 15 desde el epicardio. En 12 aplicaciones no se apreciaron con claridad las lesiones en la necropsia.
Los catéteres irrigados produjeron lesiones más grandes (856 ± 864 μl) que los catéteres estándar (146 ± 110 μl); p = 0,0004. Los datos de los distintos parámetros se exponen en la tabla 1. Las lesiones creadas con catéteres estándar tenían una profundidad media de 4,2 ± 1,7 mm y una anchura media de 5,3 ± 1,9 mm (fig. 2). Las lesiones producidas con catéteres irrigados tenían una profundidad media de 6,4 ± 2,5 mm y una anchura media de 9 ± 3 mm (p < 0,05 en comparación con catéteres estándar) (fig. 3). Siguiendo el protocolo, la energía empleada con catéteres estándar fue de 50 W en todos los casos y superior a la media empleada con catéteres irrigados (15, 25, 50 con una media de 33 ± 16 W).
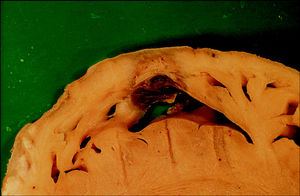
Fig. 2. Lesión producida en la pared lateral del ventrículo derecho con un catéter estándar y con 50 W, que afecta la superficie endocárdica en contacto cercano con la punta del catéter. Se trata de una de las lesiones de mayores dimensiones que obtuvimos con un catéter estándar a máxima potencia.
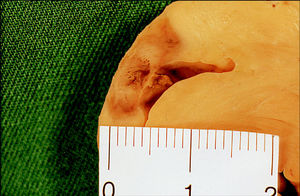
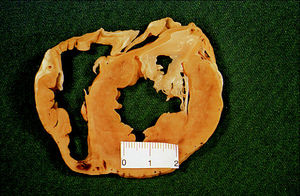
Fig. 3. Lesión producida por un catéter irrigado con 50 W, en una posición similar. La imagen muestra una regla y está realizada con la misma amplificación que el caso de la figura 2. Obsérvese que su diámetro en la superficie es de 1,4 cm, mientras que la anterior oscila alrededor de 0,7 cm. La lesión es completamente transmural, lo que le da un aspecto elipsoidal en vez de esférico.
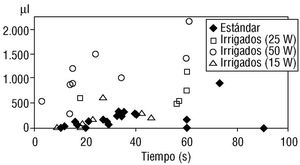
Con energías de 50 W el tamaño de la lesión fue significativamente más grande para catéteres irrigados que estándar (756 ± 420 μl para el sistema cerrado y 1.788 ± 1.133 μl para el sistema abierto frente a 146 ± 110 μl para el estándar; p = 0,0001) (fig. 4). Con energías de 25 W, el catéter irrigado produjo igualmente lesiones más grandes que las obtenidas con catéter estándar a 50 W. Sin embargo, a 15 W las lesiones producidas con catéteres irrigados no fueron significativamente mayores que las producidas con los estándares (figs. 5 y 6) (270 ± 261 μl para el sistema cerrado, 153 ± 144 μl para el sistema abierto y 146 ± 110 μl con estándares; p = NS). El tiempo de aplicación tuvo también una influencia importante en el tamaño de las lesiones. Para los catéteres estándar, la diferencia en el tamaño de las lesiones producidas con aplicaciones < 30 s (85 ± 57 μl) y aquellas > 30 s (208 ± 118 μl) fue estadísticamente significativa. Hallazgos similares se observaron con las lesiones producidas con catéteres irrigados (575 ± 475 < 30 s frente a 1.195 ± 1.110 μl > 30 s) (tabla 4).
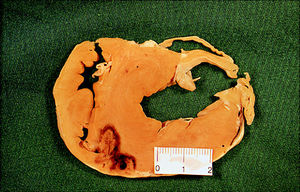
Fig. 4. Lesión producida con un catéter irrigado y 50 W. En esta figura se observan 2 lesiones cercanas en el septo interventricular, producidas desde el ventrículo derecho, como en el caso de la figura 5. Estas lesiones son muy profundas, con una base estrecha y una circunferencia máxima alejada de la superficie endocárdica y un tamaño considerablemente mayor que las de las otras figuras (estándares o irrigados de 15 W).
En 3 casos (15%; los 3 en el ventrículo derecho) las lesiones creadas con catéteres estándar se extendieron hasta la grasa epicárdica (transmurales). Sin embargo, ya que la transmuralidad depende del grosor del miocardio en un punto, hay que reseñar que sólo 2 lesiones estándar presentaron una profundidad superior a 6 mm. En comparación, 11 lesiones (50%, 8 en el ventrículo derecho y 3 en el izquierdo) creadas con irrigados fueron transmurales. Las lesiones producidas en el ápex (5 lesiones) con estándares tenían un tamaño medio de 259 ± 80 μl (límites, 144-336) y en el resto del ventrículo (15 lesiones) el tamaño medio era de 109 ± 93 μl (límites, 8-294; p = 0,0049). Las lesiones producidas en el ápex (5 lesiones) con los irrigados tuvieron un tamaño medio de 1.508 ± 1.384 μl (límites, 528-3.900) y en el resto del ventrículo (17 lesiones) el tamaño medio fue de 665 ± 571 μl (límites, 22-2.142); p = 0,0528. Se encontró cratering en 6 de 22 (27%) lesiones creadas con irrigados y en 12 de 20 lesiones (60%) con catéteres estándar (p < 0,05).
Diferencias entre las lesiones creadas con sistema abierto y cerrado
Se produjeron un total de 12 lesiones con el sistema abierto y 10 con el sistema cerrado (tabla 5). La temperatura media registrada fue de 45 ± 10 ¡C para el sistema abierto y 35 ± 5 ¡C para el sistema cerrado (p = NS). Las lesiones fueron transmurales en el 58% para el sistema abierto y en el 40% para el sistema cerrado (p = NS). La incidencia de cratering no fue significativa (4/12 aplicaciones [33%] con el sistema abierto y 2/10 aplicaciones [20%] con sistema cerrado). El tamaño medio de las lesiones fue de 1.124 ± 1.067 μl con el sistema abierto y de 535 ± 375 μl con el sistema cerrado, aunque no alcanzó diferencias significativas (p = 0,11), probablemente debido a la alta dispersión encontrada con los sistemas abiertos. No hubo diferencias entre ambos sistemas con cualquier energía empleada (15, 25 o 50 W) (tabla 6).
DISCUSIÓN
Principales hallazgos
Nuestros datos demuestran la importancia del enfriamiento de la punta del catéter para la creación de lesiones más grandes mediante radiofrecuencia. Se confirma que el aumento de los marcadores bioquímicos de lesión miocárdica es mayor con catéteres irrigados y se correlaciona con el volumen de la lesión. Estos hallazgos no fueron diferentes entre los dos sistemas de enfriamiento utilizados: irrigación abierta y cerrada.
Características de las lesiones
La energía de radiofrecuencia se libera a los tejidos para producir un área localizada de necrosis. Durante la ablación con catéteres estándar, el tejido se calienta mediante la radiofrecuencia, pero el aumento de la energía conduce a una excesiva temperatura y puede producir carbonización. El calor de esta región se transmite con un gradiente térmico lejos de la punta del catéter y el tejido, que alcanza una temperatura superior a 47-49 ¡C, se necrosa. Cuando la temperatura en la superficie del electrodo alcanza los 100 ¡C, la resistencia a la transmisión continuada de energía aumenta e impide el crecimiento de la lesión. En estas circunstancias se interrumpe la liberación de energía y puede formarse un trombo/carbonización. El enfriamiento de la punta del catéter es una forma apropiada de producir lesiones más grandes y profundas, disminuyendo la posibilidad de aumento de la impedancia 18,19.
La monitorización de la temperatura de la punta es útil durante la ablación con radiofrecuencia, pero el termopar registra una temperatura más baja en el momento de la subida de la impedancia, en comparación con la ablación con catéteres estándar y control de temperatura. Cuando la temperatura de la punta sube por encima de 50 ¡C, la incidencia de incrementos de la impedancia aumenta más del 55% 4. El sensor incorporado en estos catéteres mide la temperatura de la punta del electrodo, no la temperatura tisular. En nuestro estudio, la temperatura durante la ablación estuvo comprendida entre 35 y 45 ¡C. La temperatura media registrada durante la aplicación con catéteres irrigados no fue útil para predecir el tamaño de la lesión.
Nuestros datos confirman que los catéteres irrigados producen lesiones mayores que los catéteres estándar. Los resultados del estudio sugieren que las energías bajas (en nuestro estudio de 15 W) son inadecuadas para crear lesiones profundas o transmurales con los catéteres irrigados. Este estudio demuestra que con el empleo de catéteres irrigados con una energía ³ 25 W, la incidencia de lesiones transmurales fue del 50%. Sólo 2 lesiones producidas con catéteres estándar presentaron una profundidad > 6 mm. Ocho lesiones transmurales se produjeron en el ventrículo izquierdo con los catéteres irrigados. Por tanto, estos resultados sugieren que se deben emplear 25 W y aumentarlos sólo cuando no se observen efectos clínicos y tras un mapeo minucioso. El principal problema que podría surgir con los catéteres irrigados es la posibilidad de alcanzar una temperatura de 100 ¡C en el interior del miocardio, con formación de vapor, que podría explotar, crear un cráter profundo o incluso una perforación. Los estudios de Nakagawa 5 demostraron que con los catéteres irrigados la temperatura pico se sitúa por debajo de la superficie tisular, debajo del endocardio. La formación de cráteres podría ser evitada utilizando aplicaciones de menor energía y/o más cortas. En nuestro estudio, con ablación estándar a 50 W observamos formación de cráteres en 12 de 20 lesiones (69%). Con catéteres irrigados se observaron 6 cráteres con 15, 25 y 50 W. Algunos autores han descrito peor enfriamiento de la punta en el ápex que en otras partes del ventrículo, y por tanto, produciendo lesiones más pequeñas 20. Nuestros datos no confirman que la lesión en el ápex sean más pequeñas, incluso pueden ser grandes, quizá porque la presión de contacto puede ser mayor en esta región.
Diferencias entre sistemas de irrigación abiertos y cerrados
No encontramos diferencias en la resolución de los electrogramas del punto de ablación entre los dos sistemas de catéteres irrigados. La diferencia en la temperatura media registrada con cada tipo de catéter podría representar distinto enfriamiento, con la velocidad de infusión de 17 ml/min para sistemas abiertos y 36 ml/min para sistemas cerrados. Sin embargo, no encontramos diferencias entre el tamaño de la lesión, la transmuralidad y la incidencia de cratering para ninguna de las energías empleadas (15, 25 o 50 W). En el sistema abierto es necesario realizar un test de patencia tras cada aplicación, ya que la posible presencia de trombos en el interior de la luz del catéter no es infrecuente y puede interferir con la irrigación.
Marcadores bioquímicos
La aplicación de radiofrecuencia crea una lesión miocárdica que libera marcadores bioquímicos. Estudios previos han demostrado la relación entre el valor pico de la cTnI y el tamaño de la lesión miocárdica producida con catéteres estándar. La sensibilidad de la cTnI para la detección de lesiones tras la ablación fue del 92% en un estudio 9. La CTnI fue el mejor marcador para detectar cambios menores en ambos grupos de ablación. En nuestro estudio, el valor pico medio de cTnI postablación tuvo una buena correlación con el tamaño real de la necrosis producida con la radiofrecuencia, tanto con catéter estándar (r = 0,86) como irrigado (r = 0,79).
El valor pico de la cTnI hallado en nuestro estudio fue bajo en la mayoría de los animales, con una media de 18 ng/ml. A pesar de múltiples cardioversiones eléctricas externas, se sabe por estudios previos que tras este procedimiento no hay un aumento de la cTnI 21. Sin embargo, algunas de las lesiones producidas por catéteres irrigados demostraron valores de 40-50 ng/ml, lo que representa una mayor cantidad de tejido miocárdico necrótico.
Implicaciones clínicas
La ablación con catéter del flúter típico se ha consolidado como una terapia muy eficaz 22. Las lesiones creadas con los catéteres irrigados pueden ser útiles para la ablación de algunas arritmias, como la taquicardia ventricular o el flúter resistente. El grupo de Burdeos ha investigado el empleo de los catéteres irrigados en un subgrupo de pacientes con flúter auricular típico en los que la ablación del istmo cavotricuspídeo con catéteres estándar había fracasado 23. El bloqueo bidireccional del istmo se consiguió en 12 pacientes con una energía media de 40 ± 6 W, con una sola aplicación en 6 pacientes y 2-6 aplicaciones en el resto. No hubo complicaciones. Así mismo, la taquicardia ventricular en la cardiopatía isquémica puede tener un circuito de reentrada lejos del endocardio, en el epicardio, que no suele ser accesible con ablación con catéteres estándar. En pacientes con taquicardia ventricular asociada a cardiopatía estructural, la ablación con catéter tiene un éxito moderado, muy posiblemente debido, entre otros factores, al tamaño limitado creado tras la ablación estándar. Los catéteres irrigados pueden ser útiles para tratar a estos pacientes.
El hallazgo de que las lesiones creadas con los catéteres irrigados con una energía de 15 W no son estadísticamente significativas en comparación con aquellas creadas con los catéteres estándar puede ser útil para tratar a algunos pacientes. Es posible que existan dos sustratos distintos de arritmia, y que para un determinado sustrato no queramos lesiones grandes, por ejemplo, flúter y taquicardia intranodal.
Limitaciones
En el examen macroscópico del corazón no se detectaron con claridad 12 lesiones. Otros autores han obtenido un porcentaje similar de lesiones perdidas en estudios parecidos. Los estudios de necropsia reflejan una enfermedad tisular subaguda, al realizarse una semana tras la ablación. Es difícil asumir que con un tiempo superior se podrían haber observado lesiones más grandes. Sin embargo, en una semana algunas lesiones han podido cicatrizar o disminuir en tamaño. Se requieren estudios adicionales para establecer los efectos arritmogénicos de la ablación con catéteres irrigados a largo plazo. CONCLUSIÓN
La ablación con radiofrecuencia y catéteres irrigados aumenta el tamaño de la lesión, sin incrementar la incidencia de cratering. Con energías de 15 W, el tamaño de la lesión no es significativamente distinto entre los catéteres irrigados y los estándar. El valor pico medio de la cTnI postablación tiene una buena correlación con el tamaño real de la necrosis producida con la radiofrecuencia.
Las indicaciones para la ablación con radiofrecuencia y catéteres irrigados no deben ser generalizadas a todos los procedimientos de ablación. Cuando se persiguen lesiones transmurales o más grandes, como sustratos epicárdicos o bandas anchas de tejido muscular, la ablación con catéteres irrigados puede ser necesaria. AGRADECIMIENTOS
Al Dr. Juan Carlos Sáez Garrido por su experto trabajo fotográfico y a las patólogas Dra. Magdalena Sancho y Dra. Mónica García-Cosío.
Fig. 5. Lesión producida con un catéter irrigado y 15 W. Se observa cómo el tamaño conseguido con esta energía es similar al producido con un catéter estándar y energía de 50 W.
Fig. 6. Tamaño de la lesión según la energía empleada y el tipo de catéter. Se observa cómo los tamaños de lesión son similares entre los catéteres estándar y los irrigados a 15 W, mientras que con potencias superiores (25 y 50 W) los irrigados demuestran lesiones considerablemente mayores.
Las lesiones 1,2 producidas durante la ablación con radiofrecuencia y catéteres estándar tienen aproximadamente un diámetro de 5-7 mm y un volumen de 200 μl. Los datos de la bibliografía han demostrado la importancia del enfriamiento de la punta del catéter para la creación de lesiones más grandes. En general, el volumen obtenido con los catéteres irrigados es superior al obtenido con los catéteres estándar de punta de 4 mm 3-8. Las concentraciones de la troponina I cardíaca (cTnI) han sido caracterizadas previamente como un buen marcador bioquímico para evaluar las pequeñas lesiones miocárdicas producidas tras la ablación con radiofrecuencia y catéter 9-16. Sin embargo, no tenemos datos con los catéteres irrigados y éste sería un parámetro útil para evaluar el tamaño de la lesión producida. El enfriamiento de la punta del catéter se puede realizar mediante infusión de salino fisiológico durante la aplicación de radiofrecuencia lo cual, además, reduce la probabilidad de subidas bruscas de la impedancia 6. Están disponibles actualmente dos sistemas para el enfriamiento de la punta del catéter, sistemas abiertos y cerrados, según si el suero salino fluye o no al torrente sanguíneo 3,8. No hay estudios que comparen ambos sistemas.
El propósito de este estudio fue comparar el efecto de los distintos catéteres de ablación sobre el tamaño de la lesión miocárdica. Aunque se han publicado series de lesiones producidas con catéteres irrigados, muy pocas han efectuado la ablación en un modelo in vivo, que creemos permite acercarse mejor al efecto real de la lesión producida en el hombre 3,6,8. MATERIAL Y MÉTODOS
Material y preparación experimental
Preparación experimental
El protocolo experimental fue aprobado por el comité del hospital y sigue las guías de cuidados estándares de animales para experimentación. Se estudiaron 20 cerdos, con peso entre 20 y 55 kg. La anestesia se realizó con 25 mg/kg intravenosos de pentobarbital, y posteriormente se realizó intubación endotraqueal, con ventilación mecánica. La anestesia general se mantuvo con isofluorano. Se canalizaron la vena yugular derecha y la arteria y vena femorales derechas. Se monitorizaron las 12 derivaciones del electrocardiograma y los electrogramas intracavitarios en un polígrafo multicanal (Cardiac Pathways Corp, Sunnyvalley, CA, EE.UU.).
Material empleado para la ablación
Catéteres
Ablación con catéter estándar. Se empleó un catéter de punta de 4 mm de 7 F (EP technologies, CA, EE.UU.).
Ablación con catéteres irrigados. Se emplearon dos tipos de catéteres irrigados: con perfusión interna de salino (sistema cerrado) y con perfusión al exterior (sistema abierto). El medio de enfriamiento fue suero salino (0,9%) a temperatura ambiente.
Sistema cerrado. El sistema de circuito cerrado empleado era el correspondiente al catéter Chilli ¨ Cooled Ablation Catheter (Cardiac Pathways Corp, Sunnyvalley, CA, EE.UU.). Se trata de un catéter cuatripolar, de punta de 4 mm, de platino-iridio, que contiene una luz interna para la circulación de salino hacia la punta del electrodo. Durante la aplicación de radiofrecuencia, una bomba de infusión (modelo 8004, Cardiac Pathways) hace circular el suero salino a través del electrodo, con un flujo de 36 ml/min. La temperatura se monitoriza con un sensor de termopar en la punta del electrodo.
Sistema abierto. Empleamos un catéter Celsius Thermo-Cool ¨, de Cordis Webster, 8 F. Es un catéter cuatripolar de punta de 3,5 mm. El catéter incorpora un sensor termopar en la punta del electrodo. En la parte distal del catéter existen 6 orificios para la salida del suero salino a la punta y así poder enfriarla. En este catéter el suero salino fluye directamente a la sangre. Antes de introducirlo se aconseja realizar un test de permeabilidad del sistema de infusión. Se emplearon dos velocidades de flujo, baja durante el mapeo (2 ml/min) y alta durante la ablación (17 ml/min). El cambio a flujo alto se realizó unos segundos antes de comenzar la aplicación de radiofrecuencia, momento en el que la temperatura baja unos 2-5 ¡C, lo que nos indica la efectividad del enfriamiento.
Protocolo de ablación con radiofrecuencia
Uno de los tres tipos de catéteres empleados (estándar de 4 mm, sistema abierto o cerrado) se eligieron de forma aleatorizada y se introdujeron en el animal con control fluoroscópico. Antes de cada ablación se registró la localización anatómica de cada aplicación de radiofrecuencia efectuada, para facilitar la identificación de las lesiones específicas en el examen anatomopatológico.
Para los catéteres estándar la aplicación de radiofrecuencia se preprogramó a 60 s y a una energía de 50 W. Se empleó un generador EPT 1.000 (EP Technologies, Mountain View, CA, EE.UU.). Para los catéteres irrigados, la radiofrecuencia se empleó de forma aleatorizada con una energía de 15, 25 o 50 W durante 60 s en cada punto (8 en el ventrículo izquierdo y 21 en el derecho). Los generadores de radiofrecuencia empleados fueron Atakr de Medtronic, Minneapolis, EE.UU., y un modelo 8004 de Cardiac Pathways. La aplicación se interrumpió si el cerdo presentaba fibrilación ventricular o tras aumento brusco de la impedancia. La radiofrecuencia se aplicó entre la punta del electrodo y un parche indiferente en piel. Para cada aplicación se registraron el voltaje, la corriente, la energía, la temperatura y la impedancia.
Muestras bioquímicas
Se analizaron las concentraciones séricas de creatincinasa (CK) MB masa, cTnI, mioglobina, y actividad de CK. Se sabe por estudios previos que estos marcadores bioquímicos pueden ser medidos en el cerdo y que no son específicos de especie 17. Se tomaron muestras de sangre periférica para su análisis (5,5 ml de sangre en tubo seco) de acuerdo con el esquema prefijado. La primera muestra se recogió justo después del acceso venoso periférico (muestra inicial). El resto se tomaron tras colocar los catéteres, 20 min tras la última aplicación, a las 2, 24, 48 h y el día del sacrificio (día 7). Las muestras se centrifugaron, alicuotaron y congelaron a -20 ¡C hasta su procesamiento. Los marcadores cardíacos cTnI, mioglobina, y CK-MB masa se determinaron usando la técnica sándwich, con anticuerpos monoclonales dobles, mediante un analizador enzimático de inmunofluoroensayo (bipartición radial) Stratus II (Dade-Behring). La actividad de CK se analizó con un equipo Integra (Roche). Las concentraciones de cTnI se determinaron también con un analizador automático Dimension RxL-HM (Dade-Behring), para contrastarlo con el método previo.
Anatomía patológica
El corazón se explantó una semana después de la ablación y se conservó en una solución de formol al 10% hasta su procesamiento. Tras examinar la superficie epicárdica para objetivar la presencia de lesiones transmurales, se abrieron los ventrículos y se examinó la presencia macroscópica de las lesiones. Se realizaron múltiples cortes transversales del corazón para el análisis de las dimensiones de la lesión. La anchura, longitud y profundidad de las lesiones se midieron con un compás. El volumen se calculó a partir de las 3 dimensiones en cada corte.
Estadística
Los datos se expresan como media ± desviación estándar. Para comparar variables discretas empleamos el test de la χ 2. La correlación entre distintas variables se analizó mediante los coeficientes de correlación de Pearson. El test de la t de Student se empleó para la comparación del tamaño de las lesiones para cada electrodo. Se consideraron estadísticamente significativos los valores de p < 0,05. RESULTADOS
Se realizaron un total de 54 aplicaciones en 20 cerdos, empleando los distintos electrodos. El peso de los corazones no fue diferente entre los animales en los que se efectuó ablación con catéter estándar (215 ± 39 g) frente a irrigados (199 ± 33 g) (tabla 1). En 3 de 54 (5%) aplicaciones se escuchó un plop. Debido a alta impedancia o temperatura observamos cortes prematuros de la energía en 10 de 54 (18%) aplicaciones. A 50 W, se observaron siete (28%) subidas bruscas de impedancia en 25 aplicaciones con catéteres estándar y tres de 29 (10%) para catéteres irrigados. Con energía de 15 y 25 W en catéteres irrigados no hubo subidas bruscas de impedancia, y las tres fueron con energías de 50 W. En 14 aplicaciones se encontró un trombo en la superficie de la punta del catéter (10 con catéteres estándar y cuatro con irrigados), y hallamos un trombo en el interior de la luz, al realizar el test de permeabilidad, en 3 aplicaciones con sistema abierto. Durante 49 de 54 aplicaciones se observaron múltiples rachas de extrasístoles y taquicardia ventricular, con inducción de fibrilación ventricular en 18 cerdos, que fueron desfibrilados de inmediato. Ninguno de los animales tenía derrame pericárdico cuando se explantó el corazón.
Estudio bioquímico
Todos los animales presentaron valores anormales de cTnI y el resto de marcadores tras la ablación con los 3 tipos de catéteres. Las concentraciones de CK-MB masa y cTnI fueron significativamente más altas en el grupo de irrigados (11,3 ± 6 y 18 ± 15 μg/ml) que en el grupo de ablación estándar (5,8 ± 2 y 6,5 ± 3 μg/ml, respectivamente) (p < 0,01) (tabla 2).
Con catéteres estándar, el coeficiente de correlación entre la cTnI y el tamaño de la lesión fue r = 0,86. La fórmula:
Tamaño de la lesión = 250 cTnI pico-800 μl
predijo adecuadamente el tamaño de la lesión creada (tabla 3). Con los catéteres irrigados el coeficiente de correlación entre la cTnI y el tamaño de la lesión fue r = 0,79. La fórmula:
Tamaño de la lesión = 61,5 cTnI pico-116 μl
predijo de manera adecuada el tamaño de la lesión. También evaluamos las concentraciones de cTnI en 20 cerdos, 4 con catéter estándar y 13 con irrigados, con el sistema Dimension. La correlación con las concentraciones de cTnI obtenidas con el sistema Stratus fue excelente, r = 0,996 (cTnI Stratus = 1,76 cTnI Dimension - 0,22 ng/ml). No hubo diferencias en la comparación de ambos métodos (Stratus y Dimension).
Con respecto a la cinética, el valor pico medio de cTnI ocurrió a las 24 h de la ablación, tanto con catéteres irrigados como estándar. A las 48 h de la ablación sólo la cTnI estuvo marcadamente elevada, pero los otros marcadores bioquímicos estuvieron dentro de los límites normales, excepto un ligero incremento de las concentraciones de CK. A los 7 días, sólo la cTnI permaneció elevada. Las concentraciones de cTnI, mioglobina, CK y CK-MB se alcanzaron más precozmente de lo esperado, en comparación con los datos derivados de pacientes con cardiopatía isquémica. En la figura 1 se observa la cinética media para todos los marcadores bioquímicos, para catéteres estándar e irrigados.
Fig. 1. Cinética de los marcadores bioquímicos evaluados en nuestro estudio. Se representa los valores medios de cada marcador en cada muestra. La hora 0 es el final de la ablación. El valor pico máximo de troponina I cardíaca (cTnI) se registró a las 24 horas postablación. A las 48 horas tras la ablación, sólo las concentraciones de cTnI estaban marcadamente elevadas, pero el resto de marcadores bioquímicos estuvieron dentro de los valores normales, excepto un ligero aumento de (CK). A los 7 días, sólo las concentraciones de cTnI persistían anormalmente elevadas.
Tamaño de las lesiones
El examen macroscópico del corazón puso de manifiesto las lesiones producidas por la radiofrecuencia, como áreas equimóticas en las superficies endocárdica o epicárdica. Se encontraron un total de 20 lesiones producidas por catéteres estándar y 22 con catéteres irrigados. Se observaron 42 aplicaciones por visión macroscópica del endocardio y 15 desde el epicardio. En 12 aplicaciones no se apreciaron con claridad las lesiones en la necropsia.
Los catéteres irrigados produjeron lesiones más grandes (856 ± 864 μl) que los catéteres estándar (146 ± 110 μl); p = 0,0004. Los datos de los distintos parámetros se exponen en la tabla 1. Las lesiones creadas con catéteres estándar tenían una profundidad media de 4,2 ± 1,7 mm y una anchura media de 5,3 ± 1,9 mm (fig. 2). Las lesiones producidas con catéteres irrigados tenían una profundidad media de 6,4 ± 2,5 mm y una anchura media de 9 ± 3 mm (p < 0,05 en comparación con catéteres estándar) (fig. 3). Siguiendo el protocolo, la energía empleada con catéteres estándar fue de 50 W en todos los casos y superior a la media empleada con catéteres irrigados (15, 25, 50 con una media de 33 ± 16 W).
Fig. 2. Lesión producida en la pared lateral del ventrículo derecho con un catéter estándar y con 50 W, que afecta la superficie endocárdica en contacto cercano con la punta del catéter. Se trata de una de las lesiones de mayores dimensiones que obtuvimos con un catéter estándar a máxima potencia.
Fig. 3. Lesión producida por un catéter irrigado con 50 W, en una posición similar. La imagen muestra una regla y está realizada con la misma amplificación que el caso de la figura 2. Obsérvese que su diámetro en la superficie es de 1,4 cm, mientras que la anterior oscila alrededor de 0,7 cm. La lesión es completamente transmural, lo que le da un aspecto elipsoidal en vez de esférico.
Con energías de 50 W el tamaño de la lesión fue significativamente más grande para catéteres irrigados que estándar (756 ± 420 μl para el sistema cerrado y 1.788 ± 1.133 μl para el sistema abierto frente a 146 ± 110 μl para el estándar; p = 0,0001) (fig. 4). Con energías de 25 W, el catéter irrigado produjo igualmente lesiones más grandes que las obtenidas con catéter estándar a 50 W. Sin embargo, a 15 W las lesiones producidas con catéteres irrigados no fueron significativamente mayores que las producidas con los estándares (figs. 5 y 6) (270 ± 261 μl para el sistema cerrado, 153 ± 144 μl para el sistema abierto y 146 ± 110 μl con estándares; p = NS). El tiempo de aplicación tuvo también una influencia importante en el tamaño de las lesiones. Para los catéteres estándar, la diferencia en el tamaño de las lesiones producidas con aplicaciones < 30 s (85 ± 57 μl) y aquellas > 30 s (208 ± 118 μl) fue estadísticamente significativa. Hallazgos similares se observaron con las lesiones producidas con catéteres irrigados (575 ± 475 < 30 s frente a 1.195 ± 1.110 μl > 30 s) (tabla 4).
Fig. 4. Lesión producida con un catéter irrigado y 50 W. En esta figura se observan 2 lesiones cercanas en el septo interventricular, producidas desde el ventrículo derecho, como en el caso de la figura 5. Estas lesiones son muy profundas, con una base estrecha y una circunferencia máxima alejada de la superficie endocárdica y un tamaño considerablemente mayor que las de las otras figuras (estándares o irrigados de 15 W).
En 3 casos (15%; los 3 en el ventrículo derecho) las lesiones creadas con catéteres estándar se extendieron hasta la grasa epicárdica (transmurales). Sin embargo, ya que la transmuralidad depende del grosor del miocardio en un punto, hay que reseñar que sólo 2 lesiones estándar presentaron una profundidad superior a 6 mm. En comparación, 11 lesiones (50%, 8 en el ventrículo derecho y 3 en el izquierdo) creadas con irrigados fueron transmurales. Las lesiones producidas en el ápex (5 lesiones) con estándares tenían un tamaño medio de 259 ± 80 μl (límites, 144-336) y en el resto del ventrículo (15 lesiones) el tamaño medio era de 109 ± 93 μl (límites, 8-294; p = 0,0049). Las lesiones producidas en el ápex (5 lesiones) con los irrigados tuvieron un tamaño medio de 1.508 ± 1.384 μl (límites, 528-3.900) y en el resto del ventrículo (17 lesiones) el tamaño medio fue de 665 ± 571 μl (límites, 22-2.142); p = 0,0528. Se encontró cratering en 6 de 22 (27%) lesiones creadas con irrigados y en 12 de 20 lesiones (60%) con catéteres estándar (p < 0,05).
Diferencias entre las lesiones creadas con sistema abierto y cerrado
Se produjeron un total de 12 lesiones con el sistema abierto y 10 con el sistema cerrado (tabla 5). La temperatura media registrada fue de 45 ± 10 ¡C para el sistema abierto y 35 ± 5 ¡C para el sistema cerrado (p = NS). Las lesiones fueron transmurales en el 58% para el sistema abierto y en el 40% para el sistema cerrado (p = NS). La incidencia de cratering no fue significativa (4/12 aplicaciones [33%] con el sistema abierto y 2/10 aplicaciones [20%] con sistema cerrado). El tamaño medio de las lesiones fue de 1.124 ± 1.067 μl con el sistema abierto y de 535 ± 375 μl con el sistema cerrado, aunque no alcanzó diferencias significativas (p = 0,11), probablemente debido a la alta dispersión encontrada con los sistemas abiertos. No hubo diferencias entre ambos sistemas con cualquier energía empleada (15, 25 o 50 W) (tabla 6).
DISCUSIÓN
Principales hallazgos
Nuestros datos demuestran la importancia del enfriamiento de la punta del catéter para la creación de lesiones más grandes mediante radiofrecuencia. Se confirma que el aumento de los marcadores bioquímicos de lesión miocárdica es mayor con catéteres irrigados y se correlaciona con el volumen de la lesión. Estos hallazgos no fueron diferentes entre los dos sistemas de enfriamiento utilizados: irrigación abierta y cerrada.
Características de las lesiones
La energía de radiofrecuencia se libera a los tejidos para producir un área localizada de necrosis. Durante la ablación con catéteres estándar, el tejido se calienta mediante la radiofrecuencia, pero el aumento de la energía conduce a una excesiva temperatura y puede producir carbonización. El calor de esta región se transmite con un gradiente térmico lejos de la punta del catéter y el tejido, que alcanza una temperatura superior a 47-49 ¡C, se necrosa. Cuando la temperatura en la superficie del electrodo alcanza los 100 ¡C, la resistencia a la transmisión continuada de energía aumenta e impide el crecimiento de la lesión. En estas circunstancias se interrumpe la liberación de energía y puede formarse un trombo/carbonización. El enfriamiento de la punta del catéter es una forma apropiada de producir lesiones más grandes y profundas, disminuyendo la posibilidad de aumento de la impedancia 18,19.
La monitorización de la temperatura de la punta es útil durante la ablación con radiofrecuencia, pero el termopar registra una temperatura más baja en el momento de la subida de la impedancia, en comparación con la ablación con catéteres estándar y control de temperatura. Cuando la temperatura de la punta sube por encima de 50 ¡C, la incidencia de incrementos de la impedancia aumenta más del 55% 4. El sensor incorporado en estos catéteres mide la temperatura de la punta del electrodo, no la temperatura tisular. En nuestro estudio, la temperatura durante la ablación estuvo comprendida entre 35 y 45 ¡C. La temperatura media registrada durante la aplicación con catéteres irrigados no fue útil para predecir el tamaño de la lesión.
Nuestros datos confirman que los catéteres irrigados producen lesiones mayores que los catéteres estándar. Los resultados del estudio sugieren que las energías bajas (en nuestro estudio de 15 W) son inadecuadas para crear lesiones profundas o transmurales con los catéteres irrigados. Este estudio demuestra que con el empleo de catéteres irrigados con una energía ³ 25 W, la incidencia de lesiones transmurales fue del 50%. Sólo 2 lesiones producidas con catéteres estándar presentaron una profundidad > 6 mm. Ocho lesiones transmurales se produjeron en el ventrículo izquierdo con los catéteres irrigados. Por tanto, estos resultados sugieren que se deben emplear 25 W y aumentarlos sólo cuando no se observen efectos clínicos y tras un mapeo minucioso. El principal problema que podría surgir con los catéteres irrigados es la posibilidad de alcanzar una temperatura de 100 ¡C en el interior del miocardio, con formación de vapor, que podría explotar, crear un cráter profundo o incluso una perforación. Los estudios de Nakagawa 5 demostraron que con los catéteres irrigados la temperatura pico se sitúa por debajo de la superficie tisular, debajo del endocardio. La formación de cráteres podría ser evitada utilizando aplicaciones de menor energía y/o más cortas. En nuestro estudio, con ablación estándar a 50 W observamos formación de cráteres en 12 de 20 lesiones (69%). Con catéteres irrigados se observaron 6 cráteres con 15, 25 y 50 W. Algunos autores han descrito peor enfriamiento de la punta en el ápex que en otras partes del ventrículo, y por tanto, produciendo lesiones más pequeñas 20. Nuestros datos no confirman que la lesión en el ápex sean más pequeñas, incluso pueden ser grandes, quizá porque la presión de contacto puede ser mayor en esta región.
Diferencias entre sistemas de irrigación abiertos y cerrados
No encontramos diferencias en la resolución de los electrogramas del punto de ablación entre los dos sistemas de catéteres irrigados. La diferencia en la temperatura media registrada con cada tipo de catéter podría representar distinto enfriamiento, con la velocidad de infusión de 17 ml/min para sistemas abiertos y 36 ml/min para sistemas cerrados. Sin embargo, no encontramos diferencias entre el tamaño de la lesión, la transmuralidad y la incidencia de cratering para ninguna de las energías empleadas (15, 25 o 50 W). En el sistema abierto es necesario realizar un test de patencia tras cada aplicación, ya que la posible presencia de trombos en el interior de la luz del catéter no es infrecuente y puede interferir con la irrigación.
Marcadores bioquímicos
La aplicación de radiofrecuencia crea una lesión miocárdica que libera marcadores bioquímicos. Estudios previos han demostrado la relación entre el valor pico de la cTnI y el tamaño de la lesión miocárdica producida con catéteres estándar. La sensibilidad de la cTnI para la detección de lesiones tras la ablación fue del 92% en un estudio 9. La CTnI fue el mejor marcador para detectar cambios menores en ambos grupos de ablación. En nuestro estudio, el valor pico medio de cTnI postablación tuvo una buena correlación con el tamaño real de la necrosis producida con la radiofrecuencia, tanto con catéter estándar (r = 0,86) como irrigado (r = 0,79).
El valor pico de la cTnI hallado en nuestro estudio fue bajo en la mayoría de los animales, con una media de 18 ng/ml. A pesar de múltiples cardioversiones eléctricas externas, se sabe por estudios previos que tras este procedimiento no hay un aumento de la cTnI 21. Sin embargo, algunas de las lesiones producidas por catéteres irrigados demostraron valores de 40-50 ng/ml, lo que representa una mayor cantidad de tejido miocárdico necrótico.
Implicaciones clínicas
La ablación con catéter del flúter típico se ha consolidado como una terapia muy eficaz 22. Las lesiones creadas con los catéteres irrigados pueden ser útiles para la ablación de algunas arritmias, como la taquicardia ventricular o el flúter resistente. El grupo de Burdeos ha investigado el empleo de los catéteres irrigados en un subgrupo de pacientes con flúter auricular típico en los que la ablación del istmo cavotricuspídeo con catéteres estándar había fracasado 23. El bloqueo bidireccional del istmo se consiguió en 12 pacientes con una energía media de 40 ± 6 W, con una sola aplicación en 6 pacientes y 2-6 aplicaciones en el resto. No hubo complicaciones. Así mismo, la taquicardia ventricular en la cardiopatía isquémica puede tener un circuito de reentrada lejos del endocardio, en el epicardio, que no suele ser accesible con ablación con catéteres estándar. En pacientes con taquicardia ventricular asociada a cardiopatía estructural, la ablación con catéter tiene un éxito moderado, muy posiblemente debido, entre otros factores, al tamaño limitado creado tras la ablación estándar. Los catéteres irrigados pueden ser útiles para tratar a estos pacientes.
El hallazgo de que las lesiones creadas con los catéteres irrigados con una energía de 15 W no son estadísticamente significativas en comparación con aquellas creadas con los catéteres estándar puede ser útil para tratar a algunos pacientes. Es posible que existan dos sustratos distintos de arritmia, y que para un determinado sustrato no queramos lesiones grandes, por ejemplo, flúter y taquicardia intranodal.
Limitaciones
En el examen macroscópico del corazón no se detectaron con claridad 12 lesiones. Otros autores han obtenido un porcentaje similar de lesiones perdidas en estudios parecidos. Los estudios de necropsia reflejan una enfermedad tisular subaguda, al realizarse una semana tras la ablación. Es difícil asumir que con un tiempo superior se podrían haber observado lesiones más grandes. Sin embargo, en una semana algunas lesiones han podido cicatrizar o disminuir en tamaño. Se requieren estudios adicionales para establecer los efectos arritmogénicos de la ablación con catéteres irrigados a largo plazo. CONCLUSIÓN
La ablación con radiofrecuencia y catéteres irrigados aumenta el tamaño de la lesión, sin incrementar la incidencia de cratering. Con energías de 15 W, el tamaño de la lesión no es significativamente distinto entre los catéteres irrigados y los estándar. El valor pico medio de la cTnI postablación tiene una buena correlación con el tamaño real de la necrosis producida con la radiofrecuencia.
Las indicaciones para la ablación con radiofrecuencia y catéteres irrigados no deben ser generalizadas a todos los procedimientos de ablación. Cuando se persiguen lesiones transmurales o más grandes, como sustratos epicárdicos o bandas anchas de tejido muscular, la ablación con catéteres irrigados puede ser necesaria. AGRADECIMIENTOS
Al Dr. Juan Carlos Sáez Garrido por su experto trabajo fotográfico y a las patólogas Dra. Magdalena Sancho y Dra. Mónica García-Cosío.
Fig. 5. Lesión producida con un catéter irrigado y 15 W. Se observa cómo el tamaño conseguido con esta energía es similar al producido con un catéter estándar y energía de 50 W.
Fig. 6. Tamaño de la lesión según la energía empleada y el tipo de catéter. Se observa cómo los tamaños de lesión son similares entre los catéteres estándar y los irrigados a 15 W, mientras que con potencias superiores (25 y 50 W) los irrigados demuestran lesiones considerablemente mayores.
Bibliografía
[1]
Radiofrequency catheter ablation: the effect of electrode size on lesion volume in vivo. PACE 1990; 13: 1242-1248.
[2]
Control of radiofrequency lesion size by power regulation. Circulation 1989; 80: 962-968.
[3]
Comparison of standard and irrigated radiofrequency ablation in the canine ventricle. J Cardiovasc Electrophysiol 1998; 9: 1196-1205.
[4]
Utility of tip thermometry during radiofrequency ablation in humans using an internally perfused saline cooled catheter. Circulation 1997; 96: I318.
[5]
Inverse relationship between electrode size and lesion size during radiofrequency ablation with active cooling. Circulation 1998; 98: 458-465.
[6]
Temperature-controlled irrigated tip radiofrequency catheter ablation: comparison of in vivo and in vitro lesion dimensions for standard catheter and irrigated tip catheter with minimal infusion rate. J Cardiovasc Electrophysiol 1998; 9: 409-414.
[7]
Why a large tip electrode makes a deeper radiofrequency lesion: effects of increase in electrode cooling and electrode-tissue interface area. J Cardiovasc Electrophysiol 1998; 9: 47-54.
[8]
Ablation of ventricular tachycardia with a saline-cooled radiofrequency catheter: anatomic and histologic characteristics of the lesions in humans. J Cardiovasc Electrophysiol 1999; 10: 860-865.
[9]
Cardiac troponin I and minor cardiac damage: biochemical markers in a clinical model of myocardial lesions. Clin Chem 1998; 44: 2270-2276.
[10]
Independent prognostic value of serum creatine kinase isoenzyme MB mass, cardiac troponin T and myosin light chain levels in suspected acute myocardial infarction. J Am Coll Cardiol 1995; 25: 574-581.
[11]
Cardiac troponin I. A marker with high specificity for cardiac injury. Circulation 1993; 88: 101-106.
[12]
Troponin T and myocardial damage. Br J Cardiol 1993; 1: 16-21
[13]
Significance of cardiac troponin T release after percutaneous transluminal coronary angioplasty. Am J Cardiol 1995; 76: 521-523.
[14]
Comparative sensitivity of cardiac troponin I and lactate dehydrogenase isoenzymes for diagnosing acute myocardial infarction. Clin Chem 1996; 42: 1770-1776.
[15]
Observations on electrode-tissue interface temperature and effect on electrical impedance during radiofrequency ablation of ventricular myocardium. Circulation 1990; 82: 1034-1038.
[16]
Cardiac-specific immunoenzymometric assay of cardiac troponin I in the early phase of acute myocardial infarction. Clin Chem 1993; 39: 972-979.
[17]
Differential reactivity of cardiac and skeletal muscle from various species in a cardiac troponin I immunoassay. Clin Chem 1997; 43: 2333-2338.
[18]
Comparison of in vivo tissue temperature profile and lesion geometry for radiofrequency ablation with a saline-irrigated electrode versus temperature control in a canine thigh muscle preparation. Circulation 1995; 91: 2264-2273.
[19]
Catheter tip orientation affects radiofrequency ablation lesion size in the canine left ventricle. PACE 1999; 22: 413-420.
[20]
Lesion dimensions during temperature-controlled radiofrequency catheter ablation of left ventricular porcine myocardium. Impact of ablation site, electrode size and convective cooling. Circulation 1999; 99: 319-325.
[21]
Cardiac troponin I levels are normal or minimally elevated after transthoracic cardioversion. J Am Coll Cardiol 1997; 30: 1052-1056.
[22]
Radiofrequency ablation as the first line of treatment in patients with common atrial flutter. Rev Esp Cardiol 1999; 52: 233-236.
[23]
Successful irrigated-tip catheter ablation of atrial flutter resistant to conventional radiofrequency ablation. Circulation 1998; 98: 835-838.