INTRODUCCIÓN Y OBJETIVOS: Analizar las características de la activación reentrante durante la fibrilación ventricular en un modelo experimental mediante cartografía epicárdica de alta resolución.
MÉTODOS: En 30 preparaciones de corazón aislado de conejo se ha registrado la actividad fibrilatoria ventricular utilizando un electrodo múltiple epicárdico. En los mapas de activación con patrones de activación reentrante se han determinado el número de giros consecutivos, la longitud máxima de la zona central de la reentrada, el área abarcada por la zona central y dos electrodos alrededor de la misma y la duración de los ciclos.
RESULTADOS: En la mayor parte de los mapas se han observado patrones complejos con dos o más frentes de activación que colisionan entre sí o quedan separados por líneas de bloqueo funcional (514 mapas; 86%). En 112 mapas (19%) se han obtenido patrones compatibles con afloramiento epicárdico del proceso de activación. Se ha detectado actividad reentrante en 42 mapas (7%) y el número máximo de giros consecutivos ha sido de 3 (promedio de 1,3 ± 0,5 giros). La longitud máxima de la zona central de la reentrada ha estado comprendida entre 3 y 7 mm (promedio de 5 ± 1 mm), y el área abarcada por esta zona más dos electrodos alrededor de la misma entre 35 y 55 mm 2 (promedio de 45 ± 6 mm2). La duración de los ciclos reentrantes (promedio de 47 ± 8 ms) ha demostrado una relación lineal con la longitud máxima de la zona central de la reentrada (ciclo = 4,52 x longitud + 24,6; r = 0,7; p < 0,0001).
CONCLUSIÓN: a) La cartografía epicárdica permite objetivar patrones de activación reentrante durante la fibrilación ventricular en el modelo utilizado; b) la activación reentrante detectada es poco frecuente e inestable, y c) existe una relación lineal entre la duración de los ciclos definidos por este tipo de activación y la longitud máxima de la zona central de la reentrada.
Palabras clave
Arritmia
Fibrilación ventricular
Mapeo
Reentrada
Electrofisiología
INTRODUCCIÓN
La activación miocárdica durante los procesos fibrilatorios es compleja y su estudio ha sido abordado utilizando métodos y técnicas diversas 1-14. Conceptualmente, las aportaciones de Moe et al 1 supusieron un avance en el análisis de los procesos fibrilatorios, al postular que en las aurículas la fibrilación se mantenía a causa de la propagación no uniforme de múltiples frentes de activación que surgían al fraccionarse frentes de activación previos debido a la existencia de inhomogeneidades en la excitabilidad y en la velocidad de conducción. Los trabajos esperimentales de Allessie et al 15-17, en los que se han utilizado técnicas cartográficas y se ha demostrado la existencia de la reentrada funcional, no determinada por obstáculos anatómicos, han contribuido en gran medida al mejor conocimiento de la fibrilación auricular. Estudios posteriores, tanto teóricos como experimentales, en los que se han aplicado modelos espirales de excitación o su expresión tridimensional, han aportado vías distintas de aproximación al estudio de los procesos fibrilatorios, tanto auriculares como ventriculares 18-22, y en ellos se han apoyado diversos trabajos en los que se propone que la evolución de ritmos organizados, como la taquicardia ventricular, hacia la fibrilación ventricular (FV) ocurre debido a la desestabilización de los patrones de activación reentrante 23-25.
La cartografía epicárdica de la activación ventricular mediante el empleo de electrodos múltiples con los que se registran potenciales extracelulares 8-10,26-28 o sistemas ópticos basados en la utilización de marcadores sensibles a los cambios de voltaje, y en los que las variaciones en la fluorescencia de la señal indican los cambios del potencial transmembrana de grupos de células próximas entre sí 18-21,29-31, ha aportado información sobre las características de la activación miocárdica durante las arritmias ventriculares y han supuesto el soporte metodológico de diversos trabajos sobre la FV en los que se ha objetivado activación reentrante, tanto en el inicio de la arritmia como durante la evolución de la misma 8-10,12,14,21,23 y en los que se discute el papel desempeñado por este tipo de activación en la FV 10. En el presente trabajo se utiliza un modelo experimental con corazones aislados y perfundidos de conejo según la técnica de Langendorff para analizar el patrón fibrilatorio ventricular mediante técnicas cartográficas con los siguientes objetivos: a) estudiar las características de la activación epicárdica durante la FV en el modelo experimental utilizado; b) identificar los patrones de activación reentrante en los registros epicárdicos obtenidos durante el proceso fibrilatorio ventricular, y c) cuantificar las características de la activación reentrante estudiando su incidencia, estabilidad y las dimensiones de los elementos que la definen. MÉTODOS
Preparación experimental
Se han estudiado treinta preparaciones de corazón aislado y perfundido de conejos de raza California (peso medio de 4 ± 0,4 kg). Tras anestesia con ketamina (25 mg/kg, i.m.) y heparinización se extrajo el corazón, sumergiéndolo a continuación en Tyrode frío (4 ¡C). Una vez aislada la aorta se conectó a un sistema de Langendorff, perfundiendo solución de Tyrode a una presión de 60 mmHg y una temperatura de 37 ± 0,5 ¡C. La composición milimolar de la solución perfundida fue: ClNa = 130, CO 3HNa = 24,2, ClK = 4,7, Cl 2Ca = 2,2, PO 4H 2Na = 1,2, Cl 2Mg = 0,6 y glucosa = 12. La oxigenación se efectuó con una mezcla del 95% de O 2 y 5% de CO 2.
Se registraron los electrogramas del epicardio del ventrículo izquierdo mediante una placa con 121 electrodos unipolares (diámetro de 0,125 mm; distancia interelectrodos de 1 mm) situada en la superficie de la pared lateral del ventrículo izquierdo. Se ha utilizado como electrodo indiferente una placa de Ag/AgCl de 4 x 6 mm situada sobre la aorta. La estimulación ventricular se efectuó utilizando electrodos bipolares (diámetro de 0,125 mm; distancia interelectrodo de 1 mm) localizados en la parte superior o central del electrodo múltiple y un estimulador GRASS S88 provisto de una unidad de aislamiento de estímulos. Los estímulos fueron rectangulares, con una duración de 2 ms y una intensidad doble del umbral diastólico. Los registros se obtuvieron con un sistema de cartografía de la actividad eléctrica cardíaca (MAPTECH). Los electrogramas se amplificaron con una ganancia de 50 a 300, se filtraron eliminado las frecuencias situadas fuera de la banda comprendida entre 1 y 400 Hz y se multiplexaron. La frecuencia de muestreo en cada canal fue de 1 kHz. Los registros obtenidos a lo largo de cada experimento se almacenaron en soporte magnético para su análisis posterior.
Protocolo experimental
Treinta minutos después de situar los electrodos se indujo la fibrilación ventricular mediante estimulación a frecuencias crecientes desde 4 a 20 Hz, manteniendo la perfusión coronaria durante la arritmia. La estimulación se efectuó incrementando lentamente la frecuencia hasta inducir la FV o perder la captura ventricular. En caso de que no se desencadenase la arritmia, el procedimiento se repetía las veces necesarias hasta conseguirlo. La FV se definió como la arritmia caracterizada por la activación rápida e irregular del miocardio ventricular, con intervalos medios entre las activaciones sucesivas en un mismo electrodo inferiores a 100 ms y en la que el análisis de los mapas de activación epicárdicos demostraba patrones de activación persistentemente variables durante el desarrollo de la arritmia. Los registros de la FV se obtuvieron durante un intervalo de tiempo de 5 minutos y a continuación se efectuó una desfibrilación mediante la aplicación de una descarga DC de 5 J con un desfibrilador especialmente construido con este fin y utilizando dos electrodos cóncavos de 1,5 cm de diámetro situados sobre las paredes ventriculares derecha e izquierda.
Datos analizados
La activación local en cada electrodo se determinó identificando el momento de máxima pendiente negativa (dV/dt) de los electrogramas ventriculares. El umbral mínimo de este parámetro para ser considerado como una deflexión local fue un porcentaje (20%) del máximo valor obtenido con cada electrodo. Cuando los electrogramas registrados demostraban potenciales dobles o múltiples se asignó un único tiempo de activación que correspondió a la deflexión con la máxima pendiente negativa. Se analizaron los registros correspondientes a un segmento de dos segundos obtenido a los 30 s del inicio de la arritmia, teniendo presente que la FV en el modelo utilizado, en el que se impide el deterioro metabólico al mantener la perfusión coronaria, es estable durante el tiempo en el que se ha mantenido la arritmia 7,14. El segmento analizado se dividió en ventanas de tiempo consecutivas, con una duración de 100 ms, y en cada ventana se identificaron los patrones de activación, construyendo las isócronas y utilizando la codificación en color de los tiempo de activación correspondientes a cada electrodo (fig. 1). Se definieron como zonas de bloqueo aquellas en las que la velocidad de conducción estimada fue inferior a 5 cm/s, delimitando áreas con distinta dirección del proceso de activación. Para identificar la activación reentrante se utilizó como guía la visualización en la pantalla de los tiempos de activación correspondientes a cada electrodo codificados en color, desplazando sucesivamente el intervalo de tiempo analizado en escalones de 10 ms. Cuando mediante este procedimiento se identificaba un frente de onda que tras describir una trayectoria circular o elíptica volvía a activar la zona previamente activada por él mismo, entonces se delimitaba la zona central de la reentrada utilizando como referencia la parte interna del frente de onda; así, se definió como zona central de la reentrada al espacio comprendido entre los electrodos más cercanos activados en direcciones opuestas durante la trayectoria circular del frente de onda reentrante. Se definió como longitud máxima de la zona central al diámetro máximo del área delimitada según el procedimiento anteriormente descrito. Con el objeto de utilizar también un parámetro que indicase la extensión de la superficie epicárdica implicada en las activaciones reentrantes se utilizó otro parámetro que se denominó área de la reentrada y que arbitrariamente se definió como el área abarcada por la zona central y los electrodos más próximos (dos electrodos) con los que se registraba la activación correspondiente al frente de onda reentrante durante su rotación alrededor de la zona central. Se cuantificó el número de giros consecutivos del proceso de activación y solamente se consideró como activación reentrante aquella en la que se producía al menos un giro completo, es decir, aquellos casos en los que el proceso de activación volvía a activar la zona previamente activada por el mismo frente (reentrada completa).
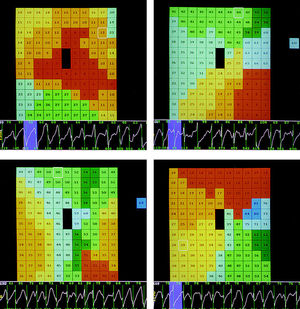
Fig. 1. Distintos tipos de mapas de activación obtenidos durante la fibrilación ventricular en cuatro de las preparaciones estudiadas. En la parte superior izquierda se observa un ejemplo de activación centrífuga, desde el interior de la zona abarcada por electrodo hacia la periferia, compatible con un afloramiento hacia la superficie del proceso de activación ventricular durante la arritmia. En la parte inferior izquierda se observa la colisión de dos frentes de activación simultáneos que entran en la zona explorada desde el lado izquierdo y desde la parte derecha del lado inferior. Los dos ejemplos de la derecha corresponden a activaciones reentrantes, en el de arriba el desplazamiento del frente de onda es en sentido horario y en el de abajo en sentido antihorario. Los tiempos de activación correspondientes a cada electrodo se han codificado en color según la secuencia: rojo, naranja, amarillo, verde claro, verde oscuro, verde más oscuro, azul claro, azul oscuro (cambios cada 5 ms en los mapas de la izquierda y cada 10 ms en los de la derecha). En la parte inferior de cada mapa se ha seleccionado el registro de la arritmia obtenido con el electrodo señalado en el mapa con un cuadrado. En dicho trazado se observa coloreada en azul la ventana de tiempo correspondiente al mapa de activación analizado.
Cálculos estadísticos
Se calcularon los parámetros estadísticos básicos de las variables cuantitativas analizadas: desviación típica, valores máximos y mínimos y diferencia entre ellos. La regresión lineal entre pares de variables se efectuó utilizando el método de los mínimo cuadrados. Se consideró como nivel de significación estadística un valor de p < 0,05. RESULTADOS
En todos los casos incluidos en el presente estudio se indujeron episodios de FV sostenida a lo largo del período de tiempo establecido en el protocolo experimental. En dos experimentos la FV se detuvo espontáneamente a los cuatro y a los tres minutos del inicio, respectivamente, y en ellos se volvió a inducir la arritmia, que persistió hasta la aplicación de la desfibrilación a los 5 minutos de la reinducción. En estos dos casos se analizaron los registros correspondientes al segundo episodio de FV.
Durante la arritmia, los mapas de activación más frecuentemente observados fueron similares al que se representa en la figura 2. En ellos se aprecia la existencia de varios frentes de activación simultáneos que colisionan entre sí o que no llegan a confluir debido a la presencia de zonas de bloqueo funcional, variables en su localización en mapas consecutivos y que delimitan zonas del epicardio que son activadas por frentes de activación distintos. Del número total de ventanas analizadas (n = 600) se observaron este tipo de mapas de activación en 514 (86%). Así mismo, se apreció con frecuencia (112 mapas, 19% del total) la existencia de mapas en los que una zona del interior del área abarcada por el electrodo múltiple era activada más precozmente que las zonas limítrofes, es decir, no se evidenciaba transmisión desde las zonas vecinas del epicardio (fig. 3). En estos mapas existía propagación centrífuga desde la zona con activación más precoz hacia la periferia del área abarcada por el electrodo, aunque a su vez el proceso de activación podía colisionar con otros frentes simultáneos o detenerse en líneas de bloqueo funcional.
Fig. 3. Superior: mapa de activación (isócronas cada 5 ms) obtenido durante uno de los episodios de fibrilación ventricular (FV) en el que se observa que la activación más precoz ocurre dentro del área abarcada por el electrodo, propagándose centrífugamente hacia la periferia. En la zona inferior el frente de activación se detiene en una línea de bloqueo funcional, de modo que la parte inferior del área abarcada por el electrodo múltiple es activada por un frente de onda distinto. Inferior: electrogramas seleccionados según la disposición indicada en el mapa que demuestran la activación centrífuga desde el interior del área explorada.
Fig. 2. Superior: mapa de activación y representación gráfica de las isócronas correspondiente a una de las ventanas de tiempo analizadas durante uno de los episodios de fibrilación ventricular (FV). Las isócronas se han construido a intervalos de 5 ms y se indican los tiempos de activación correspondientes a cada electrodo. En la zona superior se observa la entrada de dos frentes de activación simultáneos. El frente que entra desde la zona superior derecha colisiona con otro frente de activación que entra en la zona explorada por el electrodo desde la zona inferior izquierda. Este último no llega a colisionar con el que entra desde la zona superior izquierda debido a la existencia de una línea de bloqueo funcional. En el registro situado inmediatamente debajo del mapa de activación se observan los electrogramas obtenidos durante la FV con uno de los electrodos (el señalado con un cuadrado). Inferior: electrogramas seleccionados a lo largo de la trayectoria de los frentes de activación según se indica en el mapa de la parte superior.
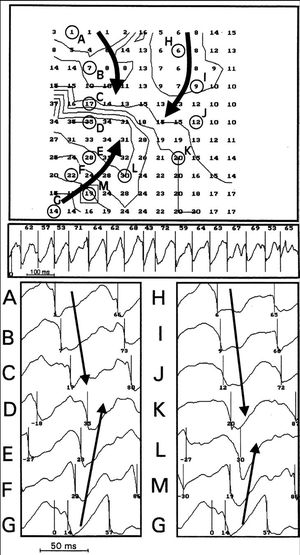
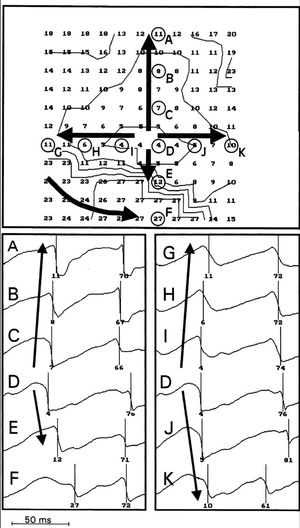
En 42 mapas (7% del total) se observaron patrones de activación reentrante similares a los que se representan en las figuras 4 y 5. En ellos existe un frente de activación que rodea una zona central que separa la propagación en direcciones opuestas a ambos lados de la misma. En la zona central se observa una aparente velocidad de conducción inferior a 5 cm/s y el frente de activación describe una trayectoria circular o elíptica alrededor de la misma, de modo que el proceso de despolarización vuelve a alcanzar la zona previamente activada por él mismo. Del total de mapas analizados en los que se identificó activación reentrante completa, el número máximo de giros consecutivos fue de tres, con un promedio de 1,3 ± 0,5 giros. La longitud máxima de la zona central delimitada por las activaciones reentrantes estuvo comprendida entre 3 y 7 mm (promedio de 5 ± 1 mm). El área delimitada por la zona central más dos electrodos con los que se registra la activación reentrante alrededor de dicha zona estuvo comprendida entre 35 y 55 mm 2 (promedio de 45 ± 6 mm 2). El ciclo medio determinado por las activaciones sucesivas en los circuitos reentrantes fue de 47 ± 8 ms. Se observó una relación lineal entre la duración de los ciclos (Cl, en ms), definidos por las activaciones sucesivas durante los procesos reentrantes, y la longitud (L, en mm) de la zona central de la reentrada: CL = 4,52 x L + 24,6 (r = 0,7; p < 0,0001; error estándar de la estimación = 6,6 ms; error estándar de la pendiente = 1,1; error estándar de la constante = 5,7 ms).
DISCUSIÎN
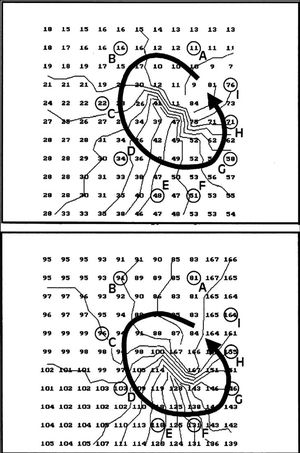
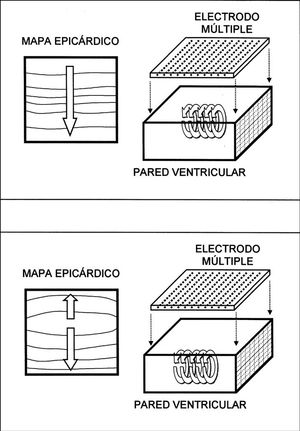
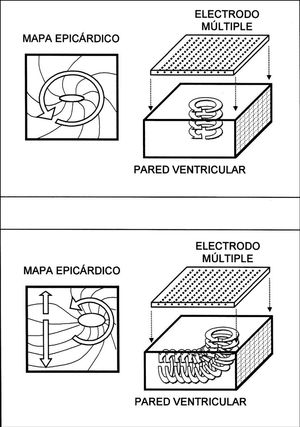
El análisis de la activación ventricular durante la FV es complejo debido a las características de la arritmia y a las limitaciones de las técnicas utilizadas para su estudio. La fibrilación ventricular se produce en un medio tridimensional y, aunque existen trabajos en los que se ha abordado su análisis mediante sistemas tridimensionales 32,33, la metodología aplicada es compleja y requiere la inserción de electrodos en las paredes ventriculares que pueden alterar el proceso que se analiza. La cartografía epicárdica, tanto la basada en registros de los electrogramas extracelulares mediante electrodos múltiples como la basada en sistemas ópticos, limita el análisis del proceso de activación a la superficie de las paredes ventriculares o en algunos casos a las capas más superficiales de las mismas 30 aunque, a pesar de esta limitación, permite describir y conocer con precisión diversos aspectos del proceso de activación analizado. La observación frecuente de patrones de activación con propagación centrífuga desde el interior del área epicárdica abarcada por el electrodo se interpreta como un indicador de las características tridimensionales del proceso fibrilatorio en el miocardio ventricular 8, ya que la propagación de frentes de activación desde el endocardio hacia el epicardio se traduce en afloramientos del proceso en el área epicárdica analizada y este fenómeno, como se observa también en el presente trabajo, ocurre con frecuencia al analizar la FV. En los procesos fibrilatorios auriculares ocurre en mucha menor medida ya que, aunque también influye el carácter tridimensional de las paredes auriculares 34, predomina la activación según una disposición bidimensional 17,35-37. Por otra parte, la tridimensionalidad del proceso fibrilatorio ventricular limita la detección de los patrones de activación reentrante y la cuantificación de su incidencia ya que, como se observa en la figura 6, cuando ocurra la reentrada en planos perpendiculares al epicardio se observarán patrones de activación simples o con evidencias de afloramientos hacia la superficie que dependerán del tamaño y localización de los circuitos implicados. Este hecho, así como la extensión del área abarcada por el electrodo, limita la identificación de circuitos reentrantes, cuya incidencia puede ser superior a la observada utilizando sistemas cartográficos epicárdicos 10. Sin embargo, cuando este tipo de activación ocurra en planos paralelos a la superficie epicárdica, como se observa en el esquema de la figura 7, entonces sí que será posible objetivar el movimiento reentrante desde el epicardio. En el presente trabajo, al igual que en otros estudios 8-10, se ha observado que la incidencia de patrones de activación reentrante es baja y que este tipo de activación, cuando aparece, es inestable, de modo que el número de giros consecutivos habitualmente ha sido inferior a dos (máximo 3; promedio de 1,3 ± 0,5 giros). La baja incidencia puede estar acrecentada por las limitaciones del método, relacionadas con la extensión de la superficie epicárdica analizada (1 cm 2) y con el hecho anteriormente señalado de que reentradas en planos perpendiculares al epicardio no quedarían objetivadas en los mapas epicárdicos 10. No obstante, el proceso fibrilatorio ventricular no parece sustentarse en procesos reentrantes estables, ya que cuando son objetivados una de sus características es la limitada duración de los mismos 8-10,12.
Fig. 6. Esquemas que representan los mapas de activación que se obtendrían desde el epicardio cuando la activación reentrante ocurre en planos perpendiculares al mismo. En la parte superior se representa el mapa que se obtendría cuando el circuito de reentrada fuese amplio y se ajustara a los límites del área abarcada por el electrodo. En este caso se observarían patrones de activación relativamente simples si no interfirieran otros frentes de activación distintos al considerado. En la parte inferior se representa un mapa de activación más complejo que se podría obtener cuando las dimensiones del circuito fueran más pequeñas y éste estuviera desplazado hacia uno de los lados del área explorada. En este caso se podrían obtener patrones de afloramiento hacia la superficie del proceso de activación intramiocárdico.
Fig. 7. Esquemas en los que se observa el tipo de mapas de activación que se obtendrían cuando la activación reentrante ocurriera según planos paralelos al epicardio. En este caso, el mapa epicárdico reflejaría las características reentrantes del proceso (esquema de la parte superior). En la parte inferior se presenta un esquema más complejo que correspondería a una activación reentrante cuyo plano variara en función de la profundidad intramiocárdica. Las zona situadas sobre el proceso reentrante cuando éste ocurre en planos paralelos al epicardio darían lugar a patrones de activación similares a los indicados en la parte superior de la figura, mientras que las situadas sobre la zona en la que el proceso reentrante cambia de plano darían lugar a modificaciones diversas en el mapa de activación recogido desde la superficie epicárdica.
Por otra parte, en relación con las características de la activación reentrante, hemos observado que la longitud máxima de la zona central de la reentrada ha sido inferior a 8 mm (promedio de 5 ± 1 mm) y que el área abarcada por la misma ha sido inferior a 60 mm 2 (promedio 45 ± 6 mm 2), es decir, la reentrada puede ocurrir en áreas reducidas 10. Efimov et al 30, en preparaciones de corazón aislado de conejo, determinaron unas dimensiones mayores de la zona central de activaciones reentrantes en el miocardio ventricular, aunque las técnicas empleadas para su análisis (cartografía basada en procedimientos ópticos) y las características de la preparación (administración previa de inhibidores del acoplamiento excitación-contracción, estudio de taquicardias polimorfas, ausencia de episodios de fibrilación ventricular) son distintas. Al analizar la relación existente entre la longitud de la zona central de la activación reentrante y la duración de los ciclos definidos por este tipo de activación se han confirmado los hallazgos de Uchida et al 38, quienes observaron una relación lineal entre ambos parámetros. Es decir, la longitud del camino recorrido por el proceso de activación reentrante determina en parte la duración de los ciclos definidos por el mismo, aunque otros factores, entre ellos la curvatura del frente de activación 20, también determinan la velocidad de propagación del proceso.
Implicaciones clínicas
La fibrilación ventricular es una arritmia letal que cuando aparece lleva consigo la pérdida de la contracción efectiva del corazón, la anulación del gasto cardíaco y la muerte súbita del paciente, siendo objeto de estudio desde distintos puntos de vista 40-44. Los avances en el conocimiento de los mecanismos básicos que determinan su inicio, su perpetuación o su cese son necesarios para intentar progresar en la prevención de la FV o en la eficacia de los procedimientos utilizados para interrumpirla adecuadamente. El estudio de los mecanismos que regulan la perpetuación de la arritmia ha hecho surgir diversas hipótesis de trabajo que intentan explicar la transición de ritmos regulares hacia ritmos irregulares, como la FV. Así, se ha postulado que serían fármacos antifibrilatorios aquellos que potenciaran la estabilidad de la activación reentrante, mientras que favorecerían la transición hacia la fibrilación aquellos que dieran lugar a su desestabilización 23-25,39, que se ha relacionado con las características de las curvas de recuperación de las propiedades eléctricas del miocardio ventricular 24,39. El trabajo presentado confirma la inestabilidad del proceso de activación reentrante durante la FV y establece un procedimiento para objetivar las modificaciones inducidas por fármacos u otros procedimientos potencialmente antifibrilatorios.
Limitaciones
El estudio de la señal fibrilatoria efectuado en el presente trabajo es limitado, tanto por el tiempo de análisis como por utilizar registros epicárdicos que no abarcan la totalidad del miocardio ventricular. En trabajos previos 7,14 hemos comprobado que en el modelo experimental utilizado, si se mantiene la perfusión coronaria durante la arritmia, las características de la misma son estables y los parámetros obtenidos son reproducibles, aunque es posible que durante los primeros segundos tras el inicio de la FV existan cambios rápidos y progresivos en la organización de la FV. En relación con el tamaño del electrodo, hay que considerar que pueden quedar fuera del análisis fenómenos que ocurren en áreas no exploradas durante el estudio. Por otra parte, el hecho de que los electrodos sean epicárdicos limita la recogida de la información a la superficie de las paredes ventriculares. Esta limitación es común a la de diversos trabajos en los que se estudia la FV mediante la utilización de electrodos múltiples o sistemas ópticos, y cuando se interpretan los resultados obtenidos con sistemas de cartografía epicárdica se debe tener presente que el proceso fibrilatorio ventricular ocurre en un medio tridimensional. Por otra parte, en el modelo utilizado, al mantener la perfusión coronaria durante la FV, no existe el deterioro metabólico que acompaña al desarrollo de la arritmia en el corazón in situ. Sin embargo, esta limitación permite manejar otras variables que también influyen sobre las características de la FV y cuyo análisis sería más complejo si simultáneamente se modificara el estado metabólico miocárdico. Esto es lo que ocurre cuando se estudia la fibrilación auricular, en la que la ausencia de deterioro metabólico permite analizar sin interferencias la influencia de distintos factores, entre ellos los fármacos antiarrítmicos, sobre el proceso fibrilatorio. CONCLUSIÓN
a) La cartografía epicárdica permite objetivar patrones de activación reentrante durante la fibrilación ventricular en el modelo experimental utilizado; b) la activación reentrante detectada es poco frecuente e inestable, y c) existe una relación lineal entre la duración de los ciclos definidos por este tipo de activación y la longitud máxima de la zona central de la reentrada.
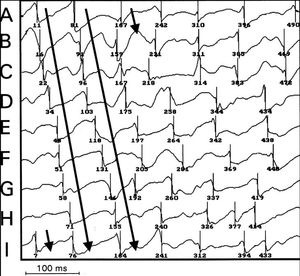
Fig. 4. Mapas de activación consecutivos obtenidos durante la fibrilación ventricular (FV) en los que se objetiva activación reentrante alrededor de la zona central representada por la mayor densidad de las isócronas. Se observa que la onda de excitación circula describiendo un giro antihorario y que la localización de la zona central varía ligeramente en el segundo ciclo, representado en la parte inferior. Las isócronas se han construido a intervalos de 5 ms.
Fig. 5. Registros obtenidos con los electrodos seleccionados a lo largo de la trayectoria del frente de activación (A hasta I) que ponen de manifiesto la activación reentrante durante los dos ciclos que se observan en los mapas de la figura 4. Se indican los tiempos de activación local identificados en cada uno de los electrogramas.
La activación miocárdica durante los procesos fibrilatorios es compleja y su estudio ha sido abordado utilizando métodos y técnicas diversas 1-14. Conceptualmente, las aportaciones de Moe et al 1 supusieron un avance en el análisis de los procesos fibrilatorios, al postular que en las aurículas la fibrilación se mantenía a causa de la propagación no uniforme de múltiples frentes de activación que surgían al fraccionarse frentes de activación previos debido a la existencia de inhomogeneidades en la excitabilidad y en la velocidad de conducción. Los trabajos esperimentales de Allessie et al 15-17, en los que se han utilizado técnicas cartográficas y se ha demostrado la existencia de la reentrada funcional, no determinada por obstáculos anatómicos, han contribuido en gran medida al mejor conocimiento de la fibrilación auricular. Estudios posteriores, tanto teóricos como experimentales, en los que se han aplicado modelos espirales de excitación o su expresión tridimensional, han aportado vías distintas de aproximación al estudio de los procesos fibrilatorios, tanto auriculares como ventriculares 18-22, y en ellos se han apoyado diversos trabajos en los que se propone que la evolución de ritmos organizados, como la taquicardia ventricular, hacia la fibrilación ventricular (FV) ocurre debido a la desestabilización de los patrones de activación reentrante 23-25.
La cartografía epicárdica de la activación ventricular mediante el empleo de electrodos múltiples con los que se registran potenciales extracelulares 8-10,26-28 o sistemas ópticos basados en la utilización de marcadores sensibles a los cambios de voltaje, y en los que las variaciones en la fluorescencia de la señal indican los cambios del potencial transmembrana de grupos de células próximas entre sí 18-21,29-31, ha aportado información sobre las características de la activación miocárdica durante las arritmias ventriculares y han supuesto el soporte metodológico de diversos trabajos sobre la FV en los que se ha objetivado activación reentrante, tanto en el inicio de la arritmia como durante la evolución de la misma 8-10,12,14,21,23 y en los que se discute el papel desempeñado por este tipo de activación en la FV 10. En el presente trabajo se utiliza un modelo experimental con corazones aislados y perfundidos de conejo según la técnica de Langendorff para analizar el patrón fibrilatorio ventricular mediante técnicas cartográficas con los siguientes objetivos: a) estudiar las características de la activación epicárdica durante la FV en el modelo experimental utilizado; b) identificar los patrones de activación reentrante en los registros epicárdicos obtenidos durante el proceso fibrilatorio ventricular, y c) cuantificar las características de la activación reentrante estudiando su incidencia, estabilidad y las dimensiones de los elementos que la definen. MÉTODOS
Preparación experimental
Se han estudiado treinta preparaciones de corazón aislado y perfundido de conejos de raza California (peso medio de 4 ± 0,4 kg). Tras anestesia con ketamina (25 mg/kg, i.m.) y heparinización se extrajo el corazón, sumergiéndolo a continuación en Tyrode frío (4 ¡C). Una vez aislada la aorta se conectó a un sistema de Langendorff, perfundiendo solución de Tyrode a una presión de 60 mmHg y una temperatura de 37 ± 0,5 ¡C. La composición milimolar de la solución perfundida fue: ClNa = 130, CO 3HNa = 24,2, ClK = 4,7, Cl 2Ca = 2,2, PO 4H 2Na = 1,2, Cl 2Mg = 0,6 y glucosa = 12. La oxigenación se efectuó con una mezcla del 95% de O 2 y 5% de CO 2.
Se registraron los electrogramas del epicardio del ventrículo izquierdo mediante una placa con 121 electrodos unipolares (diámetro de 0,125 mm; distancia interelectrodos de 1 mm) situada en la superficie de la pared lateral del ventrículo izquierdo. Se ha utilizado como electrodo indiferente una placa de Ag/AgCl de 4 x 6 mm situada sobre la aorta. La estimulación ventricular se efectuó utilizando electrodos bipolares (diámetro de 0,125 mm; distancia interelectrodo de 1 mm) localizados en la parte superior o central del electrodo múltiple y un estimulador GRASS S88 provisto de una unidad de aislamiento de estímulos. Los estímulos fueron rectangulares, con una duración de 2 ms y una intensidad doble del umbral diastólico. Los registros se obtuvieron con un sistema de cartografía de la actividad eléctrica cardíaca (MAPTECH). Los electrogramas se amplificaron con una ganancia de 50 a 300, se filtraron eliminado las frecuencias situadas fuera de la banda comprendida entre 1 y 400 Hz y se multiplexaron. La frecuencia de muestreo en cada canal fue de 1 kHz. Los registros obtenidos a lo largo de cada experimento se almacenaron en soporte magnético para su análisis posterior.
Protocolo experimental
Treinta minutos después de situar los electrodos se indujo la fibrilación ventricular mediante estimulación a frecuencias crecientes desde 4 a 20 Hz, manteniendo la perfusión coronaria durante la arritmia. La estimulación se efectuó incrementando lentamente la frecuencia hasta inducir la FV o perder la captura ventricular. En caso de que no se desencadenase la arritmia, el procedimiento se repetía las veces necesarias hasta conseguirlo. La FV se definió como la arritmia caracterizada por la activación rápida e irregular del miocardio ventricular, con intervalos medios entre las activaciones sucesivas en un mismo electrodo inferiores a 100 ms y en la que el análisis de los mapas de activación epicárdicos demostraba patrones de activación persistentemente variables durante el desarrollo de la arritmia. Los registros de la FV se obtuvieron durante un intervalo de tiempo de 5 minutos y a continuación se efectuó una desfibrilación mediante la aplicación de una descarga DC de 5 J con un desfibrilador especialmente construido con este fin y utilizando dos electrodos cóncavos de 1,5 cm de diámetro situados sobre las paredes ventriculares derecha e izquierda.
Datos analizados
La activación local en cada electrodo se determinó identificando el momento de máxima pendiente negativa (dV/dt) de los electrogramas ventriculares. El umbral mínimo de este parámetro para ser considerado como una deflexión local fue un porcentaje (20%) del máximo valor obtenido con cada electrodo. Cuando los electrogramas registrados demostraban potenciales dobles o múltiples se asignó un único tiempo de activación que correspondió a la deflexión con la máxima pendiente negativa. Se analizaron los registros correspondientes a un segmento de dos segundos obtenido a los 30 s del inicio de la arritmia, teniendo presente que la FV en el modelo utilizado, en el que se impide el deterioro metabólico al mantener la perfusión coronaria, es estable durante el tiempo en el que se ha mantenido la arritmia 7,14. El segmento analizado se dividió en ventanas de tiempo consecutivas, con una duración de 100 ms, y en cada ventana se identificaron los patrones de activación, construyendo las isócronas y utilizando la codificación en color de los tiempo de activación correspondientes a cada electrodo (fig. 1). Se definieron como zonas de bloqueo aquellas en las que la velocidad de conducción estimada fue inferior a 5 cm/s, delimitando áreas con distinta dirección del proceso de activación. Para identificar la activación reentrante se utilizó como guía la visualización en la pantalla de los tiempos de activación correspondientes a cada electrodo codificados en color, desplazando sucesivamente el intervalo de tiempo analizado en escalones de 10 ms. Cuando mediante este procedimiento se identificaba un frente de onda que tras describir una trayectoria circular o elíptica volvía a activar la zona previamente activada por él mismo, entonces se delimitaba la zona central de la reentrada utilizando como referencia la parte interna del frente de onda; así, se definió como zona central de la reentrada al espacio comprendido entre los electrodos más cercanos activados en direcciones opuestas durante la trayectoria circular del frente de onda reentrante. Se definió como longitud máxima de la zona central al diámetro máximo del área delimitada según el procedimiento anteriormente descrito. Con el objeto de utilizar también un parámetro que indicase la extensión de la superficie epicárdica implicada en las activaciones reentrantes se utilizó otro parámetro que se denominó área de la reentrada y que arbitrariamente se definió como el área abarcada por la zona central y los electrodos más próximos (dos electrodos) con los que se registraba la activación correspondiente al frente de onda reentrante durante su rotación alrededor de la zona central. Se cuantificó el número de giros consecutivos del proceso de activación y solamente se consideró como activación reentrante aquella en la que se producía al menos un giro completo, es decir, aquellos casos en los que el proceso de activación volvía a activar la zona previamente activada por el mismo frente (reentrada completa).
Fig. 1. Distintos tipos de mapas de activación obtenidos durante la fibrilación ventricular en cuatro de las preparaciones estudiadas. En la parte superior izquierda se observa un ejemplo de activación centrífuga, desde el interior de la zona abarcada por electrodo hacia la periferia, compatible con un afloramiento hacia la superficie del proceso de activación ventricular durante la arritmia. En la parte inferior izquierda se observa la colisión de dos frentes de activación simultáneos que entran en la zona explorada desde el lado izquierdo y desde la parte derecha del lado inferior. Los dos ejemplos de la derecha corresponden a activaciones reentrantes, en el de arriba el desplazamiento del frente de onda es en sentido horario y en el de abajo en sentido antihorario. Los tiempos de activación correspondientes a cada electrodo se han codificado en color según la secuencia: rojo, naranja, amarillo, verde claro, verde oscuro, verde más oscuro, azul claro, azul oscuro (cambios cada 5 ms en los mapas de la izquierda y cada 10 ms en los de la derecha). En la parte inferior de cada mapa se ha seleccionado el registro de la arritmia obtenido con el electrodo señalado en el mapa con un cuadrado. En dicho trazado se observa coloreada en azul la ventana de tiempo correspondiente al mapa de activación analizado.
Cálculos estadísticos
Se calcularon los parámetros estadísticos básicos de las variables cuantitativas analizadas: desviación típica, valores máximos y mínimos y diferencia entre ellos. La regresión lineal entre pares de variables se efectuó utilizando el método de los mínimo cuadrados. Se consideró como nivel de significación estadística un valor de p < 0,05. RESULTADOS
En todos los casos incluidos en el presente estudio se indujeron episodios de FV sostenida a lo largo del período de tiempo establecido en el protocolo experimental. En dos experimentos la FV se detuvo espontáneamente a los cuatro y a los tres minutos del inicio, respectivamente, y en ellos se volvió a inducir la arritmia, que persistió hasta la aplicación de la desfibrilación a los 5 minutos de la reinducción. En estos dos casos se analizaron los registros correspondientes al segundo episodio de FV.
Durante la arritmia, los mapas de activación más frecuentemente observados fueron similares al que se representa en la figura 2. En ellos se aprecia la existencia de varios frentes de activación simultáneos que colisionan entre sí o que no llegan a confluir debido a la presencia de zonas de bloqueo funcional, variables en su localización en mapas consecutivos y que delimitan zonas del epicardio que son activadas por frentes de activación distintos. Del número total de ventanas analizadas (n = 600) se observaron este tipo de mapas de activación en 514 (86%). Así mismo, se apreció con frecuencia (112 mapas, 19% del total) la existencia de mapas en los que una zona del interior del área abarcada por el electrodo múltiple era activada más precozmente que las zonas limítrofes, es decir, no se evidenciaba transmisión desde las zonas vecinas del epicardio (fig. 3). En estos mapas existía propagación centrífuga desde la zona con activación más precoz hacia la periferia del área abarcada por el electrodo, aunque a su vez el proceso de activación podía colisionar con otros frentes simultáneos o detenerse en líneas de bloqueo funcional.
Fig. 3. Superior: mapa de activación (isócronas cada 5 ms) obtenido durante uno de los episodios de fibrilación ventricular (FV) en el que se observa que la activación más precoz ocurre dentro del área abarcada por el electrodo, propagándose centrífugamente hacia la periferia. En la zona inferior el frente de activación se detiene en una línea de bloqueo funcional, de modo que la parte inferior del área abarcada por el electrodo múltiple es activada por un frente de onda distinto. Inferior: electrogramas seleccionados según la disposición indicada en el mapa que demuestran la activación centrífuga desde el interior del área explorada.
Fig. 2. Superior: mapa de activación y representación gráfica de las isócronas correspondiente a una de las ventanas de tiempo analizadas durante uno de los episodios de fibrilación ventricular (FV). Las isócronas se han construido a intervalos de 5 ms y se indican los tiempos de activación correspondientes a cada electrodo. En la zona superior se observa la entrada de dos frentes de activación simultáneos. El frente que entra desde la zona superior derecha colisiona con otro frente de activación que entra en la zona explorada por el electrodo desde la zona inferior izquierda. Este último no llega a colisionar con el que entra desde la zona superior izquierda debido a la existencia de una línea de bloqueo funcional. En el registro situado inmediatamente debajo del mapa de activación se observan los electrogramas obtenidos durante la FV con uno de los electrodos (el señalado con un cuadrado). Inferior: electrogramas seleccionados a lo largo de la trayectoria de los frentes de activación según se indica en el mapa de la parte superior.
En 42 mapas (7% del total) se observaron patrones de activación reentrante similares a los que se representan en las figuras 4 y 5. En ellos existe un frente de activación que rodea una zona central que separa la propagación en direcciones opuestas a ambos lados de la misma. En la zona central se observa una aparente velocidad de conducción inferior a 5 cm/s y el frente de activación describe una trayectoria circular o elíptica alrededor de la misma, de modo que el proceso de despolarización vuelve a alcanzar la zona previamente activada por él mismo. Del total de mapas analizados en los que se identificó activación reentrante completa, el número máximo de giros consecutivos fue de tres, con un promedio de 1,3 ± 0,5 giros. La longitud máxima de la zona central delimitada por las activaciones reentrantes estuvo comprendida entre 3 y 7 mm (promedio de 5 ± 1 mm). El área delimitada por la zona central más dos electrodos con los que se registra la activación reentrante alrededor de dicha zona estuvo comprendida entre 35 y 55 mm 2 (promedio de 45 ± 6 mm 2). El ciclo medio determinado por las activaciones sucesivas en los circuitos reentrantes fue de 47 ± 8 ms. Se observó una relación lineal entre la duración de los ciclos (Cl, en ms), definidos por las activaciones sucesivas durante los procesos reentrantes, y la longitud (L, en mm) de la zona central de la reentrada: CL = 4,52 x L + 24,6 (r = 0,7; p < 0,0001; error estándar de la estimación = 6,6 ms; error estándar de la pendiente = 1,1; error estándar de la constante = 5,7 ms).
DISCUSIÎN
El análisis de la activación ventricular durante la FV es complejo debido a las características de la arritmia y a las limitaciones de las técnicas utilizadas para su estudio. La fibrilación ventricular se produce en un medio tridimensional y, aunque existen trabajos en los que se ha abordado su análisis mediante sistemas tridimensionales 32,33, la metodología aplicada es compleja y requiere la inserción de electrodos en las paredes ventriculares que pueden alterar el proceso que se analiza. La cartografía epicárdica, tanto la basada en registros de los electrogramas extracelulares mediante electrodos múltiples como la basada en sistemas ópticos, limita el análisis del proceso de activación a la superficie de las paredes ventriculares o en algunos casos a las capas más superficiales de las mismas 30 aunque, a pesar de esta limitación, permite describir y conocer con precisión diversos aspectos del proceso de activación analizado. La observación frecuente de patrones de activación con propagación centrífuga desde el interior del área epicárdica abarcada por el electrodo se interpreta como un indicador de las características tridimensionales del proceso fibrilatorio en el miocardio ventricular 8, ya que la propagación de frentes de activación desde el endocardio hacia el epicardio se traduce en afloramientos del proceso en el área epicárdica analizada y este fenómeno, como se observa también en el presente trabajo, ocurre con frecuencia al analizar la FV. En los procesos fibrilatorios auriculares ocurre en mucha menor medida ya que, aunque también influye el carácter tridimensional de las paredes auriculares 34, predomina la activación según una disposición bidimensional 17,35-37. Por otra parte, la tridimensionalidad del proceso fibrilatorio ventricular limita la detección de los patrones de activación reentrante y la cuantificación de su incidencia ya que, como se observa en la figura 6, cuando ocurra la reentrada en planos perpendiculares al epicardio se observarán patrones de activación simples o con evidencias de afloramientos hacia la superficie que dependerán del tamaño y localización de los circuitos implicados. Este hecho, así como la extensión del área abarcada por el electrodo, limita la identificación de circuitos reentrantes, cuya incidencia puede ser superior a la observada utilizando sistemas cartográficos epicárdicos 10. Sin embargo, cuando este tipo de activación ocurra en planos paralelos a la superficie epicárdica, como se observa en el esquema de la figura 7, entonces sí que será posible objetivar el movimiento reentrante desde el epicardio. En el presente trabajo, al igual que en otros estudios 8-10, se ha observado que la incidencia de patrones de activación reentrante es baja y que este tipo de activación, cuando aparece, es inestable, de modo que el número de giros consecutivos habitualmente ha sido inferior a dos (máximo 3; promedio de 1,3 ± 0,5 giros). La baja incidencia puede estar acrecentada por las limitaciones del método, relacionadas con la extensión de la superficie epicárdica analizada (1 cm 2) y con el hecho anteriormente señalado de que reentradas en planos perpendiculares al epicardio no quedarían objetivadas en los mapas epicárdicos 10. No obstante, el proceso fibrilatorio ventricular no parece sustentarse en procesos reentrantes estables, ya que cuando son objetivados una de sus características es la limitada duración de los mismos 8-10,12.
Fig. 6. Esquemas que representan los mapas de activación que se obtendrían desde el epicardio cuando la activación reentrante ocurre en planos perpendiculares al mismo. En la parte superior se representa el mapa que se obtendría cuando el circuito de reentrada fuese amplio y se ajustara a los límites del área abarcada por el electrodo. En este caso se observarían patrones de activación relativamente simples si no interfirieran otros frentes de activación distintos al considerado. En la parte inferior se representa un mapa de activación más complejo que se podría obtener cuando las dimensiones del circuito fueran más pequeñas y éste estuviera desplazado hacia uno de los lados del área explorada. En este caso se podrían obtener patrones de afloramiento hacia la superficie del proceso de activación intramiocárdico.
Fig. 7. Esquemas en los que se observa el tipo de mapas de activación que se obtendrían cuando la activación reentrante ocurriera según planos paralelos al epicardio. En este caso, el mapa epicárdico reflejaría las características reentrantes del proceso (esquema de la parte superior). En la parte inferior se presenta un esquema más complejo que correspondería a una activación reentrante cuyo plano variara en función de la profundidad intramiocárdica. Las zona situadas sobre el proceso reentrante cuando éste ocurre en planos paralelos al epicardio darían lugar a patrones de activación similares a los indicados en la parte superior de la figura, mientras que las situadas sobre la zona en la que el proceso reentrante cambia de plano darían lugar a modificaciones diversas en el mapa de activación recogido desde la superficie epicárdica.
Por otra parte, en relación con las características de la activación reentrante, hemos observado que la longitud máxima de la zona central de la reentrada ha sido inferior a 8 mm (promedio de 5 ± 1 mm) y que el área abarcada por la misma ha sido inferior a 60 mm 2 (promedio 45 ± 6 mm 2), es decir, la reentrada puede ocurrir en áreas reducidas 10. Efimov et al 30, en preparaciones de corazón aislado de conejo, determinaron unas dimensiones mayores de la zona central de activaciones reentrantes en el miocardio ventricular, aunque las técnicas empleadas para su análisis (cartografía basada en procedimientos ópticos) y las características de la preparación (administración previa de inhibidores del acoplamiento excitación-contracción, estudio de taquicardias polimorfas, ausencia de episodios de fibrilación ventricular) son distintas. Al analizar la relación existente entre la longitud de la zona central de la activación reentrante y la duración de los ciclos definidos por este tipo de activación se han confirmado los hallazgos de Uchida et al 38, quienes observaron una relación lineal entre ambos parámetros. Es decir, la longitud del camino recorrido por el proceso de activación reentrante determina en parte la duración de los ciclos definidos por el mismo, aunque otros factores, entre ellos la curvatura del frente de activación 20, también determinan la velocidad de propagación del proceso.
Implicaciones clínicas
La fibrilación ventricular es una arritmia letal que cuando aparece lleva consigo la pérdida de la contracción efectiva del corazón, la anulación del gasto cardíaco y la muerte súbita del paciente, siendo objeto de estudio desde distintos puntos de vista 40-44. Los avances en el conocimiento de los mecanismos básicos que determinan su inicio, su perpetuación o su cese son necesarios para intentar progresar en la prevención de la FV o en la eficacia de los procedimientos utilizados para interrumpirla adecuadamente. El estudio de los mecanismos que regulan la perpetuación de la arritmia ha hecho surgir diversas hipótesis de trabajo que intentan explicar la transición de ritmos regulares hacia ritmos irregulares, como la FV. Así, se ha postulado que serían fármacos antifibrilatorios aquellos que potenciaran la estabilidad de la activación reentrante, mientras que favorecerían la transición hacia la fibrilación aquellos que dieran lugar a su desestabilización 23-25,39, que se ha relacionado con las características de las curvas de recuperación de las propiedades eléctricas del miocardio ventricular 24,39. El trabajo presentado confirma la inestabilidad del proceso de activación reentrante durante la FV y establece un procedimiento para objetivar las modificaciones inducidas por fármacos u otros procedimientos potencialmente antifibrilatorios.
Limitaciones
El estudio de la señal fibrilatoria efectuado en el presente trabajo es limitado, tanto por el tiempo de análisis como por utilizar registros epicárdicos que no abarcan la totalidad del miocardio ventricular. En trabajos previos 7,14 hemos comprobado que en el modelo experimental utilizado, si se mantiene la perfusión coronaria durante la arritmia, las características de la misma son estables y los parámetros obtenidos son reproducibles, aunque es posible que durante los primeros segundos tras el inicio de la FV existan cambios rápidos y progresivos en la organización de la FV. En relación con el tamaño del electrodo, hay que considerar que pueden quedar fuera del análisis fenómenos que ocurren en áreas no exploradas durante el estudio. Por otra parte, el hecho de que los electrodos sean epicárdicos limita la recogida de la información a la superficie de las paredes ventriculares. Esta limitación es común a la de diversos trabajos en los que se estudia la FV mediante la utilización de electrodos múltiples o sistemas ópticos, y cuando se interpretan los resultados obtenidos con sistemas de cartografía epicárdica se debe tener presente que el proceso fibrilatorio ventricular ocurre en un medio tridimensional. Por otra parte, en el modelo utilizado, al mantener la perfusión coronaria durante la FV, no existe el deterioro metabólico que acompaña al desarrollo de la arritmia en el corazón in situ. Sin embargo, esta limitación permite manejar otras variables que también influyen sobre las características de la FV y cuyo análisis sería más complejo si simultáneamente se modificara el estado metabólico miocárdico. Esto es lo que ocurre cuando se estudia la fibrilación auricular, en la que la ausencia de deterioro metabólico permite analizar sin interferencias la influencia de distintos factores, entre ellos los fármacos antiarrítmicos, sobre el proceso fibrilatorio. CONCLUSIÓN
a) La cartografía epicárdica permite objetivar patrones de activación reentrante durante la fibrilación ventricular en el modelo experimental utilizado; b) la activación reentrante detectada es poco frecuente e inestable, y c) existe una relación lineal entre la duración de los ciclos definidos por este tipo de activación y la longitud máxima de la zona central de la reentrada.
Fig. 4. Mapas de activación consecutivos obtenidos durante la fibrilación ventricular (FV) en los que se objetiva activación reentrante alrededor de la zona central representada por la mayor densidad de las isócronas. Se observa que la onda de excitación circula describiendo un giro antihorario y que la localización de la zona central varía ligeramente en el segundo ciclo, representado en la parte inferior. Las isócronas se han construido a intervalos de 5 ms.
Fig. 5. Registros obtenidos con los electrodos seleccionados a lo largo de la trayectoria del frente de activación (A hasta I) que ponen de manifiesto la activación reentrante durante los dos ciclos que se observan en los mapas de la figura 4. Se indican los tiempos de activación local identificados en cada uno de los electrogramas.
Bibliografía
[1]
On the multiple wavelet hypothesis of atrial fibrillation. Arch Int Pharmacodyn Ther 1962; 140: 183-188.
[2]
Aditions to the wavelet hypothesis of cardiac fibrillation. J Cardiovasc Electrophysiol 1994; 5: 553-559.
[3]
Electrophysiologic mechanisms of perpetuation of atrial fibrillation. Am J Cardiol 1996; 77: A10-A23.
[4]
Pharmacological analysis of established ventricular fibrillation. Br J Pharmacol 1990; 100: 530-534.
[5]
Effects of blockade of fast and slow inward current channels on ventricular fibrillation in the pig heart. Heart 1996; 76: 513-519.
[6]
Modifications in the evolution of the dominant frequency in ventricular fibrillation induced by amiodarone, diltiazem, and flecainide. J Electrocardiol 1996; 29: 319-326.
[7]
Quantification of the modifications in the dominant frequency of ventricular fibrillation under conditions of ischemia and reperfusion: an experimental study. Pacing Clin Electrophysiol 1998; 21: 1716-1723.
[8]
Reentrant wave fronts in Wiggers'stage II ventricular fibrillation. Characteristics and mechanisms of termination and spontaneous regeneration. Circ Res 1996; 78: 660-675.
[9]
The mechanism of termination of reentrant activity in ventricular fibrillation. Circ Res 1994; 74: 495-506.
[10]
Incidence, evolution, and spatial distribuition of functional reentry during ventricular fibrillation in pigs. Circ Res 1999; 84: 945-954.
[11]
Mechanisms of cardiac fibrillation. Science 1995; 270: 1222-1223.
[12]
Effects of procainamide on wave-front dynamics during ventricular fibrillation in open-chest dogs. Circulation 1998; 97: 1828-1836.
[13]
Spatial and temporal organization during cardiac fibrillation. Nature 1998; 392: 75-78.
[14]
Alteration of ventricular fibrillation by flecainide, verapamil and sotalol. An experimental study. Circulation 2000; 101: 1606-1615.
[15]
Circus movement in rabbit atrial muscle as a mechanism of tachycardia. Circ Res 1973; 33: 54-62.
[16]
Circus movement in rabbit atrial muscle as a mechanism of tachycardia. III. The «leading circle» concept: A new model of circus movement in cardiac tissue without the involvement of an anatomical obstacle. Circ Res 1977; 41: 9-18.
[17]
Experimental evaluation of Moe's multiple wavelet hypothesis of atrial fibrillation. En: Zipes DP, Jalife J, editores. Cardiac electrophysiology and arrhythmias. Nueva York: Grune & Stratton, 1985; 265-275.
[18]
Stationary and drifting spiral waves of excitation in isolated cardiac muscle. Nature 1992; 355: 349-351.
[19]
Spiral waves of excitation underlie reentrant activity in isolated cardiac muscle. Circ Res 1993; 72: 631-650.
[20]
Wave-front curvature as a cause of slow conduction and block in isolated cardiac muscle. Circ Res 1994; 75: 1014-1028.
[21]
Spatiotemporal evolution of ventricular fibrillation. Nature 1998; 392: 78-82.
[22]
Scroll breakup in a three-dimensional excitable medium. Physiol Rev 1996; 53: 1740-1743.
[23]
Chaos and the transition to ventricular fibrillation. A new approach to antiarrhythmic drug evaluation. Circulation 1999; 99: 2819-2826.
[24]
Electrical restitution and spatiotemporal organization during ventricular fibrillation. Circ Res 1999; 84: 955-963.
[25]
Spatiotemporal heterogeneity in the induction of ventricular fibrillation by rapid pacing. Importance of cardiac restitution properties. Circ Res 1999; 84: 1318-1331.
[26]
Influences of anisotropic tissue structure on reentrant circuits in the epicardial border zone of subacute canine infarcts. Circ Res 1988; 63: 182-206.
[27]
Double-wave reentry as a mechanism of acceleration of ventricular tachycardia. Circulation 1990; 81: 1633-1643.
[28]
Characteristics of ischemic and peri-ischemic regions during ventricular fibrillation in the canine heart. J Cardiovasc Electrophysiol 1999; 10: 1090-1100.
[29]
What exactly are optically recorded «Action potentials»? J Cardiovasc Electrophysiol 1999; 10: 1463-1465.
[30]
Evidence of three-dimensional scroll waves with ribbon-shaped filament as a mechanism of ventricular tachycardia in the isolated rabbit heart. J Cardiovasc Electrophysiol 1999; 10: 1452-1462.
[31]
Optical transmembrane potential measurements during defibrillation-strength shocks in perfused rabbit hearts. Circ Res 1995; 77: 593-602.
[32]
Reentrant and nonreentrant mechanisms contribute to arrhythmogenesis during early myocardial ischemia: Results using three-dimensional mapping. Circ Res 1987; 61: 352-371.
[33]
Comparison of activation during ventricular fibrillation and following unsuccessful defibrillation shocks in open-chest dogs. Circ Res 1990; 66: 1544-1560.
[34]
Incomplete reentry and epicardial breakthrough patterns during atrial fibrillation in the sheep heart. Circulation 1996; 94: 2649-2661.
[35]
High-density mapping of electrically induced atrial fibrillation in humans. Circulation 1994; 89: 1665-1680.
[36]
Regional entrainment of atrial fibrillation studied by high-resolution mapping in open-chest dogs. Circulation 1993; 88: 736-749.
[37]
Patrones de activación durante la fibrilación auricular en un modelo experimental. Rev Esp Cardiol 1999; 52: 327-338.
[38]
Mechanism of acceleration of functional reentry in the ventricle. Effects of ATP-sensitive potassium channel opener. Circulation 1999; 99: 704-712.
[39]
Cardiac electrical restitution properties and stability of reentrant spiral waves: a simulation study. Am J Physiol 1999; 276: H269-H283.
[40]
Muerte súbita (III). Causas de muerte súbita. Problemas a la hora de establecer y clasificar los tipos de muerte. Rev Esp Cardiol 1999; 52: 1004-1014.
[41]
Pacientes con cardiopatía estructural, síncope de etiología desconocida y arritmias ventriculares inducibles tratados con desfibrilador implantable. Rev Esp Cardiol 1998; 51: 566-571.
[42]
Incidencia y significado de los potenciales tardíos en pacientes con muerte súbita abortada. Rev Esp Cardiol 1994; 47: 157-164.
[43]
Implante pectoral de desfibrilador automático por cardiólogos en un laboratorio de electrofisiología. Rev Esp Cardiol 1994; 47: 706-709.
[44]
Registro nacional de desfibriladores automáticos implantables en 1996. Rev Esp Cardiol 1998; 51: 349-355.