Entre las complicaciones perivalvulares de la endocarditis infecciosa (EI), están los abscesos, los seudoaneurismas y las fístulas. Es obligado el tratamiento quirúrgico de estas para evitar la progresión de la insuficiencia cardiaca debida a daño estructural valvular irreversible. A pesar de la alta tasa de cirugía en estos pacientes (87%), la mortalidad hospitalaria continua siendo muy alta, en torno al 41%1,2.
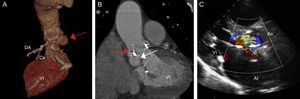
Se presenta el caso de un varón de 86 años, con antecedente de sustitución valvular aórtica por prótesis biológica (C-E Perimount Magna n.o 23) 7 años antes, que ingresó por EI sobre dicha prótesis y absceso en la zona posterior del anillo aórtico. Se propuso tratamiento quirúrgico en sesión médico-quirúrgica, pero se rechazó por el alto riesgo quirúrgico (EuroSCORE II = 25,47; STS = 27,70). Se dio el alta al paciente tras completar adecuadamente el tratamiento antibiótico, pero evolucionó con insuficiencia cardiaca en clase funcional IV de la New York Heart Association (NYHA). Se realizaron varias pruebas de imagen, que confirmaron la cavitación y la fistulización del absceso que ocasionaba insuficiencia aórtica grave con dilatación y deterioro progresivo de la función sistólica del ventrículo izquierdo (figura 1A–C). Se extendía desde el velo no coronariano, rodeando el anillo aórtico protésico, hasta el velo coronariano izquierdo cerca de la salida de la coronaria izquierda (figura 1A y B). En la tomografía computarizada (TC), se evidenciaban varios trayectos fistulosos: uno de ellos comunicaba con la aorta ascendente y otro ponía en contacto la cavidad con el tracto de salida del ventrículo izquierdo (TSVI) (figura 1A y B).
A: reconstrucción volume rendering de tomografía computarizada; la flecha roja señala la fístula originándose en la valva no coronariana y extendiéndose por la parte posterior del anillo aórtico hacia la valva coronaria izquierda. B: tomografía computarizada, plano coronal; la fecha roja señala la comunicación con la aorta ascendente; la fecha blanca señala la comunicación con el tracto de salida del ventrículo izquierdo. C: ecocardiograma transtorácico, eje paraesternal largo, en el que se evidencia chorro de regurgitación que ocupa todo el tracto de salida del ventrículo izquierdo y ocasiona insuficiencia aórtica grave. AI: aurícula izquierda; Ao: aorta; Cx: arteria circunfleja; DA: arteria descendente anterior; VI: ventrículo izquierdo. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
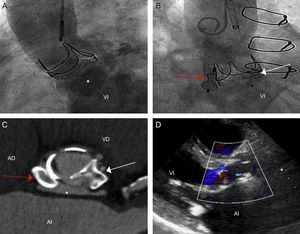
Tras valorarlo en sesión, y considerando los potenciales riesgos de nueva infección sobre el dispositivo, se decidió realizar cierre percutáneo 3 meses después de completar el tratamiento antibiótico, que el paciente aceptó. Se realizó una aortografía, que mostraba la cavidad y la comunicación fistulosa de esta con el TSVI que ocasionaba insuficiencia aórtica grave (figura 2A). Se planteó una estrategia de exclusión total cerrando las puertas de entrada y salida para prevenir una potencial rotura del trayecto fistuloso en caso de que permaneciera abierto al ventrículo. A continuación, utilizando un catéter Amplatz-Left 5 Fr y una guía hidrófila recta, se cruzó a través del trayecto fistuloso que comunicaba la aorta ascendente y se accedió al ventrículo izquierdo. Posteriormente, esta guía se intercambió por una de alto soporte y se desplegó un dispositivo PDA 008 (Amplatzer Duct Occluder, St. Jude Medical) en el trayecto fistuloso hacia el TSVI dejando el disco de retención en el ventrículo izquierdo. A continuación, se desplegó un dispositivo AVP III 14 × 5 mm (Amplatzer Vascular Plug III, St. Jude Medical) en el trayecto fistuloso hacia la aorta ascendente. Tras el despliegue de ambos dispositivos, se observó, tanto en la ecocardiografía transesofágica intraprocedimiento como en la aortografía de control, una significativa disminución de la regurgitación aórtica (figura 2B).
A: aortografía en la que se observa opacificación de la fístula tras la inyección de contraste (asterisco) y del ventrículo izquierdo como consecuencia de insuficiencia aórtica grave. B: imagen tras implante de los dispositivos; la flecha roja señala el dispositivo implantado en la puerta de entrada (comunicación hacia aorta ascendente), la flecha blanca indica el dispositivo implantado en la puerta de salida (comunicación a tracto de salida del ventrículo izquierdo). C: tomografía computarizada, plano paraaxial de los dispositivos; el asterisco indica la fístula, muy reducida. D: ecocardiograma transtorácico, eje paraesternal largo, en el que se evidencia insuficiencia aórtica leve. AD: aurícula derecha; AI: aurícula izquierda; VD: ventrículo derecho; VI: ventrículo izquierdo. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
El paciente evolucionó de manera satisfactoria y a los 3 meses de la intervención se encontraba asintomático. En una TC de control se observaba una disminución de la cavidad excluida totalmente mediante los 2 dispositivos de cierre (figura 2C). Y en el ecocardiograma de control se evidenciaba la reducción de la insuficiencia aórtica, que era de grado leve (figura 2D), con normalización del diámetro, los volúmenes y la función sistólica del ventrículo izquierdo.
Los seudoaneurismas y las fístulas posendocartidis son entidades infrecuentes, solo en el 1,6% de los pacientes se desarrollan fístulas3. El mal pronóstico asociado a estas complicaciones es consecuencia del gran deterioro valvular que ocasionan; en este caso producía insuficiencia aórtica grave, que evolucionó rápidamente con dilatación y disfunción ventricular. La cirugía es la primera opción en el tratamiento de estas complicaciones pero, dado el alto riesgo quirúrgico que en ocasiones está ligado a estos pacientes, la opción percutánea debe tenerse en cuenta de manera individualizada.
Aunque ya se han descrito recientemente algunos casos de cierre percutáneo de fístulas y seudoaneurismas de la raíz aórtica en dicho contexto4,5, la realización de técnicas de imagen como la TC junto con el tratamiento con distintos dispositivos, como lo mostrado en el presente artículo, determinan el éxito de estos procedimientos. Este caso refleja la factibilidad y la seguridad del abordaje percutáneo de las complicaciones perivalvulares tras endocarditis infecciosa.
CONFLICTO DE INTERESESI. Cruz-González es proctor para St. Jude Medical.