La ablación de vía lenta nodular es el tratamiento de elección de la taquicardia por reentrada nodular. No hay descritas variables demográficas, anatómicas ni electrofisiológicas que predigan una localización exacta de la vía lenta dentro del nódulo auriculoventricular ni su proximidad a la vía rápida. El objetivo es estudiar estas variables.
MétodosSe incluyó prospectivamente a 54 pacientes (17 varones; media de edad, 55±16 años) sometidos a ablación efectiva de vía lenta. Se midieron los periodos refractarios de ambas vías y su tiempo de conducción diferencial. Se calculó las distancias desde la región hisiana (correspondiente a la localización de la vía rápida) hasta el ostium del seno coronario (con lo que se obtuvo una estimación de la longitud anteroposterior del triángulo de Koch) y también hasta la zona de la vía lenta.
ResultadosEl tiempo de conducción diferencial (139±98 ms) no se correlacionó con las distancias His-seno coronario (19±6 mm; p=0,6) ni His-vía lenta (14±4 mm; p=0,4). A mayor distancia His-seno coronario, se estableció mayor distancia His-vía lenta (r=0,652; p<0,01) y se confirmó la correlación anatómica entre las dimensiones del triángulo y la separación entre ambas vías. En los pacientes mayores de 70 años, se observaron menor tamaño del triángulo y menor distancia entre ambas vías (p<0,001).
ConclusionesUna mayor dimensión anteroposterior del triángulo de Koch se asocia a una localización de vía lenta más alejada de la rápida, encontrándose ambas más próximas entre sí (mayor riesgo de bloqueo auriculoventricular) en los pacientes de edad avanzada.
Palabras clave
La taquicardia por reentrada nodular (TRN) es la forma más común de presentación de taquicardia paroxística supraventricular1. El mecanismo electrofisiológico que permite el inicio y el mantenimiento de TRN es la reentrada entre dos vías con características de conducción diferente, ambas incluidas en la estructura del nódulo auriculoventricular (NAV)1,2. La vía lenta (VL) se identifica como una extensión inferior y posterior del NAV, cercana al ostium del seno coronario (OSC), el cual a su vez es anatómicamente el vértice inferior del triángulo de Koch2–4. Es importante mencionar que una clara diferenciación histológica entre dos vías en el NAV (vía lenta y vía rápida) aún permanece en controversia2,5–8. La impredecible separación anatómica entre la VL y la vía rápida (VR) condiciona de manera crítica el resultado de la ablación de la VL (el tratamiento de elección en estos pacientes), dado el posible riesgo de bloqueo auriculoventricular (AV) por afectación de la VR9,10.
Trabajos previos han sugerido que la disposición anatómica de la VL podría correlacionarse con sus propiedades electrofisiológicas11,12. Dichas propiedades incluyen la duración del intervalo A(H)-A(Md), que expresaría la distancia «eléctrica» entre ambas vías e indicaría el riesgo de bloqueo AV durante la ablación de la VL13. Sin embargo, no se ha demostrado una correlación lineal entre tiempos de conducción y periodos refractarios de VR y VL y su disposición anatómica relativa. Tampoco hay datos respecto a la influencia de la edad de instauración de la TRN en la localización anatómica de la VL, su proximidad a la VR y, por lo tanto, en el riesgo de bloqueo AV durante ablación.
Finalmente, aún no se ha investigado la influencia de más de dos patrones de conducción en el NAV (demostrado por la presencia de un segundo salto del intervalo aurícula-His [AH], hasta en un 40% de los casos de TRN) en el resultado de la ablación de la VL14.
El objetivo de este estudio es comprobar si existe correlación entre características electrofisiológicas de la VL y la VR, el tamaño del triángulo de Koch y la localización de la VL en pacientes con TRN. Se analiza también la influencia del sexo y la edad en la localización de la VL.
MÉTODOSPoblación en estudioSe incluyó prospectivamente a 56 pacientes sometidos a estudio electrofisiológico y ablación efectiva de TRN. Todos los pacientes dieron su consentimiento firmado de acuerdo con las guías institucionales. Se excluyeron del análisis los casos con otros mecanismos de taquicardia supraventricular y/o aquellos en que no se consiguió la ablación efectiva, con el objetivo de determinar una localización anatómica exacta de la VL en todos los casos.
Estudio electrofisiológicoEl estudio se realizó por vía venosa femoral derecha, avanzándose dos electrocatéteres (tetrapolares, 6 Fr con espaciado entre electrodos de 5mm, Bard Inc.; Murray Hill, New Jersey, Estados Unidos) a posiciones de aurícula derecha alta e His/ventrículo derecho.
Se registraron y grabaron durante todo el procedimiento electrogramas bipolares intracardiacos (filtro entre 30 y 500Hz) utilizando el sistema Lab Pro (Bard Inc.), los cuales se analizaron tras el procedimiento. Se utilizaron calibradores electrónicos con una resolución de 2 ms utilizando una velocidad de pantalla de 100 mm/s para todas las mediciones. El diagnóstico de TRN se confirmó utilizando los criterios electrofisiológicos previamente descritos, inluidos los de encarrilamiento desde la zona parahisiana sin captura del haz de His1,15.
Medidas electrofisiológicasLas medidas realizadas incluyeron los periodos refractarios de ambas vías nodulares, la longitud de ciclo sinusal, el ciclo de la taquicardia, los intervalos AH e His-ventrículo y el punto de Wenckebach anterógrado, antes y después de la ablación. Se estableció fisiología de doble vía nodular (presencia de VL nodular) al observarse un incremento > 50 ms en el intervalo AH (A2H2) coincidiendo con un decremento de 10 ms en el intervalo de acoplamiento durante estimulación auricular programada (salto del AH). Se midió el tiempo de conducción diferencial entre VL y VR como la diferencia entre el intervalo A2H2 en el primer latido tras salto del AH (conducción inicial por la VL) y el intervalo A2H2 máximo antes de alcanzar el periodo refractario efectivo de la VR (como aproximación del tiempo de conducción más largo de la VR antes del salto del AH). En contraposición a comunicaciones previas, se especula que este tiempo de conducción diferencial expresaría mejor las características diferenciales de conducción de ambas vías, a diferencia de las medidas individuales del intervalo AH durante conducción por VR o VL11,12. Un segundo salto en el intervalo AH se expresó como A3H3.
Medidas anatómicas del triángulo de KochLas medidas anatómicas se realizaron utilizando calibradores fluoroscópicos con la referencia de 5 mm en la distancia entre electrodos de uno de los electrocatéteres tetrapolares (el catéter de zona hisiana en la proyección oblicua anterior derecha y el catéter de aurícula derecha en la proyección oblicua anterior izquierda). Para evitar errores en las mediciones relacionados con una orientación cardiaca más vertical u horizontal, ambas proyecciones se ajustaron hasta obtener una medida exacta entre electrodos de 5 mm en el catéter de referencia16–19.
Antes de iniciar el procedimiento de ablación, el catéter de mapeo/ablación se introdujo en el seno coronario de forma que los electrodos proximales quedaran a nivel del OSC. Se midió entonces la distancia (en milímetros) entre el OSC y la zona proximal de His en la proyección oblicua anterior izquierda (en la cual se observa mejor desplegado el catéter de seno coronario, cuyo ostium configura el límite inferior del triángulo de Koch). Se estimó, por lo tanto, la distancia His-OSC como una aproximación a la longitud vertical del triángulo de Koch. Dividiendo esta longitud en tres tercios, se clasificó cualitativamente la localización de la VL en posición alta, media o baja. Tras la ablación, se determinó la distancia entre VR y VL en proyección oblicua anterior derecha midiendo la distancia entre el electrodo distal del catéter de mapeo/ablación (zona de ablación efectiva de VL) y la zona de registro proximal del His.
Ablación de vía lenta nodularLa energía de radiofrecuencia emitida fue 50 W (55°C) en la zona de la VL, utilizando un catéter de ablación de punta sólida de 4 mm (distancia entre electrodos, 5 mm; Bard Inc.). La emisión de radiofrecuencia se interrumpió al observar disociación AV durante el ritmo de la unión AV (nodular) o después de un periodo de 30-60 s de aplicación con suficiente ritmo nodular18. Se consideró éxito del procedimiento la no inducibilidad de TRN mediante estimulación auricular programada durante un periodo de observación de 20 min (en los cuales se administró isoproterenol en perfusión intravenosa), además de la ausencia de ≥ 2 latidos por reentrada nodular. El sitio final de ablación efectiva de la VL se consideró el último sitio de aplicación de radiofrecuencia después del cual no se consiguió reinducir TRN.
Influencia de la edad y el sexo en la fisiopatología de la taquicardia por reentrada nodularEn caso de encontrarse una correlación significativa entre la disposición anatómica de la VL y las características demográficas, se podría deducir una diferente fisiopatología de la reentrada nodular en función de la edad o el sexo en pacientes con TRN20. Con el objetivo de confirmar este hipotético hallazgo, se consideró necesario complementar este análisis con el estudio retrospectivo de una cohorte separada de 325 pacientes consecutivos sometidos a ablación exitosa de la VL en el hospital, dividiendo esta población en grupos de edad y/o sexo diferentes.
Análisis estadísticoLas variables categóricas se expresaron como frecuencia y porcentaje y las variables cuantitativas, como media±desviación estándar o mediana [intervalo intercuartílico]. La posible asociación entre una variable cuantitativa y una categórica se analizó con la prueba de la t de Student (para medidas independientes en caso de dos categorías) o con la prueba de análisis de la varianza y correción de Tukey (para comparaciones múltiples en el caso de variables de > 2 categorías). La relación entre dos variables cuantitativas se midió con la correlación de Pearson indicando la r y el nivel de significación. En todos los análisis, un valor de p<0,05 se consideró estadísticamente significativo. Se utilizó el paquete estadístico IBM SPSS 19.0 (IBM Corp.; New York, Estados Unidos) para el análisis estadístico.
RESULTADOSPoblación en estudioFinalmente se excluyó del análisis a 2 de los 56 pacientes a causa de ablación sin éxito de la VL. De los restantes 54 pacientes, 17 eran varones, con una media de edad de 55±16 años. Se documentó cardiopatía estructural en 7 pacientes: cardiopatía isquémica en 3 y cardiopatía hipertensiva en los 4 restantes.
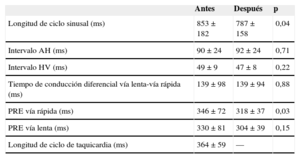
Hallazgos electrofisiológicos y ablaciónNo hubo diferencias significativas antes y después de la ablación con respecto a los parámetros basales de conducción AV ni a las características de conducción de la VR, con excepción de un menor periodo refractario efectivo de la VR después de la ablación (p=0,03) (tabla 1).
Parámetros electrofisiológicos antes y después de la ablación efectiva de la vía lenta nodular
| Antes | Después | p | |
|---|---|---|---|
| Longitud de ciclo sinusal (ms) | 853±182 | 787±158 | 0,04 |
| Intervalo AH (ms) | 90±24 | 92±24 | 0,71 |
| Intervalo HV (ms) | 49±9 | 47±8 | 0,22 |
| Tiempo de conducción diferencial vía lenta-vía rápida (ms) | 139±98 | 139±94 | 0,88 |
| PRE vía rápida (ms) | 346±72 | 318±37 | 0,03 |
| PRE vía lenta (ms) | 330±81 | 304±39 | 0,15 |
| Longitud de ciclo de taquicardia (ms) | 364±59 | — |
AH: aurícula-His; HV: His-ventrículo; PRE: periodo refractario efectivo.
Los datos expresan media ± desviación estándar. Se consideró estadísticamente significativo p < 0,05.
Si bien la taquicardia tendió a ser más lenta (mayor longitud de ciclo) cuanto mayor era el tiempo de conducción diferencial VL-VR, esta diferencia no alcanzó significación estadística en general (p=0,058) ni en ningún grupo de edad.
El tiempo de conducción diferencial VL-VR fue de 139±98 ms, con una variabilidad considerable en los valores absolutos (50-376 ms). Esta alta variabilidad se atribuyó a una amplia gama de tiempos de conducción de la VL.
En 6 pacientes se realizó únicamente una aplicación de radiofrecuencia exitosa; en el resto de los casos, fue necesario realizar > 1 aplicación de radiofrecuencia.
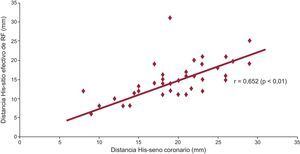
Anatomía del triángulo de Koch y características electrofisiológicas de la vía lentaLa distancia His-OSC resultó de 19±6 mm y la distancia His-VL, 14±4 mm. El tiempo de conducción diferencial VL-VR no se correlacionó con la distancia His-OSC (r=–0,084; p=0,6) ni con la distancia His-VL (r=–0,138; p=0,4). En contraste, el tamaño del triángulo de Koch (es decir, la distancia His-OSC) se correlacionó con una localización más caudal de la VL en la estructura del NAV (distancia His-VL): r=0,652 (p<0,01) (figura 1).
Correlación positiva entre el tamaño del triángulo de Koch (distancia His-ostium de seno coronario) y sitio efectivo de radiofrecuencia (localización de la vía lenta). A mayor distancia His-ostium de seno coronario, se observa una localización más caudal de la vía lenta. RF: radiofrecuencia.
Estos resultados sugieren que, a mayores dimensiones del triángulo de Koch, mayor es la distancia de la VR a la VL, sin influencia en las características de conducción de ambas vías (figura 2).
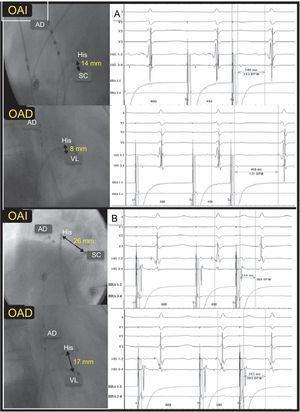
Correlación entre la distancia His-ostium de seno coronario e His-vía lenta sin correlación con el tiempo de conducción diferencial VL-VR. A: distancia corta His-ostium de seno coronario y vía conducción diferencial VL-VR significativa (458 – 246=212 ms). B: distancia larga His-ostium de seno coronario y conducción diferencial VL-VR mínima (312–254=58 ms). AD: aurícula derecha; OAD: proyección oblicua anterior derecha; OAI: proyección oblicua anterior izquierda; OSC: ostium del seno coronario; VL: vía lenta; VR: vía rápida.
En los 18 pacientes (33%) que presentaron un segundo salto del intervalo AH, el incremento A3H3 fue de 103±77 ms. La observación de un segundo salto AH no se asoció a ninguna propiedad particular de conducción de la VR o la VL. Tampoco se asoció a un subgrupo especial de edad o sexo en particular. Las distancias His-OSC e His-VL tampoco resultaron diferentes en presencia de un segundo salto del AH en comparación con los demás pacientes (19±8 frente a 20±8 mm; p=0,4 y 14±4 frente a 15±5 mm; p=0,5).
El número de aplicaciones de radiofrecuencia requerido hasta conseguir ablación exitosa de la VL tampoco difirió cuando se observó segundo salto (9±8 frente a 6±4 pulsos; p=0,3).
Características demográficas y localización de la vía lentaSe estableció una correlación estadística entre edad joven y una mayor distancia His-VL (p<0,001). Los pacientes más jóvenes presentaron mayor tiempo de conducción diferencial VL-VR (a expensas de mayor tiempo de conducción de la VL; r=–0,341; p=0,014), sin diferencias por sexo (p=0,71).
Solo en pacientes jóvenes se halló una muy débil correlación electrofisiológica-anatómica entre un tiempo de conducción más lento de la VL (A2H2 en el primer latido tras salto del AH) y una ubicación más caudal (r=–0,317; p=0,046). Sin embargo, el tiempo de conducción diferencial VL-VR no resultó útil para establecer ninguna correlación entre características electrofisiológicas de ambas vías nodulares y la anatomía del triángulo de Koch en ningún grupo de edad.
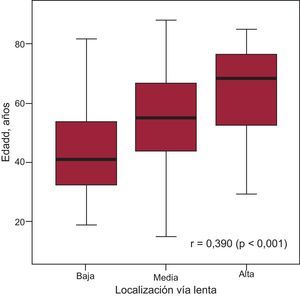
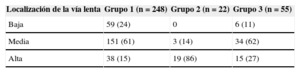
En la cohorte retrospectiva de 325 pacientes (65% mujeres; mediana de edad, 54 [41-69] años), el sitio exitoso de ablación de VL se designó cualitativamente como alta en 72 pacientes, media en 188 y baja en 65. Se estableció presencia de correlación lineal entre ubicación de la VL y envejecimiento, con una localización alta de VL asociada a edad avanzada (r=0,390; p<0,001) (figura 3), especialmente en pacientes > 70 años con TRN de inicio reciente (< 12 meses; p<0,001) (tabla 2). No hubo diferencias respecto a sexo entre los diferentes grupos de localización alta, media o baja de la VL.
La localización de la vía lenta (baja, media o alta) respecto a la vía rápida se relaciona con la edad. Análisis en una cohorte retrospectiva de 325 pacientes
| Localización de la vía lenta | Grupo 1 (n=248) | Grupo 2 (n=22) | Grupo 3 (n=55) |
|---|---|---|---|
| Baja | 59 (24) | 0 | 6 (11) |
| Media | 151 (61) | 3 (14) | 34 (62) |
| Alta | 38 (15) | 19 (86) | 15 (27) |
Los datos expresan n (%).
Grupo 2 frente a 1 y 3, p<0,001.
Grupo 1, edad < 70 años; grupo 2, edad > 70 años con inicio reciente (< 12 meses) de los paroxismos de taquicardia por reentrada nodular; grupo 3, edad > 70 años con taquicardia por reentrada nodular de inicio distante (> 12 meses).
El presente estudio demuestra que existe una correlación positiva entre el tamaño anatómico del triángulo de Koch (expresado en la distancia His-OSC) y el sitio de ablación efectiva de la VL (distancia His-VL) en pacientes con TRN. Además, la edad joven se asocia a una ubicación más baja (y por lo tanto más segura en cuanto al riesgo de bloqueo AV durante la ablación) de la VL. Sin embargo, el presente estudio confirma la ausencia de una clara correlación electrofisiológica-anatómica entre las propiedades de conducción de VR y VL y las dimensiones del triángulo de Koch o la localización de la VL con respecto a la VR. De acuerdo con esto, las propiedades de conducción de la VL no son predictivas de una disposición anatómica particular de la VL respecto a la VR en el triángulo de Koch y no proporcionan una guía anatómica para el tratamiento de ablación de la VL. Se cree asimismo que el solo hallazgo de una correlación entre velocidad de conducción de la VL y su localización anatómica con respecto a la VR en pacientes jóvenes se debe analizar con cautela. Es importante destacar que no se demostró correlación anatómica-electrofisiológica en este grupo de edad utilizando como variable electrofisiológica la conducción diferencial VL-VR, en opinión de los investigadores de este estudio más demostrativa de las características electrofisiológicas diferenciales entre ambas vías.
Se cree que el hallazgo de una fuerte correlación entre edad avanzada de inicio de TRN y localización alta de la VL (p<0,001) podría indicar una fisiopatología diferente de la TRN en función de la edad, que afectaría especialmente a la ubicación de la VL y su proximidad a la VR. Por último, este trabajo mostró que el hallazgo de un segundo salto del AH no se acompaña de ninguna implicación clínica sustancial para la ablación de TRN.
Factores que influyen en la localización de la vía lenta nodular: ¿diferente fisiopatología de taquicardia por reentrada nodular según la edad?A diferencia del presente estudio, en una serie de 55 pacientes con TRN, Manolis et al21 no establecieron correlación alguna entre edad y una ubicación determinada de la VL. En una descripción de 16 corazones procedentes de autopsia, Sanchez-Quintana et al6 apuntaron la presencia de al menos 2 disposiciones histológicas y anatómicas de la VL: a) una localización más posterior e inferior, en la que la VL emerge del tejido auricular no especializado cuando las fibras musculares se acercan a esta región particular del NAV, y b) una localización media o alta, más cefálica al OSC (y por lo tanto potencialmente más cerca de la VR). En este último escenario, la orientación de las fibras musculares y el tejido conectivo circundante (microfibrosis) contribuirían a la instauración de ≥ 2 patrones de conducción del NAV distintos, como resultado de un grado variable de anisotropía no uniforme, lo que permitiría la reentrada. De esta forma, la TRN puede ocurrir a pesar de la incapacidad para identificar dos vías histológicamente diferenciables dentro del NAV. El fondo histológico de microfibrosis postinflamatoria y/o degenerativa limitada a la porción anterior del NAV (más superponible a este último patrón histológico) se ha vinculado particularmente a una población de TRN de edad avanzada22. La observación de una distancia His-VL reducida en pacientes > 70 años con TRN de inicio reciente concuerda con este hallazgo, ya que en estas circunstancias ambas vías estarían muy próximas entre sí, situadas en la porción anterior del NAV. En contraposición, un aumento en la anchura del OSC (que conduce a un aumento de las distancias His-OSC y His-VL) se ha relacionado con una más aparente (histológica) y pronunciada extensión posteroinferior del NAV20,22,23. En el presente análisis se ha vinculado este diferente sustrato anatómico e histológico de la disposición de la VL con respecto a la VR con una población más joven. En opinión de los investigadores de este estudio, estos hallazgos concuerdan con una fisiopatología diferente de TRN en función de la edad, probablemente con patrones histopatológicos distintos. Sin embargo, al carecer de datos histológicos, el estudio no permite confirmar este supuesto.
Características electrofisiológicas de la vía lenta nodular y anatomía del triángulo de KochEn una serie publicada por Geller et al11, el intervalo AH durante conducción por VL se correlacionó con la distancia entre el sitio de ablación de la VL y el haz de His, pero no con el tamaño total del triángulo de Koch. En este trabajo, no se encontró correlación anatómica-electrofisiológica de la proximidad de la VL a la VR y sus propiedades de conducción utilizando el tiempo de conducción diferencial VL-VR como referencia. Se consideró esta variable como una función electrofisiológica más fiable, ya que tiene en cuenta las propiedades de conducción de la VL en contraposición a las propiedades de la VR. El valor absoluto del intervalo AH durante conducción por la VL es altamente variable y está influido por múltiples factores, principalmente la variabilidad entre pacientes e intraprocedimiento del tono vagal. Este puede producir cambios drásticos en el tiempo de conducción a través de la VL (expresado en el referido intervalo AH) y poner en peligro la validez de la comparación entre características anatómicas y electrofisiológicas de la VL. En este estudio se estimó que la confrontación de propiedades de conducción de VR con las de la VL en un mismo momento durante el estudio electrofisiológico sería más fiable a la hora de establecer una posible (y a posteriori no demostrada) correlación anatómica-electrofisiológica.
Anatomía del triángulo de KochLas dimensiones del triángulo de Koch, utilizando la medida de la distancia His-OSC, resultaron algo más cortas en la población estudiada que en otras series7,17. McGuire et al19, sin embargo, comunicaron resultados similares mediante el estudio de muestras post mórtem y posquirúrgicas, que probablemente representan con mayor precisión las verdaderas dimensiones anatómicas del triángulo. Este hecho parece validar la utilización de la distancia fluoroscópica His-OSC como medida de la longitud cefalocaudal del triángulo de Koch. La distancia de His-VL (14±4mm en este trabajo) fue similar a la comunicada por otras series (13-16mm)5,7,9.
Estudios anteriores han señalado una alta variabilidad en las dimensiones del triángulo de Koch, sin una correlación clara entre la longitud del triángulo y la ubicación de la VL12,17,19. En contraste, se ha demostrado que existe correlación entre el tamaño del triángulo de Koch y una ubicación determinada de la VL. Esta discrepancia puede explicarse por la concurrencia de varias disposiciones anatómicas e histológicas de la VL entre las diferentes poblaciones de estudio. Como se mencionó anteriormente, se ha vinculado estos diferentes sustratos fisiopatológicos de TRN con la edad. Por lo tanto, se cree que el análisis de una población más homogénea respecto a los grupos de edad corroboraría una correlación positiva entre las distancias His-OSC e His-VL.
LimitacionesEl triángulo de Koch es una estructura tridimensional. Las mediciones bidimensionales del triángulo de Koch realizadas en este estudio no representan con absoluta precisión las verdaderas dimensiones anatómicas de esta estructura. Además, estos valores pueden cambiar durante las distintas fases del ciclo cardiaco y/o los movimientos respiratorios. Sin embargo, los resultados similares obtenidos por observación directa anatómica del triángulo de Koch parecen validar la metodología empleada19. Se debe mencionar también que la posición del catéter de ablación en el seno coronario se determinó con criterios estándares: a) anatómicos, utilizando ambas proyecciones oblicuas; b) interpretación de electrogramas intracavitarios, y c) objetivando un incremento en la impedancia. No se utilizaron técnicas de venografía.
En esta serie no se registró ningún episodio de bloqueo AV persistente tras ablación, por lo que el presente estudio no puede servir para confirmar una correlación entre localización más alta de la VL y mayor riesgo de bloqueo AV. Sin embargo, dadas las correlaciones anatómicas observadas y asociadas a determinados grupos de edad, este análisis sí debe ayudar en la estrategia del procedimiento de ablación para la elección del catéter de ablación más adecuado en cada caso y para adelantar un riesgo a priori de bloqueo AV más aumentado en pacientes de edad avanzada.
La emisión previa de radiofrecuencia en zonas más bajas y/o más altas del triángulo de Koch respecto a la zona de aplicación efectiva podría ser origen de errores en la determinación de la localización exacta de la VL, debido a un efecto aditivo. En opinión de los investigadores de este estudio, la reinducción de taquicardia tras cada aplicación hasta la aplicación efectiva minimizó esta posible limitación.
Las mediciones no se realizaron durante bloqueo autonómico. Por lo tanto, la influencia del tono autonómico en las mediciones obtenidas no se puede descartar por completo, como se discutió anteriormente24,25. No se excluyó del análisis a los pacientes que requirieron infusión de isoproterenol para la inducción de la taquicardia, a pesar de que su utilización puede influir en los tiempos de conducción de ambas vías12. En opinión de los investigadores del estudio, el uso de un valor relativo (tiempo de conducción diferencial VL-VR) en comparación con el valor absoluto del salto del AH minimiza este inconveniente.
Finalmente, en el estudio retrospectivo, se fijó arbitrariamente el límite de 70 años considerando la hipótesis de que a edades avanzadas el mecanismo de la TRN podría deberse a degeneración del tejido en la estructura del NAV y no a la presencia de dos vías nodulares histológica y/o anatómicamente diferenciadas, especialmente en pacientes con inicio reciente (< 12 meses) de la taquiarritmia; lógicamente, esto es simplemente especulativo y se debería confirmar con otro tipo de estudio.
CONCLUSIONESUna localización más caudal, y por lo tanto más segura, del sitio de ablación efectiva de la VL se asocia con mayor dimensión longitudinal del triángulo de Koch y puede anticiparse en pacientes de edad < 70 años. No se ha demostrado la existencia de correlación entre las características anatómicas y electrofisiológicas de ambas vías nodulares. Estos resultados deben considerarse generadores de hipótesis y, teniendo en cuenta sus importantes implicaciones estratégicas para la ablación de la VL nodular, deberían confirmarse en trabajos posteriores.
CONFLICTO DE INTERESESNinguno.