Hay un amplio reconocimiento de la importancia de una dieta saludable para la promoción de la salud cardiovascular. El objetivo de este estudio es identificar los principales patrones alimentarios en la población española y determinar su relación con los perfiles lipídicos plasmáticos.
MétodosSe llevó a cabo un análisis transversal de los datos obtenidos en 1.290 participantes de la cohorte del Aragon Workers Health Study. Se utilizaron protocolos estandarizados para la obtención de datos clínicos y bioquímicos. Se evaluó la dieta a través de un cuestionario de frecuencia de alimentación, cuantificando el consumo habitual durante los 12 meses previos. Se identificaron los principales patrones de dieta mediante un análisis factorial. Se evaluó la asociación entre la adherencia a los patrones de dieta y las concentraciones plasmáticas de lípidos mediante regresión lineal y logística.
ResultadosSe identificaron dos patrones de dieta: un patrón de dieta mediterránea, rica en verduras, frutas, pescado, carnes blancas, frutos secos y aceite de oliva, y un patrón de dieta occidental, rico en carnes rojas, comida rápida, productos lácteos y cereales. En comparación con los participantes que se encontraban en el quintil más bajo de adherencia al patrón de dieta occidental, los que se encontraban en el quintil más alto presentaron cifras de colesterol unido a lipoproteínas de alta densidad 4,6mg/dl menores (p < 0,001) y de apolipoproteína A1, 8mg/dl menores (p = 0,005) y mayor riesgo de mostrar una disminución del colesterol unido a lipoproteínas de alta densidad (odds ratio = 3,19; intervalo de confianza del 95%, 1,36-7,5; p de tendencia = 0,03). Los participantes con adherencia al patrón de dieta mediterránea presentaron cifras de colesterol unido a lipoproteínas de alta densidad 3,3mg/dl mayores (p < 0,001) y un cociente de triglicéridos/colesterol unido a lipoproteínas de alta densidad 0,43 veces inferior (p = 0,043).
ConclusionesLa adherencia al patrón de dieta mediterránea se asocia a una mejora del perfil lipídico en comparación con lo que se observa con un patrón de dieta occidental, que se asoció a menor probabilidad de que los valores de colesterol unido a lipoproteínas de alta densidad fueran óptimos en esta población.
Palabras clave
Es un hecho aceptado que la enfermedad cardiovascular es un importante problema de salud pública1. Dada la influencia directa de los hábitos alimentarios poco saludables en su aparición y su progresión2, la prevención mediante el fomento de una forma de alimentación sana a todos los niveles de la población es una prioridad de salud pública3.
La relación entre dieta y enfermedad puede abordarse desde diferentes perspectivas, desde el enfoque centrado en un solo nutriente hasta la evaluación de la calidad general de la dieta4. Este último planteamiento tiene en cuenta las interacciones probables entre los componentes de la dieta y otros hábitos de estilo de vida, y puede ser más apropiado para identificar factores conductuales que determinen la enfermedad cardiovascular en vez de explorar mecanismos etiológicos inducidos por nutrientes concretos. La evidencia existente sobre cómo la calidad general de la dieta influye en la salud se traslada también con mayor facilidad a un público más amplio y a los responsables de la toma de decisiones políticas, con lo que ayuda a sustentar estrategias de salud pública efectivas. A este respecto, es bien sabido que el patrón de dieta mediterránea (PDM) tradicional, rico en alimentos de origen vegetal, carnes blancas, pescado y aceite de oliva, y pobre en carnes rojas y alimentos elaborados, tiene efectos cardioprotectores5,6 y en todo el mundo se recomienda seguirlo. Además, el PDM tradicional se ha propuesto también como explicación plausible de la paradoja mediterránea, es decir, la alta prevalencia de factores de riesgo de enfermedad cardiovascular junto con una incidencia baja de eventos cardiacos7, y como prioridad para la prevención primaria y secundaria de la enfermedad cardiovascular8.
Aunque la región mediterránea ha experimentado recientemente una transición hacia un patrón de dieta más occidentalizado y la dieta utilizada muestra diferencias significativas entre los distintos países de la zona según cuál sea su contexto agrícola y cultural, la evidencia existente indica que el PDM se asocia a una mejora del perfil lipídico del plasma, que incluye un aumento de la concentración de colesterol unido a lipoproteínas de alta densidad (cHDL) y una disminución de lipoproteínas de baja densidad, triglicéridos (TG) y colesterol total9–11. Por otra parte, se ha estudiado también el efecto del PDM en la concentración de apolipoproteína A1 (ApoA1)12,13. Algunos estudios han descrito un aumento de las concentraciones de ApoA1 con la dieta mediterránea14, así como reducciones de la tasa de catabolismo de la ApoA115.
Teniendo en cuenta estas observaciones, el objetivo de este estudio es identificar los principales patrones actuales de dieta prevalentes en una población de trabajadores de España, la cohorte del Aragon Workers Health Study, así como investigar su asociación con el perfil de lípidos en plasma como indicador intermedio de los futuros resultados cardiovasculares.
MÉTODOSPoblación en estudioAnteriormente se ha publicado información detallada sobre el diseño del estudio y la metodología utilizada16. De forma resumida, el Aragon Workers Health Study es una cohorte prospectiva que se analiza con el objetivo de investigar los factores que determinan la aparición y la progresión de la aterosclerosis subclínica en una población de mediana edad. La población en estudio está formada por una muestra aleatoria de 5.690 empleados de la planta de fabricación de automóviles de General Motors España situada en Zaragoza (España), que no presentaban enfermedad cardiovascular en la situación basal16. Cada año se selecciona de manera aleatoria a una tercera parte de los participantes en el estudio, de entre 40 y 55 años de edad, para la realización de pruebas de imagen diagnósticas de aterosclerosis subclínica, una exploración clínica y física y una evaluación de la dieta, la conducta y el estilo de vida. El presente estudio transversal se llevó a cabo en una submuestra de 1.593 participantes cuyos datos completos sobre la dieta en la situación basal estaban disponibles. De ellos, se excluyó a 104 participantes con valores extremos de consumo total de energía (< 800 o > 4.200kcal los varones y < 500 o > 3.500kcal las mujeres)17 y 199 de los que faltaban datos. La muestra final disponible para el análisis la formaron 1.290 participantes. El estudio fue aprobado por el CEICA (Comité Ético de Investigación de Aragón), y todos los participantes en el estudio dieron su consentimiento informado por escrito16.
Evaluación de la dietaSe obtuvo información sobre el consumo alimentario habitual durante los 12 meses previos mediante un cuestionario de frecuencia de consumo de alimentos validado (que incluía 136 ítems) aplicado por un dietista especialmente preparado para ello18,19. La frecuencia de consumo variaba entre «nunca o casi nunca» y «más de 6 veces al día». Se calculó el consumo total de energía y el consumo total de los nutrientes de los sujetos mediante una base de datos de nutrientes estandarizada (ENDB)20. Con estos datos, se aplicó un análisis factorial para determinar los principales patrones de dieta prevalentes en la población de estudio. Además, con objeto de validar los resultados del análisis factorial, se calcularon varios índices de calidad de la dieta descritos con anterioridad: AHEI (Alternate Healthy Eating Index)21, aMED (alternate MD Index)22, MEDAS (MD Adherence Screener)23 y el recientemente desarrollado MEDLIFE (MEDiterranean LIFEstyle Index)2. En otras publicaciones se han descrito detalladamente el desarrollo y los sistemas de puntuación de estos índices21–24.
Obtención de muestras de sangre y orinaEn la situación basal, los participantes proporcionaron información sobre su historia clínica, incluida la existencia de cualquier evento clínico y hospitalización el año anterior, indicando la presencia de antecedentes personales o familiares de enfermedad cardiovascular temprana, el uso actual de medicación y si se les había diagnosticado hipertensión, diabetes mellitus o dislipemia. Se determinó la presión arterial en reposo en sedestación mediante esfigmomanómetro oscilométrico automático OMRON M10-IT (OMRON Healthcare Co. Ltd.; Japón). Se obtuvieron tres lecturas y se utilizó el promedio de ellas para el análisis. Se obtuvieron muestras de sangre y orina en la situación basal, que se procesaron y conservaron para un posterior análisis y uso en biobanco. Se determinaron las concentraciones de TG, colesterol total, cHDL y glucosa en suero en ayunas mediante espectrofotometría (Chemical Analyzer ILAB 650, Instrumentation Laboratory). El colesterol unido a lipoproteínas de baja densidad se calculó usando la fórmula de Friedewald. Se consideraron óptimas cifras de cHDL ≥ 40 y ≥ 50mg/dl para varones y mujeres respectivamente25. Se determinaron las concentraciones séricas de ApoA1, B100 y lipoproteína (a) mediante nefelometría cinética (Immunochemistry Analyzer IMMAGE 800, Beckman Coulter) y la insulina sérica en ayunas con un método de quimioluminiscencia inmunoenzimática (Access Immunoassay System, Beckman Coulter). La glucohemoglobina total en sangre se determinó mediante cromatografía de intercambio catiónico de fase inversa y se cuantificó con colorimetría de longitud de onda doble (Analyzer ADAMS A1c HA-810, Arkray Factory). Se utilizó el índice HOMA (Homeostatic Model Assessment) para determinar la resistencia a la insulina usando los datos de glucosa e insulina26.
Evaluación de la actividad físicaLa actividad física en el tiempo libre se evaluó mediante la versión española validada de los cuestionarios de actividad27 del Nurses’ Health Study y el Health Professionals’ Follow-up Study28,29. Se preguntó a los participantes el tiempo medio dedicado por semana a 17 tipos diferentes de actividad física, y los datos obtenidos se multiplicaron por el gasto de energía típico de esas actividades, expresado en unidades de transferencia de equivalentes metabólicos30; a continuación se sumaron los de todas las actividades, con objeto de estimar el nivel total de actividad física realizado por semana.
Evaluación de otras variablesSe efectuaron determinaciones basales de los parámetros antropométricos de peso corporal, estatura y perímetro de cintura siguiendo procedimientos estandarizados31. Se obtuvieron también datos basales sobre características sociodemográficas, nivel de estudios, antecedentes de tabaquismo y ocupación.
Análisis estadísticoLos patrones de dieta principales se determinaron mediante un análisis factorial para obtener la carga del factor para grupos de alimentos predefinidos utilizando la opción de rotación Varimax. Se utilizaron combinaciones de valores eigen, el scree plot y la interpretabilidad para determinar el número de factores conservados. Cada factor tenía un valor eigen > 0,3. Se calcularon las puntuaciones de los factores para cada participante con cada patrón de dieta sumando el consumo de los grupos de alimentos ponderados por sus correspondientes cargas de factor. Con esa puntuación, se clasificó a los participantes en quintiles de adherencia al patrón de dieta específico. Para la descripción de las características basales, las variables discretas se presentan mediante el número y el porcentaje y las variables continuas, con la media ± desviación estándar. Se determinó el valor de p para la tendencia empleando la adherencia como término continuo en el modelo de regresión. La consistencia de los patrones obtenidos mediante análisis factorial se evaluó comparando las cargas de los factores con unas puntuaciones definidas a priori, es decir, el AHEI, el aMED, el MEDAS y el recientemente desarrollado MEDLIFE, mediante el estudio de la intensidad de la asociación en los diversos quintiles de puntuación del factor. Se realizaron análisis de regresión lineal entre las concentraciones de lípidos en plasma y las puntuaciones del patrón de dieta después de introducir un control respecto a los siguientes posibles factores de confusión: edad, sexo, nivel de estudios, energía de la dieta, nivel de actividad física, medicación hipolipemiante e índice de masa corporal. Se determinó la odds ratio para la disminución de la concentración de cHDL a través de un análisis de regresión logística (ajustada para los mismos posibles factores de confusión que en la regresión lineal) en los diversos quintiles de patrones de dieta (se tomó el primer quintil como valor de referencia). Se utilizó el programa STATA 12.0 (StataCorp LP; College Station, Texas, Estados Unidos) para todos los análisis estadísticos.
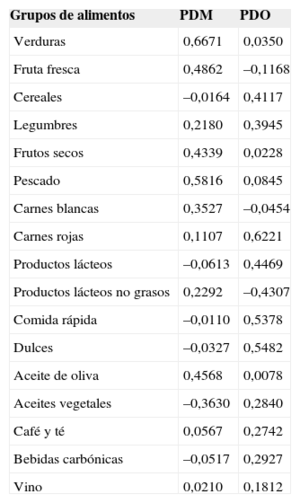
RESULTADOSPatrón de consumo de alimentosLos ítems de alimentos tomados del cuestionario de frecuencia de consumo de alimentos se clasificaron en 17 grupos principales de alimentos (tabla 1 del material suplementario). Partiendo de la carga de factores de los grupos de alimentos, se identificaron dos patrones de dieta principales (tabla 1). El primer patrón de dieta se caracteriza por un consumo superior de verduras, fruta fresca, frutos secos, pescado y aceite de oliva y, en menor medida, un consumo regular de productos lácteos sin grasa y carnes blancas, y se lo denominó «patrón de dieta mediterránea» (PDM). El segundo patrón de dieta se caracteriza por mayor consumo de cereales, carnes rojas, productos lácteos no descremados, comida rápida, postres y dulces y, en menor medida, un consumo regular de aceites vegetales, bebidas carbónicas, café, té y vino/cerveza, y se lo denominó «patrón de dieta occidental» (PDO). El grupo de alimentos correspondiente a las legumbres se encuentra en ambos patrones y no se lo consideró un elemento determinante. Estos dos patrones explicaban un 22% de la varianza del consumo alimentario total.
Matriz de carga de factores para los patrones de dieta
| Grupos de alimentos | PDM | PDO |
|---|---|---|
| Verduras | 0,6671 | 0,0350 |
| Fruta fresca | 0,4862 | –0,1168 |
| Cereales | –0,0164 | 0,4117 |
| Legumbres | 0,2180 | 0,3945 |
| Frutos secos | 0,4339 | 0,0228 |
| Pescado | 0,5816 | 0,0845 |
| Carnes blancas | 0,3527 | –0,0454 |
| Carnes rojas | 0,1107 | 0,6221 |
| Productos lácteos | –0,0613 | 0,4469 |
| Productos lácteos no grasos | 0,2292 | –0,4307 |
| Comida rápida | –0,0110 | 0,5378 |
| Dulces | –0,0327 | 0,5482 |
| Aceite de oliva | 0,4568 | 0,0078 |
| Aceites vegetales | –0,3630 | 0,2840 |
| Café y té | 0,0567 | 0,2742 |
| Bebidas carbónicas | –0,0517 | 0,2927 |
| Vino | 0,0210 | 0,1812 |
PDM: patrón de dieta mediterránea; PDO: patrón de dieta occidental.
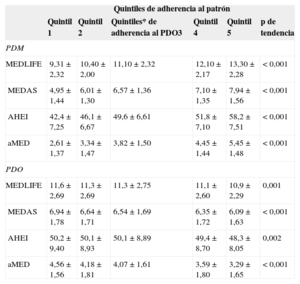
El análisis de la asociación entre los dos patrones de dieta identificados en la población de estudio y los índices de la dieta, ya descritos, que capturan la dieta/estilo de vida saludables y la dieta mediterránea se muestra en la tabla 2. Todos los índices presentaron una asociación positiva con el PDM, lo cual indica que los participantes con mayor adherencia al PDM tenían también puntuaciones elevadas en los diversos índices evaluados a priori. En cambio, todos los índices mostraron una asociación inversa con el PDO, lo cual indica que este patrón se asocia realmente a una dieta de menor calidad. Esta asociación entre los patrones de dieta determinados a priori y a posteriori indica una mayor fiabilidad de los resultados.
Asociación entre los patrones de dieta definidos a posteriori y los índices de dieta definidos a priori
| Quintiles de adherencia al patrón | ||||||
|---|---|---|---|---|---|---|
| Quintil 1 | Quintil 2 | Quintiles* de adherencia al PDO3 | Quintil 4 | Quintil 5 | p de tendencia | |
| PDM | ||||||
| MEDLIFE | 9,31 ± 2,32 | 10,40 ± 2,00 | 11,10 ± 2,32 | 12,10 ± 2,17 | 13,30 ± 2,28 | < 0,001 |
| MEDAS | 4,95 ± 1,44 | 6,01 ± 1,30 | 6,57 ± 1,36 | 7,10 ± 1,35 | 7,94 ± 1,56 | < 0,001 |
| AHEI | 42,4 ± 7,25 | 46,1 ± 6,67 | 49,6 ± 6,61 | 51,8 ± 7,10 | 58,2 ± 7,51 | < 0,001 |
| aMED | 2,61 ± 1,37 | 3,34 ± 1,47 | 3,82 ± 1,50 | 4,45 ± 1,44 | 5,45 ± 1,48 | < 0,001 |
| PDO | ||||||
| MEDLIFE | 11,6 ± 2,69 | 11,3 ± 2,69 | 11,3 ± 2,75 | 11,1 ± 2,60 | 10,9 ± 2,29 | 0,001 |
| MEDAS | 6,94 ± 1,78 | 6,64 ± 1,71 | 6,54 ± 1,69 | 6,35 ± 1,72 | 6,09 ± 1,63 | < 0,001 |
| AHEI | 50,2 ± 9,40 | 50,1 ± 8,93 | 50,1 ± 8,89 | 49,4 ± 8,70 | 48,3 ± 8,05 | 0,002 |
| aMED | 4,56 ± 1,56 | 4,18 ± 1,81 | 4,07 ± 1,61 | 3,59 ± 1,80 | 3,29 ± 1,65 | < 0,001 |
AHEI: Alternate Healthy Eating Index; aMED; alternate MD Index; MEDAS: MD Adherence Screener; MEDLIFE: MEDiterranean LIFEstyle Index; PDM: patron de dieta mediterránea; PDO: patron de dieta occidental.
Los valores expresan media ± desviación estándar.
Las características basales según los quintiles de los dos patrones de dieta principales (PDM y PDO) de los 1.290 participantes se muestran en la tabla 3. Dado que el consumo de energía no se tuvo en cuenta en el análisis factorial, la adherencia a ambos factores aumentó con el consumo de energía debido a la mayor variedad de alimentos consumidos por los individuos con mayor consumo de calorías. En promedio, los participantes que se encontraban en el quintil más alto de adherencia al PDM tenían una edad ligeramente mayor (p = 0,01), era menos probable que fueran fumadores actuales (p < 0,001) o era más probable que fueran ex fumadores (p < 0,001), hacían más actividad física (p < 0,001) y presentaban mayor consumo de energía (p < 0,001) en comparación con los situados en el quintil inferior. Ni la adherencia a un patrón ni la adherencia al otro se asociaron a los factores de riesgo cardiovascular o a los indicadores bioquímicos, ni en los diversos quintiles de la distribución (p de tendencia > 0,05) ni al comparar las muestras de los quintiles extremos (p > 0,05). En cambio, los participantes con mayor adherencia al PDO eran varones de una edad ligeramente inferior, formaban parte de familias con tres o más miembros y tenían un nivel de estudios inferior (p < 0,05). No se observaron diferencias en cuanto a los factores de riesgo cardiovascular, excepto por un porcentaje inferior de uso de medicación (p < 0,05 para toda la medicación) y una prevalencia más alta de tabaquismo (p < 0,001) entre los participantes con mayor adherencia al PDO.
Características basales por quintiles de adherencia
| Quintiles* de adherencia al PDM | |||||||
|---|---|---|---|---|---|---|---|
| Quintiles | Quintil 1258 (–3,08 a –0,84) | Quintil 2258 (–0,84 a –0,28) | Quintil 3258 (–0,28 a 0,23) | Quintil 4258 (0,23-0,79) | Quintil 5258 (0,80-3,84) | p de tendencia | p (quintil 1 frente a quintil 5) |
| Características demográficas | |||||||
| Edad (años) | 50,8 ± 3,80 | 51,1 ± 3,66 | 51,7 ± 3,60 | 51,4 ± 3,61 | 51,5 ± 3,45 | 0,010 | 0,021 |
| Miembros de la familia (n) | 3,20 ± 1,06 | 3,23 ± 1,03 | 3,21 ± 0,89 | 3,16 ± 0,93 | 3,19 ± 0,96 | 0,669 | 0,862 |
| Niños (n) | 1,50 ± 0,820 | 1,49 ± 0,734 | 1,52 ± 0,755 | 1,51 ± 0,740 | 1,53 ± 0,720 | 0,392 | 0,648 |
| Sexo (mujeres) | 7 (2,71) | 16 (6,20) | 12 (4,65) | 18 (6,98) | 11 (4,30) | 0,392 | 0,337 |
| Antecedentes de ECV | 2 (0,78) | 2 (0,79) | 0 (0,00) | 1 (0,41) | 3 (1,20) | 0,427 | 0,637 |
| Nivel de estudios | |||||||
| ≤ bachillerato | 240 (930) | 246 (95,3) | 244 (94,5) | 238 (92,6) | 245 (950) | 0,952 | 0,354 |
| > bachillerato | 18 (6,98) | 12 (4,65) | 14 (5,43) | 19 (7,39) | 13 (5,04) | ||
| Factores de riesgo de ECV | |||||||
| Medicación para dislipemia | 36 (14,2) | 38 (15,1) | 31 (12,4) | 35 (14,5) | 35 (14,1) | 0,979 | 0,970 |
| Medicación para diabetes mellitus | 11 (4,40) | 10 (3,98) | 8 (3,19) | 7 (2,89) | 11 (4,50) | 0,327 | 0,977 |
| Medicación para hipertensión | 60 (23,6) | 54 (21,4) | 47 (18,8) | 51 (21,0) | 56 (22,5) | 0,556 | 0,763 |
| Índice de masa corporal | 27,8 ± 3,56 | 27,7 ± 3,62 | 27,7 ± 3,74 | 28,1 ± 3,67 | 28,0 ± 3,33 | 0,370 | 0,575 |
| Perímetro de cintura (cm) | 98,0 ± 9,70 | 97,9 ± 9,47 | 96,9 ± 10,50 | 97,8 ± 10,00 | 97,7 ± 8,90 | 0,628 | 0,687 |
| Presión arterial sistólica (mmHg) | 125,0 ± 14,0 | 126,0 ± 14,7 | 125,1 ± 13,5 | 125,9 ± 14,9 | 126,0 ± 14,6 | 0,864 | 0,379 |
| Presión arterial diastólica (mmHg) | 83,5 ± 9,2 | 83,7 ± 9,5 | 82,8 ± 9,2 | 84,3 ± 10,1 | 83,4 ± 9,8 | 0,790 | 0,664 |
| Tabaquismo | |||||||
| Fumadores | 103 (40,1) | 74 (29,0) | 85 (33,2) | 90 (35,9) | 53 (20,9) | < 0,001 | < 0,001 |
| No fumadores | 82 (31,9) | 90 (35,3) | 92 (35,9) | 81 (32,3) | 86 (33,9) | 0,913 | 0,639 |
| Ex fumadores | 72 (28,0) | 91 (35,7) | 79 (30,9) | 80 (31,9) | 115 (45,3) | < 0,001 | < 0,001 |
| Estilo de vida | |||||||
| Consumo de energía (kcal) | 2.540 ± 673 | 2.697 ± 655 | 2.797 ± 573 | 2.875 ± 622 | 3.069 ± 578 | < 0,001 | < 0,001 |
| Actividad física (MET-h/semana) | 30,5 ± 18,3 | 33,3 ± 19,6 | 31,7 ± 18,2 | 34,6 ± 20,3 | 38,2 ± 22,4 | < 0,001 | < 0,001 |
| Sueño en días laborables (h) | 6,36 ± 0,92 | 6,25 ± 0,92 | 6,17 ± 0,89 | 6,25 ± 1,07 | 6,27 ± 1,03 | 0,619 | 0,302 |
| Bioquímica | |||||||
| Glucosa (mg/dl) | 98,7 ± 15,8 | 101,0 ± 21,7 | 98,6 ± 18,3 | 98,7 ± 17,3 | 99,9 ± 18,2 | 0,904 | 0,458 |
| Insulina (μU/ml) | 8,71 ± 7,01 | 7,68 ± 5,80 | 7,28 ± 4,90 | 8,14 ± 5,60 | 7,75 ± 5,02 | 0,230 | 0,087 |
| Glucohemoglobina (%) | 5,56 ± 0,47 | 5,56 ± 0,60 | 5,54 ± 0,50 | 5,55 ± 0,50 | 5,57 ± 0,56 | 0,836 | 0,890 |
| Resistencia a la insulina (HOMA) | 2,18 ± 2,00 | 1,95 ± 1,70 | 1,82 ± 1,40 | 2,07 ± 1,70 | 1,96 ± 1,49 | 0,342 | 0,178 |
| Proteína C reactiva (mg/dl) | 0,320 ± 0,73 | 0,262 ± 0,20 | 0,322 ± 0,40 | 0,273 ± 0,30 | 0,240 ± 0,29 | 0,081 | 0,105 |
| Quintiles* de adherencia al PDO | |||||||
|---|---|---|---|---|---|---|---|
| Quintiles | Quintil 1258 (–3,09 a –0,85) | Quintil 2258 (–0,84 a –0,25) | Quintil 3258 (–0,25 a 0,25) | Quintil 4258 (0,25-0,83) | Quintil 5258 (0,84-4,41) | p de tendencia | p (quintil 1 frente a quintil 5) |
| Características demográficas | |||||||
| Edad (años) | 51,6 ± 3,60 | 51,3 ± 3,85 | 51,7 ± 3,44 | 51,0 ± 3,57 | 50,8 ± 3,69 | 0,003 | 0,012 |
| Miembros de la familia (n) | 3,00 ± 0,98 | 3,20 ± 0,97 | 3,17 ± 0,99 | 3,29 ± 0,97 | 3,33 ± 0,92 | < 0,001 | < 0,001 |
| Niños (n) | 1,38 ± 0,76 | 1,53 ± 0,74 | 1,51 ± 0,79 | 1,55 ± 0,76 | 1,59 ± 0,69 | < 0,001 | 0,001 |
| Sexo (mujeres) | 30 (11,60) | 17 (6,59) | 14 (5,43) | 2 (0,77) | 1 (0,39) | < 0,001 | < 0,001 |
| Antecedentes de ECV | 4 (1,61) | 0 (0,00) | 1 (0,40) | 2 (0,81) | 1 (0,39) | 0,310 | 0,168 |
| Nivel de estudios | |||||||
| ≤ bachillerato | 236 (91,5) | 237 (92,2) | 245 (94,9) | 244 (94,5) | 251 (97,3) | 0,002 | 0,004 |
| > bachillerato | 22 (8,50) | 20 (7,78) | 13 (5,04) | 14 (5,43) | 7 (2,70) | ||
| Factores de riesgo de ECV | |||||||
| Medicación para dislipemia | 50 (20,40) | 31 (12,50) | 42 (16,90) | 31 (12,60) | 21 (8,24) | < 0,001 | < 0,001 |
| Medicación para diabetes mellitus | 17 (7,00) | 8 (3,24) | 8 (3,21) | 8 (3,25) | 6 (2,36) | 0,026 | 0,014 |
| Medicación para hipertensión | 71 (28,9) | 49 (19,7) | 67 (26,7) | 47 (19,0) | 34 (13,3) | < 0,001 | < 0,001 |
| Índice de masa corporal | 28,1 ± 3,71 | 27,8 ± 3,69 | 27,8 ± 3,60 | 27,9 ± 3,64 | 27,5 ± 3,27 | 0,123 | 0,054 |
| Perímetro de cintura (cm) | 97,6 ± 10,80 | 97,3 ± 10,40 | 97,9 ± 9,36 | 97,8 ± 9,52 | 97,7 ± 8,50 | 0,637 | 0,983 |
| Presión arterial sistólica (mmHg) | 126,0 ± 14,9 | 125,0 ± 14,2 | 125,0 ± 14,6 | 126,8 ± 14,1 | 125,0 ± 14,0 | 0,626 | 0,742 |
| Presión arterial diastólica (mmHg) | 83,4 ± 9,80 | 82,8 ± 9,30 | 83,8 ± 9,90 | 84,3 ± 9,90 | 83,5 ± 8,96 | 0,281 | 0,874 |
| Tabaquismo | |||||||
| Fumadores | 54 (20,9) | 77 (30,2) | 73 (29,1) | 83 (32,9) | 118 (45,9) | < 0,001 | < 0,001 |
| No fumadores | 107 (41,5) | 86 (33,7) | 82 (32,7) | 93 (36,9) | 63 (24,5) | < 0,001 | < 0,001 |
| Ex fumadores | 97 (37,60) | 92 (36,19) | 96 (38,20) | 76 (30,20) | 76 (29,60) | 0,014 | 0,054 |
| Estilo de vida | |||||||
| Consumo de energía (kcal) | 2.093 ± 455 | 2.518 ± 413 | 2.769 ± 448 | 3.085 ± 410 | 3.514 ± 408 | < 0,001 | < 0,001 |
| Actividad física (MET-h/semana) | 31,4 ± 19,3 | 35,2 ± 20,9 | 33,6 ± 20,7 | 34,7 ± 20,5 | 33,3 ± 18,2 | 0,194 | 0,266 |
| Sueño días laborables (h) | 6,25 ± 0,91 | 6,21 ± 1,01 | 6,31 ± 0,92 | 6,26 ± 1,10 | 6,27 ± 0,91 | 0,808 | 0,847 |
| Bioquímica | |||||||
| Glucosa (mg/dl) | 99,9 ± 18,0 | 98,5 ± 14,5 | 99,8 ± 17,1 | 99,2 ± 19,9 | 99,1 ± 21,3 | 0,915 | 0,657 |
| Insulina (μU/ml) | 7,49 ± 6,03 | 7,60 ± 4,48 | 7,88 ± 5,90 | 8,32 ± 6,28 | 7,87 ± 5,90 | 0,919 | 0,902 |
| Glucuohemoglobina (%) | 5,56 ± 0,57 | 5,53 ± 0,46 | 5,56 ± 0,52 | 5,56 ± 0,59 | 5,55 ± 0,55 | 0,721 | 0,828 |
| Resistencia a la insulina (HOMA) | 2,00 ± 1,75 | 1,89 ± 1,26 | 2,00 ± 1,70 | 2,13 ± 1,89 | 1,98 ± 1,77 | 0,863 | 0,909 |
| Proteína C reactiva (mg/dl) | 0,290 ± 0,39 | 0,337 ± 0,35 | 0,272 ± 0,35 | 0,276 ± 0,31 | 0,250 ± 0,21 | 0,131 | 0,235 |
ECV: enfermedad cardiovascular; HOMA: Homeostatic Model Assessment; MET: equivalentes metabólicos; PDM: patrón de dieta mediterránea; PDO: patrón de dieta occidental.
Los datos expresan n (%) o media ± desviación estándar.
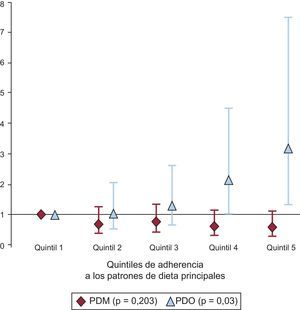
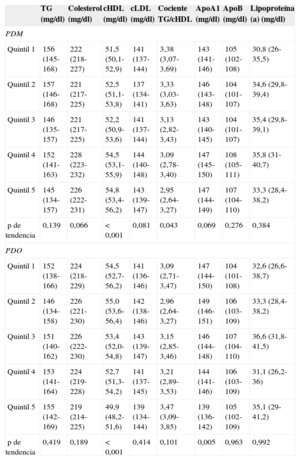
Las concentraciones de lípidos en plasma en los diversos quintiles de adherencia al PDM y el PDO se presentan en la tabla 4. Para la comparación se utilizaron modelos de regresión lineal con ajuste completo. En promedio, los participantes con mayor adherencia al PDM presentaron valores más altos de cHDL cHDL (quintil 1 = 51,5 mg/dl; quintil 5 = 54,8 mg/dl; p < 0,001) y valores inferiores del cociente (quintil 1 = 3,38; quintil 5 = 2,95; p = 0,043). En cambio, los participantes que obtuvieron puntuaciones altas en el PDO presentaron valores significativamente (p < 0,001) inferiores de cHDL (quintil 1 = 54,5 mg/dl; quintil 5 = 49,9 mg/dl) y de ApoA1 sérica (quintil 1 = 147 mg/dl; quintil 5 = 139 mg/dl; p = 0,005). En la figura se muestra el riesgo de tener el cHDL inferior a 40mg/dl (varones) o inferior a 50mg/dl (mujeres) para los diversos quintiles de adherencia al PDO y el PDM. El riesgo de presentar cHDL más bajo aumentaba con la mayor adherencia al PDO (quintil 5 frente a quintil 1; odds ratio = 3,19; intervalo de confianza del 95%, 1,36-7,50; p de tendencia = 0,03). Por lo que respecta al PDM, la tendencia en los diversos quintiles no fue significativa (quintil 5 frente a quintil 1, odds ratio = 0,603; intervalo de confianza del 95%, 0,329-1,100; p de tendencia = 0,203).
Lípidos en plasma por quintiles de adherencia a los principales patrones de dieta
| TG (mg/dl) | Colesterol (mg/dl) | cHDL (mg/dl) | cLDL (mg/dl) | Cociente TG/cHDL | ApoA1 (mg/dl) | ApoB (mg/dl) | Lipoproteína (a) (mg/dl) | |
|---|---|---|---|---|---|---|---|---|
| PDM | ||||||||
| Quintil 1 | 156 (145-168) | 222 (218-227) | 51,5 (50,1-52,9) | 141 (137-144) | 3,38 (3,07-3,69) | 143 (141-146) | 105 (102-108) | 30,8 (26-35,5) |
| Quintil 2 | 157 (146-168) | 221 (217-225) | 52,5 (51,1-53,8) | 137 (134-141) | 3,33 (3,03-3,63) | 146 (143-148) | 104 (101-107) | 34,6 (29,8-39,4) |
| Quintil 3 | 146 (135-157) | 221 (217-225) | 52,2 (50,9-53,6) | 141 (137-144) | 3,13 (2,82-3,43) | 143 (140-145) | 104 (101-107) | 35,4 (29,8-39,1) |
| Quintil 4 | 152 (141-163) | 228 (223-232) | 54,5 (53,1-55,9) | 144 (140-148) | 3,09 (2,78-3,40) | 147 (145-150) | 108 (105-111) | 35,8 (31-40,7) |
| Quintil 5 | 145 (134-157) | 226 (222-231) | 54,8 (53,4-56,2) | 143 (139-147) | 2,95 (2,64-3,27) | 147 (144-149) | 107 (104-110) | 33,3 (28,4-38,2) |
| p de tendencia | 0,139 | 0,066 | < 0,001 | 0,081 | 0,043 | 0,069 | 0,276 | 0,384 |
| PDO | ||||||||
| Quintil 1 | 152 (138-166) | 224 (218-229) | 54,5 (52,7-56,2) | 141 (136-146) | 3,09 (2,71-3,47) | 147 (144-150) | 104 (101-108) | 32,6 (26,6-38,7) |
| Quintil 2 | 146 (134-158) | 226 (221-230) | 55,0 (53,6-56,4) | 142 (138-146) | 2,96 (2,64-3,27) | 149 (146-151) | 106 (103-109) | 33,3 (28,4-38,2) |
| Quintil 3 | 151 (140-162) | 226 (222-230) | 53,4 (52,0-54,8) | 143 (139-147) | 3,15 (2,85-3,46) | 146 (144-148) | 107 (104-110) | 36,6 (31,8-41,5) |
| Quintil 4 | 153 (141-164) | 224 (219-228) | 52,7 (51,3-54,2) | 141 (137-145) | 3,21 (2,89-3,53) | 144 (141-146) | 106 (103-109) | 31,1 (26,2-36) |
| Quintil 5 | 155 (142-169) | 219 (214-225) | 49,9 (48,2-51,6) | 139 (134-144) | 3,47 (3,09-3,85) | 139 (136-142) | 105 (102-109) | 35,1 (29-41,2) |
| p de tendencia | 0,419 | 0,189 | < 0,001 | 0,414 | 0,101 | 0,005 | 0,963 | 0,992 |
Apo: apolipoproteína; cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; PDM: patrón de dieta mediterránea; PDO: patrón de dieta occidental; TG: triglicéridos.
Medias ajustadas (intervalo de confianza del 95%) para las variables edad, sexo, nivel de estudios, consumo de energía, nivel de actividad física, medicación hipolipemiante e índice de masa corporal.
En este estudio se investigó la relación entre la calidad general de la dieta, expresada mediante la adherencia a unos patrones de dieta establecidos a posteriori y el perfil de lípidos en plasma, como indicador intermedio del riesgo cardiovascular. Estudios previos han señalado que la adherencia a una dieta saludable se asocia a una mejora de las conductas relacionadas con la salud32. Un análisis de los patrones de dieta de una población holandesa puso de manifiesto que era más probable que los individuos que seguían un patrón con contenido rico en productos lácteos, carne y alimentos elaborados tuvieran un nivel de estudios inferior y menos actividad física y que fueran muy fumadores33. En cambio, era más probable que los que hacían mayor consumo de verduras y aceites vegetales, pasta, arroz, pescado, carnes blancas y vino tuvieran un nivel de estudios superior y fueran físicamente más activos33.
Hay evidencia científica de que la elección de un patrón de dieta más saludable depende del nivel socioeconómico del individuo34. Esto se observa en España, donde un estudio reciente realizado en graduados universitarios ha indicado que la dieta mediterránea es, en cierta medida, cara35. En nuestro estudio, los individuos con un nivel de estudios inferior y menores ingresos podrían tener que afrontar obstáculos económicos para seguir el PDM, por lo cual podrían ser más propensos al PDO u otro similar con consumo abundante de grasas, al dar preferencia a una dieta menos costosa y menos saludable, mientras que una población con un nivel de estudios superior y mayores ingresos económicos podría tener mayor capacidad de consumir productos alimentarios más saludables, que en promedio se consideran más caros. Además, los participantes con mayor nivel de estudios podrían tener un mejor conocimiento de la nutrición y mayor conciencia de los efectos que tiene la exposición a una dieta de baja calidad en el riesgo de progresión de la enfermedad; en consecuencia, estos participantes instaurarían un patrón de dieta más saludable. Por lo que se refiere a los hábitos de estilo de vida, en el presente estudio tan solo la actividad física mostró una asociación positiva con el aumento de la adherencia al PDM, y el tabaquismo se asoció con menos o más adherencia al PDM o al PDO, respectivamente. Los fumadores actuales tendían a estar menos concienciados respecto a la salud y a mostrar un menor grado de autopercepción de las conductas propias relacionadas con la salud, incluida la alimentación, en comparación con los individuos que no habían fumado nunca o habían dejado de fumar36. El tabaquismo causa un aumento del recambio de micronutrientes37, con lo que sitúa a los fumadores que siguen el PDO en un estado de mayor riesgo de enfermedad crónica en comparación con los no fumadores, no solo a causa del consumo alimentario poco saludable caracterizado por el PDO, sino también debido a la desnutrición38.
Los resultados del presente estudio sobre el cHDL concuerdan tanto con los de los estudios observacionales como con los de los ensayos clínicos9,10,39. En general, el mayor consumo de alimentos elaborados y refinados que caracteriza el PDO se asocia a valores de cHDL más bajos, mientras que un seguimiento más estrecho del PDM dará lugar con mayor probabilidad a un aumento del cHDL. Un mecanismo subyacente plausible para explicar la asociación entre el PDO y menores concentraciones de cHDL podría ser el mayor consumo de hidratos de carbono refinados de los individuos que siguen el PDO. Los hidratos de carbono refinados tienden a aumentar la adiposidad visceral, reducir la sensibilidad a la insulina y estimular la lipogénesis de novo hepática, lo cual da lugar a una reducción de cHDL40. En cambio, el efecto favorable del PDM en el cHDL podría deberse al mayor consumo de aceite de oliva de la población que sigue el PDM. El aceite de oliva se ha relacionado con mayor cantidad de prostaglandina trienoica, lo cual da lugar a una mejora del perfil de lípidos en plasma, por ejemplo con un aumento del cHDL en suero41.
Algunos estudios observacionales han demostrado un efecto beneficioso en el perfil lipídico, independiente de la actividad física42. El papel de la actividad física en la modificación de la asociación entre dieta y perfil lipídico se observó en cierta medida en el presente estudio. La introducción en el modelo de un control respecto a la actividad física debilitó levemente la asociación entre el PDM y el cociente TG/cHDL y la ApoA1 en los individuos que seguían el PDM, lo cual indica que en realidad la actividad física podría estar asociada en parte a una mejora de algunos de los componentes del perfil lipídico.
Algunos autores han afirmado que el efecto saludable en el perfil lipídico de la adherencia al PDM se debe a su efecto favorable en la obesidad43. Aunque se observó que un mayor cumplimiento del PDM se asocia a menor riesgo de obesidad, la introducción de un ajuste respecto al índice de masa corporal como indicador subrogado de la obesidad, según nuestros resultados, tan solo modificó levemente la asociación entre la dieta y el perfil lipídico, lo cual indica que las mejoras de los lípidos plasmáticos observadas se debían con mayor probabilidad a la adherencia al patrón de dieta que a un cambio del índice de masa corporal.
Aunque no se observó de forma directa en el presente estudio. la dieta influye en la concentración de TG en suero, según se ha descrito en varios estudios44. En el presente estudio, se observó una asociación inversa entre el PDM y el cociente TG/cHDL, que se sabe que es un indicador subrogado directamente relacionado con el riesgo coronario, sobre todo de infarto de miocardio45. Se sabe que los ácidos grasos poliinsaturados omega-3, que son abundantes en el PDM, reducen la síntesis de TG, lo cual da lugar a un valor más bajo del cociente TG/cHDL46, por lo que la adherencia al PDM, incluso sin que haya un aumento de la concentración de cHDL, probablemente dé lugar a una reducción del riesgo de aparición de enfermedad coronaria.
A pesar de que se observó una asociación directa entre la adherencia al PDM y la ApoA1 en este estudio y en otros11,14,47, la evidencia respecto a esta relación continúa siendo poco consistente. Teniendo en cuenta la importancia de las apolipoproteínas en la predicción de la enfermedad cardiovascular48, serán necesarios nuevos estudios para confirmar los resultados.
A lo largo de los años, los estudios epidemiológicos han puesto de manifiesto una asociación inversa entre las cifras de cHDL y el riesgo cardiovascular49, tal como se observa en el Framingham Heart Study, en el que un aumento de 5mg/dl en las concentraciones de cHDL se asoció a un riesgo cardiovascular un 21% inferior50. Sin embargo, algunos estudios recientes han puesto en duda esta evidencia, al mostrar que los aumentos del cHDL no se asocian necesariamente a menor riesgo de infarto de miocardio y que se deberá estudiar en mayor profundidad su efecto protector51.
Los patrones de dieta establecidos a posteriori tan solo pudieron explicar en parte la varianza en el consumo total de alimentos en esta población, de modo que no puede descartarse la influencia de otros patrones de dieta menores que atenuara las asociaciones observadas. Además, los resultados de los estudios basados en un análisis factorial dependen en gran manera de las decisiones subjetivas tomadas por los investigadores respecto a la agrupación de los ítems de alimentos en las diversas categorías. En el presente estudio, el consumo de alimentos como legumbres, cereales y vino se asoció a una dieta rica en grasas y en hidratos de carbono (PDO). Estos elementos se consideraron inicialmente parte esencial del PDM tradicional y podrían indicar que se está produciendo una transición alimentaria del PDM tradicional al patrón mediterráneo actual que se sigue en España. Se sabe que el mismo patrón de dieta muestra diferencias significativas en distintas poblaciones, y ello indica, por ejemplo, que el PDM estudiado en dos países diferentes podría diferir también52.
Puntos fuertes y limitacionesUna ventaja de este estudio es la validación de un patrón de dieta definido a posteriori, mediante la comparación con los índices de calidad de la dieta definidos a priori. A la vista de los resultados obtenidos, cabe concluir que los patrones de dieta definidos por un análisis factorial son instrumentos válidos para evaluar la relación entre la calidad general de la dieta y los biomarcadores de enfermedades. Por lo que respecta a las asociaciones observadas, y dado el diseño transversal del presente estudio, no es posible establecer una relación causal. Además, esta muestra puede no ser representativa de la población general, ya que estos participantes eran en su mayoría varones y trabajadores en activo, por lo tanto sanos o al menos sin enfermedades invalidantes. Como en la mayoría de los estudios relacionados con la dieta, no se puede descartar los sesgos de notificación debidos a la conveniencia social de sobreinformar del consumo de alimentos más saludables e infranotificar el consumo de los alimentos menos favorables.
CONCLUSIONESUna mayor adherencia al PDM se asoció a un mejor perfil de lípidos en plasma, mientras que la adherencia al PDO redujo la probabilidad de valores óptimos de cHDL en esta cohorte de trabajadores de España.
FINANCIACIÓNEste estudio contó con el apoyo económico del FIS (Fondo de Investigaciones Sanitarias) del ISCIII (Instituto de Salud Carlos III), proyecto PI11/00403.
CONFLICTO DE INTERESESNinguno.
Damos las gracias a los participantes y al personal del estudio Aragon Health Workers Study por su colaboración.