Palabras clave
INTRODUCCION
La disección aórtica es una complicación poco frecuente de la angioplastia coronaria transluminal percutánea (ACTP)1-8. La mayor parte de los casos descritos en la bibliografía se producen después de intervenciones de la arteria coronaria derecha1,3-10 y, muy raramente, después de la cateterización de la arteria coronaria izquierda1,3,4,6. Esta complicación es potencialmente grave y puede conducir a un infarto agudo de miocardio o a una muerte cardiaca súbita.
Hemos examinado mediante disección y secciones histológicas el curso y las características morfológicas y estructurales de los senos coronarios y la porción proximal de las arterias coronarias izquierda y derecha en especímenes post mortem sin y con cardiopatía isquémica estructural, con el objeto de estudiar los mecanismos y los factores que pueden hacer que la arteria coronaria izquierda sea menos propensa a la disección retrógrada que la derecha durante la ACTP.
MÉTODOS
Hemos examinado 16 corazones post mortem de pacientes que habían sido fijados previamente por inmersión en formol neutro al 10%, evitando que la fijación se hubiese realizado a presión a través de las coronarias, lo que podría haber distendido las arterias y producido distorsión de las muestras. Las causas de muerte estaban relacionadas con: accidente de tráfico (n = 6), cirrosis hepática (n = 2), suicidio (n = 3), hemorragia cerebral (n = 3) y tromboembolia pulmonar (n = 2). En total, 8 de los 16 especímenes presentaban cardiopatía isquémica estructural debido a una estenosis coronaria derecha e izquierda por aterosclerosis. Los pacientes fueron 10 varones y 6 mujeres de 30-78 años de edad (media ± desviación estándar, 55 ± 9 años). El peso de los corazones varió entre 332 y 450 g (380 ± 22 g); los corazones fueron diseccionados para localizar el origen de las arterias coronarias (16 especímenes en la coronaria derecha y 14 en la izquierda) y su curso proximal. Mediante un transportador de ángulos (goniómetro) medimos, macroscópicamente o en las secciones histológicas, el ángulo formado entre el orificio de origen y la porción proximal de la arteria coronaria derecha e izquierda con la pared aórtica. Los bloques histológicos se realizaron con posterioridad mediante la sección de la aorta ascendente en sentido horizontal 1,5 cm por encima de la unión sinutubular. Después, la aorta se seccionó de nuevo en sentido longitudinal a lo largo del seno no coronario para permitir un examen más fácil de los orificios coronarios. Los senos de Valsalva, incluida la parte proximal de las arterias coronarias, fue resecada y procesada para secciones histológicas. De cada uno de los corazones se realizaron 2 bloques de un espesor de aproximadamente 7 mm, que fueron deshidratados en alcoholes de graduación creciente, incluidos en parafina, y seccionados consecutivamente a 10 μm en un plano frontal. Las secciones fueron teñidas con técnicas de tricrómico de Masson y rojo picrosirio F3BA (Gurr, Reino Unido) al 1%, a intervalos de 60 μm. Con el microscopio de luz polarizada, las fibras de colágeno teñidas con rojo picrosirio muestran birrefringencia, lo cual es testimonio de la presencia de unidades submicroscópicas orientadas en dirección al eje de la fibra. Estas subunidades están constituidas por colágeno de tipos I y III. El de tipo I es fuertemente birrefringente, con colores que varían del amarillo al rojo; en cambio, el colágeno de tipo III es menos refringente y aparece de color verde.
Las mediciones de las estructuras fueron realizadas desde las secciones histológicas mediante un programa de análisis de imagen (SigmaScanPro 5.0, Jandel Scientific, San Rafael, CA, Estados Unidos). Para facilitar la visualización de la arquitectura de los orificios coronarios y de la pared de la aorta ascendente, hemos examinado mediante microscopia electrónica de barrido (Jeol JSM 5600) las secciones histológicas de 25-30 μm que habían sido previamente desparafinadas en xilol durante 30 min, después secadas a temperatura ambiente durante 1 h, y cubiertas con oro (BAL-TEC SDC 005 Sputter coater) durante 4 min.
Análisis estadístico
Los resultados se expresan con la media ± desviación estándar (DE). El análisis estadístico se ha realizado mediante el test de la t de Student para muestras independientes en el caso de las variables cuantitativas. Los valores de p < 0,05 se han considerado estadísticamente significativos.
RESULTADOS
Morfología de la unión aortocoronaria y su trayecto proximal
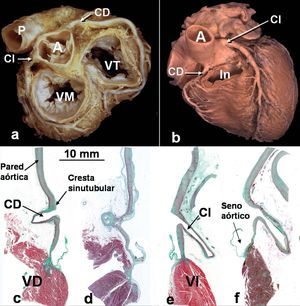
Todos los corazones estudiados poseen 3 velos aórticos y las arterias coronarias se originan de sus correspondientes senos de Valsalva (fig. 1). Las dimensiones del diámetro del seno aórtico fueron 3,7 ± 0,3 cm (rango, 2,6-4,2 cm). En 12 corazones (75%) el orificio de la arteria coronaria derecha y en 12 (85%) de la izquierda estaban localizados por debajo de la unión sinotubular (línea intercomisural). Hay diferencias significativas entre el diámetro del orificio de la coronaria izquierda y derecha. El diámetro de la coronaria izquierda en su origen en 10 especímenes (71%) fue mayor (4,5 ± 0,4 mm) que el orificio de la coronaria derecha (3,7 ± 0,5 mm) (p < 0,001). Mediante técnicas de disección y microscopia óptica, todos los especímenes muestran que el orificio y los primeros 2-3 mm de las arterias coronarias se sitúan dentro de la pared de la aorta ascendente o seno aórtico. Desde aquí, la parte inicial extraaórtica (aproximadamente 2 cm) de la coronaria izquierda desciende paralelamente a la aorta ascendente y forma con la pared del seno aórtico un ángulo de 35,5 ± 11,5º (rango, 20-55º), para situarse entre el tronco pulmonar y la orejuela izquierda (fig. 1). En contraste a esta disposición, la porción inicial de la coronaria derecha se origina casi de forma perpendicular a la pared aórtica del seno formando un ángulo de 71,5 ± 8,5º (rango, 60-88º), y pasa anterior y ligeramente a la derecha entre la aurícula derecha y el tronco de la arteria pulmonar (fig. 1). Al aproximarse al surco auriculoventricular, la coronaria derecha desciende casi verticalmente.
Fig. 1. Visión de la base (a) y la cara anterior (b) del corazón en posición anatómica que se muestra la aorta (A) y el curso de las arterias coronarias por el surco auriculoventricular. Nótese que la porción proximal de la coronaria izquierda (CI) posee un trayecto diferente del de la coronaria derecha (CD). En la figura b se ha seccionado el infundíbulo (In) o cono de salida del ventrículo derecho. c-f: secciones frontales a través del orificio y porción inicial de la arterias coronarias: derecha control (c), derecha aterosclerótica (d), izquierda control (e) e izquierda aterosclerótica (f) teñidas con tricrómico de Masson. Nótese que la coronaria izquierda forma un ángulo más agudo con el seno aórtico que la derecha y ambos orificios están localizados por debajo de la unión sinutubular. Barra 10 mm. CD: coronaria derecha; CI: coronaria izquierda; P: arteria pulmonar; VD: ventrículo derecho; VI: ventrículo izquierdo; VM: válvula mitral; VT: válvula tricúspide.
Estudio histológico y estructural de los orificios de las arterias coronarias y la pared aórtica
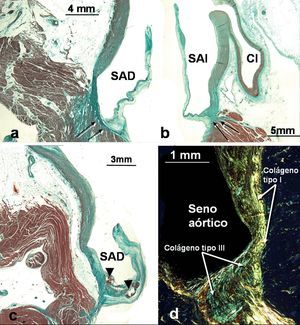
El examen histológico mediante microscopia convencional, luz polarizada y electrónica de barrido muestra que las paredes de los senos de Valsalva poseen fundamentalmente fibras de colágeno de tipo I en su parte más baja próxima a la inserción de los velos aórticos, donde terminan insertándose fibras musculares del ventrículo izquierdo (fig. 2), pero las fibras de colágeno I disminuyen a medida que aumentan las fibras elásticas en la porción ascendente de los senos aórticos (fig. 2). En la zona media de cada seno, el espesor de la pared aórtica, tanto en los senos normales como en los que presentan cardiopatía isquémica estructural, es de 1,8 ± 0,3 mm (rango, 1,1-2,4 mm). Sin embargo, los senos en los que se aprecia cardiopatía isquémica estructural presentan variaciones no uniformes en espesor de la lámina elástica de la capa media y una presencia de placas ateroscleróticas, en ocasiones con acumulaciones hemorrágicas, en la base de implantación del velo por debajo de su cara arterial (fig. 2).
Fig. 2. a-d: secciones histológicas frontales teñidas con tricrómico de Masson (a, b y c) y rojo picrosirio (d) a través de los senos aórticos de la coronaria derecha (a, c) e izquierda (b, d). Se observa que los senos aórticos derecho e izquierdo poseen más fibras de tejido conectivo (flechas) en la zona de implantación de los velos aórticos. Los velos patológicos muestran placas ateroscleróticas (cabezas de flecha) por debajo de la cara arterial del velo. En la figura d, con luz polarizada, se observa la diferencia de coloración de las fibras de colágeno de tipo I (rojo-amarillo) con las de colágeno de tipo III (verde). CI: coronaria izquierda; SAD: seno aórtico derecho; SAI: seno aórtico izquierdo.
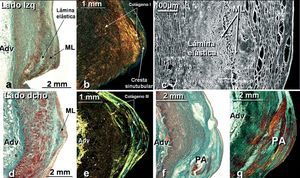
El límite superior de cada seno en el pico de la línea de inserción semilunar de cada velo se conoce anatómicamente como cresta supravalvular o «intercomisural», que marca la unión entre los senos y la porción tubular de la aorta. La cresta de la unión sinutubular está constituida sobre todo por fibras elásticas y colágenas entremezcladas con células musculares lisas y fibroblastos. La cresta en el seno coronario izquierdo contiene mayor cantidad de células musculares lisas dentro de una densa matriz extracelular de fibras colágenas de tipo I (fig. 3). En contraposición, la arteria coronaria derecha posee menor cantidad de fibras musculares lisas pero, además, inmersas en colágeno fundamentalmente de tipo III (fig. 3). El espesor de la pared aórtica en la cresta es de 4,3 ± 0,5 mm (rango, 3,6-5,1 mm), con diferencias significativas entre el espesor de la pared de cada seno de Valsalva y la cresta supravalvular en ambas arterias coronarias (p < 0,001).
Fig. 3. Secciones histológicas frontales teñidas con tricrómico de Masson (a, d, f), rojo picrosirio con luz polarizada (b, e, g) y electrónica de barrido (c) de la cresta sinutubular y pared aórtica periostial izquierda (a-c) y derecha (d-g). Nótese que la cresta sinutubular de la coronaria izquierda (a, b) posee mayor cantidad de células musculares lisas y fibras de colágeno de tipo I bajo luz polarizada (color rojo-amarillo en b) que la coronaria derecha (d, e). En la micrografía electrónica de barrido en la cresta sinutubular izquierda (c) se observa que las células musculares lisas (ML) se entrecruzan dentro de una densa matriz extracelular reforzando esta parte del orificio coronario. En (f) se observa una placa aterosclerótica (PA) en la cresta sinutubular de una coronaria derecha que afecta a la túnica media y da lugar a un adelgazamiento de la pared aórtica. En (g) se observa la placa aterosclerótica (PA) dispuesta en capas de cebolla bajo luz polarizada. Adv: capa adventicia.
La pared aórtica periostial en la cresta sinutubular se caracteriza por poseer una prominente túnica media entre la lámina elástica interna y la adventicia. Esta media está constituida predominantemente de capas de material elástico que alternan con haces de células musculares lisas con variable orientación espacial y fibras de colágeno de I y III (fig. 3). La pared aórtica periostial de la arteria coronaria derecha posee menor positividad al colágeno intersticial de tipo I que la izquierda entre las fibras musculares lisas (fig. 3). El espesor de la túnica media de la aorta en esta localización fue de 2,8 ± 0,4 mm (rango, 2,1-3,5 mm). La orientación espacial de las células musculares lisas dentro de la túnica media que rodea al ostium en ambas arterias coronarias es muy irregular, entremezclándose fibras longitudinales con fibras oblicuas. La presencia de placas ateroscleróticas con hematoma intramural en la cresta sinutubular produce un adelgazamiento de la túnica media de la aorta (fig. 3), en ocasiones de menos de 1 mm de espesor, y su observación mediante luz polarizada muestra una distribución no homogénea del colágeno de tipo I, el cual se dispone como en capas de cebolla en el interior de la cresta sinutubular y disminuye en la pared aórtica periostial (fig. 3). En uno de los casos de avanzada aterosclerosis, tal como se observó en el espécimen de 72 años de edad (fig. 4), la túnica media aórtica se caracterizó por una ausencia de fibras musculares lisas, inmediatamente por encima de la cresta sinutubular, de manera que la media estaba formada en esta zona solamente por fibras elásticas (fig. 4).
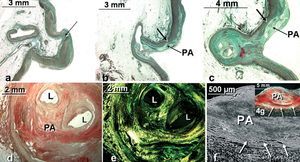
En adición a la afección aórtica, es frecuente que la placa de aterosclerosis comprometa al segmento más proximal de las arterias coronarias y se acompañe de una marcada atrofia de la túnica media con una disminución de fibras elásticas y musculares lisas, y en ocasiones ulceración, esto es, la rotura de la placa de cubierta por un aumento de la presión que favorece la trombosis y la obstrucción coronaria. La obstrucción muest ra tinción positiva fundamentalmente para el colágeno intersticial de tipo I bajo luz polarizada en la adventicia y la media (fig. 4). Por último, cabe considerar la posibilidad de que la placa se esclerose y calcifique (fig. 4), y el porcentaje de reducción del lumen es importante para la repercusión funcional (lumen de reserva).
Fig. 4. Secciones histológicas frontales teñidas con tricrómico de Masson (a, b, c) de la cresta sinutubular y pared aórtica periostial de la coronaria derecha en pacientes con cardiopatía isquémica estructural. Nótese en (a) la pérdida de fibras musculares lisas (flecha) en la pared aórtica por encima de la cresta sinutubular. En (b y c) se observa la alteración de la túnica media aórtica (flecha) que se continúa con la de la coronaria por la placa aterosclerótica (PA) y la obstrucción coronaria. En (d y e) se observan secciones transversales de la porción proximal de una arteria coronaria derecha casi obstruida con rojo picrosirio (d) y luz polarizada (e). f y g: secciones transversales de la porción proximal de una placa aterosclerótica (PA) calcificada en arteria coronaria izquierda con microscopia electrónica de barrido (f) y luz polarizada (g). Nótese la atrofia de la túnica media arterial (flechas). L: luz del vaso.
La capa más externa de la pared aórtico-coronaria es la denominada capa adventicia o matriz perivascular, la cual consiste en una red de fibras, fundamentalmente colágeno de tipo I, elásticas, adipocitos y macrófagos (figs. 1 y 2). En esta capa no hemos observado alteraciones visibles en las arterias ateroscleróticas estudiadas. Los vasa vasorum están normalmente situados en la adventicia, donde también se encuentran haces nerviosos. El espesor de la matriz perivascular en la pared aórtica es de 1,2 ± 0,4 mm (rango, 0,5-1,8 mm). La capa adventicia de la aorta se continúa con la adventicia de ambas arterias coronarias.
DISCUSION
Aunque el riesgo de disección retrógrada en la aorta ascendente durante la ACTP es poco frecuente, y aunque esta técnica es actualmente muy practicada y ha aumentado el número de casos, sigue siendo baja la proporción en los que se produce esta seria complicación. En nuestro hospital, la incidencia (0,029%) es similar a la de otros hospitales, con un rango del 0,02 al 0,15% y una media del 0,059%1,5,8-9. No está claro el mecanismo mediante el cual la disección de la arteria coronaria derecha (el 87% de los casos) ocurre con mayor frecuencia que la izquierda (el 13% de los casos)1,2,5,7-11. Estudios anatómicos de esta área se han centrado en aspectos morfométricos y topográficos de los orificios de las arterias coronarias y los han correlacionado con los velos aórticos12-14. Sin embargo, hay muy pocos estudios estructurales de la relación entre estos orificios, los senos y la pared aórtica15. El estudio histológico y estructural que hemos realizado muestra que de los 30 orificios, el 75% de los orificios de la arteria coronaria derecha y el 85% de la coronaria izquierda están localizados por debajo de la unión sinotubular (línea intercomisural). Estos resultados son similares a los obtenidos por Muriago et al12, pero difieren de los aportados por Cavalcanti et al13, quienes encuentran sólo un 55% de los orificios coronarios por debajo de la unión. Por otro lado, nuestros resultados concuerdan con el estudio morfológico de Cavalcanti et al13, quienes observan que el diámetro del ostium de la coronaria izquierda es más grande que el de la derecha en el 76% de sus casos. Además, nosotros hemos encontrado que el curso proximal de las arterias coronarias posee una gran variabilidad en su trayecto inicial; sin embargo, el ángulo que forma la coronaria izquierda con la aorta ascendente es agudo (rango, 20-55º), y el de la coronaria derecha tiende a ser recto (rango, 60-88º), por lo que la unión aortocoronaria y el curso proximal de la coronaria izquierda pueden presentar un mejor abordaje para la cateterización, por su alineación coaxial con respecto a la aorta ascendente, que la coronaria derecha. En al menos dos terceras partes de los casos descritos, la disección se produce en el momento de la inyección del contraste. Así, estos factores de variabilidad en la angulación pueden desempeñar un papel facilitador junto con los factores estructurales que se comentan más adelante.
Como decíamos, otra razón puede ser estructural, en cuanto que la unión sinutubular y la pared periostial de la izquierda son diferentes de las de la derecha. Histológicamente, aunque las paredes de los senos de Valsalva derecho e izquierdo poseen sobre todo fibras de colágeno de tipo I en su parte próxima a la inserción de los velos aórticos, estas fibras disminuyen a medida que aumentan las fibras elásticas en la porción ascendente de los senos aórticos; sin embargo, más ascendente aún, en la cresta sinotubular, la izquierda posee una mayor cantidad de células musculares lisas inmersas en gran cantidad de colágeno de tipo I, y su pared periostial posee también mayor expresión de colágeno de tipo I. Es un hecho conocido que el colágeno de tipo I frente a colágeno de tipo III presenta una mayor resistencia a la tensión16, lo que podría predisponer a que el ostium coronario derecho fuera menos resistente a las tracciones y, por lo tanto, más fácil de producir disección aórtica retrógrada como complicación del intervencionismo coronario. Hemos observado, además, diferencias estructurales entre los senos coronarios y unión sinutubular normales en relación con los especímenes con cardiopatía estructural por isquemia miocárdica, lo que podría ser un factor de riesgo que incrementase la predisposición a la disección aortocoronaria; sin embargo, no hemos observado estas diferencias al comparar la afección de la coronaria aterosclerótica derecha con la izquierda, lo que indica que la patogenia de la placa aterosclerótica debe concebirse como un conjunto de noxas capaces de producir un daño endotelial, independientemente de que la unión aortocoronaria sea derecha o izquierda aunque, como afirman Zamir y Sinclair17, es la unión aortocoronaria la que se compromete con regularidad. Con algunas variaciones de un espécimen a otro, la lesión aterosclerótica penetra en la lámina elástica interna y afecta no sólo a la distribución del colágeno de tipo I de la unión sinutubular, sino también adelgaza el espesor en la proporción de fibras musculares lisas de la túnica media de la aorta. En casos más severos, la debilidad de la pared se produce en 1 o 2 mm en sentido longitudinal de la capa media, donde las fibras musculares lisas son sustituidas por fibras elásticas. La debilidad de la aorta en la enfermedad aterosclerótica podría ser un factor preexistente que podría desempeñar un papel en la disección iatrogénica ante agresiones del tipo de la tracción mecánica o inyección de contraste, como las que se producen durante la ACTP. Otro factor potencial de riesgo es la presencia de oclusión coronaria total o subtotal en su porción proximal, como hemos observado en algunos de los especímenes, lo que es posible que desempeñe un papel radicalmente distinto del de la degeneración de la capa media de la aorta, pues la recanalización percutánea es mucho más compleja y requiere maniobras más agresivas que otro tipo de estenosis.
CONCLUSIONES
Nuestro estudio muestra diferencias estructurales entre los senos aórticos y la porción proximal de las arterias coronarias derecha e izquierda. Estas diferencias indican que el seno aórtico izquierdo es más resistente a las tracciones y presiones mecánicas que el derecho y, por lo tanto, menos propenso a la disección iatrogénica. La lesión aterosclerótica que compromete la unión aortocoronaria es un factor de riesgo que incrementa la predisposición a la disección y debe tenerse en cuenta a la hora de la ACTP.
Este estudio ha recibido una beca SAF 2004-06864 del Ministerio de Educación y Ciencia (DS-Q y VC) y Royal Brompton and Harefield Hospital Charitable Fund (SYH).
Correspondencia: Dr. D. Sánchez-Quintana.
Departamento de Anatomía Humana.
Facultad de Medicina. Universidad de Extremadura.
Avda. Elvas, s/n. 06071 Badajoz. España.
Correo electrónico: damians@unex.es
Recibido el 11 de noviembre de 2005.
Aceptado para su publicación el 23 de marzo de 2006.