INTRODUCCIÓN Y OBJETIVOS: La aurícula izquierda dividida debido al cor triatriatum es un defecto cardíaco congénito infrecuente que requiere cirugía para su corrección. Se describe nuestra experiencia clínica y quirúrgica además de los diferentes aspectos diagnósticos, operatorios y evolutivos a medio y largo plazo.
PACIENTES Y MÉTODOS: Se analizan retrospectivamente los informes quirúrgicos y los datos clínicos pre y postoperatorios de 15 niños que fueron intervenidos (resección de la membrana obstructiva) entre 1981 y 1999 a una edad media de 13 meses, ninguno de los cuales tenía asociados defectos cardiovasculares complejos. Se efectuó ecocardiograma de rutina antes y después de la cirugía; el 40% de los enfermos fue intervenido sin cateterismo cardíaco previo. El tiempo de seguimiento oscila entre 8 meses y 19,3 años.
RESULTADOS: El diagnóstico se confirmó en la sala operatoria. Un enfermo de 9 meses de edad adecuadamente corregido falleció a los 60 días de la cirugía por sepsis (7%). Catorce niños sobreviven, no han requerido reoperación y están asintomáticos, con clase funcional I de la NYHA en el seguimiento; la supervivencia global es del 93% (IC del 70%: 87-99).
CONCLUSIÓN: La cirugía correctora con escisión de la membrana obstruida restablece la normalidad anatómica y hemodinámica en el cor triatriatum no asociado a cardiopatía compleja, consiguiendo un estado clínico normal.
Palabras clave
Pediatría
Cirugía
Ecocardiografía
Defectos cardíacos congénitos
INTRODUCCIÓN
El cor triatriatum (CT) izquierdo se define como un defecto en la incorporación de la vena pulmonar común a la aurícula izquierda durante los primeros estadios de la embriogénesis. La consecuencia anatómica es la aparición de una membrana fibrosa, ocasionalmente también muscular, que divide la aurícula izquierda (AI) en dos cámaras bien diferenciadas: una proximal, posterior y relacionada con las venas pulmonares (denominada también cámara venosa pulmonar), y otra distal, anterior y adyacente al orificio de la válvula mitral en la que se encuentra la orejuela izquierda (se la considera verdadera aurícula izquierda). Su prevalencia se aproxima al 0,4% de todos los defectos cardíacos 1-3.
Si bien el patrón anatómico descrito es el más frecuente, la normal conexión de las venas pulmonares con la cámara proximal puede presentar variantes como, por ejemplo, la conexión parcial de estas venas con la cámara distal, o drenar de forma anómala en otros segmentos cardíacos o vasculares. Del mismo modo, cuando el foramen oval o un defecto atrial están presentes, su relación topográfica respecto de las dos cámaras en las que se divide la AI puede ser variable. Con menor frecuencia, el CT se asocia a un ductus arterioso permeable, defecto interventricular, tetralogía de Fallot, coartación de aorta, atresia tricuspídea, transposición de grandes arterias, defecto auriculoventricular y malformación de Ebstein 1,4-8.
La certeza diagnóstica preoperatoria se ha beneficiado con la incorporación del ecocardiograma 2-D Doppler color, tanto desde la perspectiva anatómica como hemodinámica de modo que, hoy día, una mayoría de enfermos pueden ser remitidos a cirugía correctora sin la ayuda del cateterismo cardíaco 9.
El objetivo de este informe es la descripción detallada de nuestra experiencia medicoquirúrgica con esta patología destacando aquellos aspectos de interés diagnóstico, operatorio y evolutivo. PACIENTES Y MÉTODOS
Entre marzo de 1981 y diciembre de 1999 16 niños fueron diagnosticados en nuestra institución de CT mediante ecocardiografía y/o estudio hemodinámico-angiográfico. En 15 de ellos se resecó la membrana obstructiva como intervención principal, criterio que fue utilizado como inclusión para reunir la población estudiada. Un lactante con síndrome de Down y tetralogía de Fallot severa asociado al CT falleció tras cirugía paliativa (fístula sistémico-pulmonar) sin que fuera posible la resección de la membrana, razón por la que fue excluido de este informe.
Se revisaron retrospectivamente los historiales médicos de cada enfermo analizando la información operatoria; asimismo, los datos clínicos y los derivados de estudios complementarios realizados en los períodos pre y postoperatorios fueron también evaluados. Para reconocer el estado actual de cada enfermo se examinó el informe de la última visita durante el seguimiento, siempre que la misma se efectuara en los 6 meses recientes al cierre de la adquisición de datos; en caso contrario, se obtuvo la información mediante el acceso telefónico.
En todos los niños se realizó ecocardiograma (uno con técnica M y 14 con 2-D); desde 1991 se asoció al modo bidimensional la tecnología Doppler con mapeo en color (n = 8). En el 60% de los niños (9/15) se consideró necesario el cateterismo cardíaco preoperatorio (en siete antes de 1992 y en dos en 1999). El diagnóstico se efectuó a una edad media de 10 meses, siendo la relación varón/mujer de 0,87. El CT se presentó asociado a ductus arterioso permeable (n = 1), estenosis valvular pulmonar leve (n = 1), defecto interauricular tipo fosa oval (n = 2), vena cava superior izquierda que drenaba en el seno coronario (n = 2), vena vertical con origen en la cámara proximal de AI que drenaba en la vena innominada (n = 1), y defecto auriculoventricular parcial (n = 2).
La cirugía correctora fue llevada a cabo entre los 2 meses y los 15 años de edad (media: 13 meses), seis eran lactantes menores de un año en el momento de la corrección operatoria. El peso corporal medio fue de 8,3 kg (4-35 kg). En la tabla 1 se exponen los datos demográficos, clínicos y quirúrgicos más destacables.
El 47% (7/15) de los niños -con preferencia lactantes- presentaban clínica de insuficiencia cardíaca congestiva y más de la mitad se encontraba en clase funcional III-IV de la NYHA; en todos ellos se continuó o inició tratamiento farmacológico (digital y diuréticos) antes de la cirugía. Se reconocieron infecciones respiratorias repetidas en 4 niños (27%), mientras que fue manifiesto un retraso pondoestatural en el 40% de los integrantes de la serie (6/15). En el momento de establecer el diagnóstico, sólo 3 niños (20%) estaban asintomáticos y en estudio para tipificar un soplo cardíaco.
En la radiografía de tórax predominó la cardiomegalia de leve a moderada (87%) y la congestión venosa pasiva pulmonar (66%), mientras que en 3 niños también se observó hiperaflujo pulmonar activo. La sobrecarga de cavidades derechas con el eje del QRS desviado a la derecha en el ECG fue patente en el 87% de los enfermos; el patrón de bloqueo en la rama derecha del haz de His se reconoció en 3 niños, y en dos se observó hemibloqueo anterior izquierdo asociado. RESULTADOS
Observaciones ecocardiográficas y angiohemodinámicas
En todos los estudios ecocardiográficos realizados se sospechó la presencia del CT. La decisión operatoria fue acordada en 7 niños sólo con la información resultante de dicha exploración; los cortes anatómicos más fiables y seguros para el diagnóstico fueron el eje largo paraesternal de cavidades izquierdas y el 4 cámaras apical. El eje de la presunción diagnóstica fue la visualización de una membrana que dividía la aurícula izquierda (AI) en dos cámaras bien diferenciadas. En el único enfermo estudiado sólo con técnica M se sospechó la existencia de la misma por un eco lineal dentro de la AI y un temblor diastólico en ambas hojas mitrales, en ausencia de signos sugerentes de estenosis valvular.
En 5 enfermos se objetivó un foramen oval permeable -hallazgo mayoritariamente definido con la ayuda de la técnica Doppler y mapeo en color-, y en tres un verdadero defecto interauricular. Excepto en los 2 niños con defecto auriculoventricular parcial y ranura mitral asociada, la comunicación relacionaba la cámara proximal de la AI con la aurícula derecha (fig. 1a). Dos niños acudieron a nuestra unidad con un erróneo diagnóstico ecográfico: en uno, la membrana simulaba un seno coronario dilatado y la sospecha de conexión venosa pulmonar anómala fue considerada; en otro, la disfunción de ventrículo derecho con regurgitación tricuspídea secundaria a hipertensión pulmonar indujo a considerar una miocardiopatía restrictiva con afectación derecha debido a que se interpretó como una arteria pulmonar dilatada lo que en realidad era la propia cámara proximal (figs. 1b y 2).
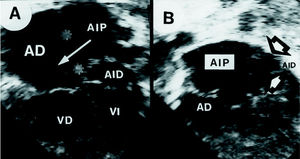
Fig. 1. Imágenes ecocardiográficas que demuestran, en 4 cámaras apical, (A) la membrana que divide la aurícula izquierda y un defecto interauricular central (asteriscos) que comunica la cámara proximal (AIP) con la aurícula derecha (AD; flecha). Desde plano subcostal (B) (caso 9) se visualiza la partición de la aurícula izquierda. La AID fue interpretada como seno coronario (flechas), en este caso sin defecto atrial. VI: ventrículo izquierdo; VD: ventrículo derecho.
En 8 enfermos, la muestra Doppler continua en el corte de 4 cámaras se alineó en la dirección del flujo desde la cámara proximal a la distal, el gradiente deducido de la velocidad registrada se situó entre los 8 y 25 mmHg. El patrón Doppler demostró un pico final debido a la contracción auricular asociado a la típica aceleración diastólica (fig. 2c). En 3 de los 8 niños estudiados con esta técnica se observó, además, flujo positivo de baja velocidad que se desaceleraba a lo largo de la sístole en la cámara distal.
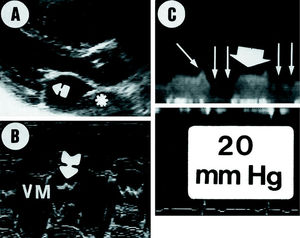
Fig. 2. Composición ecocardiográfica correspondiente a un mismo enfermo (caso 11) en la que se observa en el eje largo (A) la división de la AI; la cámara proximal (asterisco) fue interpretada como arteria pulmonar dilatada. B: se aprecia el temblor en ambas hojas mitrales. C: se observa el patrón Doppler con las ondas E (flecha fina) y A (flecha gruesa) preservadas con alta velocidad. En sístole (flechas paralelas) se visualiza el flujo que continúa atravesando el orificio de la membrana durante la sístole.
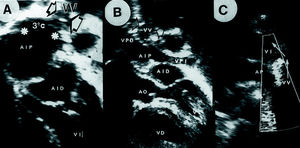
Con color también fue evidente la turbulencia del flujo en la cámara distal (fig. 3), localizándose el jet excéntrico en un tercio de los casos. Seis niños tenían regurgitación tricuspídea calificada como de leve a moderada, lo que permitió estimar la presión pulmonar. En el caso 15, además de la típica división intraauricular se observaron dos detalles anatómicos de particular interés: a) una tercera cámara muy posterior que recibía todas las venas pulmonares y conectaba ampliamente y sin obstrucción aparente con el compartimiento proximal de la AI, y b) mediante mapeo en color se visualizó una estructura vascular que, conectada a la mencionada tercera cámara, dirigía su flujo venoso hacia el territorio de la vena innominada y se trataba de una vena vertical permeable (fig. 4).
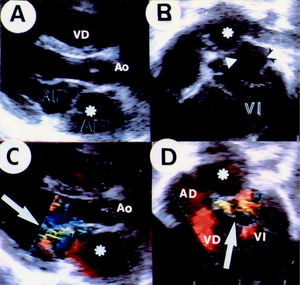
Fig. 3. Composición ecocardiográfica que en A (eje largo) y B (4 cámaras) demuestra la típica configuración de la aurícula izquierda dividida. En C y en D se aprecia, con la ayuda del mapeo en color, la excentricidad del jet que se dirige anterior y derecho (flechas). El asterisco señala la aurícula izquierda proximal.
Fig. 4. Imagen ecocardiográfica (caso 15) en la que se observa en A la presencia de la membrana obstructiva que divide la AI (AIP y AID); en una localización más posterior aparece una tercera cámara (3 ¼C) que recoje las venas pulmonares y conecta ampliamente (asteriscos) con la AIP y desde ella asciende una vena vertical que drena en la vena innominada (B,VV, flechas finas). AP: arteria pulmonar izquierda.
La presión sistólica en arteria pulmonar en los 9 enfermos sometidos a cateterismo cardíaco osciló entre 28 y 65 mmHg, mientras que el gradiente «transmembrana» (estimado entre el capilar pulmonar y la presión diastólica final del ventrículo izquierdo, o entre la cámara proximal y distal de la AI facilitando el acceso por el foramen oval o defecto interauricular) se registró entre 10 y 23 mmHg. En todos los casos excepto en uno -al igual que con eco 2D-, no fue posible deducir por angiografía de manera fiable la posición espacial de la membrana obstructiva (caso 5).
Observaciones operatorias, complicaciones y seguimiento
El diagnóstico de CT fue confirmado por el cirujano en todos los casos. Mediante esternotomía media se abordó la aurícula izquierda desde la aurícula derecha ampliando el foramen oval o la comunicación interauricular en 12 niños; en uno se utilizó la propia AI como vía de acceso y en dos se combinaron ambos caminos. Previa inspección visual de las estructuras vecinas, con el objeto de no dañarlas, se realizó la resección cuidadosa de la membrana obstructiva; en un niño, la zona de AI más angosta adyacente a las venas pulmonares tuvo que ser ampliada con PTFE (caso 3, con morfología en reloj de arena del atrio izquierdo). En el único enfermo en quien no fue posible definir la posición de la membrana por ningún método de imagen, la anatomía quirúrgica demostró que la misma tenía una orientación diagonal, dejando las venas pulmonares derechas conectadas con la cámara proximal, mientras que las izquierdas conectaban con la cámara distal (estado anatómico que tampoco fue definido antes de la cirugía, caso 5).
El tiempo medio de bypass circulatorio fue de 55 min (35-160 min). La hipotermia fue ligera o moderada según necesidad y/o decisión del cirujano, alcanzándose una temperatura rectal media de 28 ¼C (entre 16 y 34 ¼C). Sólo 2 enfermos requirieron hipotermia profunda (16 y 18 ¼C) y parada cardiocirculatoria de 10 y 17 min de duración, respectivamente. La oclusión aórtica tuvo una duración media de 35 min (12-115 min), y la protección miocárdica se llevó a cabo con cardioplejía cristaloide St. Thomas I en 3 casos y St. Thomas II (Plegisol, de Abbott) en 11 casos; la cardioplejía hemática tipo Buckberg se utilizó en un enfermo.
Los defectos asociados fueron corregidos en el mismo acto operatorio, con excepción de la estenosis pulmonar, que se consideró leve, y las dos venas cavas izquierdas a seno coronario, que no precisaban intervención alguna. Las comunicaciones auriculares se cerraron con sutura directa o con parche de pericardio autólogo y el foramen oval con un punto de sujeción en «U». El tiempo de hospitalización medio fue de 12 días (6-90 días) y, al alta hospitalaria, sólo un enfermo fue dado de alta con diuréticos. Dos enfermos presentaron cuadros sépticos (13%) de los cuales uno falleció a los 60 días de la cirugía (mortalidad precoz del 7%); en otros 4 enfermos se observaron alteraciones transitorias del ritmo cardíaco que no requirieron medicación específica.
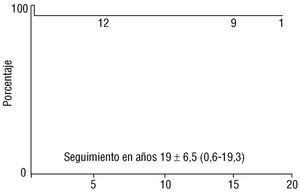
Se realizó seguimiento clínico en 14 enfermos (93%), con un mínimo de 8 meses y un máximo de 19,3 años (10 ± 6,5). No se registró mortalidad tardía y no fueron necesarias reintervenciones en ninguno de ellos. La curva actuarial de supervivencia se expone en la figura 5 (93%; IC del 70%: 87-99). Todos los enfermos están asintomáticos, sin medicación y en clase funcional I. El estado clínico fue estimado por la anamnesis y en 7 casos a través de la ergometría. La última exploración ecocardiográfica demostró que en 3 enfermos (operados entre 1993 y 1999) persiste una leve dilatación del ventrículo derecho, y en dos una insuficiencia tricuspídea trivial registrada con baja velocidad Doppler; en el seguimiento no se observó turbulencia de flujo significativa residual dentro de la AI.
Fig. 5. Gráfica de supervivencia (Kaplan-Meier) con una media de 10 años de seguimiento (extendida hasta el único niño que alcanzó los 19,3 años). Supervivencia: 93% (IC del 70%: 87-99).
DISCUSIÓN
El CT es una anomalía poco frecuente cuya presentación clínica depende en esencia de los efectos hemodinámicos que genera la congestión venosa pulmonar. Sin embargo, la sintomatología puede estar ausente debido a diferentes factores que atenúan las consecuencias de la obstrucción al modificar la condición hemodinámica señalada: a) el tamaño y/o número de los orificios presentes en la membrana; b) un foramen oval amplio o una genuina comunicación interauricular entre la cámara proximal y la aurícula derecha que libera al pulmón de la congestión venosa; c) presencia de conexión venosa pulmonar anómala o diferente localización de la misma en relación a las dos cámaras en las que se divide la AI (caso 15 de esta serie), d) patología asociada con o sin hipoaflujo pulmonar, y e) presencia de vena vertical (vena cava superior izquierda) que desvía el flujo sanguíneo desde aurícula izquierda proximal hacia otro territorio venoso sistémico.
Debido a estos mecanismos, el diagnóstico de CT y su impacto clínico pueden enmascararse. De modo especial, la anomalía debe ser excluida en aquellos enfermos portadores de la condición 4 con hipoaflujo pulmonar, ya que cualquier intento quirúrgico de aumentar el volumen circulatorio al pulmón sin actuar sobre el CT puede llevar a un desenlace fatal, evento que forma parte de nuestra experiencia. En cualquier caso, la presentación clínica en los niños presentados en este informe guardó estrecha relación con los mecanismos descritos 10,11.
El método electivo para el diagnóstico correcto del CT es la ecocardiografía 2D. La técnica Doppler y el mapeo en color acentúan los detalles anatómicos y funcionales, de modo que una experta exploración puede hacer innecesario el cateterismo cardíaco, como se confirma en los 7 niños de esta serie, que fueron operados sin estudio invasivo. Debido a que es posible la presencia de anomalías de la conexión venosa pulmonar, o incluso una errónea o insuficiente interpretación de las imágenes retroauriculares (caso 5), es indispensable contar con la contribución del Doppler y el mapeo en color en la exploración. Determinados autores incorporan el ecocardiograma intraesofágico y la resonancia magnética como métodos alternativos para optimizar el diagnóstico 6,10-13.
Es interesante destacar la presencia de flujo constante de diferente velocidad e intensidad (mayor en diástole y menor con desaceleración en sístole) a través de la membrana en las 2 fases del ciclo cardíaco (fig. 2). Este patrón Doppler parece corresponder al flujo sanguíneo, que continúa atravesando el orificio restrictivo durante la sístole debido a que se perpetúa -aunque en descenso- la elevada presión en la cámara proximal respecto de la distal. Este fenómeno hemodinámico ya fue descrito por otros investigadores 14,15.
El tratamiento quirúrgico con resección de la membrana es la elección ineludible en el CT. El pronóstico, no obstante, está en relación con la complejidad de los defectos asociados. En lactantes y niños pequeños, el abordaje habitual se realiza a través de la aurícula derecha, ampliando la comunicación interauricular, mientras que en niños mayores puede abordarse la aurícula izquierda directamente por detrás del surco interatrial. La mayoría de las publicaciones enfatizan que la cirugía en enfermos con CT aislado o asociado a defectos «menores» restablece la normalidad anatómica y hemodinámica. Si bien hacemos constar que nuestra serie tiene el sesgo derivado de la ausencia de patología compleja añadida, los resultados presentados no contradicen aquella información; la clase funcional de nuestros enfermos, estimada durante el seguimiento, confirma que la calidad de vida es comparable con la normalidad 10,11,16-19.
El cor triatriatum (CT) izquierdo se define como un defecto en la incorporación de la vena pulmonar común a la aurícula izquierda durante los primeros estadios de la embriogénesis. La consecuencia anatómica es la aparición de una membrana fibrosa, ocasionalmente también muscular, que divide la aurícula izquierda (AI) en dos cámaras bien diferenciadas: una proximal, posterior y relacionada con las venas pulmonares (denominada también cámara venosa pulmonar), y otra distal, anterior y adyacente al orificio de la válvula mitral en la que se encuentra la orejuela izquierda (se la considera verdadera aurícula izquierda). Su prevalencia se aproxima al 0,4% de todos los defectos cardíacos 1-3.
Si bien el patrón anatómico descrito es el más frecuente, la normal conexión de las venas pulmonares con la cámara proximal puede presentar variantes como, por ejemplo, la conexión parcial de estas venas con la cámara distal, o drenar de forma anómala en otros segmentos cardíacos o vasculares. Del mismo modo, cuando el foramen oval o un defecto atrial están presentes, su relación topográfica respecto de las dos cámaras en las que se divide la AI puede ser variable. Con menor frecuencia, el CT se asocia a un ductus arterioso permeable, defecto interventricular, tetralogía de Fallot, coartación de aorta, atresia tricuspídea, transposición de grandes arterias, defecto auriculoventricular y malformación de Ebstein 1,4-8.
La certeza diagnóstica preoperatoria se ha beneficiado con la incorporación del ecocardiograma 2-D Doppler color, tanto desde la perspectiva anatómica como hemodinámica de modo que, hoy día, una mayoría de enfermos pueden ser remitidos a cirugía correctora sin la ayuda del cateterismo cardíaco 9.
El objetivo de este informe es la descripción detallada de nuestra experiencia medicoquirúrgica con esta patología destacando aquellos aspectos de interés diagnóstico, operatorio y evolutivo. PACIENTES Y MÉTODOS
Entre marzo de 1981 y diciembre de 1999 16 niños fueron diagnosticados en nuestra institución de CT mediante ecocardiografía y/o estudio hemodinámico-angiográfico. En 15 de ellos se resecó la membrana obstructiva como intervención principal, criterio que fue utilizado como inclusión para reunir la población estudiada. Un lactante con síndrome de Down y tetralogía de Fallot severa asociado al CT falleció tras cirugía paliativa (fístula sistémico-pulmonar) sin que fuera posible la resección de la membrana, razón por la que fue excluido de este informe.
Se revisaron retrospectivamente los historiales médicos de cada enfermo analizando la información operatoria; asimismo, los datos clínicos y los derivados de estudios complementarios realizados en los períodos pre y postoperatorios fueron también evaluados. Para reconocer el estado actual de cada enfermo se examinó el informe de la última visita durante el seguimiento, siempre que la misma se efectuara en los 6 meses recientes al cierre de la adquisición de datos; en caso contrario, se obtuvo la información mediante el acceso telefónico.
En todos los niños se realizó ecocardiograma (uno con técnica M y 14 con 2-D); desde 1991 se asoció al modo bidimensional la tecnología Doppler con mapeo en color (n = 8). En el 60% de los niños (9/15) se consideró necesario el cateterismo cardíaco preoperatorio (en siete antes de 1992 y en dos en 1999). El diagnóstico se efectuó a una edad media de 10 meses, siendo la relación varón/mujer de 0,87. El CT se presentó asociado a ductus arterioso permeable (n = 1), estenosis valvular pulmonar leve (n = 1), defecto interauricular tipo fosa oval (n = 2), vena cava superior izquierda que drenaba en el seno coronario (n = 2), vena vertical con origen en la cámara proximal de AI que drenaba en la vena innominada (n = 1), y defecto auriculoventricular parcial (n = 2).
La cirugía correctora fue llevada a cabo entre los 2 meses y los 15 años de edad (media: 13 meses), seis eran lactantes menores de un año en el momento de la corrección operatoria. El peso corporal medio fue de 8,3 kg (4-35 kg). En la tabla 1 se exponen los datos demográficos, clínicos y quirúrgicos más destacables.
El 47% (7/15) de los niños -con preferencia lactantes- presentaban clínica de insuficiencia cardíaca congestiva y más de la mitad se encontraba en clase funcional III-IV de la NYHA; en todos ellos se continuó o inició tratamiento farmacológico (digital y diuréticos) antes de la cirugía. Se reconocieron infecciones respiratorias repetidas en 4 niños (27%), mientras que fue manifiesto un retraso pondoestatural en el 40% de los integrantes de la serie (6/15). En el momento de establecer el diagnóstico, sólo 3 niños (20%) estaban asintomáticos y en estudio para tipificar un soplo cardíaco.
En la radiografía de tórax predominó la cardiomegalia de leve a moderada (87%) y la congestión venosa pasiva pulmonar (66%), mientras que en 3 niños también se observó hiperaflujo pulmonar activo. La sobrecarga de cavidades derechas con el eje del QRS desviado a la derecha en el ECG fue patente en el 87% de los enfermos; el patrón de bloqueo en la rama derecha del haz de His se reconoció en 3 niños, y en dos se observó hemibloqueo anterior izquierdo asociado. RESULTADOS
Observaciones ecocardiográficas y angiohemodinámicas
En todos los estudios ecocardiográficos realizados se sospechó la presencia del CT. La decisión operatoria fue acordada en 7 niños sólo con la información resultante de dicha exploración; los cortes anatómicos más fiables y seguros para el diagnóstico fueron el eje largo paraesternal de cavidades izquierdas y el 4 cámaras apical. El eje de la presunción diagnóstica fue la visualización de una membrana que dividía la aurícula izquierda (AI) en dos cámaras bien diferenciadas. En el único enfermo estudiado sólo con técnica M se sospechó la existencia de la misma por un eco lineal dentro de la AI y un temblor diastólico en ambas hojas mitrales, en ausencia de signos sugerentes de estenosis valvular.
En 5 enfermos se objetivó un foramen oval permeable -hallazgo mayoritariamente definido con la ayuda de la técnica Doppler y mapeo en color-, y en tres un verdadero defecto interauricular. Excepto en los 2 niños con defecto auriculoventricular parcial y ranura mitral asociada, la comunicación relacionaba la cámara proximal de la AI con la aurícula derecha (fig. 1a). Dos niños acudieron a nuestra unidad con un erróneo diagnóstico ecográfico: en uno, la membrana simulaba un seno coronario dilatado y la sospecha de conexión venosa pulmonar anómala fue considerada; en otro, la disfunción de ventrículo derecho con regurgitación tricuspídea secundaria a hipertensión pulmonar indujo a considerar una miocardiopatía restrictiva con afectación derecha debido a que se interpretó como una arteria pulmonar dilatada lo que en realidad era la propia cámara proximal (figs. 1b y 2).
Fig. 1. Imágenes ecocardiográficas que demuestran, en 4 cámaras apical, (A) la membrana que divide la aurícula izquierda y un defecto interauricular central (asteriscos) que comunica la cámara proximal (AIP) con la aurícula derecha (AD; flecha). Desde plano subcostal (B) (caso 9) se visualiza la partición de la aurícula izquierda. La AID fue interpretada como seno coronario (flechas), en este caso sin defecto atrial. VI: ventrículo izquierdo; VD: ventrículo derecho.
En 8 enfermos, la muestra Doppler continua en el corte de 4 cámaras se alineó en la dirección del flujo desde la cámara proximal a la distal, el gradiente deducido de la velocidad registrada se situó entre los 8 y 25 mmHg. El patrón Doppler demostró un pico final debido a la contracción auricular asociado a la típica aceleración diastólica (fig. 2c). En 3 de los 8 niños estudiados con esta técnica se observó, además, flujo positivo de baja velocidad que se desaceleraba a lo largo de la sístole en la cámara distal.
Fig. 2. Composición ecocardiográfica correspondiente a un mismo enfermo (caso 11) en la que se observa en el eje largo (A) la división de la AI; la cámara proximal (asterisco) fue interpretada como arteria pulmonar dilatada. B: se aprecia el temblor en ambas hojas mitrales. C: se observa el patrón Doppler con las ondas E (flecha fina) y A (flecha gruesa) preservadas con alta velocidad. En sístole (flechas paralelas) se visualiza el flujo que continúa atravesando el orificio de la membrana durante la sístole.
Con color también fue evidente la turbulencia del flujo en la cámara distal (fig. 3), localizándose el jet excéntrico en un tercio de los casos. Seis niños tenían regurgitación tricuspídea calificada como de leve a moderada, lo que permitió estimar la presión pulmonar. En el caso 15, además de la típica división intraauricular se observaron dos detalles anatómicos de particular interés: a) una tercera cámara muy posterior que recibía todas las venas pulmonares y conectaba ampliamente y sin obstrucción aparente con el compartimiento proximal de la AI, y b) mediante mapeo en color se visualizó una estructura vascular que, conectada a la mencionada tercera cámara, dirigía su flujo venoso hacia el territorio de la vena innominada y se trataba de una vena vertical permeable (fig. 4).
Fig. 3. Composición ecocardiográfica que en A (eje largo) y B (4 cámaras) demuestra la típica configuración de la aurícula izquierda dividida. En C y en D se aprecia, con la ayuda del mapeo en color, la excentricidad del jet que se dirige anterior y derecho (flechas). El asterisco señala la aurícula izquierda proximal.
Fig. 4. Imagen ecocardiográfica (caso 15) en la que se observa en A la presencia de la membrana obstructiva que divide la AI (AIP y AID); en una localización más posterior aparece una tercera cámara (3 ¼C) que recoje las venas pulmonares y conecta ampliamente (asteriscos) con la AIP y desde ella asciende una vena vertical que drena en la vena innominada (B,VV, flechas finas). AP: arteria pulmonar izquierda.
La presión sistólica en arteria pulmonar en los 9 enfermos sometidos a cateterismo cardíaco osciló entre 28 y 65 mmHg, mientras que el gradiente «transmembrana» (estimado entre el capilar pulmonar y la presión diastólica final del ventrículo izquierdo, o entre la cámara proximal y distal de la AI facilitando el acceso por el foramen oval o defecto interauricular) se registró entre 10 y 23 mmHg. En todos los casos excepto en uno -al igual que con eco 2D-, no fue posible deducir por angiografía de manera fiable la posición espacial de la membrana obstructiva (caso 5).
Observaciones operatorias, complicaciones y seguimiento
El diagnóstico de CT fue confirmado por el cirujano en todos los casos. Mediante esternotomía media se abordó la aurícula izquierda desde la aurícula derecha ampliando el foramen oval o la comunicación interauricular en 12 niños; en uno se utilizó la propia AI como vía de acceso y en dos se combinaron ambos caminos. Previa inspección visual de las estructuras vecinas, con el objeto de no dañarlas, se realizó la resección cuidadosa de la membrana obstructiva; en un niño, la zona de AI más angosta adyacente a las venas pulmonares tuvo que ser ampliada con PTFE (caso 3, con morfología en reloj de arena del atrio izquierdo). En el único enfermo en quien no fue posible definir la posición de la membrana por ningún método de imagen, la anatomía quirúrgica demostró que la misma tenía una orientación diagonal, dejando las venas pulmonares derechas conectadas con la cámara proximal, mientras que las izquierdas conectaban con la cámara distal (estado anatómico que tampoco fue definido antes de la cirugía, caso 5).
El tiempo medio de bypass circulatorio fue de 55 min (35-160 min). La hipotermia fue ligera o moderada según necesidad y/o decisión del cirujano, alcanzándose una temperatura rectal media de 28 ¼C (entre 16 y 34 ¼C). Sólo 2 enfermos requirieron hipotermia profunda (16 y 18 ¼C) y parada cardiocirculatoria de 10 y 17 min de duración, respectivamente. La oclusión aórtica tuvo una duración media de 35 min (12-115 min), y la protección miocárdica se llevó a cabo con cardioplejía cristaloide St. Thomas I en 3 casos y St. Thomas II (Plegisol, de Abbott) en 11 casos; la cardioplejía hemática tipo Buckberg se utilizó en un enfermo.
Los defectos asociados fueron corregidos en el mismo acto operatorio, con excepción de la estenosis pulmonar, que se consideró leve, y las dos venas cavas izquierdas a seno coronario, que no precisaban intervención alguna. Las comunicaciones auriculares se cerraron con sutura directa o con parche de pericardio autólogo y el foramen oval con un punto de sujeción en «U». El tiempo de hospitalización medio fue de 12 días (6-90 días) y, al alta hospitalaria, sólo un enfermo fue dado de alta con diuréticos. Dos enfermos presentaron cuadros sépticos (13%) de los cuales uno falleció a los 60 días de la cirugía (mortalidad precoz del 7%); en otros 4 enfermos se observaron alteraciones transitorias del ritmo cardíaco que no requirieron medicación específica.
Se realizó seguimiento clínico en 14 enfermos (93%), con un mínimo de 8 meses y un máximo de 19,3 años (10 ± 6,5). No se registró mortalidad tardía y no fueron necesarias reintervenciones en ninguno de ellos. La curva actuarial de supervivencia se expone en la figura 5 (93%; IC del 70%: 87-99). Todos los enfermos están asintomáticos, sin medicación y en clase funcional I. El estado clínico fue estimado por la anamnesis y en 7 casos a través de la ergometría. La última exploración ecocardiográfica demostró que en 3 enfermos (operados entre 1993 y 1999) persiste una leve dilatación del ventrículo derecho, y en dos una insuficiencia tricuspídea trivial registrada con baja velocidad Doppler; en el seguimiento no se observó turbulencia de flujo significativa residual dentro de la AI.
Fig. 5. Gráfica de supervivencia (Kaplan-Meier) con una media de 10 años de seguimiento (extendida hasta el único niño que alcanzó los 19,3 años). Supervivencia: 93% (IC del 70%: 87-99).
DISCUSIÓN
El CT es una anomalía poco frecuente cuya presentación clínica depende en esencia de los efectos hemodinámicos que genera la congestión venosa pulmonar. Sin embargo, la sintomatología puede estar ausente debido a diferentes factores que atenúan las consecuencias de la obstrucción al modificar la condición hemodinámica señalada: a) el tamaño y/o número de los orificios presentes en la membrana; b) un foramen oval amplio o una genuina comunicación interauricular entre la cámara proximal y la aurícula derecha que libera al pulmón de la congestión venosa; c) presencia de conexión venosa pulmonar anómala o diferente localización de la misma en relación a las dos cámaras en las que se divide la AI (caso 15 de esta serie), d) patología asociada con o sin hipoaflujo pulmonar, y e) presencia de vena vertical (vena cava superior izquierda) que desvía el flujo sanguíneo desde aurícula izquierda proximal hacia otro territorio venoso sistémico.
Debido a estos mecanismos, el diagnóstico de CT y su impacto clínico pueden enmascararse. De modo especial, la anomalía debe ser excluida en aquellos enfermos portadores de la condición 4 con hipoaflujo pulmonar, ya que cualquier intento quirúrgico de aumentar el volumen circulatorio al pulmón sin actuar sobre el CT puede llevar a un desenlace fatal, evento que forma parte de nuestra experiencia. En cualquier caso, la presentación clínica en los niños presentados en este informe guardó estrecha relación con los mecanismos descritos 10,11.
El método electivo para el diagnóstico correcto del CT es la ecocardiografía 2D. La técnica Doppler y el mapeo en color acentúan los detalles anatómicos y funcionales, de modo que una experta exploración puede hacer innecesario el cateterismo cardíaco, como se confirma en los 7 niños de esta serie, que fueron operados sin estudio invasivo. Debido a que es posible la presencia de anomalías de la conexión venosa pulmonar, o incluso una errónea o insuficiente interpretación de las imágenes retroauriculares (caso 5), es indispensable contar con la contribución del Doppler y el mapeo en color en la exploración. Determinados autores incorporan el ecocardiograma intraesofágico y la resonancia magnética como métodos alternativos para optimizar el diagnóstico 6,10-13.
Es interesante destacar la presencia de flujo constante de diferente velocidad e intensidad (mayor en diástole y menor con desaceleración en sístole) a través de la membrana en las 2 fases del ciclo cardíaco (fig. 2). Este patrón Doppler parece corresponder al flujo sanguíneo, que continúa atravesando el orificio restrictivo durante la sístole debido a que se perpetúa -aunque en descenso- la elevada presión en la cámara proximal respecto de la distal. Este fenómeno hemodinámico ya fue descrito por otros investigadores 14,15.
El tratamiento quirúrgico con resección de la membrana es la elección ineludible en el CT. El pronóstico, no obstante, está en relación con la complejidad de los defectos asociados. En lactantes y niños pequeños, el abordaje habitual se realiza a través de la aurícula derecha, ampliando la comunicación interauricular, mientras que en niños mayores puede abordarse la aurícula izquierda directamente por detrás del surco interatrial. La mayoría de las publicaciones enfatizan que la cirugía en enfermos con CT aislado o asociado a defectos «menores» restablece la normalidad anatómica y hemodinámica. Si bien hacemos constar que nuestra serie tiene el sesgo derivado de la ausencia de patología compleja añadida, los resultados presentados no contradicen aquella información; la clase funcional de nuestros enfermos, estimada durante el seguimiento, confirma que la calidad de vida es comparable con la normalidad 10,11,16-19.
Bibliografía
[1]
Cor triatriatum, pulmonary vein obstruction, supravalvular mitral stenosis, and congenital mitral valve disease. En: Grason A, Bricker T, McNamara D, editores. The science and practice of pediatric cardiology. Filadelfia: Lea & Febiger, 1990; 1308-1315.
[2]
Cor triatriatum: study of 20 cases. Am J Cardiol 1975; 35: 59-66.
[3]
Subdivided left atrium: an expanded concept of cor triatriatum. Pediatr Cardiol 1976; 37: 743-752.
[4]
Succesful management of cor triatriatum associated with anomalous pulmonary/systemic venous conection in an infant. Pediatr Cardiol 1982; 2: 319-332.
[5]
Cor triatriatum asociado a una forma infrecuente de drenaje venoso pulmonar anomalo parcial. Causa de error diagnóstico. Rev Esp Cardiol 1983; 36: 173-177.
[6]
Cor triatrial con comunicación interventricular: diagnóstico por eco Doppler color y resonancia magnética. Corrección en los primeros meses. Rev Esp Cardiol 1997; 50: 290-292.
[7]
Cor triatriatum: pathologic anatomy and a consideration of morphogenesis based on 13 postmortem cases and a study of normal development of the pulmonary vein and atrial septum in 83 human embryos. Am Heart J 1969; 78: 379-405.
[8]
The role of color flow mapping in confirming the association of divided left atrium with and atrioventricular septal defect. Cardiol Young 1993; 3: 57-59.
[9]
Cirugía de las cardiopatías congénitas sin cateterismo previo. Valoración preoperatoria e indicación quirúrgica por ecocardiografía bidimensional y Doppler. Rev Esp Cardiol 1989; 42: 653-657.
[10]
Cor triatriatum: diagnosis, operative approach and late results. Mayo Clin Proc 1993; 68: 854-859.
[11]
Cor triatriatum sinistrum: one institution's 28-year experience. Pediatr Cardiol 1992; 13: 85-88.
[12]
Cor triatriatum sinistrum. Diagnosis features on cross sectional echocardiography. Br Heart J 1984; 51: 211-219.
[13]
Echocardiographic features of cor triatriatum. Am J Cardiol 1977; 40: 615-619.
[14]
Ecocardiografía Doppler en el cor triatriatum: a propósito de 2 casos. Rev Esp Cardiol 1989; 42: 418-421.
[15]
A characteristic continuous wave Doppler signal in cor triatriatum? Br Heart J 1992; 68: 6-8.
[16]
Cor triatriatum. Experiencia diagnóstica y quirúrgica. Arch Inst Cardiol Mex 1996; 66: 339-344.
[17]
Cor triatriatum: clinical presentation and operative results. J Thorac Cardiovasc Surg 1991; 101: 1088-1092.
[18]
Other cardiac conditions or operations. En: Moller J, editor. Perspectives in pediatric cardiology. Surgery of Congenital Heart Disease. Vol. 6. Pediatrc Cardiac Care Consortium 1984-1995 Armonk, Nueva York: Futura Publishing Company, Inc., 1998; 376-377.
[19]
Cirugía de algunas cardiopatías congénitas poco frecuentes. Monocardio 1991; 30: 32-43.