La detección del calcio de la aorta torácica mejora la predicción del riesgo cardiovascular, en cuanto a los eventos cardiacos y no cardiacos, respecto a la obtenida solo con los factores de riesgo tradicionales. En este trabajo se ha investigado la influencia de la morfometría de la aorta torácica en la presencia y la magnitud de las calcificaciones aórticas.
MétodosSe realizaron exploraciones por tomografía computarizada cardiaca sin contraste en 970 participantes asintomáticos con riesgo cardiovascular aumentado. Se utilizó un algoritmo automático para estimar la geometría de toda la aorta torácica y se cuantificó la puntuación de Agatston del calcio aórtico. Se utilizó un modelo no paramétrico para analizar los percentiles de la puntuación de calcio según la edad. Se calcularon modelos de regresión logística para identificar asociaciones anatómicas con las concentraciones de calcio.
ResultadosLas calcificaciones se concentraron en el cayado aórtico y la aorta descendente. Las mayores cantidades de calcio se asociaron con una aorta agrandada, desplegada, con menor estrechamiento y más tortuosa. El tamaño de la aorta ascendente no mostró correlación con la puntuación de calcio de la aorta, mientras que el tamaño de la aorta descendente es el parámetro que mostró mayor asociación: el riesgo de tener una puntuación de calcio global superior al percentil 90 fue 3,62 veces (intervalo de confianza, 2,30-5,91; p < 0,001) mayor por cada 2,5mm de aumento del diámetro de la aorta descendente. La reducción gradual del diámetro, la tortuosidad, el despliegue y los volúmenes del cayado aórtico y la aorta descendente estaban correlacionados con mayor cantidad de calcio.
ConclusionesLas calcificaciones se hallaron predominantemente en el cayado aórtico y la aorta descendente y mostraron asociación positiva con el tamaño de la aorta descendente y el cayado aórtico, pero no con el tamaño de la aorta ascendente. Estas observaciones indican que la dilatación aórtica puede tener mecanismos diferentes y, por consiguiente, requiere estrategias preventivas distintas según el segmento considerado.
Palabras clave
Determinar el tamaño de la aorta torácica (AT) es importante, ya que su aumento temprano puede predecir la futura formación de aneurismas aórticos, cuya frecuencia está en continuo aumento1. La estimación del tamaño aórtico (es decir, el diámetro, el volumen, la tortuosidad y los estrechamientos) resulta difícil, ya que la anatomía de la AT es compleja, sobre todo en la región del cayado aórtico, que tiene varias ramas y presenta una trayectoria curvilínea que no se mantiene en el mismo plano, se pliega y gira2,3. Recientemente se ha demostrado que la tomografía computarizada de dosis bajas y sin contraste utilizada para evaluar el calcio de las arterias coronarias permite, además, la reconstrucción de la morfología general de la AT y simultáneamente detectar el calcio de la aorta torácica (CAT)4–7.
La puntuación del CAT de Agatston es un indicador de enfermedad ateroesclerótica8, y la posibilidad de determinar simultáneamente el tamaño de la AT y el CAT permitiría un análisis de la participación de la enfermedad ateroesclerótica en la dilatación temprana de la AT según cuál sea el segmento considerado. Además, una evaluación detallada de la asociación entre CAT y geometría de la AT podría ser útil para esclarecer la distribución heterogénea de los depósitos de calcio a todo lo largo del trayecto de la AT y facilitar la detección de posibles regiones vulnerables9.
En este estudio se investiga la asociación entre tamaño de la AT y CAT en una cohorte de 970 individuos asintomáticos que presentaban un riesgo cardiovascular aumentado. Se analizaron simultáneamente una detallada descripción geométrica tridimensional de la AT y la posición y el tamaño del CAT mediante un programa informático específicamente desarrollado para ello, utilizando las exploraciones de imagen de tomografía computarizada multicorte (TCMC) sin contraste. Se calcularon modelos logísticos con ajuste por los factores de riesgo tradicionales con objeto de evaluar el papel específico de las variables geométricas de la AT en cuanto a la presencia de CAT y su cantidad y su distribución espacial.
MÉTODOSParticipantes en el estudioSe incluyó a los participantes en el estudio (n = 970) durante los 2 años siguientes a septiembre de 20094. Se incluyó en el estudio a todos los pacientes con riesgo de enfermedad cardiovascular a los que se practicó una TCMC sin contraste como parte de un programa de estratificación del riesgo cardiovascular. Esta exploración se realizó como parte de un examen de detección sistemática doble que incluía: a) estimación de la carga de ateroesclerosis coronaria calcificada, y b) detección de la dilatación aórtica temprana en los 3 segmentos de la AT, es decir, la aorta ascendente, el cayado aórtico y la aorta descendente. Se obtuvo el consentimiento informado de todos los pacientes que participaron en el estudio. Los participantes tenían como mínimo un factor de riesgo tradicional (hipercolesterolemia el 82%, hipertensión el 49%, tabaquismo actual el 20% y diabetes mellitus el 9%). Ninguno de los participantes presentaba enfermedad cardiovascular ni antecedentes de haberla tenido. La puntuación de riesgo de Framingham calculada en todos los participantes, tras el recalibrado para la población francesa, era < 20% a los 10 años10. Siguiendo lo establecido en las guías actuales11, se estratificó el riesgo de enfermedad cardiovascular ateroesclerótica de los participantes empleando una TCMC de dosis bajas y sin contraste para la determinación del calcio arterial coronario. Se utilizó una exploración extendida para cubrir la totalidad de la AT y cuantificar el CAT4. Se determinó la presión arterial en el brazo tomando la media de 3 determinaciones realizadas con un esfigmomanómetro, con el paciente en decúbito supino y tras 10min de reposo. La hipertensión se definió como una presión arterial ≥ 140/90mmHg o por el uso de medicación antihipertensiva. Se efectuaron determinaciones de la concentración de triglicéridos, colesterol total y colesterol unido a lipoproteínas de alta densidad en sangre después de 14 h en ayunas, y las concentraciones de lipoproteínas de baja densidad se calcularon con la fórmula de Friedewald o se determinaron directamente cuando no podía usarse esa fórmula. La hipercolesterolemia se determinó por concentración de colesterol unido a lipoproteínas de baja densidad en ayunas > 3,3 mmol/l o por el uso de un tratamiento reductor de las lipoproteínas de baja densidad. Se determinó la glucemia tras una noche en ayunas y se estableció la posible diabetes mellitus por una glucemia en ayunas ≥ 7 mmol/l o tratamiento antidiabético.
El análisis retrospectivo de los datos de salud personales de los participantes en el estudio fue autorizado por la Commission Nationale de l’Informatique et des Libertés (CNIL) y se atuvo a lo establecido en la Declaración de Helsinki.
Adquisición de las imágenesLas exploraciones de imagen aórtica se obtuvieron con un escáner de TCMC cardiaca de 64 cortes (Light-speed VCT, GE Health Care; Milwaukee, Wisconsin, Estados Unidos) sin contraste, durante la adquisición realizada para cuantificar el calcio arterial coronario según lo descrito previamente4. Las mediciones se llevaron a cabo con cortes axiales de 2,5 mm a 120 kVp, con una corriente del tubo de 250 mA, un tiempo de exposición de 250 ms y un campo de visión de 250 mm. La adquisición de las imágenes se realizó con sincronización prospectiva con el electrocardiograma, al 60% del intervalo R-R en dirección craneocaudal desde la parte superior del cayado aórtico hasta la altura del diafragma. La dosis efectiva de radiación evaluada en un subgrupo representativo de 200 participantes empleando esta exploración extendida fue de 1,23 ± 0,14 mSv6. Las exploraciones se exportaron en forma de archivos DICOM (Digital Imaging and Communication in Medicine) y se analizaron con un programa informático, específicamente diseñado en el laboratorio del centro, que estima la geometría de la AT en 3 dimensiones6 y calcula el tamaño y la posición de las calcificaciones de la AT4. El mismo experto, que no conocía los parámetros clínicos, realizó las mediciones del tamaño de la aorta torácica y el calcio. Se puede consultar información más detallada de la metodología en publicaciones previas4–6.
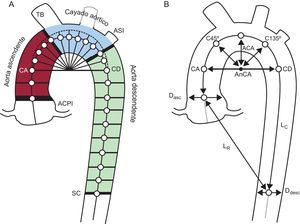
Mediciones del tamaño y la forma de la aortaEl operador inició el proceso con una selección manual de 2 puntos semilla en los cortes axiales en el centro de las aortas ascendente y descendente, a la altura de la bifurcación pulmonar (figura 1A, puntos CA y CD). A continuación, un algoritmo automático extraía el esqueleto central y estimaba el diámetro del vaso en ese punto mediante la expansión y centrado dinámicos de círculos circunscritos en el área de corte transversal del vaso6. Este algoritmo de ajuste de círculos se aplicaba secuencialmente a los cortes de la tomografía computarizada a lo largo de la parte descendente de la aorta y sobre los planos oblicuos para la parte curvilínea (figura 1A). Estos planos oblicuos se reconstruían en incrementos de ángulo de 2° siguiendo una trayectoria semitoroide. Se utilizaba el punto central de cada círculo como punto semilla para la siguiente estimación. Se realizaba una corrección de posprocesamiento para asegurar que los planos reconstruidos continuaban siendo perpendiculares a la línea central real de la aorta. El resultado de este proceso en cada paciente era una lista de ≈150 puntos de la línea central con los correspondientes diámetros que eran una aproximación al corte transversal de la aorta en cada posición.
Medición del tamaño y la forma de la aorta. A: se utilizaron dos puntos semilla en la aorta torácica ascendente y descendente para el algoritmo de segmentación automática que calculaba la línea central del vaso; los segmentos de la aorta ascendente, el cayado aórtico y la aorta descendente se separaron mediante 4 planos oblicuos a la altura de la arteria coronaria principal izquierda, el tronco braquiocefálico, la arteria subclavia izquierda y el seno coronario. B: mediciones geométricas empleadas para describir la forma de la aorta; anchura y altura del cayado aórtico, distancia del centro del cayado aórtico a los vectores diagonales (C45° y C135°), reducción gradual del calibre de la aorta calculado como porcentaje de estrechamiento del diámetro de la aorta descendente respecto a la ascendente: (Ddesc/Dasc –1) × 100; la tortuosidad de la aorta se definió como la longitud de la línea central de la aorta torácica dividida por la distancia lineal entre los puntos extremos. ACA: altura del cayado aórtico; ACPI: arteria coronaria principal izquierda; AnCA: anchura del cayado aórtico; ASI: arteria subclavia izquierda; CA: coronaria ascendente; CD: coronaria descendente; Dasc: diámetro de aorta ascendente; Ddesc: diámetro de aorta descendente; LC: longitud de la línea central de la aorta torácica; LR: distancia lineal entre los puntos extremos; SC: seno coronario; TB: tronco braquiocefálico.
Por último, se dividía el vaso sanguíneo en la parte de la aorta ascendente, el cayado aórtico y la aorta descendente, delimitadas por 4 planos a la altura de la arteria coronaria principal izquierda, el tronco braquiocefálico y la arteria subclavia izquierda, y el seno coronario (figura 1).
Se eligieron 12 variables geométricas para describir la morfología de la AT en 3 dimensiones. Estas variables se eligieron porque resumían adecuadamente las modificaciones del tamaño y la forma de la AT que se producen con el envejecimiento según algunos estudios recientes6,12,13.
El tamaño de la AT se determinó midiendo el diámetro promedio y el volumen de los segmentos de la AT ascendente, el cayado aórtico y la AT descendente. La descripción de la forma de la AT incluyó otras 6 variables: la anchura y la altura del cayado aórtico, la tortuosidad de la aorta (calculada mediante la longitud de la curva de la AT dividida por la distancia en línea recta entre los extremos), la reducción gradual del diámetro aórtico (definida como la diferencia entre el diámetro promedio de la aorta ascendente y el diámetro de la aorta descendente, normalizados respecto al diámetro de la aorta ascendente) y también dos distancias (del centro del cayado aórtico a los puntos de la línea central situados a 45° y 135°) (figura 1B).
Evaluación de la calcificaciónLas lesiones se cuantificaron con un algoritmo semiautomático utilizando el método de la puntuación de Agatston8. Para cada imagen axial, el algoritmo resaltaba todas las lesiones candidatas de área > 1 mm2 y > 130 UH. A continuación, el operador revisaba cada plano axial para validar la selección automática. Luego se calculaba la puntuación de Agatston de cada lesión empleando un valor ponderado asignado a la densidad de calcificación máxima multiplicada por el área. Se asignada a cada calcificación el segmento de la aorta más próximo. Por último, se acumulaban las puntuaciones del calcio correspondientes a cada segmento. Se presentan las puntuaciones totales y segmentarias brutas y con transformación logarítmica de cada participante.
Análisis estadísticoLas variables continuas de distribución normal se describen mediante media ± desviación estándar (DE) y las variables discretas, mediante las frecuencias (%). El CAT se expresa en forma de valores brutos y valores con transformación logarítmica (calculados mediante log [puntuación + 1]). Se comparó a los participantes con y sin CAT empleando las pruebas de la X2 para las variables discretas y de la t de Student para aquellas con distribución normal. Mediante técnicas no paramétricas, se clasificó a los pacientes según los percentiles de edad y CAT en 4 grupos14. Se siguió lo planteado en el artículo de O’Brien y Dyck15 al fijar los valores normales en distribuciones con asimetría. En consecuencia, se elaboró un modelo mediante la transformación logarítmica de la distribución de CAT como función de la edad y el sexo. Tomando la exponencial de las curvas de los percentiles 50 y 90 (p50 y p90) del CAT como función de la edad, se dividió a los participantes en 4 grupos según el CAT: CAT = 0, CAT > 0 y < p50, CAT > p50 y < p90, y CAT > p90. Se comparó la tendencia de la característica geométrica de la AT en las diversas categorías de CAT empleando ANOVA (análisis de la varianza) con ajuste por edad, sexo, área corporal e incidencia de hipertensión e hipercolesterolemia. La asociación del valor del CAT con las variables geométricas consideradas por separado se examinó mediante regresión logística con ajuste por edad, sexo, área corporal e incidencia de hipertensión e hipercolesterolemia. Se calcularon las probabilidades de presentar concentraciones de CAT crecientes respecto al grupo de CAT = 0 por cada incremento de 1 DE en cada variable geométrica. Se determinó también la asociación entre la presencia local de CAT en la aorta ascendente, el cayado aórtico y la aorta descendente y las variables geométricas locales mediante regresiones logísticas por separado. Se calcularon las odds ratio por cada incremento de 1 DE en cada uno de los parámetros con ajuste por edad, sexo, área corporal e incidencia de hipertensión e hipercolesterolemia. Todos los análisis se realizaron con el programa informático JMP 8 (SAS Institute; Cary, Carolina del Norte, Estados Unidos).
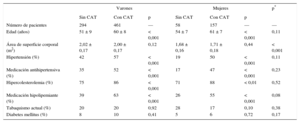
RESULTADOSLas características clínicas de la población en estudio se presentan en la tabla 1, por separado según la presencia o ausencia de CAT. En la figura 2 se presentan imágenes representativas de un paciente con CAT. Los participantes con CAT eran de mayor edad que los libres de CAT (p < 0,001). La hipertensión, el tratamiento antihipertensivo, la hipercolesterolemia y el tratamiento hipolipemiante fueron más frecuentes entre los participantes con CAT que sin este (p < 0,001 en todos los casos, excepto la hipercolesterolemia en mujeres: p < 0,01). El área de superficie corporal y la frecuencia de diabéticos y fumadores actuales no mostraron diferencias en relación con la presencia de CAT. Los factores de riesgo no diferían entre varones y mujeres con CAT.
Características basales de la cohorte de 970 participantes
| Varones | Mujeres | p* | |||||
|---|---|---|---|---|---|---|---|
| Sin CAT | Con CAT | p | Sin CAT | Con CAT | p | ||
| Número de pacientes | 294 | 461 | — | 58 | 157 | — | — |
| Edad (años) | 51 ± 9 | 60 ± 8 | < 0,001 | 54 ± 7 | 61 ± 7 | < 0,001 | 0,11 |
| Área de superficie corporal (m2) | 2,02 ± 0,17 | 2,00 ± 0,17 | 0,12 | 1,68 ± 0,16 | 1,71 ± 0,18 | 0,44 | < 0,001 |
| Hipertensión (%) | 42 | 57 | < 0,001 | 19 | 50 | < 0,001 | 0,11 |
| Medicación antihipertensiva (%) | 35 | 52 | < 0,001 | 17 | 47 | < 0,001 | 0,23 |
| Hipercolesterolemia (%) | 75 | 86 | < 0,001 | 71 | 88 | < 0,01 | 0,52 |
| Medicación hipolipemiante (%) | 39 | 63 | < 0,001 | 26 | 55 | < 0,001 | 0,08 |
| Tabaquismo actual (%) | 20 | 20 | 0,92 | 28 | 17 | 0,10 | 0,38 |
| Diabetes mellitus (%) | 8 | 10 | 0,41 | 5 | 6 | 0,72 | 0,17 |
CAT: calcio de la aorta torácica.
*Varones con calcio de la aorta torácica frente a mujeres calcio de la aorta torácica.
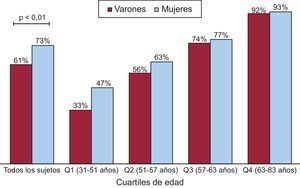
En la tabla 2 y la figura 3 se recogen las diferencias en cuanto a la presencia y la magnitud del CAT según el sexo. El valor de CAT con transformación logarítmica no mostró diferencias entre varones y mujeres en ninguno de los segmentos, ni siquiera tras introducir un ajuste por edad y superficie corporal (tabla 2). La prevalencia y los valores de la puntuación del CAT transformados logarítmicamente obtenidos en los segmentos de aorta ascendente, cayado aórtico y aorta descendente fueron en general del 21, el 66 y el 91% y 3,72 ± 2,08, 4,66 ± 1,80, y 4,57 ± 1,98 respectivamente. La prevalencia del CAT fue mayor entre las mujeres que entre los varones (p < 0,01), pero esta diferencia desapareció cuando se introdujo el ajuste por edad y área de superficie corporal (figura 3). Al realizar un análisis según los cuartiles de edad, se observó un porcentaje de mujeres con CAT mayor que de varones, pero esta diferencia no alcanzó significación estadística.
Magnitud y distribución del calcio en pacientes con calcio en la aorta torácica
| Varones con CAT (n = 461) | Mujeres con CAT (n = 157) | p | |
|---|---|---|---|
| Toda la AT | |||
| CAT con transformación logarítmica | 5,11 ± 1,91 | 5,24 ± 1,78 | 0,47 |
| Aorta ascendente | |||
| CATAsc > 0 (%) | 23 | 18 | 0,21 |
| CATAsc con transformación logarítmica | 3,72 ± 2,00 | 3,75 ± 2,37 | 0,31 |
| Cayado aórtico | |||
| CATCay > 0 (%) | 67 | 62 | 0,27 |
| CATCay con transformación logarítmica | 4,60 ± 1,82 | 4,87 ± 1,74 | 0,79 |
| Aorta descendente | |||
| CATDesc > 0 (%) | 92 | 93 | 0,56 |
| CATDesc con transformación logarítmica | 4,58 ± 2,01 | 4,55 ± 1,86 | 0,89 |
Asc: ascendente; AT: aorta torácica; CAT: calcio de aorta torácica; Cay: cayado aórtico; Desc; descendente.
En la figura 4 se presentan las curvas de p90 y p50 del CAT según edad y sexo. El CAT aumentaba exponencialmente con la edad y la curva de p90 fue similar en varones y mujeres, mientras que la curva de p50 de las mujeres evidenció un ascenso en comparación con la de los varones.
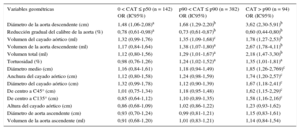
Para evaluar la asociación entre CAT y morfología aórtica, la cohorte se estratificó según la cifra de CAT y la edad, y en la tabla 3 se muestra la tendencia en los diversos valores de CAT. En general, el diámetro promedio y el volumen de la AT aumentaban a mayores cifras de CAT (p < 0,001). El tamaño de la aorta ascendente no cambió en relación con el CAT, mientras que tanto el cayado aórtico como la aorta descendente aumentaron de tamaño (p < 0,001, excepto por el diámetro del cayado aórtico: p < 0,05). La forma de la aorta evidenció también diferencias según la concentración de CAT. En los participantes con más CAT, el cayado aórtico era más ancho (p < 0,01), la distancia a los puntos de C45° y C135° era mayor (p < 0,01) y toda la AT era más tortuosa (p < 0,001) y mostraba menos reducción gradual del calibre (p < 0,001). En la tabla 4 se recoge el riesgo de tener una puntuación global de calcio < p50, p50–p90 o > p90 por cada incremento de 1 DE en cada una de las variables geométricas. Se calcularon las odds ratio respecto a los participantes con CAT = 0, con independencia de los factores de riesgo tradicionales. Se clasificaron las variables geométricas por nivel decreciente de probabilidad de tener CAT y según las concentraciones de CAT. Las únicas 2 variables geométricas asociadas a mayor probabilidad de formar parte del grupo con menos calcificación (0 < CAT < p50) fueron el diámetro de la aorta descendente (p < 0,05) y la reducción gradual del calibre de la aorta (p < 0,05). Otras 4 variables incrementaban la probabilidad de formar parte del grupo de p50 < CAT < p90: volúmenes del cayado aórtico (p < 0,001) y la aorta descendente (p < 0,05), volumen total de la AT (p < 0,05) y tortuosidad (p < 0,05). Por último, otras 5 variables geométricas se asociaron a mayor probabilidad de formar parte del grupo con la máxima calcificación (CAT > p90): diámetro medio, diámetro del cayado aórtico, anchura del cayado aórtico y distancia a los puntos C45° y C135° (p < 0,01 en todos los casos). El diámetro medio de la aorta descendente y la reducción gradual del calibre de la aorta mostraron una intensa asociación con el CAT en los 3 grupos, es decir, la probabilidad de formar parte del grupo de CAT > p90 aumentaba en 3,62 veces por 1 DE de aumento del diámetro de la aorta descendente, mientras que un aumento de 1 DE de la reducción gradual de calibre hacía que la probabilidad disminuyera en 0,60.
Comparación de las características geométricas de la aorta torácica a distintas concentraciones de calcio en la aorta torácica
| Variables de tamaño y forma de la AT | Todos (n = 970) | CAT = 0 (n = 352) | 0 < CAT ≤ p50 (n = 142) | p50 < CAT ≤ p90 (n = 382) | CAT > p90 (n = 94) | p |
|---|---|---|---|---|---|---|
| Diámetro medio (cm) | 2,92 ± 0,27 | 2,84 ± 0,25 | 2,93 ± 0,26 | 2,98 ± 0,27 | 3,06 ± 0,28 | < 0,001 |
| Volumen total (ml) | 160 ± 41 | 145 ± 33 | 156 ± 41 | 168 ± 40 | 183 ± 48 | < 0,001 |
| Diámetro de aorta ascendente (cm) | 3,32 ± 0,36 | 3,23 ± 0,34 | 3,31 ± 0,32 | 3,38 ± 0,38 | 3,43 ± 0,36 | 0,61 |
| Volumen de la aorta ascendente (ml) | 53 ± 15 | 49 ± 14 | 52 ± 14 | 55 ± 15 | 58 ± 16 | 0,34 |
| Diámetro del cayado aórtico (cm) | 2,87 ± 2,27 | 2,78 ± 0,24 | 2,90 ± 0,26 | 2,92 ± 0,27 | 2,99 ± 0,29 | < 0,05 |
| Volumen del cayado aórtico (ml) | 20 ± 7 | 18 ± 5 | 20 ± 7 | 21 ± 7 | 23 ± 8 | < 0,001 |
| Diámetro de la aorta descendente (cm) | 2,57 ± 0,25 | 2,47 ± 0,22 | 2,57 ± 0,26 | 2,62 ± 0,23 | 2,72 ± 0,25 | < 0,001 |
| Volumen de la aorta descendente (ml) | 87 ± 24 | 78 ± 19 | 86 ± 24 | 92 ± 23 | 102 ± 29 | < 0,001 |
| Anchura del cayado aórtico (cm) | 7,82 ± 1,14 | 7,43 ± 0,97 | 7,80 ± 1,06 | 8,04 ± 1,18 | 8,36 ± 1,29 | < 0,01 |
| Altura del cayado aórtico (cm) | 5,40 ± 1,14 | 5,23 ± 1,09 | 5,27 ± 1,15 | 5,53 ± 1,17 | 5,71 ± 1,06 | 0,17 |
| Tortuosidad (%) | 264 ± 30 | 254 ± 28 | 266 ± 29 | 270 ± 28 | 273 ± 33 | < 0,001 |
| Reducción gradual del calibre de la aorta (%) | 24 ± 7 | 25 ± 7 | 24 ± 7 | 24 ± 7 | 22 ± 6 | < 0,001 |
| De centro a C45° (cm) | 4,19 ± 0,58 | 4,03 ± 0,51 | 4,15 ± 0,58 | 4,30 ± 0,58 | 4,42 ± 0,63 | < 0,01 |
| De centro a C135° (cm) | 4,37 ± 0,66 | 4,17 ± 0,62 | 4,31 ± 0,63 | 4,49 ± 0,64 | 4,69 ± 0,70 | < 0,01 |
AT: aorta torácica; CAT: calcio de la aorta torácica; p50: percentil 50; p90: percentil 90.
Con ajuste por edad, sexo, área de superficie corporal, hipertensión e hipercolesterolemia.
Probabilidad de tener concentraciones de calcio de la aorta torácica crecientes por cada desviación estándar de aumento de los valores de las variables geométricas
| Variables geométricas | 0 < CAT ≤ p50 (n = 142) OR (IC95%) | p90 < CAT ≤ p90 (n = 382) OR (IC95%) | CAT > p90 (n = 94) OR (IC95%) |
|---|---|---|---|
| Diámetro de la aorta descendente (cm) | 1,48 (1,06-2,08)a | 1,68 (1,29-2,20)b | 3,62 (2,30-5,91)b |
| Reducción gradual del calibre de la aorta (%) | 0,78 (0,61-0,98)a | 0,73 (0,61-0,87)b | 0,60 (0,44-0,80)b |
| Volumen del cayado aórtico (ml) | 1,32 (0,99-1,76) | 1,35 (1,09-1,68)c | 1,78 (1,27-2,53)b |
| Volumen de la aorta descendente (ml) | 1,17 (0,84-1,64) | 1,38 (1,07-1,80)a | 2,67 (1,78-4,11)b |
| Volumen total (ml) | 1,12 (0,80-1,56) | 1,29 (1,01-1,67)a | 2,18 (1,47-3,30)b |
| Tortuosidad (%) | 0,98 (0,76-1,26) | 1,24 (1,02-1,52)a | 1,35 (1,01-1,81)a |
| Diámetro medio (cm) | 1,16 (0,84-1,61) | 1,18 (0,94-1,49) | 1,85 (1,26-2,769)c |
| Anchura del cayado aórtico (cm) | 1,12 (0,80-1,58) | 1,24 (0,98-1,59) | 1,74 (1,20-2,57)c |
| Diámetro del cayado aórtico (cm) | 1,32 (0,99-1,78) | 1,12 (0,90-1,39) | 1,67 (1,18-2,41)c |
| De centro a C45° (cm) | 1,01 (0,75-1,34) | 1,18 (0,95-1,48) | 1,62 (1,15-2,29)c |
| De centro a C135° (cm) | 0,85 (0,64-1,12) | 1,10 (0,89-1,35) | 1,58 (1,16-2,16)c |
| Altura del cayado aórtico (cm) | 0,86 (0,68-1,09) | 1,02 (0,86-1,22) | 1,23 (0,93-1,62) |
| Diámetro de aorta ascendente (cm) | 0,93 (0,70-1,24) | 0,99 (0,81-1,21) | 1,15 (0,83-1,61) |
| Volumen de la aorta ascendente (ml) | 0,91 (0,68-1,20) | 1,01 (0,83-1,21) | 1,14 (0,84-1,54) |
CAT: calcio de la aorta torácica; IC95%: intervalo de confianza del 95%; p50: percentil 50; p90: percentil 90.
La regresión logística se ajustó por edad, sexo, área de superficie corporal y presencia de hipertensión e hipercolesterolemia, respectivamente.
En la figura 5 se muestra la probabilidad de tener CAT para cada uno de los segmentos de la AT. Una mayor probabilidad de tener CAT en todos los segmentos se asociaba a un valor más alto de la media del diámetro y el volumen de la AT. Además, las probabilidades de tener CAT en la aorta ascendente aumentaban con la menor reducción gradual del calibre de la aorta. El CAT en el cayado aórtico se asociaba a la media del diámetro y el volumen total, el volumen del cayado aórtico, la anchura del cayado aórtico y las distancias a los puntos C45° y C135°. Se observaron asociaciones similares para el segmento de aorta descendente, con la adición del diámetro del cayado aórtico y la reducción gradual del calibre, pero excluyendo la distancia al punto C135°. El tamaño de la AT ascendente, la altura del cayado aórtico y la tortuosidad de la AT no mostraron asociación con la presencia de CAT en ninguno de los segmentos.
Probabilidad (odds ratio [intervalo de confianza del 95%]) de tener calcificaciones en la aorta ascendente, el cayado aórtico y la aorta descendente torácica por cada desviación estándar de aumento en cada una de las variables geométricas. Asc: ascendente; CAT: calcio en la aorta torácica ascendente; Cay: cayado aórtico; Desc: descendente. ap < 0,01. bp < 0,001. cp < 0,05.
Hasta donde se sabe, este es el primer estudio en que se hayan analizado las calcificaciones y la geometría de la AT de manera simultánea para investigar la asociación entre morfología del vaso sanguíneo y presencia y magnitud del CAT. Tanto la calcificación como la geometría se evaluaron con precisión en 3 dimensiones y en la totalidad de la AT en una cohorte de 970 participantes con un riesgo cardiovascular aumentado, utilizando para ello imágenes de TCMC. Varias variables geométricas de la AT mostraron asociación con la presencia, la magnitud y la localización de las calcificaciones de la AT, con independencia de la edad, el sexo y los factores de riesgo tradicionales. El principal hallazgo de este estudio en cuanto a la repercusión clínica es que la dilatación de la aorta descendente, con la consiguiente reducción de la disminución gradual del calibre aórtico, estaba intensamente asociada a una mayor probabilidad de hallar CAT, mientras que el tamaño de la parte ascendente de la AT no estaba relacionado con el CAT.
Resulta difícil determinar si la pérdida de la reducción gradual del calibre de la aorta es la causa o la consecuencia de las mayores concentraciones de CAT. En general, las calcificaciones se concentraron sobre todo en el cayado aórtico y el segmento descendente de la AT4,16,17, y la geometría podría ser útil para explicar esta distribución heterogénea. Aunque se cree que la tensión de cizallamiento no oscilatoria facilita la formación de infiltraciones grasas y de placas ricas en colesterol, las calcificaciones se forman en lugares en que se observan tensiones de cizallamiento bajas pero con fluctuaciones de tensión rápidas18,19. El estrechamiento de la aorta estabiliza el flujo sanguíneo y retrasa la atenuación del flujo helicoidal3, mientras que la reducción gradual del calibre de la aorta acelera la velocidad del flujo hacia la región de la aorta descendente, con lo que evita un estancamiento del flujo y la formación de placas9. Además, se ha señalado que la influencia del patrón de flujo helicoidal inhibiría áreas de estancamiento del flujo, con lo que se evitaría la acumulación de lípidos, en especial a lo largo de la aorta ascendente y el cayado aórtico3. Pero por otro lado, dado que el proceso ateroesclerótico se inicia antes en la aorta descendente20, el agrandamiento de la AT descendente puede interpretarse como un mecanismo de compensación para contrarrestar la rigidez del vaso y la progresión de la estenosis luminal21,22. En cierta medida, la geometría de la AT tiene una influencia directa en los perfiles de velocidad del flujo sanguíneo, creando zonas de predisposición a la calcificación. Sin embargo, el CAT también puede interpretarse como la expresión de un trastorno ateroesclerótico que, de hecho, produzca una deformación geométrica. Lamentablemente, la técnica de la TCMC sin contraste no permite diferenciar entre la calcificación vascular situada en el interior de la íntima (en el contexto de las placas ateroescleróticas) y la del interior de la media (que se asocia a la arteriosclerosis)21, aunque ambas parecen asociarse a la detección de CAT23. Las calcificaciones de la media son un indicador de la enfermedad de la pared aórtica, que puede debilitar la resistencia de dicha pared a las fuerzas de tensión y las fuerzas mecánicas, con lo que se propicia la dilatación crónica de la aorta. Al aumentar el tamaño, podría desencadenarse la formación de un círculo vicioso de agrandamiento. Aunque se ha señalado que la ateroesclerosis puede desempeñar un papel menor en la dilatación aórtica, en comparación con la edad y otros factores de riesgo20, no debiera desdeñarse su influencia, ya que los efectos se concentran en la parte distal de la AT, donde: a) se produce la mitad de todos los aneurismas, y b) el implante de stents endovasculares está pasando rápidamente a ser la técnica de tratamiento de elección24. En resumen, es probable que la geometría de la aorta influya en la localización de las calcificaciones de la íntima, mientras que las calcificaciones de la media podrían tener mayor asociación con la rigidez de la aorta y podrían ser causa de la dilatación de la AT descendente como mecanismo de compensación. El carácter transversal del presente estudio no permite extraer conclusiones respecto a la posible relación causa-efecto.
Al analizar la geometría de la AT en función de las concentraciones de CAT crecientes, hubo diversas variables geométricas con asociación progresiva con la acumulación de calcio, con independencia de la edad, el sexo y los factores de riesgo tradicionales (tabla 4). Tiene interés señalar que la dilatación de la aorta descendente y la pérdida de la reducción gradual del calibre de la aorta fueron las primeras variables anatómicas que se modificaron en los pacientes con pequeñas cantidades de calcio, y podrían indicar los primeros pasos de la enfermedad ateroesclerótica aórtica. El análisis morfológico y el funcional deben complementarse para mejorar la predicción de las enfermedades cardiovasculares agudas25. Se ha observado que las calcificaciones vasculares están correlacionadas con las fuerzas de la pared arterial en diferentes lechos vasculares26 y también con el aumento de la rigidez de la AT27. Estos resultados alentadores indican que debe persistir la estrategia de identificar factores de riesgo geométricos y funcionales para comprender mejor los mecanismos de la ateroesclerosis.
Las diferencias entre los sexos en cuanto a la presencia y la magnitud de la calcificación de la aorta no están del todo claras28. No se observaron diferencias significativas del CAT entre varones y mujeres al aplicar un ajuste por edad y área de superficie corporal, si bien las puntuaciones fueron más altas en las mujeres (tabla 2, figuras 3 y 4). Allison et al29 identificaron la AT proximal como el único lecho vascular en que la prevalencia de la calcificación era mayor en las mujeres de menos edad (< 50 años) en comparación con los varones. En otros estudios se ha hallado mayor prevalencia de CAT en las mujeres de todas las edades28,30, pero se han presentado también resultados contradictorios31. Se ha descrito que el cayado aórtico es una zona vulnerable a la calcificación en las mujeres4,32, y ello podría explicar la tendencia general observada en el presente estudio. Hay evidencia clara de que la aparición de la osteoporosis en las mujeres, como proceso metabólico del calcio óseo, permite explicar en parte también esta mayor prevalencia33.
LimitacionesEste estudio tuvo algunas limitaciones. En primer lugar, como ya se ha mencionado, a partir de este estudio transversal no se pudo atribuir al CAT y la morfología de la AT el papel de exposición o de resultado. En segundo lugar, los participantes tenían riesgo de enfermedad cardiovascular y, por consiguiente, los resultados no pueden extrapolarse a la población general. En tercer lugar, la dosis de radiación necesaria para este campo de medición extendido para incorporar el cayado aórtico fue ligeramente superior a la dosis de radiación utilizada al medir el CAT en la detección tradicional del calcio arterial coronario.
Por último, los resultados tienen ciertas consecuencias clínicas. En primer lugar, los mecanismos de la dilatación temprana de la AT pueden ser diferentes en la aorta descendente o el cayado aórtico y la aorta ascendente. De hecho, partiendo del supuesto de que el CAT es un indicador de enfermedad ateroesclerótica, la asociación del CAT con la dilatación de la aorta descendente y el cayado aórtico va a favor del mecanismo de la dilatación aórtica relacionada con la ateroesclerosis. El presente análisis confirma el concepto de que la enfermedad de la AT está dividida en 2 entidades: en el segmento ascendente no es ateroesclerótica, a diferencia de lo que ocurre en el segmento descendente, en el que la ateroesclerosis es abundante1. Por otro lado, la ausencia de asociación entre CAT y dilatación de la aorta ascendente indica que esta puede no estar ligada principalmente a la ateroesclerosis y podría depender de otros mecanismos. Entre ellos se encuentran las enfermedades genéticas de la pared de la aorta ascendente que, en lo relativo a la malformación valvular, desempeñan un papel importante en la formación de los aneurismas de la AT ascendente. En segundo lugar, los resultados obtenidos tienen también consecuencias en lo relativo a las intervenciones terapéuticas para retardar o prevenir la dilatación de la aorta y la formación de futuros aneurismas. El carácter ateroesclerótico de la dilatación de la aorta descendente indica que son importantes las intervenciones antiateroescleróticas convencionales basadas en la corrección agresiva de los factores de riesgo tradicionales. La prevención terapéutica de la dilatación de la aorta ascendente no está clara, dada la ausencia de asociación directa con la enfermedad ateroesclerótica. Las recomendaciones actuales proponen emplear bloqueadores beta para prevenir la progresión a aneurisma, probablemente porque este tipo de fármacos puede modificar los patrones de velocidad del flujo sanguíneo que intervienen en este segmento de la aorta y atenuar el impacto sistólico en la pared vascular. Sin embargo, todas estas consecuencias clínicas deberán confirmarse en futuros estudios.
CONCLUSIONESEste estudio muestra asociación entre la calcificación de la AT y la geometría de esta, independientemente de la edad, el sexo, el área de superficie corporal y los factores de riesgo tradicionales. Las posibles relaciones entre la geometría de la AT y la calcificación vascular deberán analizarse en lo relativo a los patrones de flujo sanguíneo y los mecanismos biomecánicos compensatorios que actúan en el interior de la pared arterial. El CAT mostró correlación positiva con los tamaños de la aorta descendente y el cayado aórtico, pero no con el de la aorta ascendente. Esto indica que la dilatación de la AT puede tener mecanismos diferentes y, por consiguiente, estrategias de prevención distintas según el segmento en que se observa.
CONFLICTO DE INTERESESNinguno.
- -
Los depósitos de calcio en las arterias son un signo de ateroesclerosis y se han asociado a mayor riesgo de muerte y eventos cardiovasculares.
- -
Las calcificaciones en las arterias coronarias y la AT pueden evaluarse con exactitud mediante imágenes de tomografía computarizada cardiaca, pero generalmente se excluye el cayado aórtico.
- -
Se ha observado que la detección y la medición del CAT mejoran la predicción del riesgo cardiovascular por encima de lo obtenido solo con los factores de riesgo tradicionales.
- -
El CAT se ha asociado a la enfermedad vascular coronaria, cerebral y periférica, pero el papel de la geometría en cuanto a la presencia y la magnitud de las calcificaciones está menos claro.
- -
Se evaluó simultáneamente el CAT y la geometría aórtica tridimensional detallada mediante imágenes de tomografía computarizada con dosis bajas y sin contraste, incluyendo en ellas el cayado aórtico.
- -
Diversas variables de la geometría aórtica se asociaron a la presencia, la magnitud y la localización de las calcificaciones, independientemente de la edad, el sexo y los factores de riesgo tradicionales.
- -
El CAT mostró relación positiva con los tamaños de la aorta descendente y el cayado aórtico, pero no con el de la aorta ascendente.
- -
La dilatación de la AT puede tener mecanismos diferentes y, por consiguiente, estrategias de prevención distintas según los segmentos que se consideren.
Damos las gracias a Sandra Wray por su valiosa ayuda en la revisión de este manuscrito.










![Probabilidad (odds ratio [intervalo de confianza del 95%]) de tener calcificaciones en la aorta ascendente, el cayado aórtico y la aorta descendente torácica por cada desviación estándar de aumento en cada una de las variables geométricas. Asc: ascendente; CAT: calcio en la aorta torácica ascendente; Cay: cayado aórtico; Desc: descendente. ap < 0,01. bp < 0,001. cp < 0,05. Probabilidad (odds ratio [intervalo de confianza del 95%]) de tener calcificaciones en la aorta ascendente, el cayado aórtico y la aorta descendente torácica por cada desviación estándar de aumento en cada una de las variables geométricas. Asc: ascendente; CAT: calcio en la aorta torácica ascendente; Cay: cayado aórtico; Desc: descendente. ap < 0,01. bp < 0,001. cp < 0,05.](https://static.elsevier.es/multimedia/03008932/0000006900000009/v3_201609140030/S0300893216300124/v3_201609140030/es/main.assets/thumbnail/gr5.jpeg?xkr=eyJpdiI6Im9sVm1ZOEoxUmEyYmpHcVN2UGJDQmc9PSIsInZhbHVlIjoibVJBcTdRZVd0QUlpNnN3TEV3QlBDWVZNVkNsTjIwa0JNYXlkOVNwTFB1QT0iLCJtYWMiOiI2NGY0YjVlYzdjZmZlMmFhNTc4ZjY3YWExMzRiODFkNzhkNDAwZmMzZWFlZTk3ZmI2ZjIwY2ExZWZiNjYxZmZhIiwidGFnIjoiIn0=)