La influencia de la cinética de la hemoglobina en la insuficiencia cardiaca no se ha establecido por completo.
MétodosSe determinó la hemoglobina en la primera visita y a los 6 meses. La anemia se definió según los criterios de la Organización Mundial de la Salud (hemoglobina < 13g/dl los varones y < 12g/dl las mujeres). Según los valores de hemoglobina, se estableció una clasificación de los pacientes como sin anemia (ambas determinaciones normales), con anemia transitoria (anemia en la primera visita, pero no a los 6 meses), con anemia de nueva aparición (inicialmente sin anemia, pero con anemia a los 6 meses) o con anemia permanente (anemia en ambas determinaciones).
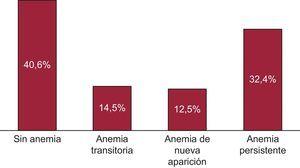
ResultadosSe incluyó en el estudio a 1.173 pacientes consecutivos (el 71,9% varones; media de edad, 66,8 ± 12,2 años). Se consideró sin anemia a 476 pacientes (40,6%), con anemia transitoria a 170 (14,5%), con anemia de nueva aparición a 147 (12,5%) y con anemia persistente a 380 (32,4%). Durante un seguimiento de 3,7 ± 2,8 años después de la visita realizada a los 6 meses, fallecieron 494 pacientes. En los análisis multivariables generales, la anemia (p < 0,001) y el tipo de anemia (p < 0,001) continuaron siendo factores independientes predictivos de mortalidad por cualquier causa. En comparación con los pacientes sin anemia, aquellos con anemia persistente (hazard ratio [HR]=1,62; intervalo de confianza del 95% [IC95%], 1,30-2,03; p < 0,001) o con anemia de nueva aparición (HR=1,39; IC95%, 1,04-1,87; p=0,03) presentaron más mortalidad, e incluso los pacientes con anemia transitoria mostraron una tendencia similar, aunque sin alcanzar significación estadística (HR=1,31; IC95%, 0,97-1,77; p=0,075).
ConclusionesLa anemia —en especial la persistente y la de nueva aparición y, en menor medida, la anemia transitoria— tiene efectos nocivos en la insuficiencia cardiaca.
Palabras clave
A pesar de los extraordinarios avances terapéuticos que se han producido en las últimas dos décadas, la insuficiencia cardiaca (IC) continúa ocupando uno de los primeros lugares entre las enfermedades cardiovasculares en lo que respecta a mortalidad y comorbilidades. La anemia es una comorbilidad frecuente en los pacientes con IC, con una prevalencia de un 5-55% según el valor de corte utilizado para definir anemia1,2, y se asocia a una evolución desfavorable3–5. En una revisión sistemática de la bibliografía Groenveld et al6 observaron que la anemia conlleva un aumento al doble del riesgo de muerte por cualquier causa, con una relación lineal entre valores de hemoglobina más bajos y mortalidad. Además, los pacientes con anemia tienen peor tolerancia al esfuerzo y presentan mayor deterioro funcional7,8, efecto que parece ser similar entre los pacientes con fracción de eyección conservada y deprimida9.
La etiología de la anemia en la IC es multifactorial, y se ha propuesto la existencia de múltiples factores contribuyentes10–12, como la reducción de la absorción intestinal, el aumento de las citocinas inflamatorias, la hemodilución, el deterioro de la función renal, la disminución de la producción de eritropoyetina y reducción de transferrina a causa de proteinuria. El tratamiento de la anemia con suplementos de hierro o con eritropoyetina no ha logrado reducir la mortalidad en ensayos controlados y aleatorizados13–15, si bien se han descrito efectos beneficiosos en clase funcional y una reducción de las hospitalizaciones por progresión de la IC16,17. De hecho, es poco lo que se conoce acerca de la cinética de la hemoglobina en la IC, y actualmente no se conoce por completo si los cambios en la evolución de la anemia influyen en la evolución clínica durante un seguimiento a largo plazo2,18,19. En consecuencia, el objetivo de este estudio es examinar si los cambios en el estado anémico a lo largo de 6 meses afectan a la supervivencia a largo plazo en una cohorte de pacientes ambulatorios con IC tratados en una clínica de IC estructurada.
MÉTODOSPoblación en estudioSe incluyó en el estudio a todos los pacientes ambulatorios consecutivos remitidos a una clínica de IC estructurada de un hospital universitario entre el 1 de agosto de 2001 y el 31 de diciembre de 2012, con independencia de la etiología. Los criterios utilizados en la práctica clínica para remitir a los pacientes a la unidad de IC se han publicado previamente20,21. De manera resumida, los criterios fueron IC con al menos una hospitalización o fracción de eyección del ventrículo izquierdo (FEVI) reducida (< 40%). La mayoría de los pacientes fueron remitidos por los servicios de cardiología y medicina interna y los demás procedían del servicio de urgencias/unidad de hospitalización breve u otros servicios del hospital. Menos del 10% de los pacientes fueron admitidos en la unidad de IC debido a FEVI deprimida asintomática tras un infarto agudo de miocardio. Se excluyó a 2 pacientes a causa de una reparación valvular quirúrgica entre la situación basal y los 6 meses.
Se visitó regularmente a todos los pacientes durante el seguimiento en la unidad de IC, según las necesidades clínicas. Las visitas de seguimiento consistieron en un mínimo de una visita de enfermería cada 3 meses y una visita de un médico (cardiólogo, internista o médico de familia) cada 6 meses, así como visitas opcionales de especialistas en geriatría, psiquiatría y rehabilitación20,21. Durante la visita inicial, los pacientes dieron su consentimiento informado para la obtención de muestras para análisis y el uso de sus datos clínicos con fines de investigación.
El estudio se llevó a cabo cumpliendo las leyes de protección de datos personales según lo establecido en las guías internacionales de investigación clínica de la Declaración de Helsinki de la World Medical Association.
Evaluación de la mortalidadEl objetivo principal fue la muerte por cualquier causa. El número y las causas de las muertes durante el seguimiento se determinaron a partir de los registros de historias clínicas de la unidad de IC, otros servicios del hospital y registros de otros hospitales o a través del contacto con familiares del paciente. Los datos se verificaron mediante consulta en las bases de datos de los sistemas de salud de Cataluña y España. Se perdió el contacto con 5 pacientes durante el seguimiento, por lo que se los censuró adecuadamente en el análisis estadístico de la supervivencia.
Definición de anemiaSe determinó la hemoglobina en la primera visita y a los 6 meses. La anemia se definió según los criterios de la Organización Mundial de la Salud (OMS) (hemoglobina < 13g/dl los varones y < 12g/dl las mujeres). Se clasificó a los pacientes, en función de los valores de hemoglobina que presentaban, como sin anemia (ambas determinaciones normales), con anemia transitoria (anemia en la primera visita, pero no a los 6 meses), con anemia de nueva aparición (inicialmente sin anemia, pero con anemia a los 6 meses) o con anemia persistente (anemia en ambas determinaciones). La resolución de la anemia se definió como la normalización de la concentración de hemoglobina (≥ 13g/dl los varones y ≥ 12g/dl las mujeres).
Análisis estadísticoLas variables discretas se expresan como frecuencia y porcentaje y las continuas, como media ± desviación estándar o mediana [intervalo intercuartílico] en casos de distribución asimétrica. Se evaluó la normalidad de la distribución con Q-Q plots. Las diferencias estadísticas entre los grupos se evaluaron con la prueba de la χ2 para las variables discretas, la prueba de la t de Student para las variables continuas con distribución normal o la prueba de la U de Mann-Whitney para las que tenían una distribución no normal. Se utilizó un análisis de regresión de riesgos proporcionales de Cox univariable, tomando la mortalidad por cualquier causa como variable dependiente y el subgrupo preespecificado de anemia como variable independiente. Se verificaron las presunciones de proporcionalidad necesarias para el uso de modelos de regresión de riesgos proporcionales de Cox para todas las variables. Para cumplir la presunción de linealidad, se utilizó la función logarítmica de la covariable de tiempo de evolución de la IC. Se elaboró también un modelo de riesgos proporcionales de Cox multivariable con las mismas variables dependiente e independiente y con diferentes covariables, que se incluyeron en el modelo debido a que resultaron significativas en el análisis univariable o porque se consideraron clínicamente relevantes, a saber: edad, sexo, clase funcional de la New York Heart Association (NYHA), tiempo de evolución de la IC, etiología de la IC, FEVI, diabetes mellitus, hipertensión, fibrilación auricular, insuficiencia renal, enfermedad pulmonar obstructiva crónica, enfermedad vascular periférica, frecuencia cardiaca, presión arterial sistólica y tratamientos (método por pasos hacia atrás). Los análisis estadísticos se realizaron con el programa SPSS 15 (SPSS Inc.; Chicago, Illinois, Estados Unidos). Se consideró estadísticamente significativo un valor bilateral de p < 0,05.
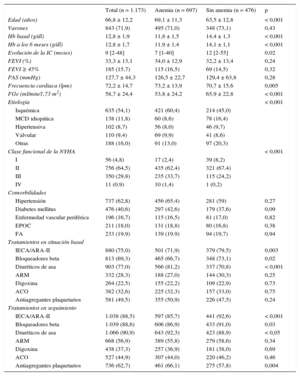
RESULTADOSEntre agosto de 2001 y diciembre de 2012, se incluyó en el estudio a 1.173 pacientes consecutivos. En la tabla 1 se presentan los datos demográficos, clínicos y bioquímicos en el momento de la inclusión en el estudio, así como el tratamiento durante el seguimiento. La media de edad era 66,8 ± 12,2 años y los pacientes, predominantemente varones (71,9%). La etiología principal de la IC fue la cardiopatía isquémica (54,1%), y la mayoría de los pacientes se encontraban en NYHA II (64,5%) y III (29,8%) en el momento de la inclusión. La mayoría de los pacientes presentaban una función sistólica deprimida (media de FEVI, 33,3 ± 13,1%) mientras que la FEVI ≥ 45% se daba en un 15,6% de los pacientes. La mayoría de nuestros pacientes recibían tratamiento con inhibidores de la enzima de conversión de la angiotensina/antagonistas del receptor de la angiotensina II, bloqueadores beta y diuréticos de asa en la situación inicial, medicaciones que se incrementaron durante el periodo de seguimiento (tabla 1). La media de la concentración de hemoglobina en la primera visita era 13,1 ± 1,9g/dl los varones y 12,1 ± 1,6g/dl las mujeres.
Características demográficas y clínicas
| Total (n = 1.173) | Anemia (n = 697) | Sin anemia (n = 476) | p | |
|---|---|---|---|---|
| Edad (años) | 66,8 ± 12,2 | 69,1 ± 11,3 | 63,5 ± 12,8 | < 0,001 |
| Varones | 843 (71,9) | 495 (71,0) | 348 (73,1) | 0,43 |
| Hb basal (g/dl) | 12,8 ± 1,9 | 11,8 ± 1,5 | 14,4 ± 1,3 | < 0,001 |
| Hb a los 6 meses (g/dl) | 12,8 ± 1,7 | 11,9 ± 1,4 | 14,1 ± 1,1 | < 0,001 |
| Evolución de la IC (meses) | 9 [2-48] | 7 [1-40] | 12 [2-55] | 0,02 |
| FEVI (%) | 33,3 ± 13,1 | 34,0 ± 12,9 | 32,2 ± 13,4 | 0,24 |
| FEVI ≥ 45% | 185 (15,7) | 115 (16,5) | 69 (14,5) | 0,32 |
| PAS (mmHg) | 127,7 ± 44,3 | 126,5 ± 22,7 | 129,4 ± 63,8 | 0,28 |
| Frecuencia cardiaca (lpm) | 72,2 ± 14,7 | 73,2 ± 13,9 | 70,7 ± 15,6 | 0,005 |
| FGe (ml/min/1,73 m2) | 58,7 ± 24,4 | 53,8 ± 24,2 | 65,9 ± 22,8 | < 0,001 |
| Etiología | < 0,001 | |||
| Isquémica | 635 (54,1) | 421 (60,4) | 214 (45,0) | |
| MCD idiopática | 138 (11,8) | 60 (8,6) | 78 (16,4) | |
| Hipertensiva | 102 (8,7) | 56 (8,0) | 46 (9,7) | |
| Valvular | 110 (9,4) | 69 (9,9) | 41 (8,6) | |
| Otras | 188 (16,0) | 91 (13,0) | 97 (20,3) | |
| Clase funcional de la NYHA | < 0,001 | |||
| I | 56 (4,8) | 17 (2,4) | 39 (8,2) | |
| II | 756 (64,5) | 435 (62,4) | 321 (67,4) | |
| III | 350 (29,8) | 235 (33,7) | 115 (24,2) | |
| IV | 11 (0,9) | 10 (1,4) | 1 (0,2) | |
| Comorbilidades | ||||
| Hipertensión | 737 (62,8) | 456 (65,4) | 281 (59) | 0,27 |
| Diabetes mellitus | 476 (40,6) | 297 (42,6) | 179 (37,6) | 0,09 |
| Enfermedad vascular periférica | 196 (16,7) | 115 (16,5) | 81 (17,0) | 0,82 |
| EPOC | 211 (18,0) | 131 (18,8) | 80 (16,8) | 0,38 |
| FA | 233 (19,9) | 139 (19,9) | 94 (19,7) | 0,94 |
| Tratamientos en situación basal | ||||
| IECA/ARA-II | 880 (75,0) | 501 (71,9) | 379 (79,5) | 0,003 |
| Bloqueadores beta | 813 (69,3) | 465 (66,7) | 348 (73,1) | 0,02 |
| Diuréticos de asa | 903 (77,0) | 566 (81,2) | 337 (70,8) | < 0,001 |
| ARM | 332 (28,3) | 188 (27,0) | 144 (30,3) | 0,25 |
| Digoxina | 264 (22,5) | 155 (22,2) | 109 (22,9) | 0,73 |
| ACO | 382 (32,6) | 225 (32,3) | 157 (33,0) | 0,75 |
| Antiagregantes plaquetarios | 581 (49,5) | 355 (50,9) | 226 (47,5) | 0,24 |
| Tratamientos en seguimiento | ||||
| IECA/ARA-II | 1.038 (88,5) | 597 (85,7) | 441 (92,6) | < 0,001 |
| Bloqueadores beta | 1.039 (88,6) | 606 (86,9) | 433 (91,0) | 0,03 |
| Diuréticos de asa | 1.066 (90,9) | 643 (92,3) | 423 (88,9) | < 0,05 |
| ARM | 668 (56,9) | 389 (55,8) | 279 (58,6) | 0,34 |
| Digoxina | 438 (37,3) | 257 (36,9) | 181 (38,0) | 0,69 |
| ACO | 527 (44,9) | 307 (44,0) | 220 (46,2) | 0,46 |
| Antiagregantes plaquetarios | 736 (62,7) | 461 (66,1) | 275 (57,8) | 0,004 |
ACO: anticoagulantes orales; ARA-II: antagonistas del receptor de la angiotensina II; ARM: antagonista de los receptores de mineralcorticoides; EPOC: enfermedad pulmonar obstructiva crónica; FA: fibrilación/aleteo auricular; FEVI: fracción de eyección del ventrículo izquierdo; FGe: filtrado glomerular estimado; Hb: hemoglobina; IC: insuficiencia cardiaca; IECA: inhibidores de la enzima de conversión de la angiotensina; MCD: miocardiopatía dilatada; NYHA: New York Heart Association; PAS: presión arterial sistólica.
Los valores expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
En situación basal, se detectó anemia en un total de 550 pacientes (46,9%). Una cuarta parte de los pacientes con anemia (14,5% del total) presentaban normalización de las concentraciones de hemoglobina a los 6 meses (anemia transitoria), y hubo un porcentaje similar de pacientes que presentaron anemia de nueva aparición (el 12,5% de la cohorte) a los 6 meses, mientras que el 32,4% de los pacientes tenían anemia persistente (figura 1). Los pacientes que sufrían algún tipo de anemia (n = 697 [59,4%]) eran de más edad (p < 0,001), tenían un filtrado glomerular inferior (fórmula de la Chronic Kidney Disease Epidemiology Collaboration) (p < 0,001), se encontraban en peor clase funcional (p < 0,001) y tenían menos tiempo de evolución de la IC (tabla 1). No se observaron diferencias significativas entre los grupos en la etiología de la IC o las comorbilidades. En cambio, el uso de un inhibidor de la enzima de conversión de la angiotensina (p < 0,001) y bloqueadores beta (p = 0,03) durante el seguimiento fue menor entre los pacientes con anemia (tabla 1). En la tabla 2 se muestran las diferencias entre los pacientes anémicos según el tipo de anemia, atendiendo a las categorías de anemia preespecificadas en cuanto a las características demográficas y clínicas. Es de destacar que los pacientes con anemia persistente eran de más edad y tenían peor clase funcional, mejor FEVI y menor filtrado glomerular estimado.
Diferencias entre las categorías de anemia
| A. Transitoria (n = 170) | B. De nueva aparición (n = 147) | C. Persistente (n = 380) | p | p A frente a B | p A frente a C | p B frente a C | |
|---|---|---|---|---|---|---|---|
| Edad (años) | 64,3 ± 13,1 | 68,0 ± 12,0 | 71,7 ± 9,2 | < 0,001 | 0,01 | 0,001 | 0,002 |
| Sexo masculino | 119 (70,0) | 106 (72,1) | 270 (71,1) | 0,95 | 0,75 | 0,80 | 0,81 |
| Evolución de la IC (meses) | 4 [2-30] | 6 [1-36] | 10 [2-48] | 0,5 | 0,68 | 0,52 | 1,0 |
| FEVI (%) | 33,4 ± 12,8 | 30,9 ± 10,9 | 35,5 ± 13,5 | 0,002 | 0,21 | 0,22 | 0,001 |
| FEVI ≥ 45% | 20 (11,8) | 13 (8,8) | 82 (21,6) | 0,001 | 0,51 | 0,006 | 0,001 |
| PAS (mmHg) | 125,3 ± 1,3 | 124,5 ± 21,3 | 127,9 ± 10,9 | 0,20 | 0,95 | 0,48 | 0,32 |
| Frecuencia cardiaca (lpm) | 73,4 ± 15,5 | 72,8 ± 13,7 | 73,2 ± 13,3 | 0,92 | 0,94 | 0,99 | 0,07 |
| FGe (ml/min/1,73 m2) | 58,5 ± 26,8 | 60,2 ± 23,1 | 49,2 ± 22,3 | < 0,001 | 0,83 | < 0,001 | < 0,001 |
| Etiología | 0,02 | 0,07 | 0,23 | 0,003 | |||
| Isquémica | 111 (65,3) | 75 (51,0) | 235 (61,8) | ||||
| MCD idiopática | 13 (7,6) | 18 (12,2) | 29 (7,6) | ||||
| Hipertensiva | 8 (4,7) | 11 (7,5) | 37 (9,7) | ||||
| Valvular | 15 (8,8) | 13 (8,8) | 41 (10,8) | ||||
| Otros | 23 (13,5) | 30 (20,3) | 38 (10,0) | ||||
| Clase funcional de la NYHA | < 0,001 | 0,14 | < 0,001 | 0,05 | |||
| I | 8 (4,7) | 3 (2,0) | 6 (1,6) | ||||
| II | 118 (69,4) | 99 (67,3) | 218 (57,4) | ||||
| III | 43 (25,3) | 42 (28,6) | 150 (39,5) | ||||
| IV | 1 (0,6) | 3 (2,0) | 6 (1,6) | ||||
| Comorbilidades | |||||||
| Hipertensión | 112 (65,9) | 97 (66,0) | 247 (65,0) | 0,96 | 0,98 | 0,84 | 0,83 |
| Diabetes mellitus | 76 (44,7) | 53 (36,1) | 168 (44,2) | 0,23 | 0,12 | 0,91 | 0,09 |
| Enfermedad vascular periférica | 30 (17,6) | 23 (15,6) | 62 (16,3) | 0,92 | 0,63 | 0,69 | 0,85 |
| EPOC | 34 (20,0) | 31 (21,1) | 66 (17,4) | 0,49 | 0,81 | 0,46 | 0,32 |
| FA | 34 (20,0) | 36 (24,5) | 69 (18,2) | 0,28 | 0,34 | 0,61 | 0,10 |
| Tratamientos en situación basal | |||||||
| IECA/ARA-II | 120 (70,6) | 114 (77,6) | 267 (70,3) | 0,21 | 0,16 | 0,94 | 0,09 |
| Bloqueadores beta | 121 (71,2) | 102 (69,4) | 242 (63,7) | 0,18 | 0,73 | 0,09 | 0,22 |
| Diuréticos de asa | 120 (70,6) | 117 (79,6) | 329 (86,6) | < 0,001 | 0,07 | < 0,001 | < 0,05 |
| ARM | 34 (20,0) | 58 (39,5) | 96 (25,3) | < 0,001 | < 0,001 | 0,18 | 0,001 |
| Digoxina | 33 (19,4) | 40 (27,2) | 82 (21,6) | 0,24 | 0,10 | 0,56 | 0,17 |
| ACO | 51 (30,0) | 46 (31,3) | 128 (33,7) | 0,66 | 0,80 | 0,39 | 0,60 |
| Antiagregantes plaquetarios | 91 (53,5) | 69 (46,9) | 195 (51,3) | 0,45 | 0,27 | 0,63 | 0,37 |
| Tratamientos en seguimiento | |||||||
| IECA/ARA-II | 146 (85,9) | 130 (88,4) | 321 (84,5) | 0,49 | 0,50 | 0,67 | 0,74 |
| Bloqueadores beta | 155 (91,2) | 127 (86,4) | 324 (85,3) | 0,16 | 0,18 | 0,06 | 0,74 |
| Diuréticos de asa | 146 (85,9) | 137 (93,2) | 360 (94,7) | 0,001 | 0,04 | < 0,001 | 0,49 |
| ARM | 85 (50,0) | 96 (65,3) | 208 (54,7) | 0,02 | 0,006 | 0,30 | 0,03 |
| Digoxina | 52 (30,6) | 63 (42,9) | 142 (37,4) | 0,08 | 0,02 | 0,12 | 0,25 |
| ACO | 68 (40,0) | 65 (44,2) | 174 (45,8) | 0,81 | 0,45 | 0,76 | 0,75 |
| Antiagregantes plaquetarios | 115 (67,6) | 945 (63,9) | 252 (66,3) | 0,45 | 0,49 | 0,21 | 0,61 |
ACO: anticoagulantes orales; ARA-II: antagonistas del receptor de la angiotensina II; ARM: antagonista de los receptores de mineralcorticoides; EPOC: enfermedad pulmonar obstructiva crónica; FA: fibrilación/aleteo auricular; FEVI: fracción de eyección del ventrículo izquierdo; FGe: filtrado glomerular estimado; Hb: hemoglobina; IC: insuficiencia cardiaca; IECA: inhibidores de la enzima de conversión de la angiotensina; MCD: miocardiopatía dilatada; NYHA: New York Heart Association; PAS: presión arterial sistólica.
Los valores expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
Los pacientes con anemia de nueva aparición diferían de los pacientes con anemia transitoria solo en que eran de más edad y recibían más furosemida, antagonistas de los receptores de mineralocorticoides y digoxina; estas tres últimas características del tratamiento probablemente reflejen un peor estado clínico a pesar de que la clase funcional de la NYHA fuera similar.
Categoría de la anemia y supervivenciaDurante un seguimiento medio de 3,7 ± 2,8 años después de la visita realizada a los 6 meses, fallecieron 494 pacientes (42,1%). Las causas de muerte fueron la progresión de la IC en 147 pacientes (29,8%), muerte súbita en 58 (11,7%), infarto agudo de miocardio en 36 (7,3%), ictus en 16 (3,2%), una intervención cardiovascular en 8 (1,6%), otras causas cardiovasculares en 28 (5,7%), causas no cardiovasculares en 168 (34,0%) y de causa desconocida en 33 (6,7%). La mortalidad fue significativamente superior en presencia de cualquier tipo de anemia (hazard ratio [HR] = 2,08; intervalo de confianza del 95% [IC95%], 1,71-2,53; p < 0,001). En un análisis de sensibilidad, la anemia basal, evaluada según los criterios de la OMS, mostró asociación independiente con la mortalidad en el análisis multivariable general (HR = 1,39; IC95%, 1,15-1,67; p = 0,001).
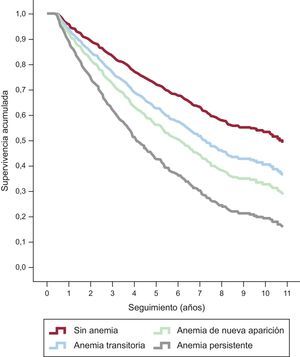
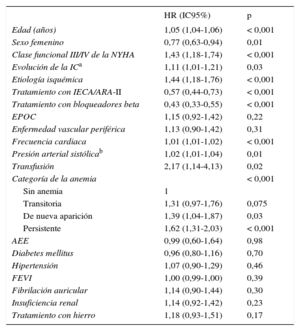
Al considerar los diferentes tipos de anemia, el peor pronóstico se observó con la anemia persistente (HR = 2,59; IC95%, 2,09-3,20; p < 0,001), seguida de la anemia de nueva aparición (HR = 1,75; IC95%, 1,31-2,34; p < 0,001) y la anemia transitoria (HR = 1,42; IC95%, 1,06-1,91; p = 0,02) (figura 2). En un extenso análisis de regresión de Cox multivariable, que incluyó como covariables edad, sexo, clase funcional de la NYHA, tiempo de evolución de la IC, etiología de la IC, FEVI, diabetes mellitus, hipertensión, fibrilación auricular, insuficiencia renal, enfermedad pulmonar obstructiva crónica, enfermedad vascular periférica, frecuencia cardiaca, presión arterial sistólica y los tratamientos durante el seguimiento, el tipo de anemia fue una variable independiente predictiva de la mortalidad por cualquier causa (p < 0,001) (tabla 3).
Curvas de supervivencia sin ajustar según los estratos de anemia. El peor pronóstico fue el observado para la anemia persistente (HR = 2,06; IC95%, 2,10-3,21; p < 0,001), seguido del de la anemia de nueva aparición (HR = 1,76; IC95%, 1,32-2,35; p < 0,001) y el de la anemia transitoria (HR = 1,42; IC95%, 1,06-1,91; p = 0,02). HR: hazard ratio; IC95%; intervalo de confianza del 95%.
Análisis de regresión de Cox multivariable del riesgo de muerte por cualquier causa
| HR (IC95%) | p | |
|---|---|---|
| Edad (años) | 1,05 (1,04-1,06) | < 0,001 |
| Sexo femenino | 0,77 (0,63-0,94) | 0,01 |
| Clase funcional III/IV de la NYHA | 1,43 (1,18-1,74) | < 0,001 |
| Evolución de la ICa | 1,11 (1,01-1,21) | 0,03 |
| Etiología isquémica | 1,44 (1,18-1,76) | < 0,001 |
| Tratamiento con IECA/ARA-II | 0,57 (0,44-0,73) | < 0,001 |
| Tratamiento con bloqueadores beta | 0,43 (0,33-0,55) | < 0,001 |
| EPOC | 1,15 (0,92-1,42) | 0,22 |
| Enfermedad vascular periférica | 1,13 (0,90-1,42) | 0,31 |
| Frecuencia cardiaca | 1,01 (1,01-1,02) | < 0,001 |
| Presión arterial sistólicab | 1,02 (1,01-1,04) | 0,01 |
| Transfusión | 2,17 (1,14-4,13) | 0,02 |
| Categoría de la anemia | < 0,001 | |
| Sin anemia | 1 | |
| Transitoria | 1,31 (0,97-1,76) | 0,075 |
| De nueva aparición | 1,39 (1,04-1,87) | 0,03 |
| Persistente | 1,62 (1,31-2,03) | < 0,001 |
| AEE | 0,99 (0,60-1,64) | 0,98 |
| Diabetes mellitus | 0,96 (0,80-1,16) | 0,70 |
| Hipertensión | 1,07 (0,90-1,29) | 0,46 |
| FEVI | 1,00 (0,99-1,00) | 0,39 |
| Fibrilación auricular | 1,14 (0,90-1,44) | 0,30 |
| Insuficiencia renal | 1,14 (0,92-1,42) | 0,23 |
| Tratamiento con hierro | 1,18 (0,93-1,51) | 0,17 |
AEE: agentes estimuladores de la eritrocitopoyesis; ARA-II: antagonistas del receptor de la angiotensina II; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; HR: hazard ratio; IC: insuficiencia cardiaca; IC95%: intervalo de confianza del 95%; IECA: inhibidores de la enzima de conversión de la angiotensina; NYHA: New York Heart Association.
Se estudió la anemia de dos tercios de los pacientes. El 50% de los pacientes con anemia basal presentaban un componente de ferropenia (definida como ferritina < 100 μg/dl o < 300 μg/dl con un índice de saturación de transferrina < 20%), mientras que el resto tenía anemia asociada a enfermedades crónicas o insuficiencia renal. Solo 199 pacientes (17%) de la cohorte total (una tercera parte de los pacientes con anemia) recibieron algún tratamiento para resolver la anemia o restablecer la concentración de hemoglobina durante los primeros 6 meses (entre las dos determinaciones de hemoglobina), y el tratamiento más frecuente consistió en suplementos de hierro (el 82% de los pacientes tratados). Se utilizó eritropoyetina en el 6,5% de los casos y fueron necesarias transfusiones para el 4,5% de los pacientes con anemia. Tiene interés señalar que los suplementos de hierro y el uso de eritropoyetina no mostraron relación independiente con la supervivencia, pero que el uso de transfusiones de sangre se asoció con el doble de riesgo de muerte en el análisis multivariable (tabla 3).
DISCUSIÓNEl tratamiento de la IC ha experimentado una notable gama de mejoras dirigidas al miocardio, el sistema eléctrico y la activación neurohormonal, y finalmente deja poco margen a una mayor optimización si la atención se restringe a solo el corazón. Así pues, es el momento de atender a las comorbilidades que también influyen en el pronóstico de los pacientes con IC. Estos pacientes presentan alta prevalencia de anemia2, en un número que varía según el valor de corte utilizado para definirla y según el contexto en que se estudie (IC crónica o aguda descompensada)3,22. En nuestra cohorte de 1.173 pacientes ambulatorios consecutivos de la práctica clínica real, se observa una prevalencia de anemia del 47% utilizando la definición de la OMS.
En las últimas 2 décadas, se ha estudiado ampliamente la relación entre la anemia y el pronóstico de la IC, pero la influencia de la cinética y la evolución de la hemoglobina durante el seguimiento ha quedado en gran parte sin explorar. En el presente trabajo, la simple presencia de anemia se asoció a mayor mortalidad, pero la cinética de la hemoglobina y, por lo tanto, el tipo de anemia fueron también factores relevantes respecto a la evolución clínica. El tipo de anemia, definido según las determinaciones de hemoglobina realizadas con 6 meses de separación, continuó mostrando una asociación significativa con el pronóstico en el análisis multivariable, aun teniendo en cuenta los factores de confusión habituales y el tratamiento médico. Previamente, un estudio retrospectivo unicéntrico evaluó también el pronóstico a largo plazo de pacientes consecutivos con IC según la presencia y la dinámica de la anemia2. Se observó anemia solo en el 17,2% de los pacientes, aunque los criterios utilizados para la definición de anemia (hemoglobina < 12g/dl los varones y < 11g/dl las mujeres) fueron más estrictos que los nuestros (criterios de la OMS). Tiene interés señalar que, en ese estudio un 43% de los pacientes mostraron resolución de la anemia a los 6 meses, mientras que un 16% de los pacientes sin anemia en la situación basal contrajeron anemia en los primeros 6 meses. En la comparación de los 2 estudios, más allá de las diferencias en la prevalencia de anemia, en nuestro estudio hubo menos pacientes con anemia transitoria, probablemente debido a las diferencias en las características clínicas de la población (de más edad y con más comorbilidades, sobre todo insuficiencia renal, en nuestra cohorte). En cambio, el porcentaje de pacientes que presentaron anemia de nueva aparición en los primeros 6 meses de seguimiento de nuestra cohorte fue muy similar a lo descrito por Tang et al2. Tal como se preveía, la anemia persistente fue la que se asoció a una tasa de mortalidad más alta en ambos estudios.
Tang et al2 observaron que los pacientes con anemia transitoria mostraban resultados similares a los de los pacientes sin anemia, mientras que en nuestro estudio la anemia transitoria se asoció a un aumento de la mortalidad. No se encuentra una explicación clara a esta divergencia, pero es muy posible que la anemia transitoria, a pesar del tratamiento actual recomendado, refleje una enfermedad subyacente de mayor gravedad.
Aunque la anemia se ha estudiado ampliamente, su origen en la IC no se conoce completamente11,23–25 y la mayoría de los pacientes con IC y anemia no están plenamente caracterizados. Se considera que la anemia se produce a causa de una interacción compleja entre ferropenia, enfermedad renal, producción de citocinas y pérdida hemática, lo cual puede interaccionar con la absorción y dar lugar a un déficit de nutrientes10. En este estudio, la causa más frecuente de anemia fue la ferropenia. Además, la cuestión de si el tratamiento de la anemia puede mejorar la evolución de estos pacientes continúa generando controversia, y varios ensayos no han podido demostrar una mejora de las tasas de mortalidad en diferentes poblaciones con IC, si bien algunos de ellos han mostrado beneficio clínico en poblaciones seleccionadas15,26,27. Recientemente se ha descrito que el tratamiento de la ferropenia con hierro intravenoso aporta un beneficio clínico, si bien no se evaluó el efecto en la supervivencia28. En nuestro estudio (que se inició antes de la actual «era del tratamiento con hierro intravenoso»), menos de una quinta parte de los pacientes con anemia recibieron un tratamiento específico para restablecer la concentración de hemoglobina. Es de destacar que la mayoría de los pacientes cuya anemia se resolvió recibieron solo tratamiento convencional para la IC. Sin embargo, los pacientes que recibieron transfusiones de sangre tuvieron peor evolución, mientras que no se detectó un aumento del riesgo de muerte asociado a los demás tratamientos de la anemia.
Limitaciones del estudioSe utilizaron solo 2 determinaciones de hemoglobina separadas 6 meses y no se dispuso de información adicional sobre cambios en las concentraciones durante el resto del periodo de seguimiento. Además, se utilizó un valor de corte fijo para definir anemia (aunque con valores de corte específicos para cada sexo). Como ocurre en todos los estudios publicados que se basan en 2 determinaciones clínicas o analíticas, nuestros análisis se realizaron en los pacientes que «completaron» el estudio, es decir, aquellos de los que había disponibles datos tanto basales como a los 6 meses. En consecuencia, no se incluyó en el estudio a los pacientes que fallecieron antes de la visita de los 6 meses, lo que puede haber introducido un sesgo inevitable en el análisis realizado. Por lo tanto, no es posible predecir la asociación de los cambios de la hemoglobina con el pronóstico en los pacientes que no completaron el estudio.
Aunque nuestra cohorte de estudio estaba formada por una población no seleccionada de pacientes con IC tratados en una unidad de IC multidisciplinaria de un hospital terciario, la mayoría de ellos procedían de la sala de cardiología. Los pacientes eran predominantemente varones y la causa más frecuente de IC fue la cardiopatía isquémica. En consecuencia, los resultados de este estudio deben interpretarse con precaución al considerar población general.
CONCLUSIONESEn una amplia cohorte de pacientes ambulatorios con IC de la práctica clínica real consecutivos, la anemia persistente, la de nueva aparición o incluso la transitoria tuvieron un efecto negativo en el pronóstico de la IC durante un seguimiento a largo plazo. Parece recomendable prestar más atención al tratamiento de la anemia en la IC y se necesitan nuevos estudios para clarificar esta cuestión.
CONFLICTO DE INTERESESNinguno.
- –
La anemia es una comorbilidad frecuente en la IC, que afecta a un 5-55% de los pacientes, dependiendo del contexto clínico y el valor de corte utilizado para definir estado anémico.
- –
La anemia conlleva una peor evolución de los pacientes con IC: se ha descrito el doble de riesgo de mortalidad por cualquier causa, con una relación lineal entre los valores de hemoglobina más bajos y la mortalidad.
- –
Se sabe poco de la cinética de la hemoglobina en la IC, y actualmente no está del todo claro si los cambios en el estado anémico influyen en la evolución clínica en el seguimiento a largo plazo.
- –
El tipo de anemia definido según determinaciones de hemoglobina separadas 6 meses (ausencia de anemia, anemia transitoria, anemia de nueva aparición y anemia persistente) mostró una asociación estadísticamente significativa con el pronóstico, aun teniendo en cuenta los factores de confusión habituales y el tratamiento médico.
- –
El peor pronóstico se observó en los pacientes con anemia persistente, seguidos de los pacientes con anemia de nueva aparición.
- –
La anemia transitoria se asoció también a un aumento de la mortalidad, aunque en el análisis multivariable se mantuvo en el límite de la significación estadística.
- –
La anemia se resolvió en el 24% de los pacientes. La mayoría de ellos recibieron solo un tratamiento convencional para la IC. Los pacientes que recibieron transfusiones de sangre presentaron resultados peores, aunque los demás tratamientos de la anemia no se asociaron a aumento del riesgo de muerte.